Ожирение и метаболизм
Рецензируемый научный медицинский журнал, посвященный проблемам ожирения, метаболических нарушений и эндокринных заболеваний.
Главный редактор
Иван Иванович Дедов, Член Президиума РАН, академик, д.м.н., профессор
ORCID: https://orcid.org/0000-0002-8175-7886
Учредители журнала
- ФГБУ «НМИЦ эндокринологии» Минздрава России (https://www.endocrincentr.ru/)
- Российская ассоциация эндокринологов (https://rae-org.ru/)
О журнале
Журнал "Ожирение и метаболизм" это междисциплинарный форум для клинических и прикладных исследований в сфере биохимии, физиологии, патофизиологии, генетики, диетологии, а также молекулярных, метаболических, психологических и эпидемиологических аспектов ожирения и метаболизма. Тематика "Метаболизм", освещаемая в журнале, может относиться к жировому, углеводному, белковому, костному, водно-электролитному и др. видам обмена веществ в спектре патологии эндокринной системы.
Периодичность
| Языки публикации
|
Открытый доступ
- Статьи публикуются в сети Интернет в открытом доступе (Gold Open Access) и распространяются на условиях открытой лицензии Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
Индексация
|
|
Журнал входит в Перечень рецензируемых научных изданий, рекомендованных ВАК РФ для опубликования основных результатов диссертационных исследований на соискание ученых степеней доктора и кандидата наук.
Роскомнадзор
Журнал зарегистрирован Федеральной службой по надзору за соблюдением законодательства в сфере массовых коммуникаций и охране культурного наследия ПИ № ФС 77 - 59669.
Текущий выпуск

ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
Обоснование. Стабильный ежегодный прирост публикаций в области изучения микробиоты кишечника (МК) и резистентности к инсулину свидетельствует о растущем признании важности этой проблемы исследований.
Цель. Исследовать особенности и взаимосвязь метаболитов МК и параметров инсулинорезистентности (ИР) у пациентов с артериальной гипертензией (АГ) и определить их роль в качестве индикаторов развития и прогрессирования АГ.
Материалы и методы. В сравнительное исследование вошли пациенты с АГ I–II стадии, в возрасте от 25 до 65 лет, получающие базовую антигипертензивную терапию. Всем пациентам проводилось исследование биообразцов крови и кала. Исследовали параметры МК: уровень триметиламина (ТМА), триметиламина-N-оксида (ТМАО), эндотоксина, короткоцепочечные жирные кислоты (КЦЖК) — уксусная — С2, пропионовая — С3, масляная — С4; биохимические параметры — липидный профиль, глюкозу натощак, концентрацию вч-С-реактивного белка (вч-СРБ), уровень интерлейкина (ИЛ) 1β, 6, 8, С-пептид, индекс триглицериды — глюкоза (TyG). Проводились суточное мониторирование артериального давления (АД) на аппарате BPLaB (Россия), и сфигмография на аппарате Vasera VS-1000 Series (Япония), оценивали показатель СРПВ — скорость распространения пульсовой волны. Статистический анализ проводился с использованием программ IBM SPSS Statistics 21.
Результаты. Включен 161 пациент, сформированы 3 группы: 1-я группа (контрольная) — лица без АГ (n=45), 2-я группа — пациенты с АГ 1-3 степенью (n=53); 3-я группа — пациенты с АГ 1-3 степенью и абдоминальным ожирением (АО) (n=63), сопоставимых по возрасту, полу, проводимой терапии. Пациенты в 3-й группе значимо отличались от пациентов 1-й и 2-й групп по параметрам ИМТ, ОТ, ОБ и от 1-й группы значениями офисного САД, ДАД (p < 0,001) и СРПВ (р=0,015). Уровень ТМАО, эндотоксина был значимо выше в 3-й группе пациентов по сравнению с 1-й группой. Суммарное содержание монокарбоновых кислот было выше во 2-й и 3-й группах по сравнению с 1-й группой (p < 0,002, p < 0,004). В группах с АГ зарегистрировано значимое превышение уровня ОХС, ХСЛПНП, а в 3-й зарегистрирован максимальный уровень ТГ (p=0,001), TyG, ИЛ-1β и вч-СРБ (p=0,001). Методом логистической регрессии выделена зависимость СРПВ от КЦЖКС2, TyG и САД от TyG в 3-й группе пациентов.
Заключение. Сопряженность связи метаболитов МК и индекса TyG с параметрами СРПВ и АД может подтверждать роль биомаркеров в качестве индикаторов развития и прогрессирования АГ. Внедрение в клиническую практику этих диагностических методов будет способствовать осуществлению ранних профилактических и терапевтических стратегий вмешательства в течение АГ.
Обоснование. Выявление характера изменений состава тела и взаимосвязи с клинической картиной ХОБЛ является актуальной проблемой, так как полученные данные могут быть использованы для оценки исхода и прогноза заболевания.
Цель. Установить взаимосвязь компонентного состава тела с особенностями клинического течения и функции внешнего дыхания пациентов с хронической обструктивной болезнью легких.
Материалы и методы. Исследование проводилось в клиниках Сибирского государственного медицинского университета, в том числе были обследованы приглашенные пациенты из пульмонологического отделения ОГАУЗ «Городская клиническая больница №3 им. Б.И. Альперовича». Данное исследование многоцентровое, интервенционное, двухвыборочное, сравнительное. Были включены пациенты с ХОБЛ и условно-здоровые лица для группы контроля. Всем были проведены антропометрия, анкетирование, биоимпедансометрия, спирометрия и проба на обратимость бронхообструкции.
Результаты. Пациенты с ХОБЛ в количестве 105 человек были условно поделены на три группы по ИМТ. Группа контроля составила 40 человек. Распределение больных ХОБЛ по спирометрической классификации GOLD при различной массе тела отличалось статистически значимо (χ² =13,81; p=0,031). Наибольшее количество пациентов с GOLD IV наблюдалось в группе с нормальной массой тела. У больных ХОБЛ с ожирением и избыточной массой тела выше показатели тощей массы тела и висцерального жира. Пациенты со стадией GOLD I имели наибольшее количество жидкости в организме, минеральной массы, висцерального жира, а также тощей и мышечной масс тела, а со спирометрической стадией GOLD IV характеризовались наименьшими показателями мышечной массы, жировой ткани. Обнаружено, что при большем количестве жировой ткани наблюдаются лучшие показатели функции внешнего дыхания. Висцеральный жир имел положительную корреляцию с количеством баллов опросников CAT и CCQ. Взаимосвязи между составом тела и количеством обострений в год обнаружено не было.
Заключение. Показатели спирометрии у больных ХОБЛ имеют взаимосвязь не только с мышечной и жировой тканью, а также с количеством жидкости в организме и минеральной массой тела. Больные ХОБЛ с нормальной массой тела имели наименьшее количество жировой ткани и наихудший показатель ОФВ1. Пациенты со стадией GOLD I имели наибольшее количество жидкости в организме, минеральной массы, висцерального жира, а также тощей и мышечной масс тела, а при GOLD IV регистрировалось наибольшее количество пациентов с дефицитом мышечной массы тела и избытком жировой ткани. Это подчеркивает важность оценки состава тела в клиническом ведении пациентов с ХОБЛ.
Обоснование. Рост числа лиц с ожирением сопряжен с распространением сердечно-сосудистых заболеваний, что обосновывает поиск новых средств для коррекции метаболических нарушений. Цель. Оценить метаболические эффекты производных ГАМК (композиции ФПС и МФБА) при раздельном и комбинированном применении с ситаглиптином на модели нарушения углеводного обмена, вызванного алиментарным ожирением.
Материалы и методы. Исследование выполнено на крысах-самцах с алиментарным ожирением. После полугодовой высокожировой и высококалорийной диеты формировали 7 групп (n=8), включая группу позитивного (интактные крысы без ожирения) и негативного контроля, а также 5 сопоставимых по выраженности ожирения групп, получавших в течение 30 дней раздельно исследуемые композиции: МФБА (20 мг/кг) и ФПС (50 мг/кг), референтный препарат ситаглиптин (10 мг/кг), а также комбинации: МФБА+ситаглиптин (20+10 мг/кг), ФПС+ситаглиптин (50+10 мг/кг). По завершении курсового лечения оценивали изменение массы тела, массу висцерального жира, липидный профиль, выраженность углеводных нарушений на основе перорального теста на толерантность к глюкозе и теста толерантности к инсулину. Методом иммуноферментного анализа определяли уровень глюкагона, инсулина и глюкагоноподобного пептида-1 (ГПП-1). Оценка степени повреждения печени осуществлялась по уровню печеночных трансаминаз (АЛТ и АСТ) и при морфологическом исследовании структурных изменений.
Результаты. Установлено, что композиции МФБА и ФПС, раздельно и в комбинации с ситаглиптином, статистически значимо снижали массу тела и массу висцерального жира, усиливали гипогликемическое действие ситаглиптина (особенно в сочетании с ФПС). Раздельное, а также комбинированное с ситаглиптином введение МФБА и ФПС способствовало увеличению уровня ГПП-1 и инсулина, улучшению утилизации глюкозы и повышению чувствительности к инсулину, а также нормализации липидного профиля и уровней АЛТ, АСТ. При морфологическом исследовании на фоне лечения отмечалось меньшее число очагов лимфоидной инфильтрации и менее выраженная жировая дистрофия печени. Наибольшую эффективность проявила комбинация ФПС+ситаглиптин.
Заключение. Производные ГАМК – МФБА и ФПС при монотерапии и более выраженно в комбинации с ситаглиптином уменьшали выраженность метаболических нарушений, связанных с ожирением. Отмеченное для циклического производного ГАМК (ФПС) анорексигенное действие и способность улучшать углеводный и липидный обмен представляет интерес для дальнейших исследований.
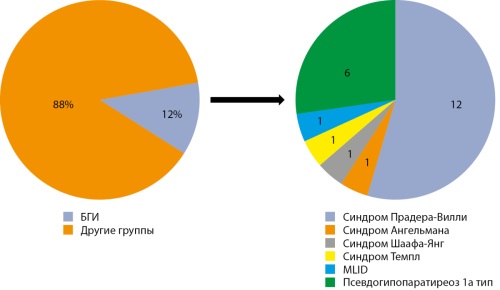
Обоснование. Болезни геномного импринтинга — это особый класс наследственных заболеваний, обусловленных нарушением моноаллельной экспрессии генов. Некоторые из них тесно связаны с развитием ожирения и метаболических расстройств. Такие синдромы, как Прадера-Вилли, Ангельмана, Шаафа-Янг, Темпл, псевдогипопаратиреоз 1а и 1b типов, иллюстрируют, как дисрегуляция экспрессии импринтированных генов может приводить к нарушению энергетического баланса, гиперфагии, снижению физической активности и аномальному распределению жировой ткани. В настоящее время в структуре раннего и тяжелого ожирения неуклонно возрастает удельный вес случаев, обусловленных именно генетическими причинами.
Цель. Изучить клинические и генетические характеристики синдромальных форм ожирения у детей.
Материалы и методы. Ретроспективное несравнительное исследование. В исследование включены 186 пациентов, обследованных в ГНЦ ФГБУ «НМИЦ эндокринологии имени академика И.И. Дедова» с подозрением на генетические формы ожирения в период с октября 2022 по май 2025 гг.
Результаты. У 12% пациентов (n=22) было подтверждено наличие болезней геномного импринтинга: синдром Прадера-Вилли (n=12), синдром Ангельмана (n=1), синдром Шаафа-Янг (n=1), синдром Темпл (n=1), мультилокусные нарушения импринтинга (MLID) (n=1), псевдогипопаратиреоз 1а типа (n=6). На момент обследования избыточный вес (SDS ИМТ 1,0–1,9 SD) имели 13,6% (n=3), ожирение 1 степени (SDS ИМТ 2,0 2,4 SD) имели 4,6% (n=1), ожирение 3 степени (SDS ИМТ 3,0–3,9 SD) имели 18,2% (n=4), морбидное ожирение (SDS ИМТ≥4,0 SD) — 40,9% (n=9). Избыточный набор массы тела на 1-м году жизни отмечался в 40,9% случаев (n=9), и в 31,8% (n=7) со 2-го года жизни. Полифагия клинически была выявлена в 54,5% случаев (n=12). Наследственность по ожирению была отягощена в 31,8% случаев (n=7). Медиана SDS ИМТ составила 3,71 SD [1,8025; 4,2875]. У 13 из 17 пациентов отмечались осложнения ожирения и избыточной массы тела.
Заключение. В работе представлены генетические и клинические характеристики болезней геномного импринтинга в структуре синдромального ожирения у детей в Российской Федерации.
Цель исследования. Оценить эффективность и безопасность физических тренировок различной интенсивности у пациентов с ожирением.
Материал и методы. Одноцентровое открытое рандомизированное исследование 37 пациентов с ожирением. Больных распределили в три группы: группа 1 — 15 больных 5–7 дней в неделю по 60 мин выполняли тренировочную ходьбу со скоростью, достигнутой на уровне 25–30% VO2peak, группа 2 — 15 больных 5–7 дней в неделю по 40 мин выполняли тренировочную ходьбу со скоростью, достигнутой на уровне 60% VO2peak, группа 3 — 7 больных 3 раза в неделю по 30 мин выполняли тренировочную ходьбу со скоростью, достигнутой на уровне 75–80% VO2peak. Выполнен анализ динамики ИМТ, ОТ, ТФН (на основании оценки поглощения кислорода на пике ФН (VO2peak)).
Результаты исследования. В группу 3 преждевременно прекратили включение пациентов ввиду плохой переносимости высокоинтенсивных интервальных тренировок, поэтому в группу 3 всего включили 7 больных. После 6 месяцев тренировок наиболее выраженное уменьшение ИМТ и ОТ, а также больший рост ТФН, скорости ходьбы на уровне лактатного порога и периода преимущественного поглощения жиров в ходе физической тренировки зарегистрировано в группе 1, пациенты которой тренировались с интенсивностью 25–30% от VO2peak. По результатам анализа дневников наблюдений выявили большую частоту нежелательных явлений в группе больных, выполняющих тренировки умеренной и высокой интенсивности.
Заключение. 1. ФТ с интенсивностью 75–80% VO2peak хуже переносятся больными с ожирением и менее эффективны по сравнению с ФТ интенсивностью 25–30% и 60% от VO2peak. 2. Аэробные тренировки с интенсивностью 25–30% VO2peak наиболее безопасны и эффективны в отношении толерантности к физической нагрузке и снижения массы тела у пациентов с ожирением.
Обоснование. Гены PPARGC1A и ACE, продукты которых обеспечивают энергетический обмен клетки, активно изучаются не только в развитии взаимосвязи с физическим признаками индивидуумов (спортивные результаты), но и в отношении патологических изменений в организме, в результате появления продуктов обмена с измененными физико-химическими свойствами и параметрами функциональной активности, приводящими к различным заболеваниям (ожирение, сахарный диабет 2 типа (СД2), инсулинорезистентность, метаболический синдром).
Цель исследования. Провести ассоциативный поиск полиморфных вариантов генов ACЕ (I/D) и PPARGC1A (G/A) с клиническими фенотипами ожирения у детей.
Материалы и методы. В исследование включено 177 детей с ожирением и 135 здоровых детей в возрасте от 5 до 18 лет. Изучали: нутритивный статус, показатели липидного, углеводного обмена для проведения ассоциативного поиска полиморфных вариантов генов ACЕ (I/D) и PPARGC1A (G/A) с клиническими фенотипами ожирения (ОЖ).
Тестирование полиморфных вариантов генов ACЕ (I/D), PPARGC1A (PGC-1) проведено методом ПЦР и ПДРФ-анализа.
Результаты. В выборке здоровых детей чаще встречаются генотипы I/D и I/I гена ACЕ и генотипы А/A и G/A гена PPARGC1А. У пациентов с ожирением чаще встречаются генотип I/D и аллель D гена ACЕ и генотип G/A гена PPARGC1А.
Генотип G/G и аллель G гена PPARGC1А при ожирении были ассоциированы с метаболическим синдромом и гипертриглицеридемией.
Заключение. Генотип I/D гена ACЕ встречался чаще у пациентов ожирением, однако ассоциаций генотипа с метаболическими рисками не было выявлено. Генотип G/G гена PPARGC1А чаще выявлялся у пациентов с ожирением и был связан с риском развития метаболических нарушений и гипертриглицеридемии.
Заболеваемость сахарным диабетом 1 типа (СД1) неуклонно растет во всем мире, особенно среди пациентов молодого возраста. Данная тенденция является весьма неблагоприятной, поскольку риск смерти пациентов с диабетом от сердечно-сосудистых и других сопутствующих заболеваний в пять раз превышает таковой у пациентов без СД1 в анамнезе. Основными причинами преждевременной смертности являются микро- и макрососудистые осложнения, усугубляемые сопутствующими заболеваниями, одним из которых является артериальная гипертензия (АГ). Риск таких осложнений, как острые нарушения мозгового кровообращения, инфаркт миокарда, ампутации конечностей, сердечная недостаточность и внезапная сердечная смерть, возрастает с увеличением продолжительности и тяжести АГ, особенно при ее неконтролируемом течении. Больные с СД1, находящиеся на стационарном или амбулаторном наблюдении и лечении, в своем большинстве не контролируют артериальное давление (АД) либо руководствуются данными домашнего/офисного измерения АД. По нашему мнению, стоит обратить особое внимание на скрининговую диагностику, раннее выявление, а также профили повышения АД у пациентов с СД1, так как это позволит рассмотреть возможность ранней инициации антигипертензивного лечения с целью оптимизации терапевтических подходов к ведению данной группы пациентов, а также имеет ключевое значение для снижения риска неблагоприятных исходов данного заболевания.
ОБЗОРЫ
В условиях современного мира все глобальнее становится проблема ожирения и метаболического синдрома. Социальные и экологические факторы, играющие роль в развитии этих состояний, еще не до конца изучены, однако уже сейчас накапливаются данные, свидетельствующие о том, что развитию ожирения и метаболического синдрома способствуют неблагоприятные условия раннего периода жизни, например, заболевания матери в периоды беременности и лактации, использование различных химических и лекарственных агентов, низкая масса плода при рождении, неблагоприятные режим и качество питания. Все эти факторы оказывают воздействие на состояние желудочно-кишечного тракта, в частности приводят к дисбалансу кишечной микрофлоры. Накапливаются данные о том, что микробиом кишечника людей с ожирением структурно и функционально отличен от микрофлоры кишечника здорового человека. Выявление прочной корреляционной связи между этими параметрами может открыть перспективы для профилактики метаболического синдрома и всех ассоциированных с ним состояний путем поддержания здоровья кишечной микрофлоры. Целью данной статьи является освещение данных исследований, проводимых на животных и людях, которые подтверждают наличие патофизиологических механизмов влияния кишечной микрофлоры на развитие ожирения и сопутствующего метаболического синдрома, а также поиск возможностей профилактики данных состояний посредством добавления пре- и пробиотиков к пище.
На заболевания, связанные с метаболическим синдромом, приходится две трети смертей от неинфекционных заболеваний, большинство из которых могут начинаться еще в раннем возрасте. Провоспалительная среда, наблюдаемая у пациентов с МС при ожирении, может способствовать нарушению иммунной регуляции у пациентов с COVID 19, включая неоптимальные иммунные реакции, гипервоспаление, микрососудистую дисфункцию и тромбоз. Физические упражнения могут быть одной из ключевых мер по уменьшению воспаления у лиц с COVID-19, страдающих ожирением, поскольку могут снизить количество и размер адипоцитов, а также воспалительную реакцию и экспрессию цитокинов, связанные с нарушением иммунной регуляции, опосредованной избытком жировой ткани. С учетом увеличения количества людей с метаболическим синдромом и значимости данной патологии в контексте последствий пандемии COVID-19, а также с учетом важности физической активности в лечении, реабилитации и профилактики факторов кардиометаболического риска, необходимо рассмотреть основные аспекты патогенеза МС, особенности реабилитационных стратегий у пациентов с метаболическим синдромом и ожирением с последствиями перенесенной новой коронавирусной инфекции (НКВИ). Целью обзора стал поиск, обобщение и обсуждение имеющихся литературных данных по развитию и патогенезу метаболического синдрома в длительном постковидном периоде, а также систематизация имеющихся методов кардиореабилитации у данной категории лиц.
Материалы и методы. Поиск и отбор литературных источников осуществлялся в системе опубликованных исследований в научных базах cyberleninka.ru, elibrary.ru, link.springer.com, frontiersin.org, pubmed.ncbi.nlm.nih.gov, Web of Science, Google Scholar и других.
Уже длительное время сердечно-сосудистые заболевания (ССЗ) занимают первое место в структуре общей смертности и заболеваемости. Было показано, что нарушения кальций-фосфорного обмена, в частности первичный гиперпаратиреоз (ПГПТ), могут вносить дополнительный вклад в их развитие и прогрессирование. Несмотря на прослеживаемую связь между ПГПТ и ССЗ, многие аспекты этой проблемы остаются недостаточно изученными. Состояние сердечно-сосудистой системы имеет решающее значение при оценке смертности пациентов, тем не менее в настоящее время отсутствуют четкие предикторы развития ССЗ при ПГПТ. Сердечно-сосудистая патология не входит в перечень абсолютных показаний к хирургическому лечению заболевания околощитовидных желез. Однако, принимая во внимание частоту артериальной гипертензии и других ССЗ, в обновленные отечественные рекомендации по ПГПТ включена консультация врача-кардиолога в целях диагностики сердечно-сосудистой патологии и подготовки к хирургическому лечению всем пациентам. Цель данной статьи — рассмотреть результаты актуальных исследований, посвященных влиянию ПГПТ на сердечно-сосудистую систему, проанализировать патогенетические механизмы и обсудить стратегию диагностики и лечения данной группы пациентов. Комплексная оценка кардиоваскулярных изменений с учетом патогенетических механизмов их развития направлена прежде всего на повышение качества и продолжительности жизни населения.
В мире более 2 млрд человек (это 30–39% населения планеты) имеют избыточную массу тела. На фоне имеющегося ожирения у пациентов прогрессирует коморбидная патология.
В статье представлена информация о патогенетических основах ожирения. Описаны особенности функционирования и гормональной активности адипоцитов. Рассмотрены механизмы влияния гормонов и метаболически активных веществ, вырабатываемых адипоцитами на организм человека, развитие коморбидной патологии.
На основании проведенного анализа можно предположить, что неизученные метаболиты, выделяемые жировой тканью, могут играть ключевую роль в регуляции метаболизма, воспалительных процессов и даже в развитии различных заболеваний, в том числе ожирения. Низкая эффективность лечения ожирения, несмотря на финансовые затраты, ежегодно превышающие 2 трлн долларов США, актуализирует пересмотр существующих подходов, разработку новых методов лечения и лекарственных препаратов, основанных на более глубоком понимании патогенетических основ ожирения.
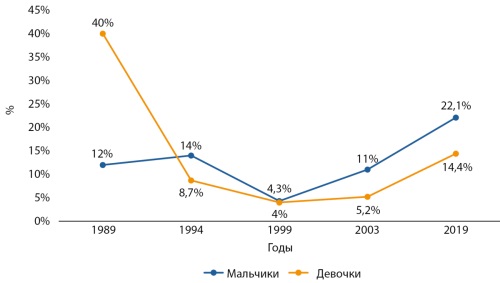
В настоящем обзоре проанализирована распространенность детского и подросткового ожирения на территории Российской Федерации. Приводятся данные различных региональных исследований. В отдельных регионах изучена многолетняя динамика ожирения. История изучения эпидемиологии ожирения в России насчитывает более 30 лет. По полученным данным, распространенность детского ожирения на территории всей страны остается высокой, продолжая увеличиваться. Во всех регионах, где удалось оценить многолетние тренды, распространенность ожирения возросла (максимум — 15,8% в Тюменской области). Среди детей ожирение регистрируется среди мальчиков чаще (максимум — 38,3% в Санкт-Петербурге) по сравнению с девочками (максимум — 37,4% в Санкт-Петербурге).
КЛИНИЧЕСКИЙ СЛУЧАЙ
Гормоны щитовидной железы участвуют в активации гликогенолиза и митохондриального окислительного фосфорилирования. Синдром Кохера-Дебре-Семелена (СКДС), или по-другому «гипотиреоидная миопатия» характеризуется снижением гликогенолитической активности, что приводит к отложению гликогена в мышцах, запасы которого начинают истощаться по мере достижения эутиреоза.
В основном пациенты предъявляют жалобы на мышечную слабость, преимущественно проксимальных групп мышц, скованность, миалгию и судороги. Отличительной чертой гипотиреоидных миопатий является обратимость клинических проявлений и значительное улучшение самочувствия на фоне медикаментозной компенсации заболевания. Однако отсутствие яркой клинической картины гипотиреоза в сочетании с редкой встречаемостью затрудняет раннюю диагностику и часто требует дифференциального диагноза с другими видами миопатий. Представлен клинический случай сочетания генетически детерминированной миопатии с экстрапирамидными симптомами, ассоциированной с мутацией в гене MICU1 и гипотиреоидной миопатии на фоне врожденного гипотиреоза у пациента от близкородственного брака.

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
ISSN 2306-5524 (Online)