Перейти к:
Клинический случай бессимптомной соматотропиномы у пациентки с морбидным ожирением
https://doi.org/10.14341/omet13103
Аннотация
Ожирение — это хроническое, эндокринное заболевание, обусловленное избыточным содержанием жировой ткани и ассоциированное с развитием ряда неблагоприятных метаболических процессов в организме.
В работе демонстрируется случай из практики, включающий выявление у пациентки гормонально-активной микроаденомы гипофиза на фоне морбидного ожирения и репродуктивной дисфункции. Применение описанного мультидисциплинарного подхода привело к своевременной верификации основного заболевания и маршрутизации пациентки в специализированный центр, позволило предотвратить развитие осложнений, ассоциированных с наличием акромегалии, и улучшить качество жизни. Восстановление циклической овариальной функции после нейрохирургического вмешательства на фоне регресса жировой массы привели к клиническому улучшению самочувствия и наступлению беременности. В настоящее время пациентка находится под наблюдением многопрофильной команды специалистов.
Ключевые слова
Для цитирования:
Гусейнова Р.М., Аверкина А.А., Рафаелян М.Г., Васюкова О.В., Андреева Е.Н., Пигарова Е.А., Азизян В.Н., Бондаренко Е.В., Копытина Д.А., Доровских А.В., Мокрышева Н.Г. Клинический случай бессимптомной соматотропиномы у пациентки с морбидным ожирением. Ожирение и метаболизм. 2025;22(1):52-59. https://doi.org/10.14341/omet13103
For citation:
Guseinova R.M., Averkina A.A., Rafaelyan M.G., Vasyukova O.V., Andreeva E.N., Pigarova E.A., Azizyan V.N., Bondarenko E.V., Kopytina D.A., Dorovskikh A.V., Mokrysheva N.G. Clinical case of somatotropinoma in a patient with morbid obesity. Obesity and metabolism. 2025;22(1):52-59. (In Russ.) https://doi.org/10.14341/omet13103
АКТУАЛЬНОСТЬ
Актуальность статьи определяется общими точками пересечения двух тяжелейших заболеваний: ожирения и акромегалии. Ввиду схожести патогенетических путей развития инсулинорезистентности, пациенты с данными патологическими состояниями имеют высокие риски возникновения сахарного диабета 2 типа (СД2), атеросклеротических сердечно-сосудистых заболеваний (АССЗ) и репродуктивных нарушений. Более того, сосуществование двух данных заболеваний одновременно существенно отягощает данные риски. Однако, в отличие от ожирения, диагноз которого устанавливается без трудностей, акромегалия долгое время может не проявлять себя клинически. В тот момент, когда клиника акромегалии дебютировала, к сожалению, радикальное лечение не способно нивелировать резвившиеся изменения. Именно поэтому крайне важным является умение предположить и выявить специфические для акромегалии ранние клинические проявления — триггеры инициации своевременного расширенного диагностического поиска.
Одними из первых клинических признаков акромегалии могут быть нарушение менструального цикла и бесплодие, что связано с изменениями в регуляции секреции гонадотропных гормонов или из-за прямого воздействия опухоли. Данные признаки могут служить основанием для поиска акромегалии еще до появления явных клинических изменений внешности и тяжелых нарушений, таких как кардиомиопатия, гипопитуитаризм, респираторная дисфункция, апноэ, атеросклероз, дисфункция эндотелия, артропатии (до 75%), остеопороз, нарушения углеводного, липидного и минерального обменов [1][2]. Согласно литературным данным, бесплодие может быть связано с неконтролируемой акромегалией (до половины пациентов с акромегалией). Гиперпролактинемия, которая встречается у трети пациентов, также играет значительную роль в нарушении фертильности, так как избыток пролактина может подавлять овуляцию и нарушать менструальный цикл [3]. Кроме того, нарушения углеводного обмена, которые встречаются у 10–70% пациентов с акромегалией, оказывают негативное влияние на фертильность. Важно отметить, что у беременных женщин с акромегалией повышен риск развития кардиометаболических осложнений, включая артериальную гипертензию (в том числе преэклампсию и эклампсию) и гестационный сахарный диабет (ГСД). Предикторами таких осложнений являются отсутствие контроля заболевания на момент зачатия, повышенный индекс массы тела (ИМТ) и наличие СД2 у родственников [4–9].
К сожалению, у большинства пациентов уже на этапе обращения к специалисту наблюдаются характерные признаки заболевания, что связано с задержкой постановки диагноза от появления первых симптомов вплоть до 8–10 лет [10].
Актуальность проблемы ожирения не вызывает сомнения.
В нашем примере отсутствие эффективного снижения веса на фоне неоднократных попыток немедикаментозного лечения, а также возникновение головных болей и репродуктивных нарушений позволили своевременно заподозрить и диагностировать гормонально-активную аденому гипофиза.
Данное клиническое наблюдение демонстрирует важность междисциплинарного, персонализированного подхода и представляет значительный интерес в практике.
ОПИСАНИЕ СЛУЧАЯ
Пациентка А., 36 лет, направлена в Центр лечения и профилактики метаболических заболеваний и ожирения ГНЦ ФГБУ «НМИЦ эндокринологии» Минздрава России (НМИЦ эндокринологии) с жалобами на прогрессирующий набор массы тела, повышенную утомляемость, периодически головные боли пульсирующего характера в лобной доле, эпизоды повышения артериального давления (АД) до 140/100 мм рт.ст., бесплодие. Исходно обратилась в наш центр на прием к репродуктологу в связи с планированием беременности.
В течение длительного времени наблюдается у гинеколога по поводу миомы матки, эндометриоидных кист яичников (оперирована в 2019 г.). Наследственность по эндокринопатиям не отягощена.
Из анамнеза известно, что избыточная масса тела беспокоит пациентку с подросткового возраста (в 14 лет вес 95 кг при росте 163 см). Максимальный вес в 23 года — 167 кг. Предпринимались многократные попытки по снижению массы тела (диеты, физические нагрузки) со слабоположительным и непродолжительным эффектом. Фармакотерапия ожирения не проводилась. В возрасте 32 лет на фоне перенесенного психоэмоционального стресса и интенсивных физических нагрузок пациентка отметила резкое прекращение менструаций, хотя до этого менструальный цикл был регулярным со времени менархе в 11 лет. При обследовании у гинеколога по месту жительства выявлено повышение пролактина до 628 мЕд/л (94–557), в связи с чем инициирована терапия каберголином в дозе 0,125 мг 2 раза в неделю. После однократного приема 0,125 мг каберголина цикл восстановился и сохранялся регулярным, препарат был отменен. В течение длительного времени пациентку также беспокоили головные боли, купируемые приемом триптанов, в связи с чем неврологом была направлена на магнито-резонансную томографию, при которой была впервые выявлена микроаденома гипофиза размерами 7х4 мм.
Впервые обследована в нашем центре в возрасте 36 лет объективно: морбидное ожирение (рост — 167 см, вес — 120 кг, окружность талии — 98 см, ИМТ — 43 кг/м²), перераспределение подкожно-жировой клетчатки — по абдоминальному типу, АД — 140/80 мм рт.ст., немногочисленные розовые стрии на боковых поверхностях туловища. Акантоза гирсутизма, укрупнения черт лица, периферических отеков не было; менструальный цикл регулярный.
Принимая во внимание наличие ожирения без наследственной предрасположенности, стрий на теле, артериальной гипертензии, микроаденомы гипофиза с целью исключения гормональной активности аденомы проведено дополнительное обследование. Выявлено повышение уровня ИФР-1 до 428 нг/мл (78–311 нг/мл), отмечена неадекватная супрессия СТГ (соматотропного гормона) в ходе ПГТТ (стандартного перорального глюкозотолерантного теста) (0–30–60–90–120 мин — 2,0–0,7–0,8–1,7–1,4 нг/мл). Эндогенный гиперкортицизм исключен (по результатам ночного подавляющего теста с 1 мг дексаметазона кортизол 19 нмоль/л). Нарушение секреции других тропных гормонов не выявлено. Исключены нарушения углеводного, белкового, минерального обменов. Выявлены дислипидемия, недостаточность витамина D (табл. 1). В общеклиническом анализе крови — без патологии. Лабораторных признаков анемии не получено.
Таблица 1. Показатели лабораторных исследований, 01.03.2023
|
Показатели |
Значение |
Единицы измерения |
Референсный интервал |
|
Пролактин |
375 |
мЕд/л |
94–500 |
|
Пролактин биоактивный |
262 |
мЕд/л |
64–365 |
|
ТТГ |
1,9 |
мМе/л |
0,2–3 |
|
Тестостерон |
0,5 |
нмоль/л |
0,3–2,5 |
|
ЛГ |
3,9 |
Ед/л |
2,6–12,1 |
|
ФСГ |
5,3 |
Ед/л |
1,9–11,7 |
|
Глюкоза |
5,0 |
ммоль/л |
3,1–6,1 |
|
Глюкоза 120 мин |
4,0 |
ммоль/л |
4,3–11,1 |
|
Гликированный гемоглобин |
5,2 |
% |
4–6 |
|
25(ОН)витамин D |
20,1 |
нг/мл |
30–100 |
|
Белок общий |
72 |
г/л |
64–83 |
|
Креатинин |
61 |
мкмоль/л |
50–98 |
|
АСТ |
13 |
Ед/л |
5–34 |
|
АЛТ |
15 |
Ед/л |
0–55 |
|
Кальций |
2,2 |
ммоль/л |
2,1–2,5 |
|
Альбумин |
42 |
г/л |
35–50 |
|
Холестерин общий |
7,6 |
ммоль/л |
3,3–5,2 |
|
Холестерин ЛПНП |
5,5 |
ммоль/л |
1,1–3 |
|
Холестерин ЛПВП |
1.4 |
ммоль/л |
1,1–2,6 |
|
Триглицериды |
1,7 |
ммоль/л |
0,1–1,7 |
|
Мочевая кислота |
331 |
мкмоль/л |
142–339 |
При УЗИ органов брюшной полости выявлены признаки умеренной гепатомегалии, диффузные изменения поджелудочной железы по типу липоматоза. Ввиду отягощенного гинекологического анамнеза и планируемой беременности, проведено УЗИ органов малого таза (признаки аденомиоза, миомы матки (по задней стенке в теле — интерстициальный узел с усиленным кровотоком при ЦДК, размером 5,5х5,2х3,8 см), эндометриоидной (?) кисты правого яичника) с последующей консультацией гинеколога.
По данным повторного МРТ головного мозга с контрастным усилением, визуализирована эндо-инфраселлярная микроаденома гипофиза размерами 7,5x6x8,8 мм (рис. 1).
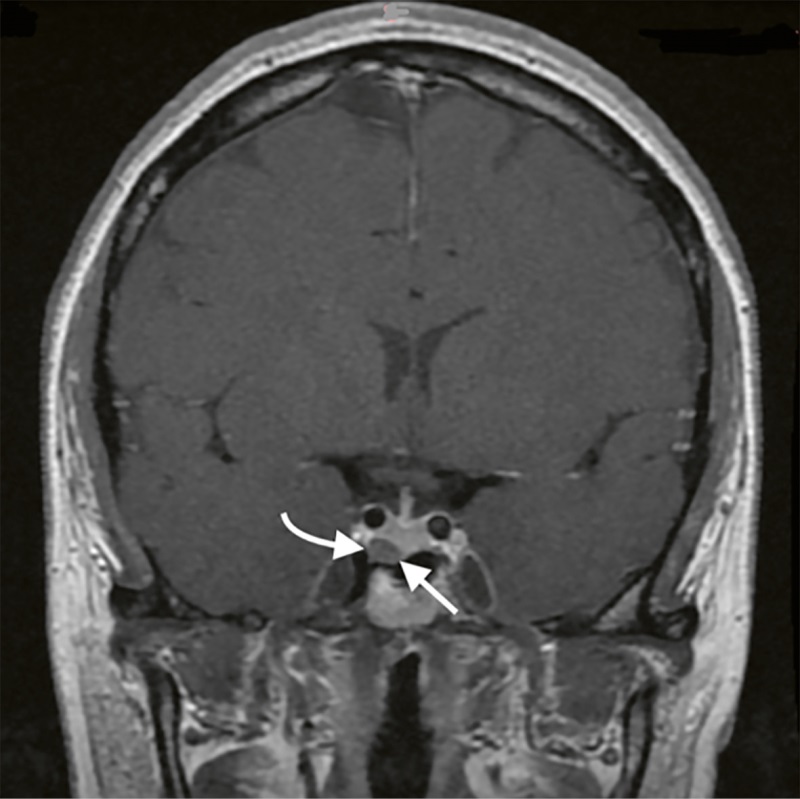
Рисунок 1. МРТ головного мозга с внутривенным болюсным контрастированием.
Примечание: на фронтальных снимках в режиме Т1 с контрастным усилением визуализируется эндо-инфраселлярная аденома гипофиза (белые стрелки).
На основании проведенных обследований установлен диагноз: «Акромегалия? Микроаденома гипофиза с эндо-инфра-пара(D)(Knosp II)селлярным распространением. Морбидное ожирение (ИМТ — 43,0 кг/м²). Дислипидемия 2а типа. Гипертриглицеридемия. Дивертикулы нисходящей кишки. Гиперурикемия. Аденомиоз. Эндометриоидная киста правого яичника, миома матки. Гемангиома в S6 печени, простые кисты в печени. Субкапсулярная киста правой почки малых размеров (Bosniak I). Варикозное расширение вен нижних конечностей. Недостаточность витамина D». В ходе повторного обследования подтверждено наличие активной стадии акромегалии: в лабораторных анализах сохранялось умеренное повышение концентрации ИФР-1 — 364 нг/мл (78–311), при этом концентрация базального СТГ — в пределах референсного интервала лаборатории 2,1 нг/мл (0,0–6,9). В ходе ПГГТ с 75 г глюкозы per os должного подавления СТГ не отмечено (0–30–60–90–120 мин — 2,2—1, 1–2, 0–2, 3–3,1 нг/мл). Исследованы другие тропные функции гипофиза: данных за вторичный гипотиреоз (ТТГ — 2,5 мМЕ/л (0,2–3,5), свТ4 — 12,6 пмоль/л (9,0–19,0)), вторичный гипокортицизм (кортизол утром — 493 нмоль/л (171–536), АКТГ — 25,9 пг/мл), гипо- и гиперпролактинемию (пролактин — 470 мЕд/л (94–500) не выявлено. В рамках исключения МЭН-1 синдрома исследован уровень ПТГ — 28 пг/мл (15–65), данных за гиперкальциемию не получено (альбумин-скорректированный кальций — 2,3 ммоль/л (2,1–2,5)). Пациентка направлена в отделение нейрохирургии НМИЦ эндокринологии, где проведено трансназальное транссфеноидальное удаление эндоселлярной аденомы гипофиза. Послеоперационный период протекал без осложнений.
При плановом гистологическом исследовании материал представлен новообразованием солидного строения из клеток с базофильной цитоплазмой. По результатам проведенного иммуногистохимического исследования выявлена цитоплазматическая экспрессия CAM5.2, выраженная экспрессия соматотропного гормона, очаговая слабовыраженная экспрессия пролактина (рис. 2).
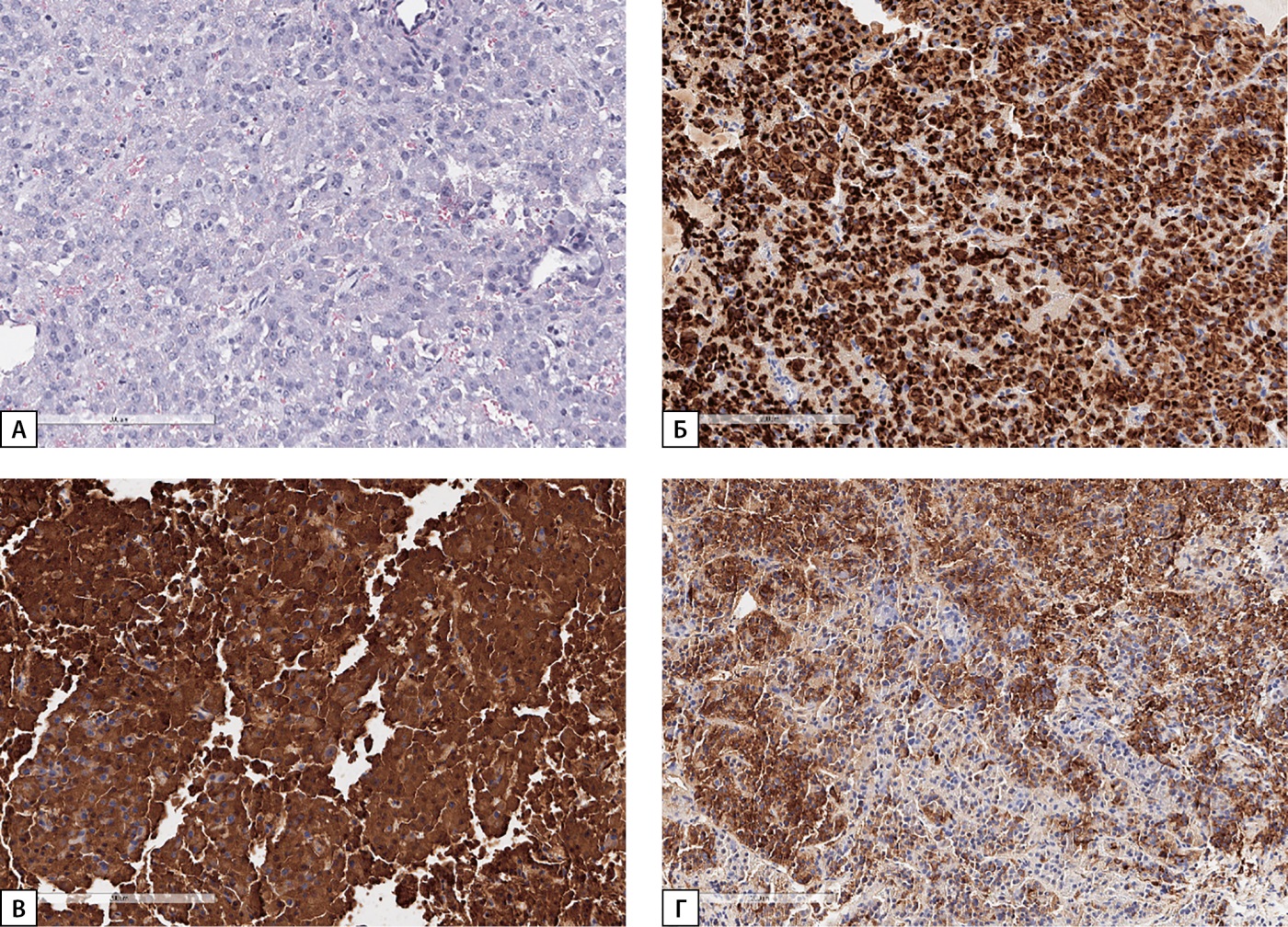
Рисунок 2. Морфологическое и иммуногистохимическое исследование опухоли гипофиза.
Примечание: А — опухоль солидного строения (окраска гематоксилин эозином); Б — цитоплазматическое окрашивание с антителами к CAM5.2; В — диффузное цитоплазматическое окрашивание с антителами к соматотропному гормону; Г — очаговое цитоплазматическое окрашивание с антителами к пролактину.
На 5-е сутки после оперативного вмешательства, по данным лабораторного исследования, достигнута нормализация ИФР-1, при этом должного подавления СТГ в ходе ОГТТ не отмечено. Через 3 месяца при контрольном обследовании у пациентки наблюдалась положительная клиническая (снижение частоты и интенсивности головной боли, улучшение общего самочувствия) и лабораторная динамика (табл. 2). Данных за вторичный гипотиреоз (свТ4 — 14,2 пмоль/л (9–19), гипогонадотропный гипогонадизм (ФСГ — 8,0 Ед/л (1,9–11,7), ЛГ — 3,7 Ед/л (2,6–12,1), эстрадиол — 248 пмоль/л (97–592), несахарный диабет (осмоляльность плазмы — 282 mOsm/кг (280–300), натрий — 138 ммоль/л (136–145), калий — 4,9 ммоль/л (3,5–5,1), вторичную надпочечниковую недостаточность (кортизол крови утром — 535 нмоль/л (171–536) не получено.
Таблица 2. Показатели крови в динамике после оперативного лечения
|
Показатель |
5-е сутки после операции |
Через 3 месяца после операции |
Единицы измерения |
Референсный интервал |
|
СТГ в ходе ОГТТ: |
0 мин — 0,7 30 мин — 0,6 60 мин — 1,0 90 мин — 0,9 120 мин — 0,4 |
нг/мл нг/мл нг/мл нг/мл нг/мл |
Менее 0,4 |
|
|
ИФР-1 |
292 |
160 |
нг/мл |
78–311 |
Уже в раннем послеоперационном периоде у нашей пациентки достигнуто клиническое улучшение, уровень ИФР-1 через 12 недель фиксировался в пределах референсных значений. В настоящее время сохраняется ремиссия акромегалии, через 3 месяца после оперативного лечения отмечена положительная динамика массы тела (снижение веса на 11 кг), значительное улучшение качества жизни на фоне модификации образа жизни и поведенческой терапии. Рекомендовано исследование уровня ИФР-1 и проведение МРТ головного мозга с контрастным усилением через 6 месяцев после операции, продолжение наблюдения мультидисциплинарной командой специалистов (эндокринолога, диетолога, клинического психолога, гинеколога-репродуктолога, реабилитолога) с целью удержания достигнутых результатов в долгосрочной перспективе и снижения рисков акушерской патологии.
ОБСУЖДЕНИЕ
Увеличение массы тела, головные боли, повышение АД, слабость и сонливость, ночное апноэ, храп, нарушение половой функции (менструального цикла у женщин и эректильная дисфункция у мужчин, бесплодие), отечность, стрии — могут заставить обратиться пациентов к врачам разных специальностей. У нашей пациентки не было выраженных признаков изменения внешности по акромегалоидному типу (грубые черты лица, увеличение носа и надбровных дуг, расширение межзубных промежутков (диастема). Представленный клинический случай достаточно интересен ранней постановкой диагноза. Постепенное появление симптоматики и часто медленное развитие заболевания может быть одной из причин того, что средний возраст, в котором диагностируется акромегалия, как правило приходится на пятое десятилетие жизни, при более раннем выявлении с медианой 4–5 лет [4][11][12][13]. В работе Lamas и соавт. исследуются особенности бессимптомных соматотропином и подчеркивается трудность их диагностики ввиду отсутствия явных изменений внешности [14]. Такие опухоли могут оставаться нераспознанными вплоть до развития масс-эффекта или случайного обнаружения при обследовании по другой причине. Хронический избыток СТГ и ИФР-1 имеет драматические последствия в отношении кардио-метаболических параметров, таких как повышение АД, гипергликемия и гиперхолестеринемия, гипертрофия левого желудочка, диастолическая, систолическая и эндотелиальная дисфункции и даже сердечная недостаточность, заболевания органов дыхания, злокачественные новообразования желудочно-кишечного тракта. В свою очередь своевременная диагностика и адекватное лечение позволяют приблизить выживаемость пациентов с акромегалией к общепопуляционному уровню [15].
Клиническая картина акромегалии складывается из множественных системных проявлений, обусловленных длительной гиперпродукцией СТГ и ИФР-1, а также последствий давления (масс-эффекта) соматотропиномы на окружающие ткани. Из-за медленного развития изменений внешности заболевание может оставаться нераспознанным в течение многих лет. Это в том числе обуславливает необходимость исключения гиперпродукции СТГ при выявлении инциденталомы гипофиза при отсутствии явных внешних изменений. Селективный скрининг акромегалии целесообразен среди пациентов с сахарным диабетом, артериальной гипертензией (особенно молодого возраста), апноэ сна, ожирением, отеками при наличии жалоб на головную боль, повышенную потливость, боли в суставах, нарушение менструального цикла или бесплодие. Согласно проекту отечественных клинических рекомендаций 2024 г. [16], алгоритм ранней диагностики акромегалии включает несколько ключевых этапов: оценка клинических симптомов и триггеров заболевания. На втором этапе диагностического поиска для лабораторного подтверждения акромегалии важна оценка уровня ИФР-1 (соматомедина С) в сыворотке крови, уровень которого отражает интегрированную секрецию СТГ. При этом важно помнить, что различные состояния могут приводить к ложному повышению или снижению уровня ИФР-1, например, ИФР-1 снижается при печеночной или почечной недостаточности, декомпенсированном гипотиреозе, недостаточности питания, декомпенсированном сахарном диабете, на фоне приема эстрогенов. У пациентов без явных клинических признаков акромегалии и/или с умеренным повышением уровня ИФР-1 (ИФР-1 индекс — соотношение уровня ИФР-1 к верхнему референсному значению в соответствии с полом и возрастом — менее 1,3) для лабораторного подтверждения диагноза рекомендуется определение реакции СТГ на гипергликемию (СТГ в ходе перорального глюкозотолерантного теста (ПГТТ)): подавление СТГ в ходе ПГТТ менее 1,0 нг/мл хотя бы в одной точке, кроме исходной, позволяет исключить диагноз. Следует помнить о «мягкой» форме акромегалии (так называемой микромегалии), при которой, несмотря на явные клинические проявления заболевания и значимо повышенный уровень ИФР-1, может наблюдаться подавление СТГ в ходе ПГТТ. Далее при лабораторном подтверждении акромегалии рекомендуется проведение магнитно-резонансной томографии (МРТ) гипофиза с внутривенным контрастированием для определения размера, расположения и характера роста аденомы гипофиза. После биохимического подтверждения акромегалии и визуализации аденомы гипофиза требуется исключение осложнений и сопутствующей патологии, влияющей на выбор метода лечения: оценка углеводного обмена (нарушения выявляются более чем в 50% случаев, преимущественно у пациентов с высоким ИМТ, наследственным анамнезом сахарного диабета), исследование уровня пролактина в крови для исключения гиперпролактинемии (выявляется у 40% пациентов с акромегалией), в случае с бессимптомной гиперпролактинемией — исключение феномена макропролактинемии, при наличии показаний (синусовая тахикардия, фибрилляция предсердий) целесообразно исследование всей панели тиреоидных гормонов для исключения смешанной СТГ/ТТГ-секретирующей опухоли — тиреотропиномы.
Патогенез ожирения и акромегалии тесно взаимосвязан: повышенная секреция СТГ приводит к инсулинорезистентности и нарушению обмена веществ, что в свою очередь способствует развитию ожирения. В работе Freda и соавт. отмечают, что при длительной гиперсекреции ГР увеличивается гликогеногенез и снижается утилизация глюкозы, что сопровождается развитием гипергликемии и инсулинорезистентности. Не менее важна роль ИФР-1, высокая концентрация которого способствует десенситизации инсулиновых рецепторов, уменьшая их способность к активации при нормальных уровнях инсулина. Это создает порочный круг, где повышенные ГР и ИФР-1 приводят к прогрессированию инсулинорезистентности [17]. Кроме того, акромегалия приводит к нарушению толерантности к глюкозе у многих пациентов, а в 50% случаев — к сахарному диабету. Снижение поглощения глюкозы происходит за счет повышения уровня свободных жирных кислот и снижения экспрессии рецепторов GLUT1 и GLUT 4 [18].
Гиперсекреция СТГ также приводит к развитию провоспалительного состояния в жировых тканях с изменением генов, кодирующих висфатин и интерлейкин-6 [19]. Степень инсулинорезистентности коррелирует с уровнем ИФР-1 [20] и улучшается по мере лечения заболевания. Описано, что уровни висфатина и ирисина коррелируют с метаболическими нарушениями и факторами сердечно-сосудистого риска [21][22]. Когда проатеросклеротические эффекты, опосредованные MAPK, преобладают над протективными эффектами, опосредованными PI3K-Akt, ГР и ИФР-1 оказывают отрицательное воздействие на сердечно-сосудистую систему [23].
СТГ и ИФР-1 играют ключевую роль в регулировании массы тела и состава тканей. Имеются данные, демонстрирующие изменения состава тела у пациентов с акромегалией в зависимости от активности заболевания: они в активной стадии имеют высокий процент жировой массы и низкое содержание мышечной по сравнению с теми, кто находится в ремиссии [24][25].
Репродуктивная дисфункция при сочетании морбидного ожирения и микроаденомы гипофиза может быть объяснена как прямым воздействием гиперпродукции тропных гормонов (в том числе СТГ), так и вторичными метаболическими нарушениями, такими как нарушения углеводного обмена и дислипидемия [26][27], что обуславливает необходимость комплексного обследования при первичном обращении. Ожирение само по себе оказывает негативное влияние на репродуктивное здоровье женщин. В работе Itriyeva K. и соавт. представили обзор данных о влиянии ожирения на менструальный цикл и репродукцию. Ожирение часто ассоциируется с гиперинсулинемией, гиперсекрецией андрогенов, что может привести к ановуляторным циклам и способствует риску развития синдрома поликистозных яичников. После нормализации метаболических нарушений у части женщин овуляторный менструальный цикл восстанавливается и наступает беременность [28][29]. Акромегалия в активной стадии может снижать фертильность за счет прямого воздействия избыточного СТГ и ИФР-1 на репродуктивную систему, что увеличивает риск осложнений при беременности, таких как преэклампсия ГСД.
В одном из исследований оценивалось состояние репродуктивной сферы у женщин после удаления аденомы гипофиза, авторы выяснили, что наступление беременности возможно, однако некоторые пациентки все еще сталкиваются с нарушением менструального цикла и неудовлетворительным результатом лечения бесплодия [30]. После удаления аденомы гипофиза у пациенток с акромегалией могут быть риски, включая рецидив заболевания, нарушение секреции гормонов и другие эндокринопатии. В исследовании Abreu A. и соавт. подчеркивают важность достижения компенсации акромегалии и нормализацию уровня СТГ и ИФР-1 перед планированием беременности [1]. В другом исследовании авторы рассматривают случай успешного наступления беременности после частичной транссфеноидальной резекции макроаденомы гипофиза, что доказывает возможность восстановления фертильности и наступления беременности [31].
Бесплодие чаще наблюдается при активной стадии заболевания, и зачастую для наступления беременности пациенткам требуется лечение. Оценка исходного объема опухоли при планируемой беременности полезна для безопасного планирования мониторинга во время беременности. Как следствие физиологических изменений, распространенность ГСД и гипертонии выше у женщин с акромегалией, но это, по-видимому, коррелирует с показателями контроля до беременности, а не со степенью повышения уровня ИФР-1 [32].
Уже в раннем послеоперационном периоде у нашей пациентки достигнуто клиническое улучшение. В дальнейшем удалось нормализовать массу тела и своевременно запланировать беременность.
ЗАКЛЮЧЕНИЕ
Представленный клинический случай демонстрирует важность комплексной оценки пациентов с ожирением, что позволяет своевременно начать лечение и дальнейшее планирование беременности. Обращает внимание связь между акромегалией и ожирением, которое само по себе является фактором риска развития репродуктивных нарушений. Ожирение усугубляет симптомы и может затруднять течение акромегалии, создавая дополнительные проблемы с репродуктивной функцией. Акромегалия, в свою очередь, может приводить к различным изменениям, включая менструальную дисфункцию и снижение фертильности. Результаты исследований показывают, что у пациенток с микроаденомой гипофиза, страдающих акромегалией и морбидным ожирением, репродуктивная функция может улучшаться после получения адекватного лечения и достижения ремиссии заболевания.
Данная статья подчеркивает необходимость комплексного подхода к ведению пациентов с акромегалией, ожирением и репродуктивной дисфункцией, включая регулярный мониторинг показателей и индивидуализированные стратегии лечения.
Особое внимание следует уделять сбору истории болезни и жизни, наследственного анамнеза у пациенток с ожирением с целью раннего выявления каких-либо немых эндокринопатий.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена в рамках государственного задания «Механизмы развития эффекта «плато» после снижения массы тела и рецидива ожирения у детей и взрослых: адаптивный термогенез, миокиновый профиль, пищевое поведение, метаболические, нутритивные и провоспалительные маркеры», регистрационный номер 1023022400038-1
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Все авторы внесли равный вклад в работу: анализ данных и их интерпретацию, написание статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациента. Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Ожирение и метаболизм».
Список литературы
1. Abreu A, Tovar AP, Castellanos R, et al. Challenges in the diagnosis and management of acromegaly: a focus on comorbidities. Pituitary. 2016;19(4):448-457. doi:10.1007/s11102-016-0725-2
2. Зайдиева Я. З., Рифатова А. В. Акромегалия у женщин: взгляд гинеколога //Российский вестник акушера-гинеколога. – 2014. – Т. 14. – №. 3. – С. 38-42.
3. Popescu AD, Carsote M, Valea A, et al. Approach of Acromegaly during Pregnancy. Diagnostics (Basel). 2022;12(11):2669. Published 2022 Nov 2. doi:10.3390/diagnostics12112669
4. Dal J, Feldt-Rasmussen U, Andersen M, et al. Acromegaly incidence, prevalence, complications and long-term prognosis: a nationwide cohort study. Eur J Endocrinol. 2016;175(3):181-190. doi:10.1530/EJE-16-0117
5. Park KH, Lee EJ, Seo GH, Ku CR. Risk for Acromegaly-related Comorbidities by Sex in Korean Acromegaly. J Clin Endocrinol Metab. 2020;105(4):dgz317. doi:10.1210/clinem/dgz317
6. Guo X, Fu H, Pang H, Xing B. Risk of left ventricular hypertrophy and diastolic and systolic dysfunction in Acromegaly: A meta-analysis. J Clin Neurosci. 2018;48:28-33. doi:10.1016/j.jocn.2017.10.067
7. Shi S, Zhang L, Yu Y, Wang C, Li J. Acromegaly and non-parathyroid hormone-dependent hypercalcemia: a case report and literature review. BMC Endocr Disord. 2021;21(1):90. Published 2021 May 1. doi:10.1186/s12902-021-00756-z
8. Khan SA, Ram N, Masood MQ. Patterns of Abnormal Glucose Metabolism in Acromegaly and Impact of Treatment Modalities on Glucose Metabolism. Cureus. 2021;13(3):e13852. Published 2021 Mar 12. doi:10.7759/cureus.13852
9. de Silva T, Cosentino G, Ganji S, Riera-Gonzalez A, Hsia DS. Endocrine Causes of Hypertension. Curr Hypertens Rep. 2020;22(11):97. Published 2020 Oct 20. doi:10.1007/s11906-020-01108-3
10. Carroll PV, Joshi MN. Acromegaly. In: Feingold KR, Anawalt B, Blackman MR, et al., eds. Endotext. South Dartmouth (MA): MDText.com, Inc.; September 7, 2022.
11. Chevallier M, Pontier S, Sedkaoui K, Caron P, Didier A. Caractéristiques du syndrome d'apnées du sommeil dans une cohorte de patients acromégales [Characteristics of sleep apnea syndrome in a cohort of patients with acromegaly]. Rev Mal Respir. 2012;29(5):673-679. doi:10.1016/j.rmr.2011.11.017
12. Penev PD. Sleep deprivation and energy metabolism: to sleep, perchance to eat?. Curr Opin Endocrinol Diabetes Obes. 2007;14(5):374-381. doi:10.1097/MED.0b013e3282be9093
13. Salvador J, Iriarte J, Silva C, Gómez Ambrosi J, Díez Caballero A, Frühbeck G. El síndrome de apneas obstructivas del sueño en la obesidad: un conspirador en la sombra [The obstructive sleep apnoea syndrome in obesity: a conspirator in the shadow]. Rev Med Univ Navarra. 2004;48(2):55-62.
14. Струева Н. В. и др. Ожирение и сон //Ожирение и метаболизм. – 2013. – №. 3 (36). – С. 11-18.
15. Ogedegbe OJ, Cheema AY, Khan MA, et al. A Comprehensive Review of Four Clinical Practice Guidelines of Acromegaly. Cureus. 2022;14(9):e28722. Published 2022 Sep 3. doi:10.7759/cureus.28722
16. Hage M, Kamenický P, Chanson P. Growth Hormone Response to Oral Glucose Load: From Normal to Pathological Conditions. Neuroendocrinology. 2019;108(3):244-255. doi:10.1159/000497214
17. Lavrentaki A, Paluzzi A, Wass JA, Karavitaki N. Epidemiology of acromegaly: review of population studies. Pituitary. 2017;20(1):4-9. doi:10.1007/s11102-016-0754-x
18. Ganz JC. Pituitary adenomas. Prog Brain Res. 2022;268(1):191-215. doi:10.1016/bs.pbr.2021.10.032
19. Ambrosio MR, Gagliardi I, Chiloiro S, et al. Acromegaly in the elderly patients. Endocrine. 2020;68(1):16-31. doi:10.1007/s12020-020-02206-7
20. Lamas C, García-Martínez A, Cámara R, Fajardo-Montanana C, Viguera L, Aranda I. Silent somatotropinomas. Minerva Endocrinol. 2019;44(2):137-142. doi:10.23736/S0391-1977.18.02946-2
21. Esposito D, Ragnarsson O, Granfeldt D, Marlow T, Johannsson G, Olsson DS. Decreasing mortality and changes in treatment patterns in patients with acromegaly from a nationwide study. Eur J Endocrinol. 2018;178(5):459-469. doi:10.1530/EJE-18-0015
22. Frara S, Maffezzoni F, Mazziotti G, Giustina A. Current and Emerging Aspects of Diabetes Mellitus in Acromegaly. Trends Endocrinol Metab. 2016;27(7):470-483. doi:10.1016/j.tem.2016.04.014
23. Olarescu NC, Bollerslev J. The Impact of Adipose Tissue on Insulin Resistance in Acromegaly. Trends Endocrinol Metab. 2016;27(4):226-237. doi:10.1016/j.tem.2016.02.005
24. Reid TJ, Jin Z, Shen W, et al. IGF-1 levels across the spectrum of normal to elevated in acromegaly: relationship to insulin sensitivity, markers of cardiovascular risk and body composition. Pituitary. 2015;18(6):808-819. doi:10.1007/s11102-015-0657-2
25. Calan M, Demirpence M. Increased circulating levels of irisin are associated with cardiovascular risk factors in subjects with acromegaly. Hormones (Athens). 2019;18(4):435-442. doi:10.1007/s42000-019-00151-3
26. Ciresi A, Amato MC, Pizzolanti G, Giordano C. Serum visfatin levels in acromegaly: Correlation with disease activity and metabolic alterations. Growth Horm IGF Res. 2015;25(5):240-246. doi:10.1016/j.ghir.2015.07.002
27. Lopes AA, Albuquerque L, Fontes M, Rego D, Bandeira F. Body Composition in Acromegaly According to Disease Activity - Performance of Dual X-Ray Absorptiometry and Multifrequency Bioelectrical Impedance Analysis. Front Endocrinol (Lausanne). 2022;13:866099. Published 2022 May 18. doi:10.3389/fendo.2022.866099
28. Khiyami A, Mehrotra N, Venugopal S, et al. IGF-1 is positively associated with BMI in patients with acromegaly. Pituitary. 2023;26(2):221-226. doi:10.1007/s11102-023-01307-6
29. Vorotnikova S. Y., Pigarova E. A., Dzeranova L. K. Metabolicheskie effekty gormona rosta //Obesity and metabolism. – 2011. – Т. 8. – №. 4. – С. 55-59.
30. Schmid C, Goede DL, Hauser RS, Brändle M. Increased prevalence of high Body Mass Index in patients presenting with pituitary tumours: severe obesity in patients with macroprolactinoma. Swiss Med Wkly. 2006;136(15-16):254-258. doi:10.4414/smw.2006.10955
31. Itriyeva K. The effects of obesity on the menstrual cycle. Curr Probl Pediatr Adolesc Health Care. 2022;52(8):101241. doi:10.1016/j.cppeds.2022.101241
32. Fielder S, Nickkho-Amiry M, Seif MW. Obesity and menstrual disorders. Best Pract Res Clin Obstet Gynaecol. 2023;89:102343. doi:10.1016/j.bpobgyn.2023.102343
33. Pirchio R, Auriemma RS, Grasso LFS, et al. Fertility in Acromegaly: A Single-Center Experience of Female Patients During Active Disease and After Disease Remission. J Clin Endocrinol Metab. 2023;108(8):e583-e593. doi:10.1210/clinem/dgad042
34. Tomczyk K, Rzymski P, Woźniak J, Wilczak M. Pregnancy in a woman with acromegaly after transsphenoidal partial resection of pituitary macroadenoma - a case report. Pol Merkur Lekarski. 2017;43(258):268-271.
35. Caron P, Broussaud S, Bertherat J, et al. Acromegaly and pregnancy: a retrospective multicenter study of 59 pregnancies in 46 women. J Clin Endocrinol Metab. 2010;95(10):4680-4687. doi:10.1210/jc.2009-2331
Об авторах
Р. М. ГусейноваРоссия
Гусейнова Раисат Магомедкамиловна
117036, Москва, ул. Дм. Ульянова, д. 11
Scopus Author ID: 58077013800
Researcher ID: HDO-1221-2022
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
А. А. Аверкина
Россия
Аверкина Анастасия Алексеевна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
М. Г. Рафаелян
Россия
Рафаелян Манушак Гагиковна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
О. В. Васюкова
Россия
Васюкова Ольга Владимировна, к.м.н.
Москва
Researcher ID: AAO-375 0-2020
Scopus Author ID: 57192194141
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Е. Н. Андреева
Россия
Андреева Елена Николаевна, д.м.н., профессор
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Е. А. Пигарова
Россия
Пигарова Екатерина Александровна, д.м.н.
Москва
Scopus Author ID: 55655098500
Researcher ID: T-9424-2018
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
В. Н. Азизян
Россия
Азизян Вилен Неронович, к.м.н., нейрохирург
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Е. В. Бондаренко
Россия
Бондаренко Екатерина Владимировна, к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Д. А. Копытина
Россия
Копытина Дарья Александровна
117036, Москва, ул. Дм. Ульянова, д. 11
Scopus Author ID: 58853779500
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
А. В. Доровских
Россия
Доровских Анна Владимировна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Н. Г. Мокрышева
Россия
Мокрышева Наталья Георгиевна, д.м.н., профессор, член-корр. РАН
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. МРТ головного мозга с внутривенным болюсным контрастированием. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(161KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Морфологическое и иммуногистохимическое исследование опухоли гипофиза. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(3MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Гусейнова Р.М., Аверкина А.А., Рафаелян М.Г., Васюкова О.В., Андреева Е.Н., Пигарова Е.А., Азизян В.Н., Бондаренко Е.В., Копытина Д.А., Доровских А.В., Мокрышева Н.Г. Клинический случай бессимптомной соматотропиномы у пациентки с морбидным ожирением. Ожирение и метаболизм. 2025;22(1):52-59. https://doi.org/10.14341/omet13103
For citation:
Guseinova R.M., Averkina A.A., Rafaelyan M.G., Vasyukova O.V., Andreeva E.N., Pigarova E.A., Azizyan V.N., Bondarenko E.V., Kopytina D.A., Dorovskikh A.V., Mokrysheva N.G. Clinical case of somatotropinoma in a patient with morbid obesity. Obesity and metabolism. 2025;22(1):52-59. (In Russ.) https://doi.org/10.14341/omet13103

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































