Перейти к:
Метаболиты микробиоты кишечника и параметры инсулинорезистентности как потенциальные индикаторы развития и прогрессирования артериальной гипертензии
https://doi.org/10.14341/omet13212
Аннотация
Обоснование. Стабильный ежегодный прирост публикаций в области изучения микробиоты кишечника (МК) и резистентности к инсулину свидетельствует о растущем признании важности этой проблемы исследований.
Цель. Исследовать особенности и взаимосвязь метаболитов МК и параметров инсулинорезистентности (ИР) у пациентов с артериальной гипертензией (АГ) и определить их роль в качестве индикаторов развития и прогрессирования АГ.
Материалы и методы. В сравнительное исследование вошли пациенты с АГ I–II стадии, в возрасте от 25 до 65 лет, получающие базовую антигипертензивную терапию. Всем пациентам проводилось исследование биообразцов крови и кала. Исследовали параметры МК: уровень триметиламина (ТМА), триметиламина-N-оксида (ТМАО), эндотоксина, короткоцепочечные жирные кислоты (КЦЖК) — уксусная — С2, пропионовая — С3, масляная — С4; биохимические параметры — липидный профиль, глюкозу натощак, концентрацию вч-С-реактивного белка (вч-СРБ), уровень интерлейкина (ИЛ) 1β, 6, 8, С-пептид, индекс триглицериды — глюкоза (TyG). Проводились суточное мониторирование артериального давления (АД) на аппарате BPLaB (Россия), и сфигмография на аппарате Vasera VS-1000 Series (Япония), оценивали показатель СРПВ — скорость распространения пульсовой волны. Статистический анализ проводился с использованием программ IBM SPSS Statistics 21.
Результаты. Включен 161 пациент, сформированы 3 группы: 1-я группа (контрольная) — лица без АГ (n=45), 2-я группа — пациенты с АГ 1-3 степенью (n=53); 3-я группа — пациенты с АГ 1-3 степенью и абдоминальным ожирением (АО) (n=63), сопоставимых по возрасту, полу, проводимой терапии. Пациенты в 3-й группе значимо отличались от пациентов 1-й и 2-й групп по параметрам ИМТ, ОТ, ОБ и от 1-й группы значениями офисного САД, ДАД (p < 0,001) и СРПВ (р=0,015). Уровень ТМАО, эндотоксина был значимо выше в 3-й группе пациентов по сравнению с 1-й группой. Суммарное содержание монокарбоновых кислот было выше во 2-й и 3-й группах по сравнению с 1-й группой (p < 0,002, p < 0,004). В группах с АГ зарегистрировано значимое превышение уровня ОХС, ХСЛПНП, а в 3-й зарегистрирован максимальный уровень ТГ (p=0,001), TyG, ИЛ-1β и вч-СРБ (p=0,001). Методом логистической регрессии выделена зависимость СРПВ от КЦЖКС2, TyG и САД от TyG в 3-й группе пациентов.
Заключение. Сопряженность связи метаболитов МК и индекса TyG с параметрами СРПВ и АД может подтверждать роль биомаркеров в качестве индикаторов развития и прогрессирования АГ. Внедрение в клиническую практику этих диагностических методов будет способствовать осуществлению ранних профилактических и терапевтических стратегий вмешательства в течение АГ.
Ключевые слова
Для цитирования:
Петелина Т.И., Авдеева К.С., Валеева Л.Л., Горбачевский А.В., Капустина А.А., Гапон Л.И. Метаболиты микробиоты кишечника и параметры инсулинорезистентности как потенциальные индикаторы развития и прогрессирования артериальной гипертензии. Ожирение и метаболизм. 2025;22(3):145-155. https://doi.org/10.14341/omet13212
For citation:
Petelina T.I., Avdeeva K.S., Valeeva L.L., Gorbachevskii A.V., Kapustina A.A., Gapon L.I. Gut microbiota metabolites and insulin resistance parameters as potential indicators of the development and progression of arterial hypertension. Obesity and metabolism. 2025;22(3):145-155. (In Russ.) https://doi.org/10.14341/omet13212
ОБОСНОВАНИЕ
В 2019 г. Sun S. et al. опубликовали первое популяционное когортное исследование взаимосвязи между микробиотой кишечника и гипертонией, которое показало, что разнообразие микробиоты кишечника отрицательно коррелирует с гипертонией. Были выявлены значительные различия в структуре и составе микробиоты кишечника у пациентов с гипертонией при разном уровне риска сердечно-сосудистых заболеваний, а некоторые кишечные микробы были тесно связаны с тяжестью гипертонии. Полученные данные подтвердили, что микробиота кишечника является ключевым фактором, влияющим на развитие и прогрессирование гипертонии [1].
Ge Y. et al. показали, что у пациентов с гипертонией наблюдается явная связь нарушения микробиоты кишечника и дисфункции кишечного барьера. Повреждение кишечного барьера не только вызывает дисбиоз микробиоты кишечника, но и приводит к повышению проницаемости кишечника, бактериальной транслокации эндотоксина, системному воспалению, которые, в свою очередь, усиливают дисфункцию эндотелиальных клеток и в итоге инициируют или усугубляют артериальную гипертензию [2]. Kim S. et al. подтвердили, что у пациентов с гипертонией значительно повышался уровень белков, связывающих жирные кислоты в кишечнике, липополисахарида (ЛПС) и провоспалительных Т-хелперов 17 (Th17), что указывает на наличие системного воспаления на фоне повышенной проницаемости кишечника у пациентов с гипертонией [3].
O’Donnell JA. et al. обратили внимание на то, что микробиом кишечника может регулировать артериальное давление несколькими способами, в первом случае за счет метаболитов, которые могут быть как полезными (например, короткоцепочечные жирные кислоты и индолуксусная кислота), так и вредными (например, N-оксид триметиламина), и путем активирования сигнальных путей через рецепторы, связанные с G-белком или путем прямой активации иммунных клеток. Более того, нарушение эпителиального барьера кишечника может активировать механизмы, такие как ренин-ангиотензин-альдостероновая система, вегетативная нервная система и иммунная система [4].
Существует также ряд работ, свидетельствующих о том, что микробиота кишечника является фактором развития инсулинорезистентности, поскольку регулирует выработку метаболитов, влияющих на метаболизм глюкозы и липидов. Кроме этого, микробиота кишечника регулирует выработку короткоцепочечных жирных кислот (КЦЖК), влияет на выработку кишечных гормонов и контролирует выработку цитокинов, которые играют ключевую роль в регулировании воспаления и резистентности к инсулину, особенно у пациентов с ожирением [5][6].
Стабильный интерес в представляемой нами теме исследования определяет ее актуальность и свидетельствует о растущем признании важности этой области исследований [5].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Исследовать особенности и взаимосвязь метаболитов МК с параметрами инсулинорезистентности (ИР) у пациентов с АГ и определить их роль в качестве индикаторов развития и прогрессирования АГ.
МАТЕРИАЛЫ И МЕТОДЫ
Место проведения исследования
Настоящее исследование проводилось на базе отделения артериальной гипертонии и коронарной недостаточности Научного отдела клинической кардиологии Тюменского кардиологического научного центра — филиала Томского НИМЦ СО РАН.
Время исследования
Набор пациентов осуществлялся с 10.09.2021 по 20.05.2022 гг.
Изучаемые популяции
Исследование проводилось в группе больных АГ и контрольной группе лиц без АГ, сопоставимых по полу, возрасту, жителей г. Тюмень и Тюменского района.
Критерии включения: мужчины и женщины в возрасте от 25 до 65 лет, с наличием АГ 1–3 степени, I–II стадии согласно Клиническим рекомендациям по АГ для взрослых 2020 г. — и без; наличие АО определялось согласно критериям диагностики МС, предложенных ВНОК в 2009 г.; наличие подписанного пациентом добровольного информированного согласия.
Критерии исключения: хронические гепатиты и цирроз печени различной этиологии; эндокринные заболевания — установленный СД 1 и 2 типа, заболевания ЩЖ и других желез внутренней секреции; хроническая почечная недостаточность различной этиологии; опухоли различной локализации; беременность и лактация; воспалительные заболевания кишечника; резистентная гипертония, ИБС и перенесенное ОНМК в анамнезе; острые или обострение хронических воспалительных заболеваний; системные заболевания соединительной ткани; злокачественные новообразования; острые заболевания с кишечной симптоматикой, перенесенные менее 3 месяцев назад; лечение антимикробными препаратами в период за 3 месяца до исследования.
Критерии включения и исключения определялись на основе опроса жалоб и анамнеза пациентов, исследования объективного статуса пациентов, изучения выписок и данных 1С информационной системы.
Способ формирования выборки из изучаемой популяции
Выборка для участия в исследование формировалась методом случайных чисел из пациентов ТКНЦ, сопоставимых по полу и возрасту.
Дизайн фрагмента проводимого исследования
Одноцентровое, одномоментное, сравнительное исследование.
Методы
Всем пациентам проводилось антропометрическое исследование в утренние часы. Рост и массу тела измеряли с помощью ростомера и электронных весов. Индекс массы тела (ИМТ) определяли по формуле: ИМТ=Масса тела (кг)/Рост (м²). Окружность талии измеряли в положении стоя, на середине расстояния между нижним краем грудиной клетки и гребнем подвздошной кости по средней подмышечной линии с помощью сантиметровой ленты. При окружности талии >94 см у мужчин и >80 см у женщин и коэффициенте ОТ/ОБ у мужчин >1,0, у женщин >0,85 диагностировали абдоминальное ожирение (АО) по критериям ВНОК.
В лаборатории клинико-диагностических и молекулярно-генетических исследований ТКНЦ пациентам во всех исследуемых группах проводилось лабораторное исследование биообразцов крови и кала. Оценивали параметры метаболома МК: уровень ТМА, ТМАО определялся в сыворотке крови на базе биоаналитической лаборатории «Экзактэ лабс» на жидкостном хромато-масс-спектрометре Shimadzu 8050 (Япония) с электрораспылительной ионизацией; короткоцепочечные жирные кислоты (КЦЖК) в копрофильтрате исследовали методом газовой хроматографии-масс-спектрометрии/ газовой хроматографии с пламенно-ионизационным детектированием (ГХМС/ГХ-ПИД); уровень эндотоксина оценивали хромогенным набором LAL-тест; из биохимических параметров определяли липидный профиль (ОХС, ХСЛПНП, ХСЛПВП, ТГ), глюкозу натощак — на аппарате «Cobas integra plus 400» (Италия); концентрацию С-реактивного белка (вч-CРБ, Вектор — Бест, Россия) — иммуноферментным анализом на микропланшетном фотометре Stat Fax4200 (США); уровень ИЛ-1β, 6, 8, гомоцистеина — методом твердофазного хемилюминесцентного иммуноферментного анализа («сэндвич» метод) на анализаторе «IMMULITE 2000» (реактивы Siemens Diagnostics, США), гормональный статус — С-пептид (Diagnostics Biochem Cаnada Inc). Индекс TyG рассчитывали: TyG=ln (триглицериды натощак [ммоль/л] x 88,57 x глюкоза натощак [ммоль/л] x 18) / 2).
В исследуемых группах проводилось суточное мониторирование артериального давления (АД) на аппарате BPLaB, производитель ООО «Петр Телегин», по стандартному протоколу; исследование эластических свойств сосудистой стенки методом сфигмографии — на аппарате Vasera VS-1000 Series (Fukuda Denishi, Япония), с оценкой показателя скорости распространения пульсовой волны (СРПВ, PWV).
Статистический анализ
Статистический анализ проведен с помощью пакета прикладных программ SPSS 21 (SPSS Inc., Chicago, IL, USA) и Statistica 12.0. Распределение переменных оценивали по критерию Колмогорова-Смирнова с коррекцией значимости Лильефорса. При нормальном распределении количественных данных показатели оценивали как среднее арифметическое ± стандартное отклонение (M±SD), в случае распределения, отличного от нормального, — как медианное значение (Me) и интерквартильный размах в 25 и 75 процентилей [ 25; 75]. Значимость различий непрерывных переменных между группами оценивали в зависимости от распределения данных критерием Стьюдента для независимых выборок или критерием Манна-Уитни. Изменения в динамике количественных переменных оценивали критерием Стьюдента для парных выборок, дисперсионным анализом или критерием Вилкоксона, критерием Фридмана. Применялась поправка Бонферрони на множественные сравнения. Для сравнения качественных переменных между группами использовали критерий хи-квадрат или точный критерий Фишера, для сравнения изменений в динамике — критерий Мак Немара. Оценку корреляционных связей между парами количественных признаков осуществляли при нормальном распределении с использованием анализа Пирсона, при отсутствии нормального распределения — с помощью анализа Спирмена. Также использовали логистическую и линейную регрессии, данные ROC-анализа. Результаты считали статистически значимыми при уровне p<0,05.
Этическая экспертиза
Протокол исследования одобрен Комитетом по биомедицинской этике Тюменского кардиологического научного центра, Томского национального исследовательского медицинского центра Российской академии наук (номер протокола № 171 от 11.05.2021 г.). Перед включением в исследование у каждого из участников исследования было получено письменное информированное согласие на участие в исследовании и об использовании результатов обследования в научных целях.
РЕЗУЛЬТАТЫ
В исследование вошел 161 пациент, из которых были сформированы 3 основные группы: 1-я группа — лица без АГ (n=45), 2-я группа — пациенты с эссенциальной АГ 1-3 степенью (n=53); 3-я группа — пациенты с АГ 1-3 степенью и абдоминальным ожирением (n=63), сопоставимые по возрасту, полу, проводимой терапии. Медикаментозная терапия во 2-й и 3-й группах включала: ИАПФ — 32,10–28,60%; БРА — 62,30–65,10%; бета-блокаторы — 26,40–25,40%; антагонисты кальция — 9,40–12,70%; тиазидоподобные диуретики — 13,20–22,20%; статины — 43,40– 50,80% соответственно.
Клинико-антропометрическая характеристика пациентов представлена в таблице1.
Таблица 1. Клинико-антропометрическая характеристика лиц контрольной группы и пациентов с АГ и АГ с абдоминальным ожирением
Table 1. Clinical and anthropometric characteristics of individuals in the control group and patients with AH and AH with abdominal obesity
|
Параметры |
КГ (п=45) |
АГ (n=53) |
АГ+АО (n=63) |
р между группами |
|
|
Пол |
Женский |
32 (74,4%) |
34 (61,8%) |
37 (58,7%) |
0,235 |
|
Мужской |
11 (25,6%) |
21 (38,2%) |
26 (41,3%) |
||
|
Возраст, лет |
44,62±10,78 |
46,40±10,43 |
46,11±10,10 |
0,773 |
|
|
Масса тела, кг |
66,84±11,55 |
74,56±12,33 |
103,08±17,80 |
р1-2=0,077 р1-3<0,001 р2-3<0,001 |
|
|
ИМТ, кг/м² |
23,56±3,21 |
25,94±3,14 |
36,05±5,36 |
р1-2=0,114 р1-3<0,001 р2-3<0,001 |
|
|
ОТ, см |
80,66±11,10 |
86,08±11,33 |
110,51±14,91 |
р1-2=0,277 р1-3<0,001 р2-3<0,001 |
|
|
ОБ, см |
98,33±9,65 |
100,16±10,68 |
113,68±14,69 |
р1-2=0,436 р1-3<0,001 р2-3<0,001 |
|
|
ОТ/ОБ |
0,80±0,08 |
0,87±0,12 |
0,98±0,15 |
р1-2=0,017 р1-3<0,001 р2-3<0,001 |
|
|
САД, мм рт.ст. |
113,50±12,33 |
138,40±15,90 |
140,95±18,64 |
р1-2<0,001 р1-3<0,001 р2-3=0,635 |
|
|
ДАД, мм рт.ст. |
74,07±8,88 |
88,06±9,53 |
90,03±12,29 |
р1-2<0,001 р1-3<0,001 р2-3=0,686 |
|
|
ЧСС, ударов в минуту |
74,57±9,80 |
73,02±8,99 |
74,45±7,94 |
0,714 |
|
|
Стаж АГ, годы |
5,38±4,53 |
6,30±5,73 |
0,300 |
||
|
Степень АГ |
1 |
0 (0,00%) |
28 (52,83%) |
19 (30,16%) |
0,082 |
|
2 |
0 (0,00%) |
15 (28,30%) |
26 (41,27%) |
||
|
3 |
0 (0,00%) |
10 (18,87%) |
18 (28,57%) |
||
|
Курение |
4 (9,3%) |
11 (20,0%) |
17 (27,0%) |
р1-2=0,144 р1-3=0,081 р2-3=0,606 |
|
|
Алкоголь |
0 (0,00%) |
0 (0,00%) |
2 (3,2%) |
0,207 |
|
|
Аллергический анамнез отягощен |
2 (4,8%) |
6 (10,9%) |
10 (15,9) |
0,210 |
|
Примечания: ИМТ — индекс массы тела; ОТ — объем талии; ОБ — объем бедер; ОТ/ОБ — отношение объема талии к объему бедер; САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление; ЧСС — частота сердечных сокращении; АГ — артериальная гипертония; р — достоверность различий между группами; % — процент случаев.
Notes: BMI — body mass index; WC — waist circumference; HC — hip circumference; WC/HC — waist-to-hip ratio; SBP — systolic blood pressure; DBP — diastolic blood pressure; HR — heart rate; AH — arterial hypertension; p — reliability of differences between groups; % — percentage of cases.
Из представленных в таблице 1 данных видно: пациенты в 1-й группе значимо отличались от пациентов 2-й и 3-й групп по параметрам ИМТ, ОТ, ОБ, офисного САД, ДАД (p<0,001). Пациенты во 2-й группе отличались от 3-й группы по параметрам массы тела, ИМТ, ОТ, ОБ, ОТ/ОБ, которые были значимо выше в 3-й группе.
Результаты исследования метаболитов микробиоты кишечника в группах пациентов с АГ и АГ с АО по сравнению с контрольной группой лиц представлены в таблице 2.
Таблица 2. Сравнительная характеристика метаболитов микробиоты кишечника в контрольной группе и в группах пациентов с АГ и АГ с АО
Table 2. Comparative characteristics of intestinal microbiota metabolites in the control group and in groups of patients with AH and AH with AO
|
Параметры |
КГ (n=45) |
АГ (n=53) |
АГ+АО (n=63) |
р между группами |
|
TMA, мкмоль/л |
0,23±0,08 |
0,47±0,32 |
0,35±0,21 |
р1-2=0,003 р1-3=0,124 р2-3=0,175 |
|
TMAO, мкмоль/л |
5,77 [ 1,40; 13,13] |
5,75 [ 3,67; 8,11] |
8,76 [ 6,43; 18,57] |
р1-2=0,943 р1-3=0,061 р2-3=0,012 |
|
TMA/TMAO |
0,04 [ 0,02; 0,16] |
0,08 [ 0,03; 0,11] |
0,03 [ 0,02; 0,04] |
р1-2=0,356 р1-3=0,241 р2-3=0,001 |
|
Эндотоксин |
0,56±0,23 |
0,80±0,57 |
0,83±0,32 |
р1-2=0,212 р1-3=0,019 р2-3=0,762 |
|
КЦЖК С2 (уксусная), мг/г |
0,51 [ 0,45; 1,04] |
2,16 [ 1,48; 3,08] |
1,89 [ 0,99; 2,68] |
р1-2=0,001 р1-3=0,016 р2-3=0,750 |
|
КЦЖК С3 (пропионовая), мг/г |
0,12 [ 0,04; 0,14] |
0,09 [ 0,03; 0,27] |
0,27 [ 0,13; 0,64] |
р1-2=0,456 р1-3=0,008 р2-3=0,015 |
|
КЦЖК С4 (масляная), мг/г |
0,09 [ 0,02; 0,12] |
0,07 [ 0,02; 0,29] |
0,16 [ 0,08; 0,40] |
р1-2=0,774 р1-3=0,091 р2-3=0,058 |
|
Суммарное содержание С2+С3+С4+С5+С6+ изоС4+изоС5+изоС6 |
1,36±1,00 |
3,43±2,29 |
3,02±1,83 |
р1-2=0,002 р1-3=0,004 р2-3=0,645 |
Примечания: p — статистическая значимость различий между 1-й и 2-й, 2-й и 3-й, 3-й и 1-й группами. ТМА — триметиламин; ТМАО — триметиламин-N-оксид; КЦЖК — короткоцепочечные жирные кислоты С5и С6 — изо формы КЦЖК.
Notes: p — statistical significance of differences between groups 1 and 2, 2 and 3, 3 and 1; TMA — trimethylamine; TMAO — thimethylamine-N-oxide; SCFA — short-chain fatty acids C5 and C6 — isoforms of SCFA; AH — arterial hypertension.
Из представленных данных видно, что уровень ТМА значимо выше в группе пациентов АГ по сравнению с параметрами в группе контроля (p=0,002). Уровень ТМАО в 3-й группе имеет тенденцию к превышению параметра в КГ (р=0,061) и значимо выше параметра в группе пациентов с АГ (р=0,012).
Образующийся в печени из ТМА ТМАО является эндотелиальным токсическим фактором, который подавляет обмен холестерина, способствует агрегации тромбоцитов, тромбозу и развитию атеросклероза. TMAO имеет ключевое значение в развитии воспалительных процессов, активируя различные инфламмасомы и способствуя увеличению уровня воспалительных маркеров, таких как цитокины ИЛ- 1β, ИЛ-6, ИЛ-8 и циклооксигеназы-2 [7][8].
Зарегистрированный повышенный уровень ТМАО в группе АГ с АО может быть ассоциирован в этой группе с более выраженной воспалительной реакцией и эндотелиальной дисфункцией, вероятнее всего, за счет наличия у пациентов в этой группе абдоминального ожирения. В целом, повышенное содержание ТМАО существенно повышает риск развития больших сердечно-сосудистых событий [9].
Следующий исследуемый маркер — эндотоксин, в нашем исследовании максимальный уровень эндотоксина зарегистрирован в группе пациентов с АГ и АО, при этом параметр значимо превышает показатель в КГ (p=0,019). Превышение уровня в группах больных АГ подтверждает данные о том, что нарушение кишечного барьера способствует усилению проникновения липополисахаридов (ЛПС) в кровоток, приводя к развитию «метаболической эндотоксемии» и к созданию условий для развития кардиометаболических заболеваний [9, 10].
По результатам исследования КЦЖК выявлено, что суммарное содержание монокарбоновых кислот: С2 — уксусной, С3 — пропионовой, С4 — масляной значимо выше во 2-й и 3-й группах по сравнению с контрольной группой пациентов (p<0,002, p<0,004, соответственно группам). Анализ относительной концентрации представленных КЦЖК не выявил значимых изменений между группами, поэтому результаты их содержания в работе не приводятся.
Параллельно мы оценили спектр биохимических, воспалительных параметров и гормональный профиль пациентов в исследуемых группах. В таблице 3 представлены результаты основных параметров, имеющих различия между группами пациентов.
Таблица 3. Сравнительная характеристика биохимических и гормональных параметров в контрольной группе и у пациентов с АГ и АГ с АО
Table 3. Comparative characteristics of biochemical and hormonal parameters in the control group and in patients with AH and AH with AO
|
Параметры |
КГ (n=45) |
АГ (n=53) |
АГ+АО (n=63) |
р между группами |
|
Мочевая кислота, мкмоль/л |
262,53±79,62 |
322,09±88,60 |
364,50±93,27 |
р1-2=0,005 р1-3=0,001 р2-3=0,100 |
|
ОХС, ммоль/л |
5,10±0,96 |
5,85±1,09 |
5,39±1,32 |
р1-2=0,002 р1-3=0,922 р2-3=0,027 |
|
ХСЛПНП, ммоль/л |
2,87±0,85 |
3,62±0,98 |
3,30±1,00 |
р1-2=0,001 р1-3=0,106 р2-3=0,180 |
|
ХСЛПВП, ммоль/л |
1,74±0,41 |
1,55±0,40 |
1,31±0,37 |
р1-2=0,126 р1-3=0,001 р2-3=0,007 |
|
ТГ, ммоль/л |
1,01±0,41 |
1,56±0,87 |
1,98±1,38 |
р1-2=0,001 р1-3=0,001 р2-3=0,169 |
|
вч-СРБ, мг/л |
1,91 [ 1,01; 2,82] |
1,69 [ 0,73; 3,02] |
3,27 [ 1,68; 6,07] |
р1-2=0,998 р1-3=0,009 р2-3=0,005 |
|
Глюкоза, ммоль/л |
5,26±0,46 |
5,48±0,60 |
5,59±0,59 |
р1-2=0,170 р1-3=0,007 р2-3=0,804 |
|
Гликозилированный гемоглобин, % |
5,32±0,37 |
5,48±0,39 |
5,63±0,43 |
р1-2=0,132 р1-3=0,001 р2-3=0,264 |
|
Триглицериды/глюкоза, мг/дл |
4,49±0,21 |
4,69±0,25 |
4,80±0,29 |
р1-2=0,001 р1-3=0,001 р2-3=0,100 |
|
Интерлейкин 1β, пг/мл |
4,42±2,88 |
6,51±3,04 |
8,08±3,98 |
р1-2<0,001 р1-3<0,001 р2-3=0,252 |
|
С-пептид, пг/мл |
0,84±0,17 |
1,84±1,06 |
2,70±1,40 |
р1-2=0,008 р1-3<0,001 р2-3=0,299 |
Примечания: вч-СРБ — высокочувствительный С-реактивный белок; р — достоверность различий между группами.
Notes: hs-CRP — high-sensitivity C-reactive protein; p — significance of differences between groups; AH — arterial hypertension.
Как видно из представленных данных в таблице 3, обращают на себя внимание параметры липидограммы. В группах пациентов с АГ отмечается значимое превышение целевого уровня показателей ОХС, ХСЛПНП, а в группе АГ с АО — еще дополнительное превышение целевого уровня ТГ (p=0,001) по сравнению с КГ. Нами зарегистрировано повышение значения индекса «триглицериды/глюкоза» (TyG) в группе пациентов с АГ и АГ с АО по сравнению с группой контроля (р<0,001). В настоящее время индекс TyG стал шире использоваться в роли доступного и надежного маркера инсулинорезистентности, поэтому важно, что в группе с АГ с АО был также зарегистрирован повышенный по сравнению с КГ и группой с АГ уровень с-пептида (p<0,001) как одного из маркеров ИР.
Кроме этого, зарегистрированы значимо более высокие показатели интерлейкина 1β в группе АГ и АГ с АО (p=0,001, для обеих групп); у пациентов с АГ и АО выявлено значимо превышающее значение показателя вч-СРБ, чем в КГ (р=0,002) и группе с АГ (p=0,001). Повышение уровня воспалительных маркеров в группах с АГ является фактором, отражающим наличие неспецифического низкоинтенсивного воспалительного процесса, способного обусловливать как инициацию, так и прогрессирование эндотелиальной дисфункции и ИР с развитием атеросклеротических процессов в артериальной стенке.
Сравнительная характеристика параметров СМАД в группах пациентов показала закономерное превышение параметров систолического АД (САД) — 112,26±9,46, 122,60±12,76, 130±14,56 мм рт.ст. и диастолического АД (ДАД) 74,42±8,45, 78,77±10,08, 80,88±9,97 мм рт.ст. во 2-й и 3-й группах по сравнению с 1-й группой (р=0,001) для всех показателей. Такая же тенденция зарегистрирована по параметру вариабельности САД и ДАД.
Скорость распространения пульсовой волны (СРПВ) во всех группах пациентов достоверно превышала нормативные значения (10 м/сек) (11,58±1,70, 12,46±1,71, 12,59±2,6 м/с), но значимо выше была в 3-й группе по сравнению с 1-й группой (р=0,015).
Методом корреляционного анализа выявлены ассоциации метаболитов МК с биохимическими параметрами крови, АД и СРПВ. Так, в группе с АГ: ТМА взаимосвязана с вч-СРБ (r=0,434; p=0,039), С-пептидом (r=0,592; p=0,001), САД24 (r=0,807, р=0,052), ЧСС24 (r=0,391, р=0,048).
В группе с АГ и АО: ТМA с ИЛ-1β (r=0,458, р=0,042), гомоцистеином (r=0,580, р=0,005); ТМАО с ИЛ-1β (r=0,506, р=0,023); эндотоксин с вч-СРБ (r=0,514, р=0,042); КЦЖК С2 с СРПВ (r=0,425, р=0,049), ТГ (r=0,330; p=0,014) и мочевой кислотой (r=0,422; p=0,001); ТМАО с САД в дневное время (дн.) (r=0,649, p=0,001).
Зарегистрированная взаимосвязь TyG с изучаемыми лабораторно-инструментальными параметрами представлена в таблице 4.
Таблица 4. Данные корреляционного анализа индекса TyG с параметрами микробиоты кишечника, с биохимическими параметрами, профилем артериального давления и скоростью распространения пульсовой волны
Table 4. Data from the correlation analysis of the TyG index with intestinal microbiota parameters, biochemical parameters, blood pressure profile, and pulse wave velocity
|
Параметры |
КГ (n=45) |
АГ (n=53) |
АГ+АО (n=63) |
|
ТМАО |
r=0,322, p=0,021 |
||
|
Эндотоксин |
r=0,464, p=0,001 |
r=0,421, p=0,030 |
|
|
КЦЖК С3 |
r=0,464, p=0,001 |
r=0,243, p=0,045 |
|
|
КЦЖК С2 |
r=0,312, p=0,028 |
||
|
ИЛ-6 |
r=-0,356, p=0,010 |
||
|
вч-СРБ |
r=0,403, p=0,007 |
r=0,464, p=0,001 |
|
|
С-пептид |
r=0,605, p=0,028 |
r=0,408, p=0,048 |
r=0,417, p=0,014 |
|
ОХС |
r=0,422, p=0,002 |
r=0,412, p=0,001 |
|
|
ХСЛПНП |
r=0,473, p=0,002 |
r=0,562, p=0,023 |
|
|
ХСЛПВП |
r=-0,502, p=0,000 |
r=-0,458, p=0,000 |
|
|
Триглицериды |
r=0,315, p=0,048 |
||
|
ср. дневное САД |
r=0,315, p=0,048 |
r=0,321, p=0,026 |
r=0,441, p=0,001 |
|
сут. вар. САД |
r=0,379, p=0,021 |
r=0,273, p=0,046 |
|
|
сут. вар. ДАД |
r=0,413, p=0,002 |
||
|
ноч. ЧСС |
r=0,332, p=0,017 |
||
|
СПВР |
r=0,363, p=0,007 |
||
|
ОТ |
r=0,474, p=0,000 |
r=0,256, p=0,043 |
|
|
ИМТ |
r=0,352, p=0,011 |
Примечание: ТМАО — триметиламиноксид; КЦЖК — короткоцепочечные жирные кислоты; САД — систолическое артериальное давление, ДАД — диастолическое артериальное давление, сут. вар. САД/ДАД — суточная вариабельность АД, ЧСС — частота сердечных сокращений, СРПВ — скорость распространения пульсовой волны.
Note: TMAO — trimethylamine-N-oxide; SCFA — short-chain fatty acids; SBP — systolic blood pressure; DBP — diastolic blood pressure; diurnal variability of blood pressure; SBP/DBP — diurnal BP variability; HR — heart rate; PWV — pulse wave velocity.
В целом, представленные взаимосвязи метаболитов МК и TyG с изучаемыми лабораторно-инструментальными параметрами могут свидетельствовать об их потенциальной значимости в качестве индикаторов развития жесткости сосудистой стенки, подтверждая важность использования новых диагностических подходов для уточнения звеньев патофизиологического процесса ремоделирования сосудистой стенки, инициации и прогрессирования АГ.
Проведение логистического регрессионного анализа позволило подтвердить наличие зависимости показателя СРПВ от уровня КЦЖК С2, индекса TyG и САД от TyG в группе пациентов с АГ и АО, таблица 5.
Таблица 5. Результаты логистического регрессионного анализа ассоциации метаболитов МК, индекса TyG, артериального давления и жесткости сосудистой стенки у пациентов с АГ и АО
Table 5. Results of logistic regression analysis of the association of MK metabolites, TyG index, blood pressure and vascular wall stiffness in patients with АН and AO
|
Нестандартизованные коэффициенты |
Стандартизованные коэффициенты |
Значимость |
||
|
B |
Стандартная ошибка |
Бета |
||
|
СРПВ |
||||
|
Константа |
7,168 |
2,237 |
0,005 |
|
|
КЦЖК С2 |
-0,003 |
0,001 |
-0,540 |
0,003 |
|
TyG |
0,052 |
0,015 |
0,555 |
0,002 |
|
САД среднее (дневное) |
||||
|
Константа |
21,720 |
30,620 |
0,481 |
|
|
TyG |
20,743 |
6,478 |
0,376 |
0,002 |
Примечание: зависимая переменная среднее значение СРПВ и среднее значение САД (дн.); КЦЖК С2 — уксусная кислота; TyG — индекс триглицериды-глюкоза.
Note: dependent variable is mean PWV and mean SBP (days); SCFA C2 — acetic acid; TyG — triglyceride-glucose index; AH — arterial hypertension.
Ассоциированная связь состояния ИР со структурно-функциональным состоянием сосудистой стенки и развитием АГ находит подтверждение в ряде экспериментальных и клинических работ. Так в исследовании Yan Y et al. индекс TyG зарекомендовал себя как надежный маркер ИР, связанный с жесткостью артерий, которая считается одним из самых ранних признаков повреждения сосудов и достоверно предсказывает сердечно-сосудистую заболеваемость и смертность [10].
Также в исследовании Lee SB et al. было продемонстрировано, что индекс TyG связан с повышенной жесткостью артерий у взрослых корейцев [11].
Кроме всего, проведение нами ROC-анализа показало высокую диагностическую значимость параметра TyG в качестве маркера инсулинорезистентности у пациентов с АГ. Площадь под ROC-кривой (AUC) составила 0,770 (95% ДИ 0,693–0,847), р<0,001, точка отсечения TyG для использования в диагностике инсулинорезистентности равна 4,61 с чувствительностью 68,7% и специфичностью 77,3% (рис. 1).
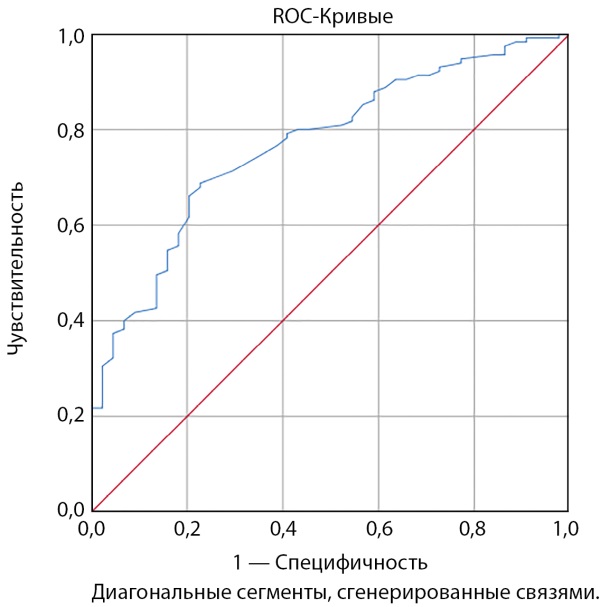
Рисунок 1. RОС-анализ диагностической значимости индекса TyG.
Figure 1. ROC-analysis of the diagnostic significance of the TyG index.
ОБСУЖДЕНИЕ
Артериальная гипертония является одним из ведущих факторов риска развития ССЗ. В России смертность от ССЗ обусловливает каждый второй случай летальных исходов. АГ и ее осложнения играют ключевую роль среди причин высокой смертности в индустриально развитых странах по данным Бойцова С.А., 2018.
Значительный интерес в последнее время сосредоточен на изучении роли нарушений МК как нового фактора риска развития и прогрессирования кардиоваскулярных заболеваний [12], который способен выступать в качестве самостоятельного фактора, определяющего неблагоприятный прогноз заболевания, способствуя выработке активных вторичных метаболитов, вызывающих побочные эффекты [3][4]. Кроме того, в настоящее время накапливаются научные данные по влиянию метаболитов МК на развитие и прогрессирование АГ за счет влияния на процессы инсулинорезистентности [5].
По данным ряда исследований, микробиота кишечника влияет на резистентность к инсулину несколькими способами. Во-первых, она регулирует выработку КЦЖК, которые образуются в результате ферментации пищевых волокон и играют ключевую роль в регулировании метаболизма глюкозы и липидов. Во-вторых, микробиота кишечника влияет на выработку кишечных гормонов, таких как глюкагоноподобный пептид-1 (GLP-1), который играет ключевую роль в регулировании гомеостаза глюкозы и секреции инсулина. Наконец, микробиота кишечника регулирует выработку цитокинов, таких как фактор некроза опухоли-альфа (TNF-альфа), который играет ключевую роль в регулировании воспаления и резистентности к инсулину, особенно у пациентов с абдоминальным ожирением [5][12][13].
Увеличению жировой ткани способствуют как гиперплазия, так и гипертрофия адипоцитов. Хемотаксические сигналы от адипоцитов, находящихся в состоянии стресса, привлекают макрофаги из костного мозга [14][15][16], которые накапливаются вокруг адипоцитов и выделяют цитокины [17][18]. Это метаболически активированное воспаление — дополнительный механизм, способствующий развитию резистентности к инсулину. Хотя в настоящее время хорошо известно, что ожирение у человека — это хроническое воспалительное состояние, которое нарушает метаболический гомеостаз [19][20], механизмы, с помощью которых воспаление может вызывать резистентность к инсулину в различных тканях, и важность этих процессов для развития резистентности к инсулину, остаются предметом активных исследований [21][22]. К цитокинам, наиболее часто связанным с резистентностью к инсулину, относятся TNF-α и ИЛ-1β, хотя другие цитокины, в том числе лейкотриен B4 и галектин-3, также были предметом недавних исследований [23][24]. По данным ряда авторов, висцеральный жир может быть не просто инертным хранилищем, а ключевым фактором чувствительности и резистентности организма к инсулину [25].
Полученные данные в исследовании дают возможность объяснить максимальную выраженность процессов ИР у пациентов в группе АГ с АО в нашей работе, в частности максимальный уровень эндотоксина, ТМАО, ИЛ-1β, С-пептида и индекса TyG были зарегистрированы именно в этой группе пациентов. Однако надо помнить о том, что механизмы, демонстрирующие взаимосвязь микробиоты кишечника, инсулинорезистентности, жесткости сосудистой стенки и артериальной гипертонии, более сложная проблема, чем кажется на первый взгляд, и требует более глубокого исследования.
Имеется достаточно данных о том, что артериальная жесткость — одно из самых ранних функциональных нарушений в процессе старения сосудов и напрямую влияет на сердечно-сосудистую систему, снижая эластичность артерий и повышая пульсовое давление. Все больше исследований показывают, что жесткость артерий является предвестником будущих сердечно-сосудистых заболеваний, таких как инфаркт миокарда, нестабильная стенокардия, сердечная недостаточность, инсульты. Учитывая, что патология, связанная с жесткостью артерий, развивается в течение длительного времени, существует острая необходимость в доступных и надежных маркерах для выявления пациентов на ранней стадии развития АГ и разработки соответствующих профилактических стратегий [26]. Своевременная коррекция МК и процессов инсулинорезистентности могут быть новыми инструментами в этом процессе.
Ограничения исследования
Данное исследование было ограничено количественным половым составом пациентов, расширение групп даст возможность нам оценить изучаемые параметры с учетом половых особенностей при дальнейших исследованиях с проспективным наблюдением пациентов.
ЗАКЛЮЧЕНИЕ
Сопряженность связи метаболитов МК и индекса TyG с воспалительными и липидными биомаркерами сыворотки крови, параметрами СРПВ и АД может подтверждать их роль в качестве индикаторов развития и прогрессирования АГ. Своевременное внедрение в клиническую практику этих диагностических критериев будет способствовать осуществлению ранних профилактических и терапевтических стратегий вмешательства.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Петелина Т.И. — концепция и дизайн исследования, написание статьи; Авдеева К.С. — анализ данных, написание статьи; Валеева Л.Л. — получение и анализ данных, написание статьи; Горбачевский А.В. — интерпретация результатов, внесение в рукопись существенной правки; Капустина А.А. — получение и анализ данных, написание статьи; Гапон Л.И. — концепция и дизайн исследования, внесение в рукопись существенной правки.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Sun S, Lulla A, Winglee K, Wu MC, Jacobs DR, Shikany DM. Gut Microbiota Composition and Blood Pressure. Hypertension. 2019;73(5):998-1006. doi: https://doi.org/10.1161/HYPERTENSIONAHA.118.12109
2. Ge Y, Wang J, Wu L, Wu J. Gut microbiota: a potential new regulator of hypertension. Front Cardiovasc Med. 2024;11:1333005. doi: https://doi.org/10.3389/fcvm.2024.1333005
3. Kim S, Goel R, Kumar F. Imbalance of gut microbiome and intestinal epithelial barrier dysfunction in patients with high blood pressure. Clin Sci (Lond). 2018;132 (6):701-18. doi: https://doi.org/10.1042/CS20180087
4. O’Donnell JA, Zheng T, Meric G, Marques FZ. The gut microbiome and hypertension. Nat Rev Nephrol. 2023;19(3):153-167. doi: https://doi.org/10.1038/s41581-022-00654-0
5. Jang HR, Lee HY. Mechanisms linking gut microbial metabolites to insulin resistance. World J Diabetes. 2021;12(6):730-744. doi: https://doi.org/10.4239/wjd.v12.i6.730.
6. Würtz P, Mäkinen V-P, Soininen P, Kangas AJ, Tukiainen T, et al. Metabolic signatures of insulin resistance in 7,098 young adults. Diabetes. 2012;61:1372–1380. doi: https://doi.org/10.2337/db11-1355
7. Seldin MM, Meng Y, Qi H, Zhu W, Wang Z, Hazen SL, Lusis AJ, Shih DM. Trimethylamine N-Oxide Promotes Vascular Inflammation Through Signaling of Mitogen-Activated Protein Kinase and Nuclear Factor-κB. J Am Heart Assoc. 2016;5(2):e002767. doi: https://doi.org/10.1161/JAHA.115.002767
8. Zhu W, Gregory JC, Org E, Buffa JA, Gupta N, et al. Gut Microbial Metabolite TMAO Enhances Platelet Hyperreactivity and Thrombosis Risk. Cell. 2016;165(1):111-124. doi: https://doi.org/10.1016/j.cell.2016.02.011
9. Wang PX, Deng XR, Zhang CH, Yuan HJ. Gut microbiota and metabolic syndrome. Chin Med J (Engl). 2020;133(7):808-816. doi: https://doi.org/10.1097/CM9.0000000000000696
10. Yan Y, Wang D, Sun Y, Ma Q, Wang K, Liao Y, et al. Triglyceride-glucose index trajectory and arterial stiffness: results from Hanzhong Adolescent Hypertension Cohort Study. Cardiovasc Diabetol. 2022;21(1):33. doi: https://doi.org/10.1186/s12933-022-01453-4
11. Lee SB, Ahn CW, Lee BK, Kang S, Nam JS, et al. Association between triglyceride glucose index and arterial stiffness in Korean adults. Cardiovasc Diabetol. 2018;17(1):41. doi: https://doi.org/10.1186/s12933-018-0692-1
12. Драпкина О.М., КабуроваА.Н. Состав и метаболиты кишечной микробиоты как новые детерминанты развития сердечнососудистой патологии // Рациональная фармакотерапия в кардиологии. — 2020. — Т. 16. — № 2. — С. 277-285. doi: https://doi.org/10.20996/1819-6446-2020-04-02
13. Yang Z, Wang Q, Liu Y, Wang L, Ge Z, Li Z, Feng S, Wu C. Gut microbiota and hypertension: association, mechanisms and treatment. Clin Exp Hypertens. 2023;45(1):2195135. doi: https://doi.org/10.1080/10641963.2023.2195135
14. Jang HR, Lee HY. Mechanisms linking gut microbial metabolites to insulin resistance. World J Diabetes. 2021;12(6):730-744. doi: https://doi.org/10.4239/wjd.v12.i6.730
15. Petersen MC, Shulman GI. Mechanisms of Insulin Action and Insulin Resistance. Physiol Rev. 2018;98(4):2133-2223. doi: https://doi.org/10.1152/physrev.00063.2017
16. Weisberg SP, Hunter D, Huber R, Lemieux J, Slaymaker S, et al. CCR2 modulates inflammatory and metabolic effects of high-fat feeding. J Clin Invest. 2006;116:115–124. doi: https://doi.org/10.1172/JCI24335
17. Würtz P, Mäkinen V-P, Soininen P, Kangas AJ, Tukiainen T, et al. Metabolic signatures of insulin resistance in 7,098 young adults. Diabetes. 2012;61:1372–1380. doi: https://doi.org/10.2337/db11-1355
18. Nagarajan A, Petersen MC, Nasiri AR, Butrico G, Fung A, et al. MARCH1 regulates insulin sensitivity by controlling cell surface insulin receptor levels. Nat Commun. 2016;7:12639. doi: https://doi.org/10.1038/ncomms12639
19. Onuma H, Osawa H, Yamada K, Ogura T, Tanabe F, Granner DK, Makino H. Identification of the insulin-regulated interaction of phosphodiesterase 3B with 14-3-3 β protein. Diabetes. 2002;51:3362–3367. doi: https://doi.org/10.2337/diabetes.51.12.3362
20. Samuel VT, Liu Z-X, Qu X, Elder BD, Bilz S, Befroy D, Romanelli AJ, Shulman GI. Mechanism of hepatic insulin resistance in nonalcoholic fatty liver disease. J Biol Chem. 2004;279:32345–32353. doi: https://doi.org/10.1074/jbc.M313478200
21. Lambert JE, Ramos-Roman MA, Browning JD, Parks EJ. Increased de novo lipogenesis is a distinct characteristic of individuals with nonalcoholic fatty liver disease. Gastroenterology. 2014;146:726–735. doi: https://doi.org/10.1053/j.gastro.2013.11.049
22. Le Marchand-Brustel Y, Grémeaux T, Ballotti R, Van Obberghen E. Insulin receptor tyrosine kinase is defective in skeletal muscle of insulin-resistant obese mice. Nature. 1985;315:676–679. doi: https://doi.org/10.1038/315676a0
23. Koves TR, Ussher JR, Noland RC, Slentz D, Mosedale M, et al. Mitochondrial overload and incomplete fatty acid oxidation contribute to skeletal muscle insulin resistance. Cell Metab. 2008;7:45–56. doi: https://doi.org/10.1016/j.cmet.2007.10.013
24. Jaworski K, Sarkadi-Nagy E, Duncan RE, Ahmadian M, Sul HS. Regulation of triglyceride metabolism. IV. Hormonal regulation of lipolysis in adipose tissue. Am J Physiol Gastrointest Liver Physiol. 2007;293:G1–G4
25. Holt LJ, Brandon AE, Small L, Suryana E, Preston E, et al. Ablation of Grb10 Specifically in Muscle Impacts Muscle Size and Glucose Metabolism in Mice. Endocrinology. 2018;159:1339–1351. doi: https://doi.org/10.1210/en.2017-00851
26. Holland WL, Summers SA. Sphingolipids, insulin resistance, and metabolic disease: new insights from in vivo manipulation of sphingolipid metabolism. Endocr Rev. 2008;29:381–402. doi: https://doi.org/10.1210/er.2007-0025
27. Wu S, Xu L, Wu M, Chen S, Wang Y, Tian Y. Association between triglyceride-glucose index and risk of arterial stiffness: a cohort study. Cardiovasc Diabetol. 2021;20(1):146. doi: https://doi.org/10.1186/s12933-021-01342-2
Об авторах
Т. И. ПетелинаРоссия
Петелина Татьяна Ивановна, д.м.н
Researcher ID: I-8913-2017
Scopus Author ID: 6507194861
625026, ул. Мельникайте, д. 111, Тюмень; Томск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
К. С. Авдеева
Россия
Авдеева Ксения Сергеевна, к.м.н.
Researcher ID: J-1751-2017
Scopus Author ID: 57210713674
Томск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Л. Л. Валеева
Россия
Валеева Лиана Леонидовна, м.н.с.
Томск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. В. Горбачевский
Россия
Горбачевский Александр Владимирович, м.н.с.
Томск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. А. Капустина
Россия
Капустина Анастасия Андреевна, м.н.с.
Томск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Л. И. Гапон
Россия
Гапон Людмила Ивановна, д.м.н., профессор
Researcher ID: S-6520-2016
Scopus Author ID: 7003891206
Томск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. RОС-анализ диагностической значимости индекса TyG. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(234KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Петелина Т.И., Авдеева К.С., Валеева Л.Л., Горбачевский А.В., Капустина А.А., Гапон Л.И. Метаболиты микробиоты кишечника и параметры инсулинорезистентности как потенциальные индикаторы развития и прогрессирования артериальной гипертензии. Ожирение и метаболизм. 2025;22(3):145-155. https://doi.org/10.14341/omet13212
For citation:
Petelina T.I., Avdeeva K.S., Valeeva L.L., Gorbachevskii A.V., Kapustina A.A., Gapon L.I. Gut microbiota metabolites and insulin resistance parameters as potential indicators of the development and progression of arterial hypertension. Obesity and metabolism. 2025;22(3):145-155. (In Russ.) https://doi.org/10.14341/omet13212
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































