Перейти к:
Метаболические эффекты производных ГАМК и их сочетанного применения с ситаглиптином в условиях экспериментального ожирения
https://doi.org/10.14341/omet13114
Аннотация
Обоснование. Рост числа лиц с ожирением сопряжен с распространением сердечно-сосудистых заболеваний, что обосновывает поиск новых средств для коррекции метаболических нарушений. Цель. Оценить метаболические эффекты производных ГАМК (композиции ФПС и МФБА) при раздельном и комбинированном применении с ситаглиптином на модели нарушения углеводного обмена, вызванного алиментарным ожирением.
Материалы и методы. Исследование выполнено на крысах-самцах с алиментарным ожирением. После полугодовой высокожировой и высококалорийной диеты формировали 7 групп (n=8), включая группу позитивного (интактные крысы без ожирения) и негативного контроля, а также 5 сопоставимых по выраженности ожирения групп, получавших в течение 30 дней раздельно исследуемые композиции: МФБА (20 мг/кг) и ФПС (50 мг/кг), референтный препарат ситаглиптин (10 мг/кг), а также комбинации: МФБА+ситаглиптин (20+10 мг/кг), ФПС+ситаглиптин (50+10 мг/кг). По завершении курсового лечения оценивали изменение массы тела, массу висцерального жира, липидный профиль, выраженность углеводных нарушений на основе перорального теста на толерантность к глюкозе и теста толерантности к инсулину. Методом иммуноферментного анализа определяли уровень глюкагона, инсулина и глюкагоноподобного пептида-1 (ГПП-1). Оценка степени повреждения печени осуществлялась по уровню печеночных трансаминаз (АЛТ и АСТ) и при морфологическом исследовании структурных изменений.
Результаты. Установлено, что композиции МФБА и ФПС, раздельно и в комбинации с ситаглиптином, статистически значимо снижали массу тела и массу висцерального жира, усиливали гипогликемическое действие ситаглиптина (особенно в сочетании с ФПС). Раздельное, а также комбинированное с ситаглиптином введение МФБА и ФПС способствовало увеличению уровня ГПП-1 и инсулина, улучшению утилизации глюкозы и повышению чувствительности к инсулину, а также нормализации липидного профиля и уровней АЛТ, АСТ. При морфологическом исследовании на фоне лечения отмечалось меньшее число очагов лимфоидной инфильтрации и менее выраженная жировая дистрофия печени. Наибольшую эффективность проявила комбинация ФПС+ситаглиптин.
Заключение. Производные ГАМК – МФБА и ФПС при монотерапии и более выраженно в комбинации с ситаглиптином уменьшали выраженность метаболических нарушений, связанных с ожирением. Отмеченное для циклического производного ГАМК (ФПС) анорексигенное действие и способность улучшать углеводный и липидный обмен представляет интерес для дальнейших исследований.
Для цитирования:
Тюренков И.Н., Бакулин Д.А., Соколова А.А., Смирнов А.В., Бацунов А.И., Болохов Н.С., Великородная Ю.И., Васильева О.С., Макаренко С.В. Метаболические эффекты производных ГАМК и их сочетанного применения с ситаглиптином в условиях экспериментального ожирения. Ожирение и метаболизм. 2025;22(3):167-179. https://doi.org/10.14341/omet13114
For citation:
Tyurenkov I.N., Bakulin D.A., Sokolova A.A., Smirnov A.V., Batsunov A.I., Bolokhov N.S., Velikorodnaya Yu.I., Vasilyeva O.S., Makarenko S.V. Metabolic effects of GABA derivatives and their combined use with sitagliptin in experimental obesity. Obesity and metabolism. 2025;22(3):167-179. (In Russ.) https://doi.org/10.14341/omet13114
ОБОСНОВАНИЕ
В настоящее время ожирение становится тяжелым бременем — из-за значительного роста числа больных и из-за большого количества ассоциированных с ним осложнений. По данным Всемирной организации здравоохранения (ВОЗ), в 2020 г. 38% населения планеты (более 2,6 млрд) имели избыточный вес или ожирение, а к 2030 г. прогнозируется рост до 46% [1].
Избыточное накопление жира сопровождается хроническим воспалением, гиперхолестеринемией, гипертриглицеридемией, снижением уровня ЛПВП [2], активацией провоспалительных и прооксидантных процессов в организме. Высвобождение провоспалительных цитокинов (фактора некроза опухоли (TNF-α), интерлейкина 6 (IL-6), интерлейкина-1β (IL-1β), резистина и др.) [3] и снижение противовоспалительных цитокинов (адипонектина и секретируемого белка Frizzled-related Protein 5 (SFRP5)) способствуют развитию хронического воспаления [4]. Усиленная генерация активных форм кислорода в свою очередь способствует развитию окислительного стресса. Эти процессы лежат в основе развития осложнений, связанных с длительным ожирением: инсулинорезистентность, сахарный диабет (СД) 2 типа, сердечно-сосудистые заболевания (инсульт, инфаркт миокарда, артериальная гипертензия, развитие атеросклероза и др.), неалкогольная жировая дистрофия печени (НАЖБП), артрит, остеоартроз, нейродегенеративные заболевания и нарушения когнитивных функций.
В 1950 г. была открыта гамма-аминомасляная кислота (ГАМК), позже были определены ее свойства как тормозного нейромедиатора центральной нервной системы. За прошедший период представления о физиологической роли ГАМК существенно изменились.
Было установлено, что ГАМК определяется практически во всех тканях и органах. Содержание ГАМК в тканях поджелудочной железы сопоставимо с таковым в головном мозге; ГАМК высоко экспрессируется в α- и β-клетках островков Лангерганса [5].
Установлено, что у животных с СД ГАМК подавляет апоптоз и стимулирует регенерацию β-клеток, увеличивая β-клеточную массу и продукцию инсулина. Эти данные говорят о важном значении ГАМК в регуляции и поддержании гомеостаза глюкозы и о целесообразности восполнения дефицита ГАМК при нарушениях углеводного обмена ее дополнительным введением [6][7].
Ожирение играет ключевую роль в развитии инсулинорезистентности, СД и его осложнений. Поэтому снижение инсулинорезистентности является самостоятельной задачей профилактики и лечения ожирения и СД. ГАМК путем подавления аппетита (вследствие воздействия на пищевой центр в гипоталамусе), а также вследствие подавления воспаления, окислительного стресса и стресса эндоплазматического ретикулума может предупредить осложнения, связанные с ожирением. ГАМК также снижала экспрессию адипогенного фактора транскрипции PPAR-γ в жировой ткани и печени мышей, получавших богатую жиром и высококалорийную пищу. Установлены различные эффекты ГАМК, лежащие в основе панкреопротективного действия. При дисметаболизме, связанном с потреблением животными высокоуглеводной и высокожировой пищи, ГАМК модулирует активность НАДФН-оксидазы (NOX4) и тем самым ослабляет ось «Nox4-индуцированное сульфонирование IRE-1α — RIDD-опосредованный распад SIRT1». Согласно литературным данным [8], введение ГАМК значительно повышало уровни AMPK и SIRT-1 у мышей с ожирением. Rezazadeh H. и др. (2021) показали увеличение уровня гликогена в печени, улучшение липидного профиля, снижение уровня глюкозы и гликированного гемоглобина [9], снижение инсулинорезистентности за счет активации экспрессии гена переносчика глюкозы (GLUT-4), подавления пути глюконеогенеза в печени, снижения экспрессии генов FOXO1 и Pepck и одновременного увеличения экспрессии генов IRS-2 и Akt2 [10]. ГАМК стимулирует фосфорилирование CREB через AMPK, что способствует увеличению β-клеточной массы. Трофические эффекты ГАМК формируются через активацию сигнальных путей Akt и CREB независимо друг от друга, но для оптимального ответа необходима активация обоих путей. Для пластичности ответа β-клеток на повышенную потребность в инсулине важно участие Ca2+ и CREB, а также зависимая от них активация IRS-2 β-клеток глюкозой. ГАМК-индуцированная активация CREB одновременно связана с повышенным уровнем экспрессии транскрипта IRS-2 [11].
Установлено влияние ГАМК на экспрессию глюкагоноподобного пептида-1 (ГПП-1), участвующего в регуляции аппетита [12].
Ситаглиптин – это первый препарат из группы ингибиторов дипептидилпептидазы-4 (ДПП-4), который был выведен на рынок в 2006 г. для лечения СД2 и который улучшает гликемический контроль без риска гипогликемии, в том числе у больных с патологиями печени и почек [13]. Установлено снижение массы тела (на 0,99 кг) у животных с СД и ожирением, по данным комплексного обзора и метаанализа [14]. В нашей обзорной работе, посвященной синергии действия ГАМК и гипогликемических препаратов, было показано более выраженное повышение уровня инкретинов и инсулина, более выраженное снижение гликемии при совместном применении ингибиторов ДПП-4 с ГАМК [15].
Таким образом, на основании представленных данных представляется обоснованным проведение поиска в ряду производных ГАМК (в том числе в комбинации с ситаглиптином) веществ с анорексигенным действием, профилактирующих осложнения, связанные с ожирением.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить метаболические эффекты производных ГАМК — композиций гидрохлорида метилового эфира DL-4-амино-3-фенилбутановой кислоты и моногидрохлорида L-аргинина (МФБА) и 2-(2-оксо-4-фенилпирролидин-1-ил)ацетамида и бутандиовой (янтарной) кислоты (ФПС) при раздельном и комбинированном применении с ситаглиптином на модели нарушения углеводного обмена, вызванного алиментарным ожирением.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Научный центр инновационных лекарственных средств, ФГБОУ ВО Волгоградский государственный медицинский университет Минздрава России, Волгоград, Россия.
Время исследования. В период с ноября 2022 г. по апрель 2023 г. проводилось моделирование патологии; май 2023 г. — формирование групп, лечение, проведение функциональных тестов, забор образцов для анализа; июнь-июль 2023 г. — проведение биохимических, иммуноферментных и морфологических исследований.
Изучаемая популяция
Исследование выполнено на одной популяции беспородных лабораторных крыс-самцов (N=56), полученных из питомника «Столбовая» (Московская область).
Критерии включения: в группы крыс с патологией включали особей с массой более 500 г.
Способ формирования выборки из изучаемой популяции
Данные о массе тела использовали для предварительного проведения стратификации, после чего крыс с использованием генератора случайных чисел случайным образом распределяли по группам методом полной (простой) рандомизации с формированием сбалансированных по весу животных с патологией экспериментальных групп (n=8).
Дизайн исследования
Интервенционное, динамическое, проспективное, контролируемое, рандомизированное исследование.
После получения из питомника в возрасте 4–5 мес крысы до достижения возраста 12 мес содержались в стандартных условиях вивария при температуре 20–26 °С, влажности воздуха 30–70%, свето-темновом режиме 12/12 час и при свободном доступе к питьевой воде и пище (ГОСТ Р 51849-2001) (ООО «Лабораторкорм», Москва).
Дизайн исследования представлен ниже (рис. 1). В возрасте 12 месяцев группа позитивного контроля (n=8) продолжала получать стандартный гранулированный корм, а все остальные животные были переведены на высокожировую и высококалорийную диету (свободный доступ к следующим продуктам: сливочное масло (на 100 г: 748 ккал; Б: 0,5 г; Ж: 82,5 г; У: 0,8 г), подсолнечная халва (на 100 г: 523 ккал; Б: 11,6 г; Ж: 29,7 г; У: 54 г) и козинак подсолнечный (на 100 г: 576 ккал, Б: 14,8 г; Ж: 42,6 г; У: 34,5 г)) [16]. На высокожировой и высококалорийной диете крыс содержали 6 мес по 5 особей в одной клетке, изменение массы тела регистрировали 1 раз в месяц. При достижении возраста 18 мес случайным образом формировали экспериментальные группы (n=8), сопоставимые по выраженности углеводных нарушений и весом более 500 г.
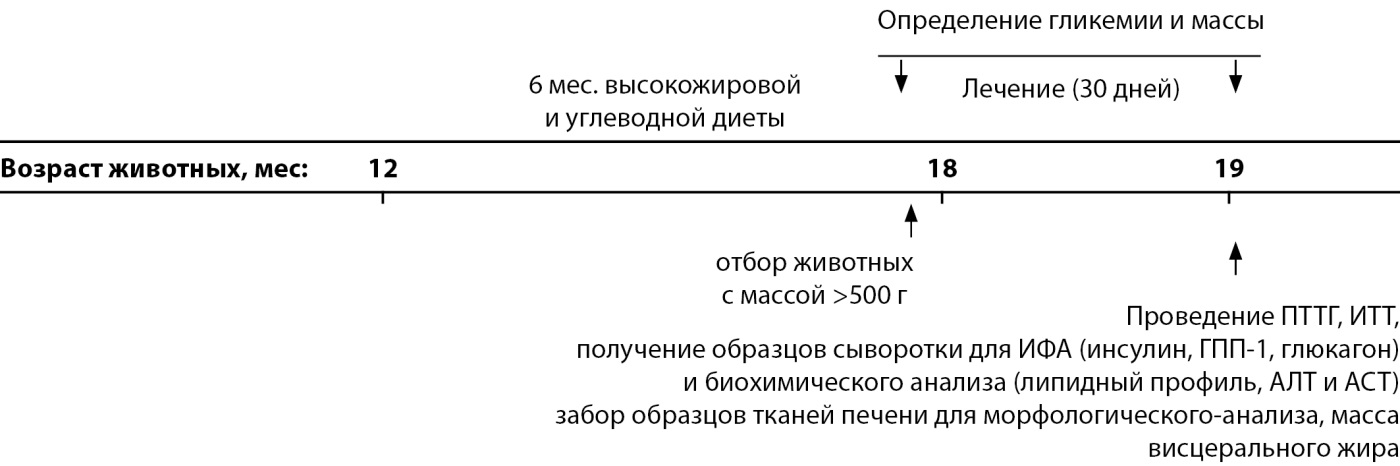
Рисунок 1. Дизайн исследования.
Примечание: ПТТГ — пероральный тест толерантности к глюкозе; ИТТ — инсулиновый тест толерантности; ИФА — иммуноферментный анализ; ГПП-1 — глюкагоноподобный пептид-1; АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза.
Figure 1. Study design.
Note: OGTT — oral glucose tolerance test; ITT — insulin tolerance test; ELISA — enzyme-linked immunosorbent assay; GLP-1 — glucagon-like peptide-1; ALT — alanine aminotransferase; AST — aspartate aminotransferase.
Описание медицинского вмешательства
После формирования групп, в течение 30 дней, перорально вводили физиологический раствор (группа «Диета»), исследуемые композиции МФБА 20 мг/кг («Диета+МФБА») и ФПС 50 мг/кг («Диета+ФПС»), референтный препарат ситаглиптин 10 мг/кг («Диета+Сит»), и комбинации: МФБА с ситаглиптином 20 мг/кг+10 мг/кг («Диета+МФБА+Сит») и ФПС с ситаглиптином 50 мг/кг+10 мг/кг («Диета+ФПС+Сит»). На этапе лечения животные с патологией продолжали получать высокожировую и высококалорийную диету.
Композиция МФБА представляет собой композицию линейного производного ГАМК с L-аргинином (гидрохлорид метилового эфира DL-4-амино-3-фенилбутановой кислоты и моногидрохлорид L-аргинина в соотношении 1:1). Композиция ФПС представляет собой композицию производного циклической ГАМК (2-пирролидона) с янтарной кислотой (2-(2-Оксо-4-фенилпирролидин-1-ил)ацетамид и бутандиовая (янтарная) кислота в соотношении 2:1). Данные композиции были отобраны в предварительных скрининговых исследованиях по изучению их панкреопротективного противодиабетического действия на аллоксановой модели СД по влиянию на сохранение массы β-клеток (косвенно, по способности стимулировать продукцию инсулина), а также используя функциональный тест на толерантность к глюкозе с регистрацией уровня гликемии, глюкагоноподобного пептида-1 (ГПП-1) и инсулина в сыворотке крови. Также противодиабетический потенциал композиций был подтвержден в условиях длительной гипергликемии: на животных с 6-месячным стрептозотоцин-никотинамид-индуцированным СД [17][18].
Методы
После курсового перорального введения исследуемых композиций выполнялся пероральный тест на толерантность к глюкозе (ПТТГ) с введением глюкозы в дозе 4 г/кг, определением уровня гликемии до введения глюкозы, а также через 60 и 120 мин и последующим расчетом площади под кривой (AUC0-120). Концентрацию глюкозы измеряли портативным глюкометром (Contour TS, Bayer, Германия), образцы крови получали путем пункции подъязычной вены.
В условиях проведения глюкозной нагрузки у крыс отбирали образцы сыворотки для дальнейшего определения уровня ГПП-1, инсулина и глюкагона методом иммуноферментного анализа (ИФА). ИФА проводили с использованием готовых наборов (Cloud-Clone Corp., США) в соответствии с инструкциями фирмы-производителя. Оптическую плотность измеряли при помощи микропланшетного автоматического анализатора SPECTROstar Nano (BMGLabtech, Германия) при длине волны 450 нм.
Выраженность инсулинорезистентности оценивали в ходе проведения инсулинового теста толерантности (ИТТ) при интраперитонеальном введении инсулина в дозе 0,3 МЕ/кг и последующем определении уровня гликемии через 60, 120 и 180 минут.
На заключительном этапе проводили эвтаназию с забором образцов крови для оценки липидного профиля и активности печеночных трансаминаз (АЛТ и АСТ), а также образцов печени для морфологического исследования. Биохимический анализ (липидный профиль, активность АЛТ и АСТ) проводили с использованием наборов фирмы Ольвекс (Россия) в соответствии с прилагаемыми инструкциями.
Статистический анализ
Статистический анализ проводили с использованием программного обеспечения Excel для Microsoft 365 (Microsoft, США) и Prism 6 (GraphPad Software Inc., США). Межгрупповые различия оцениваемых показателей между группой негативного контроля («Диета»), интактной или опытными группами оценивали с помощью критерия Краскела-Уоллиса и апостериорного критерия Данна (Dunn’s multiple comparisons test). Для визуализации данных использовали среднее значение и стандартную ошибку среднего (M±m). Статистически значимыми отличия считались при р<0,05.
Этическая экспертиза
Все эксперименты были выполнены в соответствии с законодательством Российской Федерации и техническими стандартами Евразийского экономического союза по надлежащей лабораторной практике (ГОСТ Р 53434-2009, ГОСТ Р 51000.4-2011). Дизайн исследования и протокол были одобрены локальным этическим комитетом Волгоградского государственного медицинского университета, протокол №2022/116 от 04.03.2022 г. (регистрационный номер: IRB 00005839 IORG 0004900 (OHRP)).
РЕЗУЛЬТАТЫ
Влияние исследуемых композиций на массу тела и массу висцерального жира
У животных контрольной группы средний вес был на 31% больше по сравнению с животными, которые получали обычный корм. У группы крыс, которым проводили курсовое введение композиции ФПС, а также ФПС с ситаглиптином, масса тела была значимо ниже, чем в группе негативного контроля (рис. 2А).
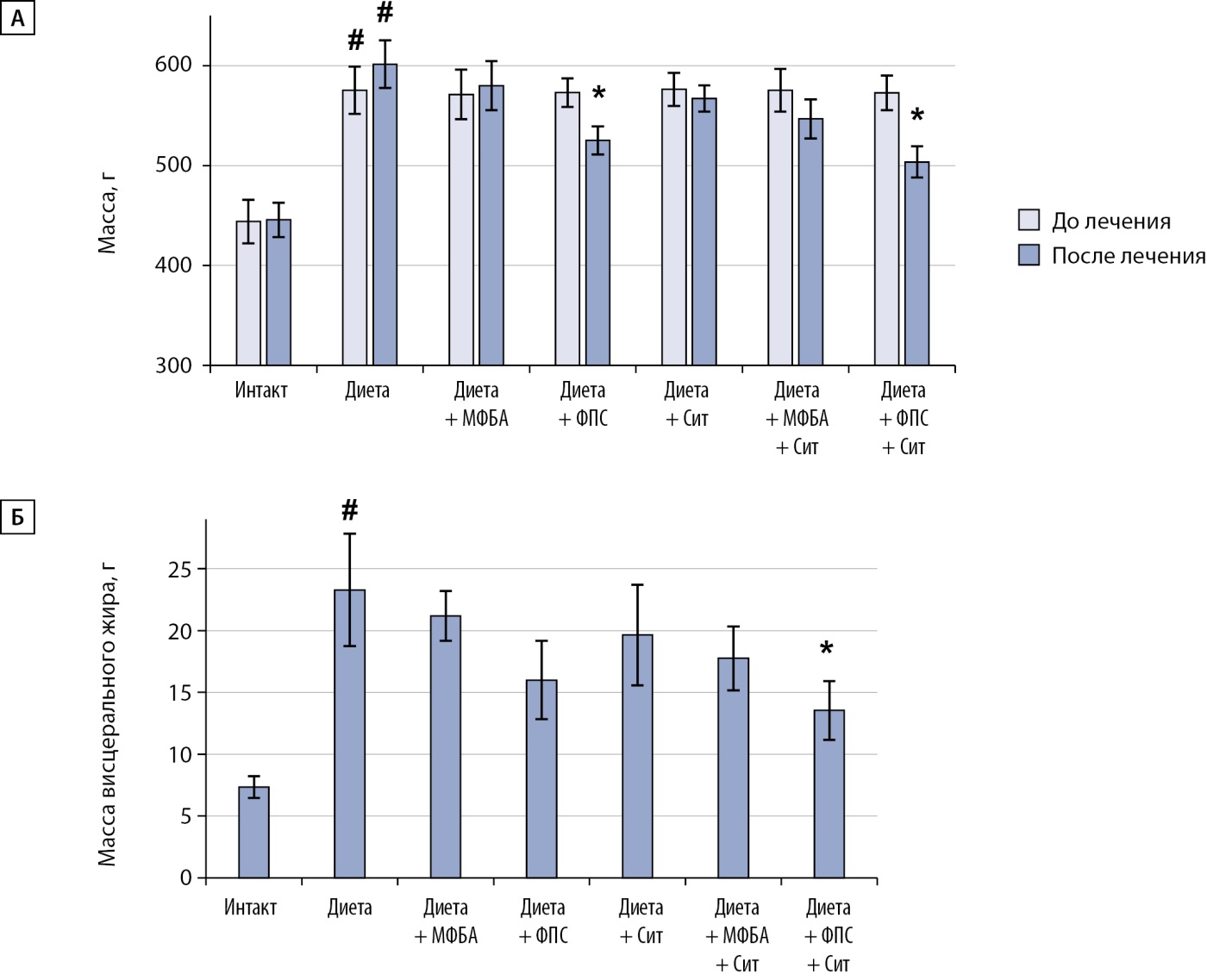
Рисунок 2. Влияние курсового (4-недельного) введения исследуемых веществ на массу тела (А) и массу висцерального жира (Б).
Примечание: # — различия значимы относительно группы интактных животных <0,05; * — различия значимы относительно группы негативного контроля соответственно при p<0,05.
Figure 2. Impact of a 4-week course of administration of the substances under study on body weight (A) and visceral fat mass (B).
Note: # — differences are significant relative to the group of intact animals at p<0.05; * — differences are significant relative to the negative control group at p<0.05.
Масса висцерального жира, которая определялась после выведения из эксперимента, у контрольной группы животных значительно превышала (более чем в 3 раза) таковую у интактной группы животных. Курсовое введение композиции ФПС, и особенно ФПС совместно с ситаглиптином, привело к снижению массы тела и висцерального жира, соответственно, на 34 и 46% (рис. 2Б). У животных, которым раздельно вводили МФБА и ситаглиптин, а также при сочетанном их применении наблюдалась лишь тенденция к снижению массы тела и висцерального жира.
Оценка толерантности к глюкозе
Влияние на углеводный обмен раздельного применения композиций МФБА, ФПС и ситаглиптина и сочетанного применения МФБА и ФПС с ситаглиптином у животных с ожирением.
У контрольной группы с ожирением исходный уровень глюкозы в крови был почти вдвое выше по сравнению с интактными животными. После перорального введения глюкозы большее повышение его уровня отмечалось на 60-й и 120-й минутах в контрольной группе животных. У животных, получавших раздельно только композицию ФПС, и особенно в комбинации с ситаглиптином, был отмечен статистически значимо меньший прирост уровня глюкозы в крови. Введение животным композиции МФБА, ситаглиптина и их комбинации привело лишь к незначительному улучшению утилизации глюкозы (повышение уровня глюкозы было лишь незначительно ниже в сравнении с уровнем у животных контрольной группы). Сочетанное применение композиции ФПС с ситаглиптином в большей мере приводило к улучшению утилизации глюкозы тканями (рис. 3А). На что указывает более низкая площадь под кривой (AUC) «уровень гликемии-время» в группе, получавшей ФПС и комбинацию МФБА и ФПС с ситаглиптином (рис. 3Б). Эти данные свидетельствуют о том, что композиция ФПС усиливает гипогликемическое действие ситаглиптина и утилизацию глюкозы тканями организма.
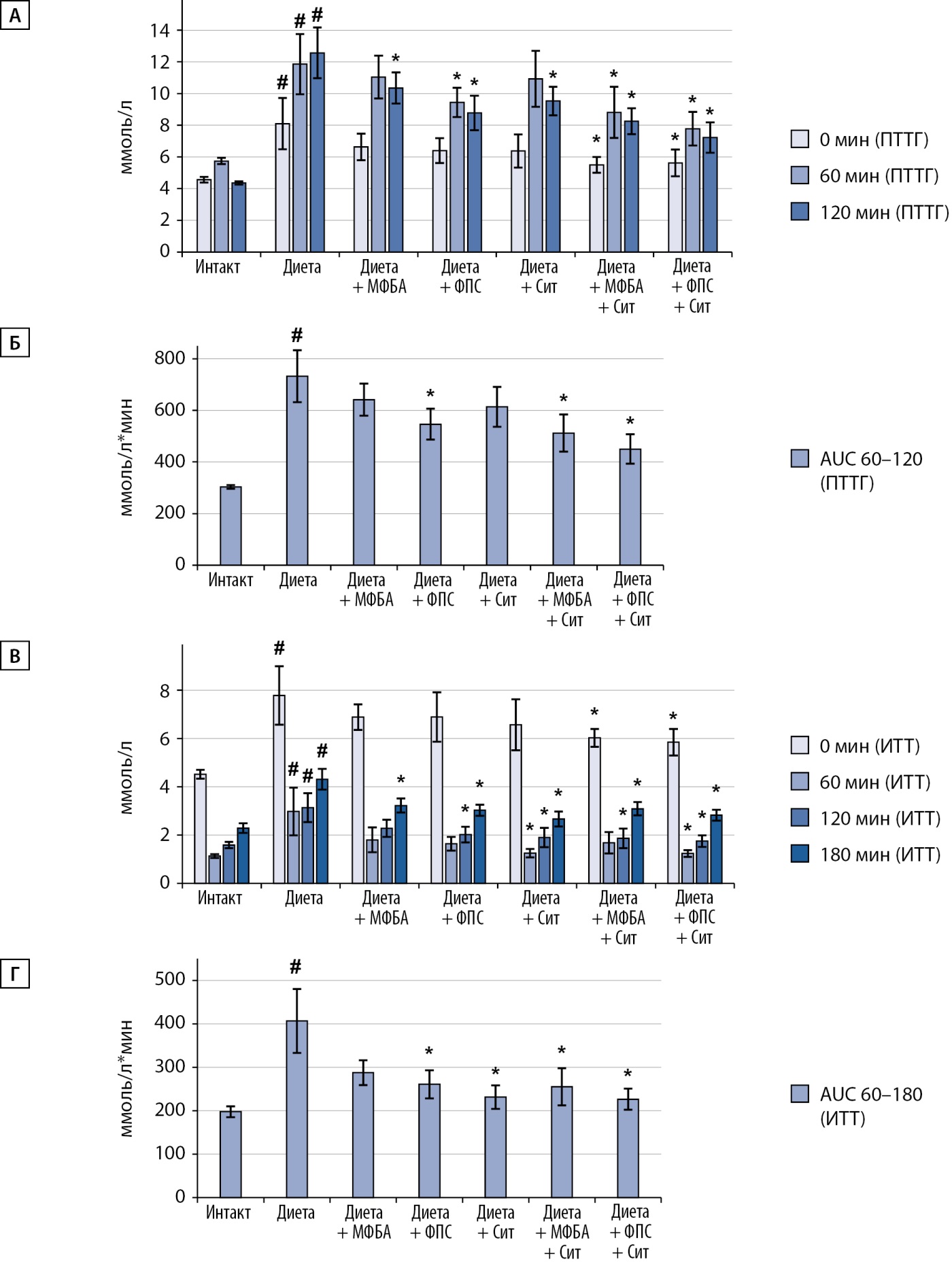
Рисунок 3. Уровень гликемии (А) и площадь под кривой «уровень гликемии время» AUC60-120 (Б) при проведении перорального теста на толерантность к глюкозе (ПТТГ); уровень гликемии (В) и площадь под кривой «уровень гликемии время» AUC60-180 (Г) при проведении инсулинового теста толерантности (ИТТ).
Примечание: # — различия значимы относительно группы интактных животных <0,05; * — различия значимы относительно группы негативного контроля соответственно при p<0,05.
Figure 3. Glycemia level (A) and the area under the curve «glycemia level over time» AUC60-120 (B) during the oral glucose tolerance test (OGTT); glycemia level (C) and the area under the curve «glycemia level over time» AUC60-180 (D) during the insulin tolerance test (ITT).
Note: # — differences are significant relative to the group of intact animals at p<0.05; * — differences are significant relative to the negative control group at p<0.05.
Оценка выраженности инсулинорезистентности
При проведении теста на толерантность к инсулину у животных с ожирением по сравнению с интактными отмечается практически вдвое более высокий уровень сахара в крови на 60-й, 120-й и 180-й минутах после введения инсулина (рис. 3В). У животных, получавших в течение 4-х недель исследуемые композиции, уровень сахара в крови на 60-й, 120-й и 180-й минутах после введения инсулина был значимо ниже, чем у животных контрольной группы (рис. 3В и Г).
Оценка уровня ГПП-1, инсулина и глюкагона
При ожирении исходный уровень ГПП-1 и инсулина у животных контрольной группы был выше, чем у интактных животных, но в ответ на введение глюкозы отмечалось значимое повышение уровня ГПП-1 и инсулина у интактных животных, а в контрольной группе регистрировалась лишь небольшая тенденция к увеличению. У животных с ожирением, получавших в течение 4-х недель исследуемые композиции, в ответ на введение глюкозы отмечалось значительное увеличение содержания и ГПП-1 и инсулина, что согласуется с динамикой снижения AUC и снижения резистентности к глюкозе. Уровень глюкагона после перорального введения глюкозы снижался как у интактных животных, так и у животных контрольной группы. У животных, получавших исследуемые композиции, уровень глюкагона после введения глюкозы практически не изменялся (рис. 4).
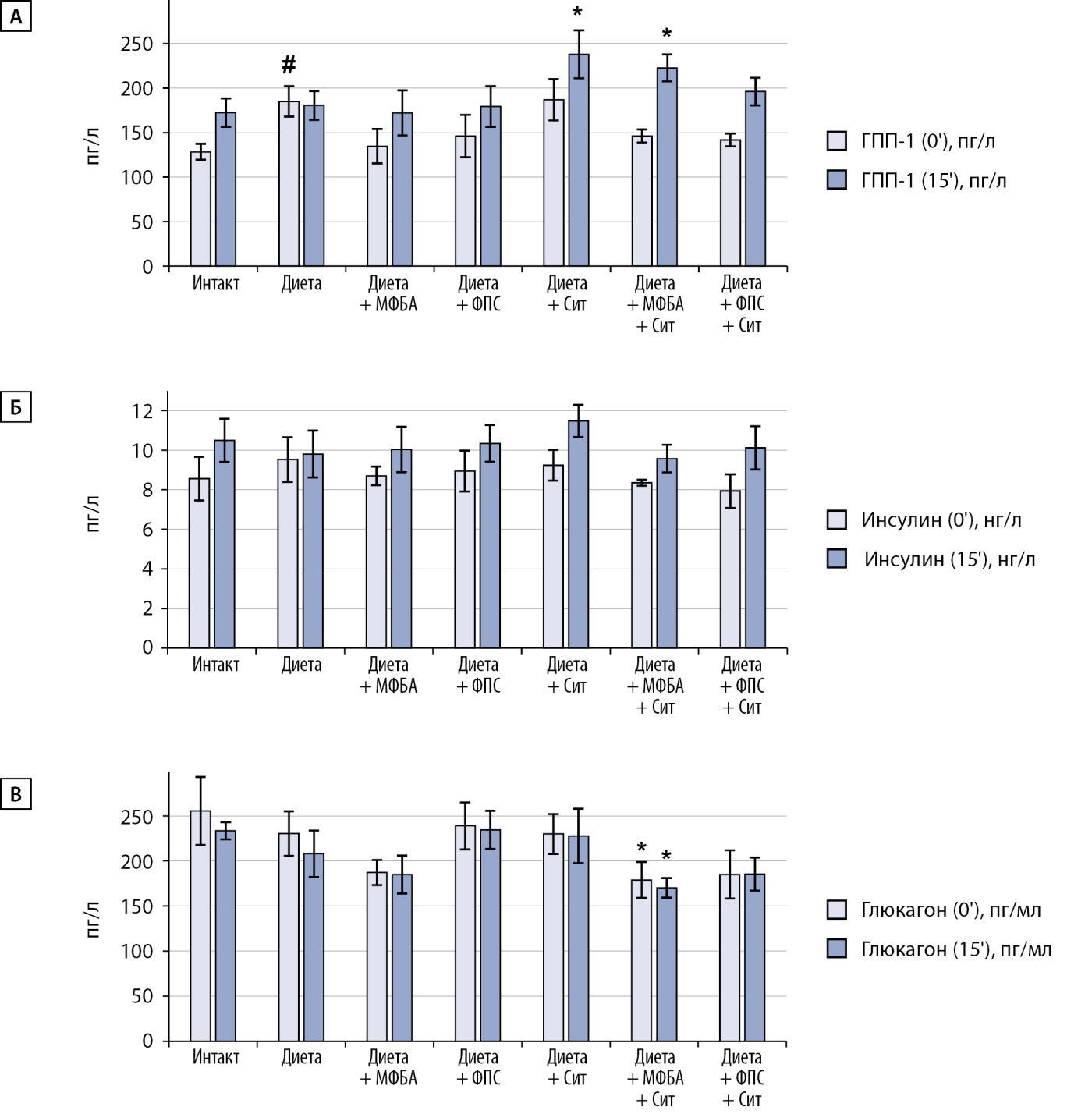
Рисунок 4. Уровень ГПП-1 (А), инсулина (Б) и глюкагона (В) до и через 15 минут после глюкозной нагрузки.
Примечание: # — различия значимы относительно группы интактных животных <0,05; * — различия значимы относительно группы негативного контроля соответственно при p<0,05.
Figure 4. Levels of GLP-1 (A), insulin (B), and glucagon (C) before and 15 minutes after glucose administration.
Note: # — differences are significant relative to the group of intact animals at p<0.05; * — differences are significant relative to the negative control group at p<0.05.
Оценка липидного профиля
При анализе липидного профиля у животных с ожирением установлено повышение общего холестерина, липопротеинов низкой плотности (ЛПНП), триглицеридов (ТГ) и снижение уровня липопротеинов высокой плотности (ЛПВП). У животных, которым раздельно вводили композицию ФПС и ситаглиптин, и в большей степени при их комбинированном применении, отмечалось выраженное понижение уровня общего холестерина, ЛПНП и ТГ. Композиция МФБА в монотерапии не оказывала выраженного влияния на липидный профиль животных с ожирением, а при совместном применении МФБА с ситаглиптином только в небольшой степени повышала гипохолестеринемическое действие ситаглиптина (рис. 5А).
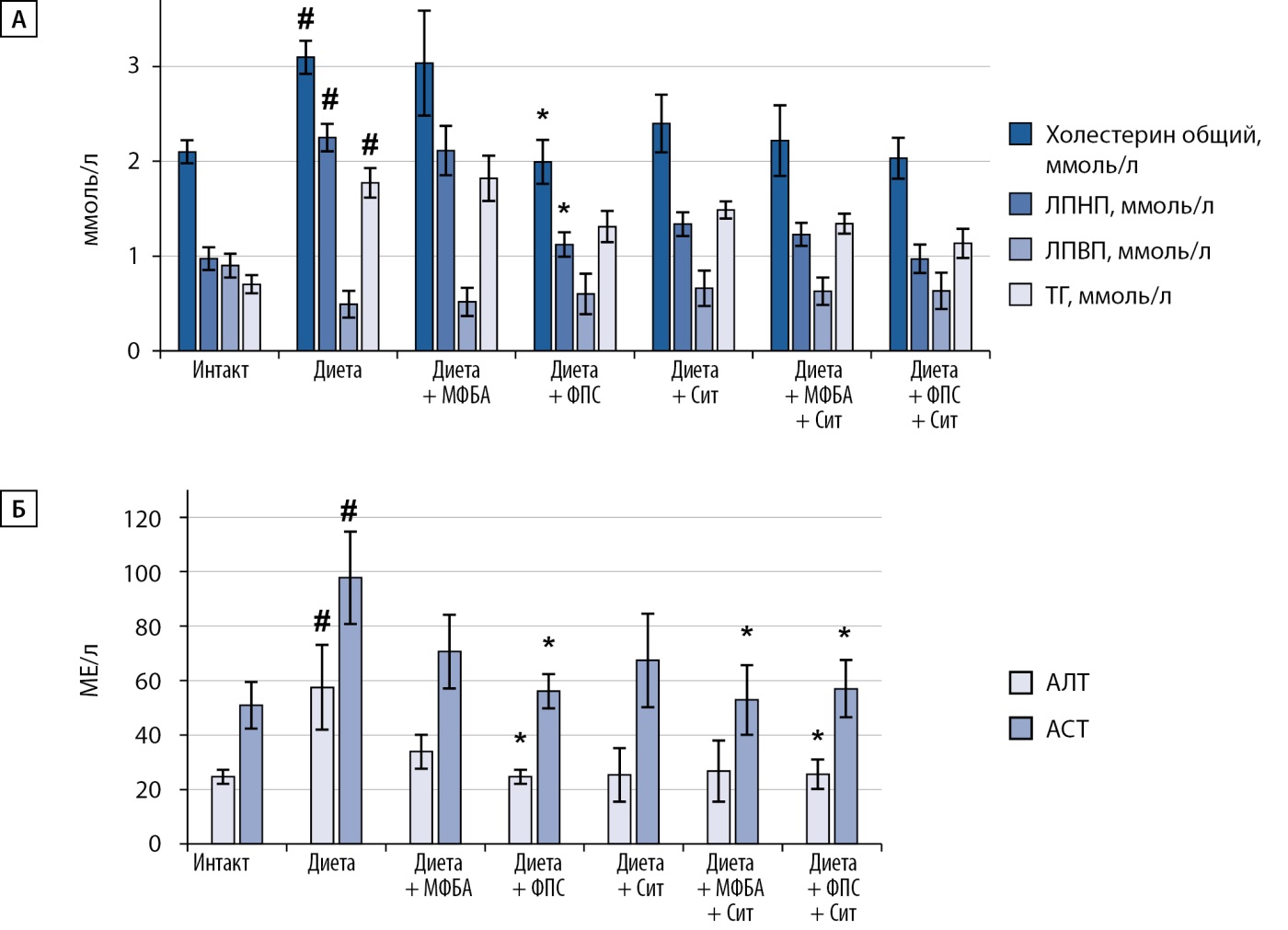
Рисунок 5. Содержание в сыворотке крови общего холестерина, липопротеидов низкой и высокой плотности (ЛПНП и ЛПВП) и триглицеридов (ТГ) (А); активность аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) в сыворотке крови животных с ожирением (Б).
Примечание: # — различия значимы относительно группы интактных животных <0,05; * — различия значимы относительно группы негативного контроля соответственно при p<0,05.
Figure 5. Serum levels of total cholesterol, low-density and high-density lipoproteins (LDL and HDL), and triglycerides (TG) (A); activity of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) in the serum of animals with obesity (B).
Note: # — differences are significant relative to the group of intact animals at p<0.05; * — differences are significant relative to the negative control group at p<0.05.
Определение активности печеночных трансаминаз
По сравнению с интактной группой в контрольной группе животных с ожирением активность АЛТ и АСТ в сыворотке была значительно выше, что может указывать на поражение печени в условиях длительной высокожировой диеты. Во всех опытных группах, получавших лечение, наблюдалась нормализация активности печеночных трансаминаз (рис. 5Б).
Морфологическое исследование печени
При морфологическом исследовании печени крыс в группе негативного контроля(Диета) отмечалась слабовыраженная мелкокапельная жировая дистрофия гепатоцитов (рис. 6А), преимущественно в перицентральных зонах печеночных долек (зона 3). В портальных трактах наблюдалось слабовыраженное фиброзирование, слабовыраженная лимфоидная инфильтрация в части портальных трактов.
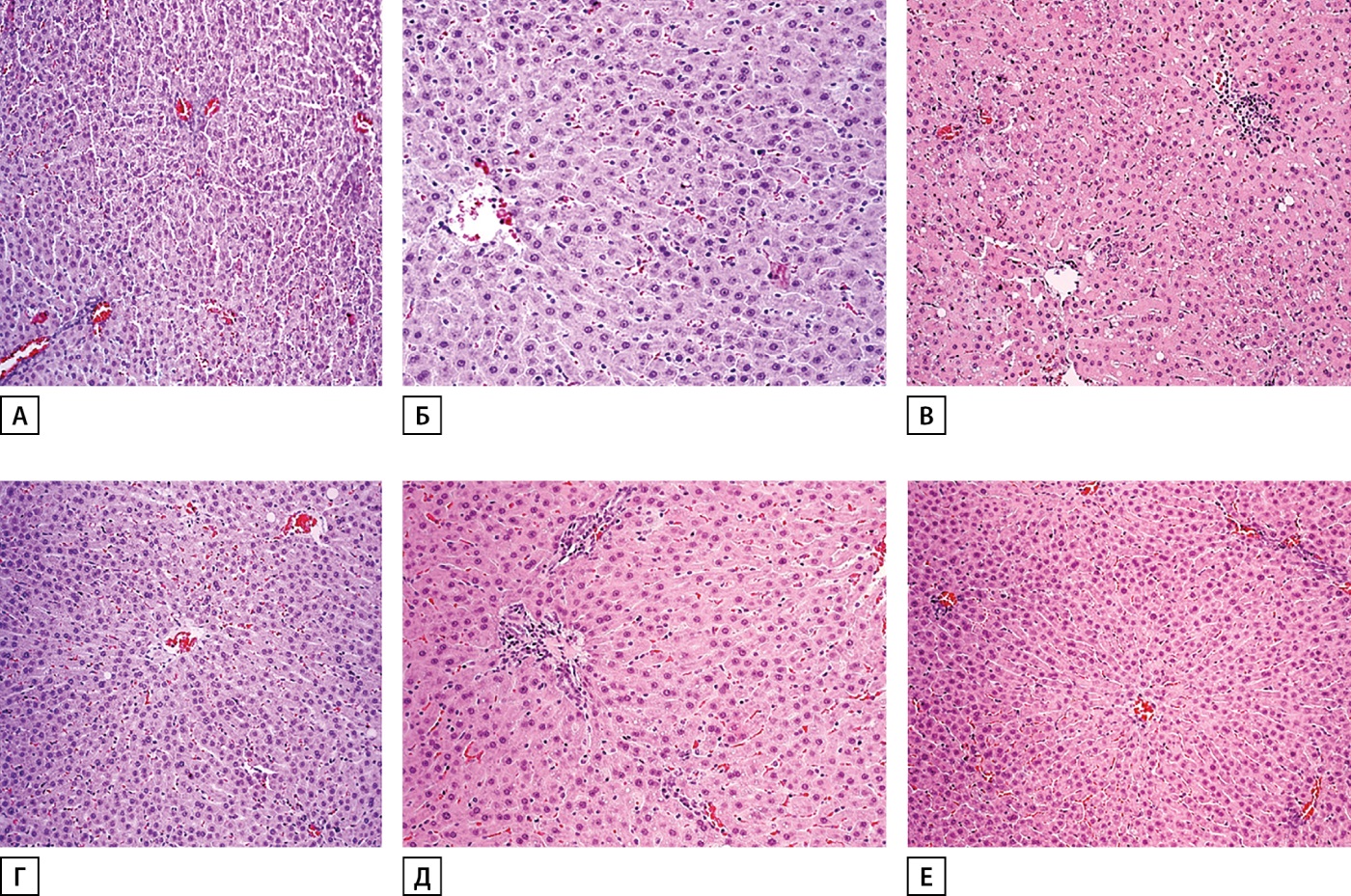
Рисунок 6. Морфологические изменения в ткани печени при ожирении у крыс.
Примечание: у контрольной группы (группа «Диета»), слабовыраженная мелкокапельная жировая дистрофия гепатоцитов (А); в группе с фармакологической коррекцией композицией МФБА, слабовыраженная мелкокапельная жировая дистрофия гепатоцитов (Б); с фармакологической коррекцией ситаглиптином слабовыраженная мелкокапельная жировая дистрофия гепатоцитов, слабовыраженная лимфоидная инфильтрация портального тракта (В); с фармакологической коррекцией ситаглиптином и МФБА, слабовыраженная мелкокапельная жировая дистрофия гепатоцитов (Г); с фармакологической коррекцией композицией ФПС, слабовыраженная мелкокапельная жировая дистрофия гепатоцитов (Д); с фармакологической коррекцией ситаглиптином и ФПС слабовыраженная мелкокапельная жировая дистрофия гепатоцитов (Е). Окраска гематоксилин-эозин. Ув. Об. Х20.
Figure 6. Morphological changes in liver tissue in rats with obesity.
Note: In the control group (Diet group), there is mild microvesicular fatty dystrophy of hepatocytes (A); in the group with pharmacological correction using the MFBA composition, mild microvesicular fatty dystrophy of hepatocytes (B); with pharmacological correction using sitagliptin, mild microvesicular fatty dystrophy of hepatocytes and mild lymphoid infiltration of the portal tract (C); with pharmacological correction using sitagliptin and MFBA, mild microvesicular fatty dystrophy of hepatocytes (D); with pharmacological correction using the FPS composition, mild microvesicular fatty dystrophy of hepatocytes (E); with pharmacological correction using sitagliptin and FPS, mild microvesicular fatty dystrophy of hepatocytes (F). Hematoxylin and eosin staining. Magnification 20x.
В группах фармакологической коррекции выявлены признаки жировой дистрофии в гепатоцитах, сопоставимые с таковыми в группе негативного контроля (Диета). Так, при ожирении с фармакологической коррекцией композицией МФБА в гепатоцитах определялась слабовыраженная мелкокапельная жировая дистрофия в части печеночных долек, поражались преимущественно перипортальные зоны. Кроме того, были отмечены гепатоциты со среднекапельной жировой дистрофией (рис. 6Б); у животных с ожирением и фармакологической коррекцией ситаглиптином определялась слабовыраженная мелкокапельная жировая дистрофия в отдельных печеночных дольках преимущественно в промежуточных зонах (зонах 2) и умеренно выраженная мелко-, среднекапельная жировая дистрофия в различных зонах в 33% случаев, слабовыраженная лимфоидная инфильтрация в части портальных трактов (рис. 6В). При ожирении и фармакологической коррекции комбинацией (ситаглиптин+МФБА) наблюдалась менее выраженная мелкокапельная жировая дистрофия в отдельных печеночных дольках по сравнению с негативным контролем (Диета) (рис. 6Г), также была отмечена слабовыраженная лимфоидная инфильтрация в части портальных трактов. У большинства подопытных животных с ожирением под влиянием композиции ФПС (75%) выявлена слабовыраженная мелкокапельная жировая дистрофия в отдельных печеночных дольках, у 25% животных данной группы выявлена очаговая среднекапельная жировая дистрофия в различных зонах, слабовыраженное фиброзирование портальных трактов, в которых наблюдалась небольшая лимфоидная инфильтрация (рис. 6Д). При ожирении с сочетанной фармакологической коррекцией ситаглиптином и ФПС отмечалась менее выраженная мелкокапельная жировая дистрофия в отдельных печеночных дольках по сравнению с негативным контролем (Диета) (рис. 6Е), которая встречалась во всех зонах. Отмечалась слабовыраженная лимфоидная инфильтрация в части портальных трактов, а также фиброзирование отдельных портальных трактов.
ОБСУЖДЕНИЕ
Высокая распространенность ожирения с СД и их осложнений приводит к ранней инвалидизации и высокой смертности, что делает данные заболевания глобальной социальной, медицинской и финансовой проблемой для современного общества [19].
Ожирение и СД — две патологии, имеющие в основе много общих взаимосвязанных патофизиологических механизмов, включающих инсулинорезистентность, нарушения углеводного и липидного обменов. Оба состояния являются высокими факторами риска развития сердечно-сосудистых, нейродегенеративных и многих других заболеваний. Одной из важнейших задач в лечении ожирения и СД является снижение массы тела и достижение контроля гликемии при минимизации побочных эффектов. Все больше признается необходимость в рациональных комбинациях гипогликемических препаратов, воздействующих на мишени, связанные с ожирением. Антидиабетические свойства ГАМК объясняются ее взаимодействием с различными сигнальными белками (белком Клото, SIRT, PI3K/Akt, CREB-IRS2, NF-kB, Nrf2 и многими другими), посредством модуляции которых реализуются антиоксидантные, противовоспалительные, антиапоптические и многие другие эффекты [11]. Активация антивозрастного белка Klotho, Nrf2, сиртуинов способствует подавлению ядерного фактора NF-kB, отвечающего за выработку провоспалительных цитокинов (TNF-α, IL-1β, IL-6 и др.), что говорит о подавлении активности системы антиоксидантной защиты на фоне активации воспаления [19].
Ожирение характеризуется избыточным накоплением жира в различных органах. Согласно полученным данным у животных, получавших композицию ФПС, а также ФПС в комбинации с ситаглиптином, зарегистрировано снижение как массы тела, так и массы висцерального жира. Это можно объяснить тем, что производные ГАМК, а также их комбинация с иДПП-4 повышают уровень ГПП-1, который подавляет аппетит и повышает чувство насыщения.
При ожирении нарушение углеводного обмена выраженно проявляется развитием инсулинорезистентности и нарушением утилизации глюкозы тканями. Для определения этих показателей мы использовали пероральный тест толерантности к глюкозе (ПТТГ) и тест толерантности к инсулину. Полученные в нашем исследовании данные, с одной стороны, свидетельствуют о выраженном нарушении углеводного обмена, связанного с нарушением утилизации глюкозы, обусловленного, очевидно, инсулинорезистентностью, с другой стороны, мы получили выраженный гипогликемический эффект при применении ФПС, а также его аддитивное действие в комбинации с ситаглиптином.
В нашем исследовании при проведении теста на толерантность к инсулину у животных с ожирением отмечается в 2–3 раза менее выраженное снижение сахара в крови через 60, 120 и 180 минут после введения инсулина (рис. 3). Все исследуемые композиции повышали чувствительность тканей к инсулину, но наиболее выраженное действие отмечалось у животных, которым в течение 4-х недель вводился ситаглиптин изолированно, а также в комбинации с ФПС. Безусловно, это действие композиции ФПС при раздельном, но особенно комбинированном применении с ситаглиптином, заслуживает внимания, т.к. мы видим отчетливое усиление действия ситаглиптина.
Основными пептидными гормонами, регулирующими углеводный обмен, являются инкретины ГПП-1 и ГИП, инсулин и глюкагон. При ожирении исходный уровень ГПП-1 и инсулина был выше, чем у интактных животных, но в ответ на введение глюкозы отмечалось значимое повышение уровня ГПП-1 и инсулина у интактных животных, а в контрольной группе регистрировалась лишь небольшая тенденция к увеличению. Такой эффект можно объяснить, очевидно, тем, что у животных с ожирением развилась инсулинорезистентность. Это согласуется с литературными данными, в которых отмечается повышение продукции инсулина при развитии инсулинорезистентности. Интенсивно функционирующие в условиях диеты энтероэндокринные клетки и бета-клетки имели меньший ответ на введение глюкозы по сравнению с интактными животными. При этом у животных с ожирением, получавших в течение 4-х недель исследуемые композиции в ответ на введение глюкозы отмечался более выраженный прирост и ГПП-1 и инсулина, что согласуется с динамикой снижения AUC и снижения резистентности к глюкозе. Уровень глюкагона при пероральном введении глюкозы снижался только у интактных животных, а у животных остальных групп менялся незначительно (рис. 4).
Липидный профиль у животных с ожирением мы оценивали по таким биомаркерам, как уровень общего холестерина (ОХ), липопротеидов низкой плотности (ЛПНП), триглицеридов (ТГ) и липопротеидов высокой плотности (ЛПВП). О наличии метаболических нарушений говорит увеличение показателей ОХ, ЛПНП, а также одновременное снижение уровня ЛПВП, что было отмечено в нашем исследовании у контрольной группы с ожирением. Такие данные указывают на нарушение липидного обмена, высокий риск образования атеросклеротических бляшек в сосудах и дальнейших сердечно-сосудистых осложнений. При раздельном применении композиции ФПС и ситаглиптина, и в большей степени при их комбинированном введении, наблюдалось выраженное понижение уровня общего холестерина, ЛПНП и ТГ. Композиция МФБА в монотерапии не оказывала выраженного влияния на липидный профиль животных с ожирением, а совместное применение МФБА и ситаглиптина только в небольшой степени повышало гипохолестеринемическое действие ситаглиптина.
Одним из серьезных осложнений длительного ожирения также является поражение печени. В объединенном анализе с участием 101 028 человек была установлена распространенность неалкогольной жировой дистрофии печени среди населения с избыточным весом, которая составила 69,99% [20]. В контрольной группе животных с ожирением активность АЛТ и АСТ была значительно выше, чем у интактной группы, что указывает на возможное повреждение не только печени, но, очевидно, и других органов (миокарда, почек, поджелудочной железы). На фоне введения исследуемых производных ГАМК отмечалась нормализация данных маркеров, а при морфологическом исследовании на фоне лечения отмечалось меньшее число очагов лимфоидной инфильтрации и менее выраженная жировая дистрофия печени.
Таким образом, для исследуемых производных линейной и циклической ГАМК (композиции МФБА и ФПС) на модели алиментарного ожирения при курсовом введении были выявлены выраженные метаболические эффекты, усиливающиеся при комбинировании с ситаглиптином. Отмеченное для циклического производного ГАМК (композиции ФПС) анорексигенное действие, а также способность улучшать углеводный и липидный обмены в условиях высокожировой и высококалорийной диеты, представляет интерес для дальнейших исследований.
Репрезентативность выборок
Результаты данного исследования были получены на крысах с алиментарно-индуцированным ожирением. Несмотря на то, что использование животных моделей является одним из основных подходов при изучении патофизиологических механизмов и эффективности новых методов лечения ожирения и СД2, следует с осторожностью экстраполировать полученные данные на целевую популяцию пациентов с данными заболеваниями. Для подтверждения эффективности и безопасности изученных композиций производных ГАМК у людей необходимы дальнейшие клинические исследования.
Сопоставление с другими публикациями
Полученные нами данные согласуются с результатами других исследований, показавших, что производные ГАМК обладают антидиабетическими свойствами, связанными с их способностью модулировать различные сигнальные белки (белок Klotho, SIRT, PI3K/Akt, CREB-IRS2, NF-kB, Nrf2 и др.) и оказывать антиоксидантное, противовоспалительное и метаболическое действия [11]. Новизна нашего исследования заключается в том, что мы впервые показали способность новых линейных и циклических производных ГАМК усиливать гипогликемический и гиполипидемический эффекты ситаглиптина на модели алиментарного ожирения у крыс. Комбинирование производных ГАМК с ингибиторами ДПП-4 представляется перспективным направлением для повышения эффективности лечения ожирения и СД2.
Клиническая значимость результатов
Учитывая высокую распространенность ожирения и СД2, а также недостаточную эффективность и безопасность существующих методов их лечения, поиск новых терапевтических подходов имеет большое клиническое значение. Полученные в данном исследовании результаты свидетельствуют о перспективности дальнейшего изучения производных ГАМК, особенно в комбинации с ситаглиптином, для разработки новых эффективных средств лечения метаболических нарушений при ожирении и СД2.
Ограничения исследования
Основными ограничениями данного исследования являются относительно небольшой объем выборки и использование крыс одного пола, а также отсутствие информации о безопасности длительного применения исследуемых композиций в условиях изучаемой патологии.
Направления дальнейших исследований
В продолжение данной работы планируется изучить возможные механизмы, лежащие в основе метаболических эффектов композиций производных ГАМК в условиях алиментарного ожирения.
ЗАКЛЮЧЕНИЕ
На модели алиментарного ожирения у крыс показано, что 4-недельное введение линейного и циклического производных ГАМК (композиций МФБА и ФПС), особенно в комбинации с ситаглиптином, приводит к снижению массы тела и висцерального жира, улучшению толерантности к глюкозе, чувствительности к инсулину и липидного профиля, а также уменьшению признаков неалкогольной жировой дистрофии печени. При этом композиция ФПС оказывала более выраженное анорексигенное и гипогликемическое действие по сравнению с композицией МФБА. Полученные данные свидетельствуют о перспективности дальнейшего изучения производных ГАМК в качестве потенциальных средств для лечения метаболических нарушений при ожирении и СД2 как в виде монотерапии, так и в составе комбинированной терапии с ингибиторами ДПП-4.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена при финансовой поддержке гранта РНФ от 19 апреля 2021 №21-15-00192.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Тюренков И.Н. — идея и планирование исследования, написание черновика и утверждение финальной версии рукописи; Бакулин Д.А. — моделирование и контроль патологии, введение исследуемых соединений, оформление финальной версии рукописи; Соколова А.А., Болохов Н.С. — проведение функциональных тестов, выполнение биохимических исследований и описание результатов; Бацунов А.И. — проведение иммуноферментного анализа и описание результатов; Смирнов А.В., Великородная Ю.И. — проведение гистохимического окрашивания и оценка морфологических изменений в печени, анализ и описание результатов; Васильева О.С., Макаренко С.В. — разработка исследуемых соединений, внесение правок в текст рукописи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Koliaki C, Dalamaga M, Liatis S. Update on the Obesity Epidemic: After the Sudden Rise, Is the Upward Trajectory Beginning to Flatten? Curr Obes Rep. 2023;12(4):514-527. doi: https://doi.org/10.1007/s13679-023-00527-y
2. Ahmed B, Sultana R, Greene MW. Adipose tissue and insulin resistance in obese. Biomed Pharmacother. 2021;137:111315. doi: https://doi.org/10.1016/j.biopha.2021.111315
3. Mezouar S, Chantran Y, Michel J, et al. Microbiome and the immune system: from a healthy steady-state to allergy associated disruption. Hum. Microbiome J. 2018;10:11–20. doi: https://doi.org/10.1016/j.humic.2018.10.001
4. Santos-Marcos JA, Perez-Jimenez F, Camargo A. The role of diet and intestinal microbiota in the development of metabolic syndrome. J Nutr Biochem. 2019;70:1-27. doi: https://doi.org/10.1016/j.jnutbio.2019.03.017
5. Al-Kuraishy HM, Hussian NR, Al-Naimi MS, et al. The Potential Role of Pancreatic γ-Aminobutyric Acid (GABA) in Diabetes Mellitus: A Critical Reappraisal. Int J Prev Med. 2021;12:19. doi: https://doi.org/10.4103/ijpvm.IJPVM_278_19
6. Wang KL, Tao M, Wei TJ, Wei R. Pancreatic β cell regeneration induced by clinical and preclinical agents. World J Stem Cells. 2021;13(1):64-77. doi: https://doi.org/10.4252/wjsc.v13.i1.64
7. Hagan DW, Ferreira SM, Santos GJ, Phelps EA. The role of GABA in islet function [published correction appears in Front Endocrinol (Lausanne). 2023;14:1301830]. Front Endocrinol (Lausanne). 2022;13:972115. doi: https://doi.org/10.3389/fendo.2022.972115
8. Lee HY, Lee GH, Hoang TH, et al. GABA and Fermented Curcuma longa L. Extract Enriched with GABA Ameliorate Obesity through Nox4-IRE1α Sulfonation-RIDD-SIRT1 Decay Axis in High-Fat Diet-Induced Obese Mice. Nutrients. 2022;14(8):1680. doi: https://doi.org/10.3390/nu14081680
9. Rezazadeh H, Sharifi MR, Soltani N. Insulin resistance and the role of gamma-aminobutyric acid. J Res Med Sci. 2021;26:39. doi: https://doi.org/10.4103/jrms.JRMS_374_20
10. Hosseini Dastgerdi A, Sharifi M, Soltani N. GABA administration improves liver function and insulin resistance in offspring of type 2 diabetic rats. Sci Rep. 2021;11(1):23155. doi: https://doi.org/10.1038/s41598-021-02324-w
11. Purwana I, Zheng J, Li X, et al. GABA promotes human β-cell proliferation and modulates glucose homeostasis. Diabetes. 2014;63(12):4197-4205. doi: https://doi.org/10.2337/db14-0153
12. Fortin SM, Lipsky RK, Lhamo R, et al. GABA neurons in the nucleus tractus solitarius express GLP-1 receptors and mediate anorectic effects of liraglutide in rats. Sci Transl Med. 2020;12(533):eaay8071. doi: https://doi.org/10.1126/scitranslmed.aay8071
13. Goldsmith F, Keenan MJ, Raggio AM, et al. Induction of Energy Expenditure by Sitagliptin Is Dependent on GLP-1 Receptor. PLoS One. 2015;10(5):e0126177. doi: https://doi.org/10.1371/journal.pone.0126177
14. Janani L, Bamehr H, Tanha K, et al. Effects of Sitagliptin as Monotherapy and Add-On to Metformin on Weight Loss among Overweight and Obese Patients with Type 2 Diabetes: A Systematic Review and Meta-Analysis. Drug Res (Stuttg). 2021;71(9):477-488. doi: https://doi.org/10.1055/a-1555-2797
15. Тюренков И.Н., Файбисович Т.И., Бакулин Д.А. Синергия в действии ГАМК и гипогликемических препаратов. Проблемы эндокринологии. — 2023. — Т. 69. — № 4. — С. 61-69. doi: https://doi.org/10.14341/probl13257
16. Тюренков И.Н., Куркин Д.В., Бакулин Д.А., и др. Влияние агониста рецептора GPR119 на уровень глюкозы, массу тела и потребление пищи у животных с ожирением, обусловленным высокожировой и углеводной диетой. Проблемы эндокринологии. — 2016. — Т. 62. — № 1. — С. 44-49. doi: https://doi.org/10.14341/probl201662144-49
17. Tyurenkov IN, Bakulin DA, Velikorodnaya YuI, et al. Pancreatic β-cell protective effect of novel GABA derivatives in rats with type 2 diabetes. Research Results in Pharmacology. 2023;9(3):59-70. doi: https://doi.org/10.18413/rrpharmacology.9.10042
18. Тюренков И.Н., Бакулин Д.А., Андриашвили Т.М., и др. Скрининг в ряду структурных аналогов ГАМК веществ с панкреопротективным действием. Лекарственный вестник. — 2023. — Т. 24. — № 3(91). — С. 36-42.
19. Prud’homme GJ, Glinka Y, Udovyk O, et al. GABA protects pancreatic beta cells against apoptosis by increasing SIRT1 expression and activity. Biochem Biophys Res Commun. 2014;452(3):649-654. doi: https://doi.org/10.1016/j.bbrc.2014.08.135
20. Quek J, Chan KE, Wong ZY, et al. Global prevalence of nonalcoholic fatty liver disease and non-alcoholic steatohepatitis in the overweight and obese population: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2023;8(1):20-30. doi: https://doi.org/10.1016/S2468-1253(22)00317-X
Об авторах
И. Н. ТюренковРоссия
Тюренков Иван Николаевич, д.м.н., профессор, член-корр. РАН
ResearcherID: P-7173-2015
Scopus Author ID: 6603562607
Волгоград
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Д. А. Бакулин
Россия
Бакулин Дмитрий Александрович, к.м.н.
ResearcherID: Q-1965-2015
Scopus Author ID: 56399326300
400131, г. Волгоград, площадь Павших Борцов, д. 1
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. А. Соколова
Россия
Соколова Алина Андреевна
Волгоград
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. В. Смирнов
Россия
Смирнов Алексей Владимирович, д.м.н., профессор
ResearcherID: I-8876-2017
Волгоград
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. И. Бацунов
Россия
Бацунов Александр Игоревич
Волгоград
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. С. Болохов
Россия
Болохов Никита Сергеевич
Волгоград
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Ю. И. Великородная
Россия
Великородная Юлия Ивановна
Волгоград
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
О. С. Васильева
Россия
Васильева Ольга Сергеевна, к.х.н.
Scopus Author ID: 7004359518
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
С. В. Макаренко
Россия
Макаренко Сергей Валентинович, д.х.н., доцент
Scopus Author ID: 700418205
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Дизайн исследования. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(292KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Влияние курсового (4-недельного) введения исследуемых веществ на массу тела (А) и массу висцерального жира (Б). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(509KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Уровень гликемии (А) и площадь под кривой «уровень гликемии время» AUC60-120 (Б) при проведении перорального теста на толерантность к глюкозе (ПТТГ); уровень гликемии (В) и площадь под кривой «уровень гликемии время» AUC60-180 (Г) при проведении инсулинового теста толерантности (ИТТ). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(886KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Уровень ГПП-1 (А), инсулина (Б) и глюкагона (В) до и через 15 минут после глюкозной нагрузки. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(724KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Содержание в сыворотке крови общего холестерина, липопротеидов низкой и высокой плотности (ЛПНП и ЛПВП) и триглицеридов (ТГ) (А); активность аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) в сыворотке крови животных с ожирением (Б). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(532KB)
|
Метаданные ▾ | |
|
|
6. Рисунок 6. Морфологические изменения в ткани печени при ожирении у крыс. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(2MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Тюренков И.Н., Бакулин Д.А., Соколова А.А., Смирнов А.В., Бацунов А.И., Болохов Н.С., Великородная Ю.И., Васильева О.С., Макаренко С.В. Метаболические эффекты производных ГАМК и их сочетанного применения с ситаглиптином в условиях экспериментального ожирения. Ожирение и метаболизм. 2025;22(3):167-179. https://doi.org/10.14341/omet13114
For citation:
Tyurenkov I.N., Bakulin D.A., Sokolova A.A., Smirnov A.V., Batsunov A.I., Bolokhov N.S., Velikorodnaya Yu.I., Vasilyeva O.S., Makarenko S.V. Metabolic effects of GABA derivatives and their combined use with sitagliptin in experimental obesity. Obesity and metabolism. 2025;22(3):167-179. (In Russ.) https://doi.org/10.14341/omet13114
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































