Перейти к:
Конечные продукты гликирования как один из «пусковых» факторов развития сахарного диабета 2 типа у лиц с ожирением
https://doi.org/10.14341/omet13059
Аннотация
Употребление высококалорийной пищи, подвергнутой термической обработке, приводит к набору массы тела и увеличению содержания конечных продуктов гликирования (AGE — advanced glycation end product/КПГ — конечные продукты гликирования) в организме. Доказан вклад AGE пищевого происхождения в усиление окислительного стресса и воспаления, процессов, которые играют важную роль в возникновении cахарного диабета 2 типа (СД2). Данные, полученные на клеточных и мышиных моделях, показывают, что взаимодействие AGE с их рецептором — RAGE (receptor for advanced glycation end products) способствует развитию воспаления в жировой ткани (ЖТ) за счет активации провоспалительных сигнальных каскадов. Кроме того, появились данные о влиянии RAGE на преобразование макрофагов ЖТ в провоспалительный фенотип М1, что позволяет также увеличивать степень воспаления в ЖТ. Воспаление в ЖТ приводит к развитию инсулинорезистентности и, соответственно, СД2. При этом существуют и защитные изоформы RAGE, которые способны предотвращать запуск воспалительной реакции. Обзор посвящен современным взглядам на роль cистемы AGE-RAGE в развитии нарушений углеводного обмена у лиц с ожирением.
Для цитирования:
Томилова А.О., Шестакова Е.А., Самсонова М.Д., Шестакова М.В. Конечные продукты гликирования как один из «пусковых» факторов развития сахарного диабета 2 типа у лиц с ожирением. Ожирение и метаболизм. 2024;21(3):302-308. https://doi.org/10.14341/omet13059
For citation:
Tomilova A.O., Shestakova E.A., Samsonova M.D., Shestakova M.V. Advanced glycation end products as one of the “trigger” factors in the development of type 2 diabetes in individuals with obesity. Obesity and metabolism. 2024;21(3):302-308. (In Russ.) https://doi.org/10.14341/omet13059
ВВЕДЕНИЕ
Распространенность ожирения за прошедшие несколько десятилетий возросла примерно в 3 раза и продолжает неуклонно расти, что представляет глобальную медико-социальную проблему [1]. Ожирение является значимым фактором риска развития ряда хронических заболеваний, включая сахарный диабет 2 типа (СД2) [2]. В последние годы предполагается, что первичную роль в развитии инсулинорезистентности (ИР) и СД2 могут играть конечные продукты гликирования (AGE — advanced glycation end product/КПГ — конечные продукты гликирования) и их рецептор (RAGE — receptor for advanced glycation end products) [3][4]. Взаимодействие RAGE с AGE способствует развитию окислительного стресса и активирует воспалительный сигнальный каскад через активацию ядерного фактора каппа-В (NF-κB) [5]. Кроме того, активность RAGE способствует преобразованию макрофагов в провоспалительный фенотип. Ввиду влияния на основные патогенетические звенья, лежащие в основе развития СД2, возможно, именно связывание AGE с RAGE в жировой ткани (ЖТ) при ожирении без СД2 является первопричиной развития нарушения углеводного обмена.
В настоящем обзоре литературы представлено обобщение данных, соответствующих тематике обзора, и приведен предполагаемый нами «сценарий» развития СД2 по мере прогрессирования ожирения и накопления AGE в организме человека. Поиск литературы выполнен в электронных базах данных eLIBRARY.RU и PubMed. Поисковый запрос состоял из следующих ключевых терминов: «advanced glycation end products», «weight loss», «type 2 diabetes», «obesity», «RAGE», «adipose tissue», «AGE», «конечные продукты гликирования», «сахарный диабет 2 типа». Поиск литературы окончен в июле 2023 г., ограничений по дате издания статей не устанавливали.
ВЗАИМОСВЯЗЬ МЕЖДУ ОСЬЮ СИСТЕМЫ КОНЕЧНЫХ ПРОДУКТОВ ГЛИКИРОВАНИЯ И РАЗВИТИЕМ СД2
Источники AGE
AGE — гетерогенная группа химически модифицированных необратимых соединений, образующихся в ходе неферментативной реакции, известной как гликирование, между аминогруппами и карбонильными группами.
Существуют эндогенные и экзогенные причины повышения уровня AGE в организме. К экзогенным относят табакокурение и поступление AGE с термически обработанной пищей. Продуктами, наиболее богатыми AGE, являются жареное мясо, жареные орехи и нагретое масло, наиболее низкая концентрация AGE содержится в молоке, овощах и фруктах. Исследования на людях показывают, что потребление большого количества AGE с пищей является определяющим фактором развития ИР и системного воспаления [6][7].
При высококалорийном рационе с пищей в организм поступает большое количество AGE, что вызывает повышение уровня AGE в крови с дальнейшим накоплением AGE в различных тканях, в том числе жировой [8].
Усиление образования AGE в организме человека происходит при некоторых состояниях, таких как стойкая гипергликемия, окислительный стресс, старение [9][10].
Провоспалительный эффект AGE реализуют через свой рецептор — RAGE. Для понимания сути взаимодействия AGE-RAGE необходимо объяснить структуру рецептора.
Строение рецептора конечных продуктов гликирования (RAGE)
Рецептор RAGE существует в двух основных формах — трансмембранной (RAGE) и растворимой (sRAGE).
Рецептор RAGE — это трансмембранный белок, который состоит из внеклеточной облаcти, содержащей 3 домена: один домен V-типа и два домена С-типа (С1 и С2), трансмембранной спирали и короткого цитоплазматического хвоста (рис. 1). Внеклеточная часть отвечает за связывание с лигандами RAGE. Цитоплазматический хвост RAGE лишен киназной активности, однако необходим для опосредованной лигандами RAGE передачи сигналов в различных клетках, что реализуется через связывание этого домена с формином — Diaphanous1 [11].
RAGE экспрессируются в нескольких типах клеток, включая адипоциты, макрофаги и эндотелиальные клетки, участвует во многих физиологических процессах, таких как воспаление, передача сигналов клетками, образование активных форм кислорода [8][12].
Взаимодействие AGE с RAGE активирует множество сигнальных путей, таких как MAPK/ERK, TGF-β, JNK и NF-κB, что приводит к усилению окислительного стресса и воспаления. Степень экспрессии RAGE зависима от концентрации AGE и увеличивается при повышении уровня AGE как у людей, так и в экспериментальных моделях [13–15].
Активация RAGE вносит вклад в патогенез различных заболеваний и состояний, включая СД2, поздние осложнения СД2, атеросклероз, дислипидемию, болезнь Альцгеймера, онкологические и нейродегенеративные заболевания [16–20].
При этом, помимо трансмембранной формы RAGE, существуют растворимые формы рецептора RAGE (soluble RAGE — sRAGE), которые обнаруживаются внеклеточно — в плазме, синовиальной и спинномозговой жидкостях, а также в жидкости бронхоальвеолярного лаважа [21]. Растворимый вариант рецептора представлен двумя основными формами sRAGE. Большая часть циркулирующего sRAGE образуется в результате расщепления полноразмерного рецептора матриксными металлопротеиназами (MMPs) и белком ADAM10 и называется сRAGE (cleaved RAGE). Другая форма sRAGE, известная как esRAGE (endogenous secretory RAGE), представляет собой менее распространенную форму sRAGE и является продуктом сплайс-варианта Ager (Ager-ген, кодирующий RAGE) [22]. Отличительная особенность sRAGE от RAGE заключена в структуре — sRAGE также состоит из доменов V, C1 и C2, но при этом не содержит цитоплазматического и трансмембранного доменов, что обеспечивает способность sRAGE связываться со всеми лигандами RAGE без последующей индукции сигнальных воспалительных путей. Таким образом, sRAGE действуют противоположно трансмембранному RAGE и функционируют как рецепторы-ловушки для AGE, не вызывая патологической воспалительной реакции.
Роль активации RAGE в жировой ткани
Избыточное поступление высококалорийной пищи приводит к гипертрофии и гиперплазии адипоцитов, что не сопровождается достаточной капилляризацией ткани. Возникающая в результате гипоксия активирует клеточные сигнальные пути, которые приводят к стрессовой реакции, в результате происходит высвобождение провоспалительных веществ (цитокинов и хемокинов), вызывающих рекрутирование макрофагов и преимущественное их накопление в ВЖТ [23]. В нормальных условиях макрофаги ЖТ (МЖТ) в основном представляют собой противовоспалительные макрофаги. При ожирении ЖТ подвергается различным метаболическим метаморфозам, а МЖТ преобразовывают противовоспалительный фенотип (М2) в провоспалительный (М1), что позволяет им производить некоторые воспалительные факторы, усиливая степень воспаления в ЖТ. Более ранние исследования показали, что МЖТ, вызывая хроническое воспаление, могут играть ключевую роль в генезе ИР, вызванной ожирением [24].
Сообщалось, что RAGE может индуцировать активацию макрофагов, а также опосредовать хемотаксис моноцитов/макрофагов и способствовать усилению воспалительной реакции в ЖТ [25][26]. RAGE в высокой степени экспрессируется на моноцитах и макрофагах, и экспрессия RAGE еще более усиливается, когда иммунные клетки в организме активируются, что в совокупности само по себе формирует «порочный круг» по увеличению степени воспаления.
Проведено несколько исследований, направленных на изучение функции RAGE в ЖТ (рис. 2 А). В одном из исследований оценивалось содержание макрофагов фенотипов М1 и М2 в ВЖТ у мышей с делецией Ager и у мышей дикого типа на фоне кормления высокожировой диетой. Оказалось, что уровни экспрессии маркеров макрофагов М2, таких как CD163, IL-10, CD209d, Arg1 и CD209e, в ВЖТ у мышей с делецией Ager были значительно выше, чем у мышей дикого типа. По данным иммуногистохимии, в этом же исследовании на фоне высокожировой диеты выявлено меньше клеток М1 в ВЖТ у мышей с делецией Ager по сравнению с ВЖТ мышей дикого типа. На фоне низкожировой диеты у мышей подобных наблюдений выявлено не было. Полученные в этом исследовании данные в совокупности свидетельствуют о том, что RAGE может способствовать развитию ожирения на фоне высокожировой диеты [27]. Кроме того, Monden M. et al. показали, что сверхэкспрессия RAGE in vitro вызывает гипертрофию адипоцитов [28]. В другой работе (рис. 2 Б) оценивали влияние высокожировых диет с низким и высоким содержанием AGE на выраженность ожирения у мышей дикого типа. В результате этого исследования получено, что у мышей, получавших диету с высоким содержанием жиров и высоким содержанием AGE в течение 6 недель, наблюдалось большее увеличение веса и более выраженное висцеральное ожирение по сравнению с мышами, которых кормили пищей с высоким содержанием жиров и низким содержанием AGЕ [29], что, в свою очередь, учитывая данные вышеперечисленных исследований, подчеркивает влияние активации RAGE через AGЕ на развитие ожирения.
Делеция Ager у мышей предотвращает развитие ожирения, гипертрофии адипоцитов, воспаления и ИР на фоне кормления высокожировой диетой, что отражает вовлеченность RAGE в патогенез этих состояний [8][28][30][31]. Кроме того, у мышей, несущих адипоцит-специфическую делецию Ager, отмечается лучшая способность к терморегуляции во время холодовой пробы по сравнению с мышами контрольной группы. Также у мышей с делецией Ager отмечается более высокий расход энергии и более высокая экспрессия термогенина (UCP-1) в жировой ткани, что в совокупности является процессами, связанными с улучшением метаболического здоровья и предупреждением развития ожирения. Механизмы регуляции термогенеза были прослежены до RAGE-зависимого подавления активности протеинкиназы А в коричневых и белых адипоцитах, что свидетельствует о том, что RAGE подавляет термогенное программирование ЖТ [32].
Несмотря на подтверждение влияния RAGE на МЖТ и его участие в генезе ожирения и ИР, точные механизмы его воздействия на ЖТ все еще недостаточно изучены, что вызывает необходимость проведения дальнейших исследований.
Также показано, что на фоне значимого снижения веса после бариатрического лечения улучшаются метаболические параметры уже через три месяца, тогда как для достижения значительного снижения уровня циркулирующих провоспалительных цитокинов, в том числе TNFα, у той же группы пациентов потребовалось шесть месяцев [33]. Уровни циркулирующего цитокина MCP-1 (Monocyte Chemoattractant Protein 1), ответственного за привлечение макрофагов и усугубляющего ИР у мышей, существенно не снижались в течение периода наблюдения [34]. Сохранение концентрации MCP-1 может являться одним из факторов, обуславливающих «феномен метаболической памяти», в существовании которого определенная роль отводится и оси AGE-RAGE.
Эволюция изменений в системе AGE-RAGE при развитии ожирения и переходе к СД2
В задачи нашего обзора входило описание функционирования системы AGE-RAGE в крови и ЖТ у лиц с разной массой тела (нормальной массой и при ожирении), а также с разным состоянием углеводного обмена (нормогликемией и СД2). Исходя из данных литературы существуют особенности в системе AGE-RAGE в перечисленных выше условиях. В связи с этим, на основании результатов отдельных исследований, мы предполагаем следующий сценарий взаимодействия AGE со своим рецептором по мере прогрессирования метаболических нарушений (рис. 3).
При увеличении массы тела основным источником AGE выступают продукты питания, что, предположительно, должно вызывать высокий уровень AGE в кровотоке, однако результаты исследований свидетельствуют об обратном. При избыточном поступлении AGE они начинают накапливаться в ЖТ, возможно, именно этим объясняется снижение уровня AGE в кровотоке и увеличение экспрессии RAGE в ЖТ у лиц с ожирением без СД2 (по сравнению с контрольной группой здоровых) [8][35–37]. При этом низкий уровень AGE в кровотоке сопровождается увеличением степени системного воспаления у пациентов с ожирением [Gaens KH, 2015].
Cтоит также предположить, что у человека есть определенный «предел накопления» AGE в ЖТ, при превышении которого AGE начинают накапливаться и в кровотоке. Вероятно, повышение уровня AGE в кровотоке у людей с ожирением может служить сигналом перехода к преддиабету и СД2 [38].
Кроме того, у людей с ожирением — как с СД2, так и без него, — отмечается снижение уровня sRAGE по сравнению с людьми с нормальной массой тела [21, 39–43]. Вероятно, это связано с тем, что при высоком уровне AGE в крови большое количество sRAGE оказываются связаны с AGE.
Вышеперечисленные наблюдения предполагают связь оси AGE/RAGE с патофизиологией ожирения, ИР и СД2, обусловленную, по крайней мере частично, экспрессией и активностью этой оси в ЖТ.
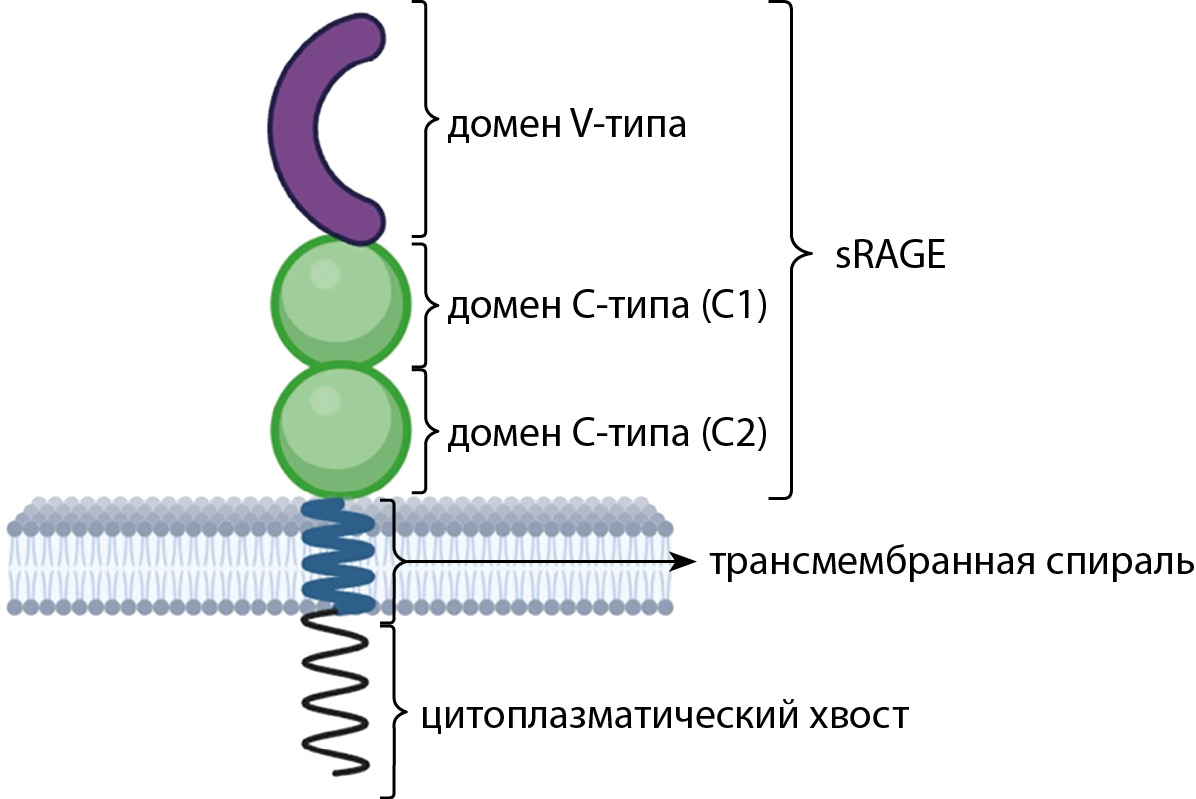
Рисунок 1. Строение рецептора конечных продуктов гликирования (RAGE) и его изоформы sRAGE.
Figure 1. Structure of the receptor for advanced glycation end products (RAGE) and its isoform sRAGE.
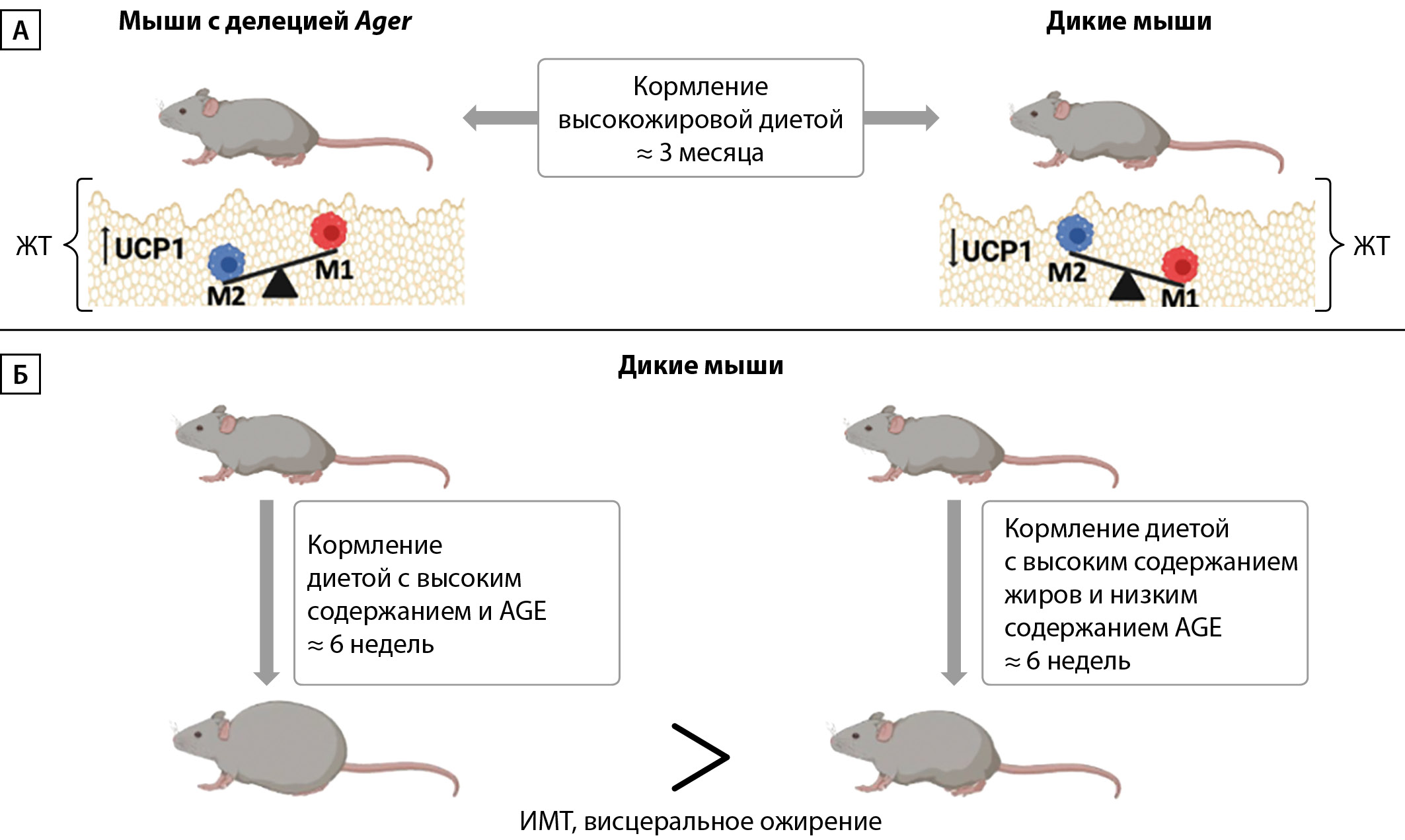
Рисунок 2. Наглядное изображение результатов исследований, изучающих роль RAGE в ЖТ на мышиных моделях.
Примечание. ЖТ — жировая ткань; М1 — макрофаги фенотипа М1; М2 — макрофаги фенотипа М2; UCP1(Uncoupling protein 1) — термогенин; Ager — ген, кодирующий RAGE.
А — адаптация результатов исследований [24][29], Б — [26].
Figure 2. Visual representation of the results of studies investigating the role of RAGE in adipose tissue in mouse models.
Note. ЖТ — adipose tissue; M1 — macrophages of the M1 phenotype; M2 — macrophages of the M2 phenotype; UCP1 (Uncoupling protein 1) — thermogenin; Ager — the gene encoding RAGE.
A — adaptation of research results [24][29], B — [26].
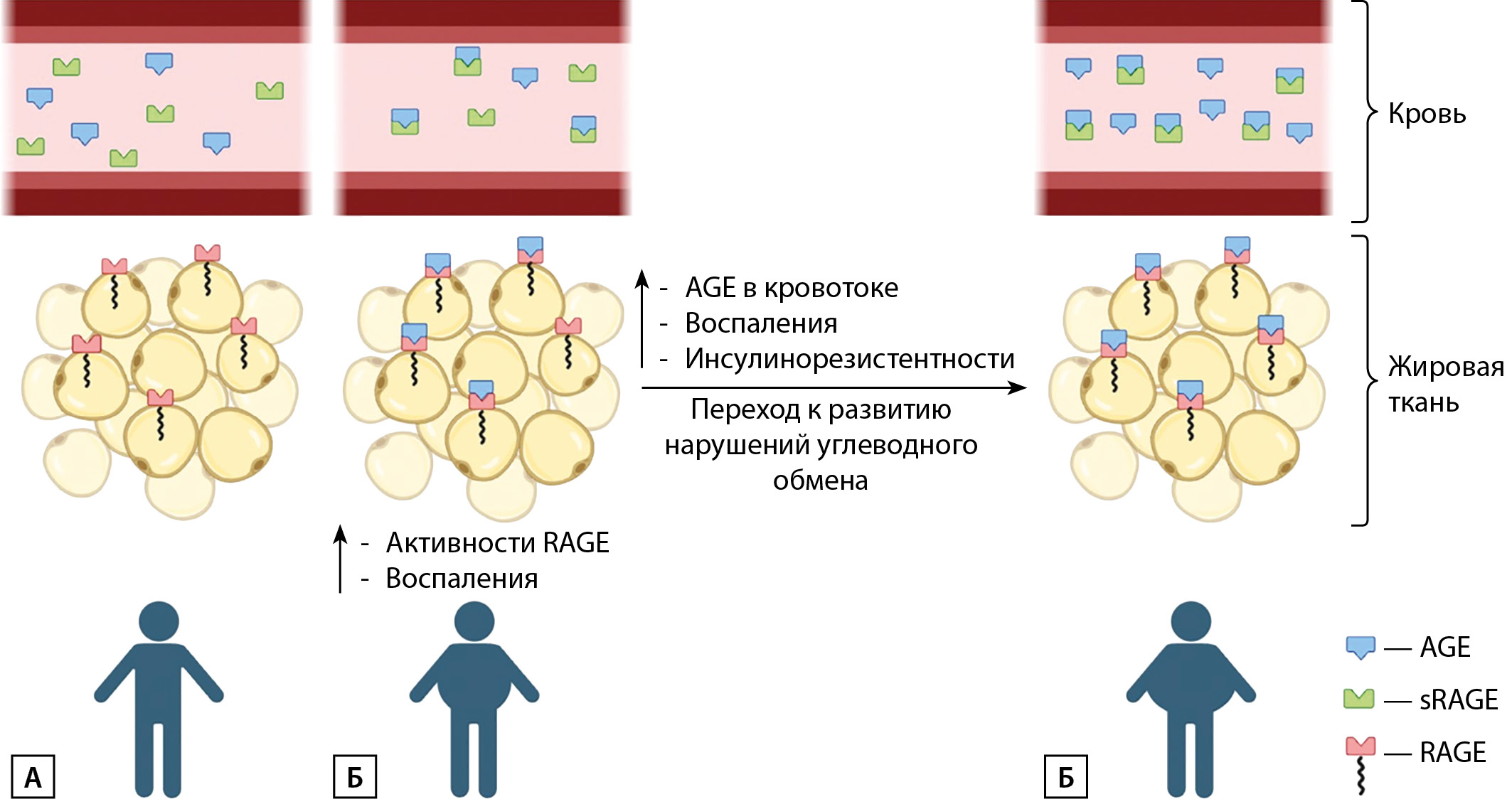
Рисунок 3. Cхематичное изображение изменений в системе AGE-RAGE при развитии ожирения и СД.
А — при нормальной массе тела низкая концентрация AGE, нормальная экспрессия RAGE и высокая концентрация sRAGE.
Б — при увеличении массы тела концентрации AGE и sRAGE в крови снижаются в связи с образованием комплексов AGE-sRAGE, AGE-RAGE и накоплением AGE в ЖТ. Вследствие связывания AGE с RAGE усиливается воспаление.
В — при достижении определенного «предела накопления» AGE в ЖТ повышается уровень AGE в крови, развивается ИР, что является отражением перехода от ожирения без с СД к развитию нарушений углеводного обмена.
Figure 3. Schematic representation of changes in the AGE-RAGE system during the development of obesity and diabetes.
A — with normal body weight, low AGE concentration, normal RAGE expression and high sRAGE concentration.
B — with an increase in body weight, the concentrations of AGE and sRAGE in the blood decrease due to the formation of AGE-sRAGE, AGE-RAGE complexes and the accumulation of AGE in the adipose tissue. Due to the binding of AGE to RAGE, inflammation increases.
B — when a certain "accumulation limit" of AGE in the adipose tissue is reached, the level of AGE in the blood increases, IR develops, which reflects the transition from obesity without diabetes to the development of carbohydrate metabolism disorders.
ЧТО ПРОИСХОДИТ В СИСТЕМЕ КОНЕЧНЫХ ПРОДУКТОВ ГЛИКИРОВАНИЯ ПРИ СНИЖЕНИИ ВЕСА?
Соблюдение диеты с ограничением продуктов, подвергнутых высокой термической обработке, может снизить концентрацию AGE [44]. Кроме того, соблюдение диеты с ограничением продуктов высокого содержания AGE снижает выраженность ИР, гиперинсулинемию, уровни AGE, маркеров окислительного стресса и воспаления [6][7].
Ограничение суточной калорийности также может способствовать уменьшению общего пула AGE в организме за счет уменьшения потребления пищи с высоким содержанием AGE.
Соблюдение низкокалорийной диеты (~1200 ккал/сут) в течение 2 месяцев снижало концентрацию AGE в сыворотке крови на 7,21% у здоровых лиц с избыточной массой тела. Эти изменения положительно коррелировали с изменениями триглицеридов, окружности талии и ИМТ [45].
Существует взаимосвязь между sRAGE и изменением веса после бариатрической операции и диетотерапии.
В исследовании Miranda ER et al. у пациентов с ожирением снижение массы тела отрицательно коррелировало с изменением общего sRAGE, cRAGE и esRAGE, при этом esRAGE наиболее сильно коррелировало с ИМТ и процентным содержанием жира в организме [46].
В 24-месячном исследовании у лиц с морбидным ожирением после бариатрической хирургии увеличивалась концентрация sRAGE. Более того, изменения sRAGE отрицательно коррелировали с изменениями уровней инсулина натощак, глюкозы через 1 и 2 часа после приема пищи, триглицеридов, γ-глутамилтрансферазы (ГГТ) и индексом HOMA-IR [47].
В 3-летнем наблюдении Horwitz et al. за пациентами с СД2 и ожирением, которым было проведено бариатрическое лечение, не выявлено связи между процентом потери массы тела и развитием ремиссии СД [48]. Это предполагает дополнительные механизмы, помимо снижения массы тела, играющие роль в развитии ремиссии СД, вероятно, связанные с осью AGE-RAGE. В этом исследовании также получено, что более высокий исходный уровень sRAGE был связан отрицательно с изменением гликированного гемоглобина (HbA1с) и положительно — с процентом потери массы тела после операции.
ЗАКЛЮЧЕНИЕ
Для разных метаболических статусов пациентов (ожирение с СД2 и без, снижение веса) выявлены свои изменения в оси конечных продуктов гликирования. Это дает нам основание говорить о вкладе данной оси в развитие метаболических заболеваний, в том числе СД2, и как следствие — о возможности поиска «мишеней» для разработки терапевтических стратегий по предупреждению развития и лечению СД2. Введение в практику диетических рекомендаций, направленных на уменьшение потребления пищевых AGE, может являться одним из способов профилактики развития СД2, поскольку ограничение потребления пищевых продуктов с высоким содержанием AGE приводит к снижению уровня воспаления и степени ИР. Проведение исследований для комплексного изучения оси конечных продуктов гликирования с оценкой уровней экспрессии RAGE в тканях и накопления его лигандов в крови и тканях у разных групп пациентов (с разными ИМТ, ИР и состоянием углеводного обмена) может позволить не только улучшить понимание патогенеза ожирения и СД2, но и положить основу для разработки новых таргетных препаратов для лечения данных заболеваний.
Дополнительная информация
Источники финансирования. Работа выполнена при поддержке Российского научного фонда (проект №22-15-00365 «Динамика гормонально-метаболических факторов, маркеров “метаболической памяти” и фенотипических особенностей зрелых и прогениторных клеток жировой ткани на фоне постбариатрической ремиссии сахарного диабета 2 типа»).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Томилова А.О., Шестакова Е.А. — концепция и дизайн статьи, анализ литературы, написание статьи, утверждение итогового варианта текста рукописи; Самсонова М.Д. — анализ литературы, написание статьи; Шестакова М.В. — редактирование текста, утверждение итогового варианта текста рукописи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Chooi YC, Ding C, Magkos F. The epidemiology of obesity. Metabolism. 2019;92:6-10. doi: https://doi.org/10.1016/j.metabol.2018.09.005
2. La Sala L, Pontiroli AE. Prevention of Diabetes and Cardiovascular Disease in Obesity. Int J Mol Sci. 2020;21(21):8178. doi: https://doi.org/10.3390/ijms21218178
3. Feng Z, Zhu L, Wu J. RAGE signalling in obesity and diabetes: focus on the adipose tissue macrophage. Adipocyte. 2020;9(1):563-566. doi: https://doi.org/10.1080/21623945.2020.1817278
4. Ruiz HH, Nguyen A, Wang C, et al. AGE/RAGE/DIAPH1 axis is associated with immunometabolic markers and risk of insulin resistance in subcutaneous but not omental adipose tissue in human obesity. Int J Obes. 2021;45(9):2083-2094. doi: https://doi.org/10.1038/s41366-021-00878-3
5. Wautier MP, Guillausseau PJ, Wautier JL. Activation of the receptor for advanced glycation end products and consequences on health. Diabetes Metab Syndr Clin Res Rev. 2017. doi: https://doi.org/10.1016/j.dsx.2016.09.009
6. Vlassara H, Striker GE. AGE restriction in diabetes mellitus: a paradigm shift. Nat Rev Endocrinol. 2011;7(9):526-539. doi: https://doi.org/10.1038/nrendo.2011.74
7. de Courten B, de Courten MP, Soldatos G, et al. Diet low in advanced glycation end products increases insulin sensitivity in healthy overweight individuals: a double-blind, randomized, crossover trial. Am J Clin Nutr. 2016;103(6):1426-1433. doi: https://doi.org/10.3945/ajcn.115.125427
8. Gaens KHJ, Goossens GH, Niessen PM, et al. N ε -(Carboxymethyl)lysine-Receptor for Advanced Glycation End Product Axis Is a Key Modulator of Obesity-Induced Dysregulation of Adipokine Expression and Insulin Resistance. Arterioscler Thromb Vasc Biol. 2014;34(6):1199-1208. doi: https://doi.org/10.1161/ATVBAHA.113.302281
9. Snelson M, Coughlan M. Dietary Advanced Glycation End Products: Digestion, Metabolism and Modulation of Gut Microbial Ecology. Nutrients. 2019;11(2):215. doi: https://doi.org/10.3390/nu11020215
10. Иванникова Е.В., Смирнова О.М. Роль конечных продуктов гликирования и их рецепторов в развитии осложнений сахарного диабета // Эффективная фармакотерапия. — 2019. — Т. 15. — №5. — С. 20-27.
11. Jangde N, Ray R, Rai V. RAGE and its ligands: from pathogenesis to therapeutics. Crit Rev Biochem Mol Biol. 2020;55(6):555-575. doi: https://doi.org/10.1080/10409238.2020.1819194
12. Feng Z, Du Z, Shu X, et al. Role of RAGE in obesity-induced adipose tissue inflammation and insulin resistance. Cell Death Discov. 2021;7(1):305. doi: https://doi.org/10.1038/s41420-021-00711-w
13. Goldin A, Beckman JA, Schmidt AM, Creager MA. Advanced Glycation End Products. Circulation. 2006;114(6):597-605. doi: https://doi.org/10.1161/CIRCULATIONAHA.106.621854
14. Schmidt AM, Yan S Du, Yan SF, Stern DM. The multiligand receptor RAGE as a progression factor amplifying immune and inflammatory responses. J Clin Invest. 2001;108(7):949-955. doi: https://doi.org/10.1172/JCI200114002
15. Rogge MM. The role of impaired mitochondrial lipid oxidation in obesity. Biol Res Nurs. 2009. doi: https://doi.org/10.1177/1099800408329408
16. Kong Y, Liu C, Zhou Y, et al. Progress of RAGE Molecular Imaging in Alzheimer’s Disease. Front Aging Neurosci. 2020;12. doi: https://doi.org/10.3389/fnagi.2020.00227
17. Prasad K, Khan AS, Bhanumathy KK. Does AGE–RAGE Stress Play a Role in the Development of Coronary Artery Disease in Obesity? Int J Angiol. 2022;31(01):001-009. doi: https://doi.org/10.1055/s-0042-1742587
18. Reddy VP, Aryal P, Darkwah EK. Advanced Glycation End Products in Health and Disease. Microorganisms. 2022;10(9):1848. doi: https://doi.org/10.3390/microorganisms10091848
19. Гаврилова А.О., Северина А.С., Шамхалова М.Ш. и др. Роль конечных продуктов гликирования в патогенезе диабетической нефропатии // Сахарный диабет. — 2021. — Т. 24. — №5. —С. 461-469. doi: https://doi.org/10.14341/DM12784
20. Каландия М.М., Токмакова А.Ю., Галстян Г.Р. Роль конечных продуктов гликирования в развитии и прогрессировании диабетической нейроостеоартропатии // Проблемы эндокринологии. — 2021. — Т. 67. №3. — С. 4-9. doi: https://doi.org/10.14341/probl12778
21. Miranda ER, Somal VS, Mey JT, et al. Circulating soluble RAGE isoforms are attenuated in obese, impaired-glucose-tolerant individuals and are associated with the development of type 2 diabetes. Am J Physiol - Endocrinol Metab. 2017. doi: https://doi.org/10.1152/ajpendo.00146.2017
22. Tavares JF, Ribeiro PVM, Coelho OGL, Silva LE da, Alfenas RCG. Can advanced glycation end‐products and their receptors be affected by weight loss? A systematic review. Obes Rev. 2020;21(6). doi: https://doi.org/10.1111/obr.13000
23. Püschel GP, Klauder J, Henkel J. Macrophages, Low-Grade Inflammation, Insulin Resistance and Hyperinsulinemia: A Mutual Ambiguous Relationship in the Development of Metabolic Diseases. J Clin Med. 2022. doi: https://doi.org/10.3390/jcm11154358
24. Xu H, Barnes GT, Yang Q, et al. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance. J Clin Invest. 2003. doi: https://doi.org/10.1172/JCI200319451
25. Byun K, Yoo Y, Son M, et al. Advanced glycation end-products produced systemically and by macrophages: A common contributor to inflammation and degenerative diseases. Pharmacol Ther. 2017;177:44-55. doi: https://doi.org/10.1016/j.pharmthera.2017.02.030
26. Xu Y, Toure F, Qu W, et al. Advanced Glycation End Product (AGE)-Receptor for AGE (RAGE) Signaling and Up-regulation of Egr-1 in Hypoxic Macrophages. J Biol Chem. 2010;285(30):23233-23240. doi: https://doi.org/10.1074/jbc.M110.117457
27. Schmidt AM. RAGE and Implications for the Pathogenesis and Treatment of Cardiometabolic Disorders – Spotlight on the Macrophage. Arterioscler. Thromb. Vasc. Biol. 2017;37(4):613–621 doi: https://doi.org/10.1161/ATVBAHA.117.307263
28. Monden M, Koyama H, Otsuka Y, et al. Receptor for Advanced Glycation End Products Regulates Adipocyte Hypertrophy and Insulin Sensitivity in Mice. Diabetes. 2013;62(2):478-489. doi: https://doi.org/10.2337/db11-1116
29. Sayej WN, Knight PR, Guo WA, et al. Advanced Glycation End Products Induce Obesity and Hepatosteatosis in CD-1 Wild-Type Mice. Biomed Res Int. 2016. doi: https://doi.org/10.1155/2016/7867852
30. Song F, Hurtado del Pozo C, Rosario R, et al. RAGE Regulates the Metabolic and Inflammatory Response to High-Fat Feeding in Mice. Diabetes. 2014;63(6):1948-1965. doi: https://doi.org/10.2337/db13-1636
31. Ueno H, Koyama H, Shoji T, et al. Receptor for advanced glycation end-products (RAGE) regulation of adiposity and adiponectin is associated with atherogenesis in apoE-deficient mouse. Atherosclerosis. 2010. doi: https://doi.org/10.1016/j.atherosclerosis.2010.04.006
32. Hurtado del Pozo C, Ruiz HH, Arivazhagan L, et al. A Receptor of the Immunoglobulin Superfamily Regulates Adaptive Thermogenesis. Cell Rep. 2019;28(3):773-791.e7. doi: https://doi.org/10.1016/j.celrep.2019.06.06133.
33. Villarreal-Calderon JR, Cuellar-Tamez R, Castillo EC, Luna-Ceron E, García-Rivas G, Elizondo-Montemayor L. Metabolic shift precedes the resolution of inflammation in a cohort of patients undergoing bariatric and metabolic surgery. Sci Rep. 2021;11(1):12127. doi: https://doi.org/10.1038/s41598-021-91393-y
34. Kamei N, Tobe K, Suzuki R, et al. Overexpression of Monocyte Chemoattractant Protein-1 in Adipose Tissues Causes Macrophage Recruitment and Insulin Resistance. J Biol Chem. 2006;281(36):26602-26614. doi: https://doi.org/10.1074/jbc.M601284200
35. Turki Jalil A, Alameri AA, Iqbal Doewes R, et al. Circulating and dietary advanced glycation end products and obesity in an adult population: A paradox of their detrimental effects in obesity. Front Endocrinol (Lausanne). 2022;13. doi: https://doi.org/10.3389/fendo.2022.966590
36. Ruiz HH, Ramasamy R, Schmidt AM. Advanced Glycation End Products: Building on the Concept of the “Common Soil” in Metabolic Disease. Endocrinology. 2020;161(1). doi: https://doi.org/10.1210/endocr/bqz006
37. Šebeková K, Krivošíková Z, Gajdoš M. Total plasma Nε-(carboxymethyl)lysine and sRAGE levels are inversely associated with a number of metabolic syndrome risk factors in non-diabetic young-to-middle-aged medication-free subjects. Clin Chem Lab Med. 2014;52(1). doi: https://doi.org/10.1515/cclm-2012-0879
38. Uribarri J, Cai W, Woodward M, et al. Elevated Serum Advanced Glycation Endproducts in Obese Indicate Risk for the Metabolic Syndrome: A Link Between Healthy and Unhealthy Obesity? J Clin Endocrinol Metab. 2015;100(5):1957-1966. doi: https://doi.org/10.1210/jc.2014-3925
39. Dozio E, Briganti S, Delnevo A, et al. Relationship between soluble receptor for advanced glycation end products (sRAGE), body composition and fat distribution in healthy women. Eur J Nutr. 2017. doi: https://doi.org/10.1007/s00394-016-1291-0
40. Koborová I, Gurecká R, Csongová M, et al. Association between metabolically healthy central obesity in women and levels of soluble receptor for advanced glycation end products, soluble vascular adhesion protein-1, and the activity of semicarbazide-sensitive amine oxidase. Croat Med J. 2017. doi: https://doi.org/10.3325/cmj.2017.58.106
41. Norata GD, Garlaschelli K, Grigore L, et al. Circulating soluble receptor for advanced glycation end products is inversely associated with body mass index and waist/hip ratio in the general population. Nutr Metab Cardiovasc Dis. 2009;19(2):129-134. doi: https://doi.org/10.1016/j.numecd.2008.03.004
42. Guclu M, Ali A, Eroglu DU, Büyükuysal SO, Cander S, Ocak N. Serum Levels of sRAGE Are Associated with Body Measurements, but Not Glycemic Parameters in Patients with Prediabetes. Metab Syndr Relat Disord. 2016;14(1):33-39. doi: https://doi.org/10.1089/met.2015.0078
43. Davis KE, Prasad C, Vijayagopal P, Juma S, Imrhan V. Serum soluble receptor for advanced glycation end products correlates inversely with measures of adiposity in young adults. Nutr Res. 2014;34(6):478-485. doi: https://doi.org/10.1016/j.nutres.2014.04.012
44. Uribarri J, Woodruff S, Goodman S, et al. Advanced Glycation End Products in Foods and a Practical Guide to Their Reduction in the Diet. J Am Diet Assoc. 2010. doi: https://doi.org/10.1016/j.jada.2010.03.018
45. Gugliucci A, Kotani K, Taing J, et al. Short-Term Low Calorie Diet Intervention Reduces Serum Advanced Glycation End Products in Healthy Overweight or Obese Adults. Ann Nutr Metab. 2009;54(3):197-201. doi: https://doi.org/10.1159/000217817
46. Miranda ER, Fuller KNZ, Perkins RK, et al. Endogenous secretory RAGE increases with improvements in body composition and is associated with markers of adipocyte health. Nutr Metab Cardiovasc Dis. 2018;28(11):1155-1165. doi: https://doi.org/10.1016/j.numecd.2018.07.009
47. Brix JM, Höllerl F, Kopp H-P, Schernthaner GH, Schernthaner G. The soluble form of the receptor of advanced glycation endproducts increases after bariatric surgery in morbid obesity. Int J Obes. 2012;36(11):1412-1417. doi: https://doi.org/10.1038/ijo.2012.107
48. Horwitz D, Saunders JK, Ude-Welcome A, et al. Three-year follow-up comparing metabolic surgery versus medical weight management in patients with type 2 diabetes and BMI 30–35. The role of sRAGE biomarker as predictor of satisfactory outcomes. Surg Obes Relat Dis. 2016;12(7):1337-1341. doi: https://doi.org/10.1016/j.soard.2016.01.016
Об авторах
А. О. ТомиловаРоссия
Томилова (Гаврилова) Алина Олеговна – аспирант.
117036, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Нет
Е. А. Шестакова
Россия
Шестакова Екатерина Алексеевна - д.м.н., г.н.с.
Москва
Конфликт интересов:
Нет
М. Д. Самсонова
Россия
Cамсонова Маргарита Денисовна - клинический ординатор.
Москва
Конфликт интересов:
Нет
М. В. Шестакова
Россия
Шестакова Марина Владимировна - д.м.н., профессор, академик РАН.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Строение рецептора конечных продуктов гликирования (RAGE) и его изоформы sRAGE | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(109KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Наглядное изображение результатов исследований, изучающих роль RAGE в ЖТ на мышиных моделях | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(263KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Cхематичное изображение изменений в системе AGE-RAGE при развитии ожирения и СД | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(259KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Томилова А.О., Шестакова Е.А., Самсонова М.Д., Шестакова М.В. Конечные продукты гликирования как один из «пусковых» факторов развития сахарного диабета 2 типа у лиц с ожирением. Ожирение и метаболизм. 2024;21(3):302-308. https://doi.org/10.14341/omet13059
For citation:
Tomilova A.O., Shestakova E.A., Samsonova M.D., Shestakova M.V. Advanced glycation end products as one of the “trigger” factors in the development of type 2 diabetes in individuals with obesity. Obesity and metabolism. 2024;21(3):302-308. (In Russ.) https://doi.org/10.14341/omet13059

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































