Перейти к:
Костное ремоделирование при менопаузе в сочетании с сахарным диабетом у крыс Wistar
https://doi.org/10.14341/omet12961
Аннотация
Обоснование. Остеопороз — хроническое метаболическое заболевание скелета, характеризующееся высокой частотой низкотравматичных переломов вследствие снижения плотности костной ткани и нарушения ее микроархитектоники. Постменопаузальный остеопороз занимает около 80% в структуре остеопороза у женщин после 50 лет. Сахарный диабет (СД) не только является фактором риска низкотравматичных переломов, но и ухудшает репаративные процессы в костной ткани. Встречаемость и СД 2 типа, и остеопороза возрастает в период менопаузы, поэтому изучение костного обмена в условиях экспериментального СД и менопаузы без вмешательства внешних факторов представляется важным.
Цель. Изучение маркеров костного обмена и параметров гистоморфометрии костной ткани в условиях хирургической менопаузы и экспериментального СД.
Материалы и методы. В начале эксперимента половине самок крыс стока Wistar проводилась двусторонняя овариэктомия (ОЭ). Затем в течение 4 нед и далее на протяжении всего эксперимента животные находились на диете с повышенным содержанием насыщенных жиров. Для моделирования СД вводился раствор никотинамида и стрептозотоцина. Были сформированы следующие группы: «Контроль» (самки без каких-либо вмешательств, получавшие стандартный корм, n=5), «ОЭ» (самки после ОЭ, n=5), «CД» (самки с моделированным СД, n=4), «ОЭ+CД» (самки после ОЭ с СД, n=4). Период наблюдения составил 8 нед. В конце эксперимента производился забор крови с последующим определением маркеров костного ремоделирования и фосфорно-кальциевого обмена (остеокальцин, остеопротегерин (ОПГ), лиганд активатора рецептора ядерного фактора каппа-бета (RANKL), склеростин, фактор роста фибробластов-23 (ФРФ-23), кальций общий, фосфор неорганический). После эвтаназии проводилось гистоморфометрическое исследование костей.
Результаты. Уровень фосфора был значимо ниже как в группе «ОЭ» (1,63 [1,58; 1,65] ммоль/л), так и в группе «СД» (2,81 [2,57; 2,83] ммоль/л) по сравнению с группой «Контроль» (3,12 [2,55; 3,24] ммоль/л), р<0,001. Данный показатель был значимо выше в группе «ОЭ+СД» (2,79 [2,46; 2,81] ммоль/л) по сравнению с группой «ОЭ» (2,79 [2,46; 2,81] ммоль/л), р=0,025. Уровень остеокальцина был достоверно ниже в группе «СД» (8,11 [7,84; 9,19] нг/мл) по сравнению с группой «Контроль» (16,97 [14,07; 17,07] нг/мл), р=0,005. Найдена слабая отрицательная корреляционная связь (r=-0,5; p<0,05 ) между уровнем глюкозы и уровнем остеокальцина. Выявлены более низкая концентрация RANKL в группе «ОЭ+СД» (278,1 [273,1; 289,7] пг/мл) по сравнению с группой «ОЭ» (400,6 [394,5; 415,1] пг/мл) и более высокое соотношение ОПГ/RANKL (0,03 [0,02; 0,04] и 0,01 [0,004; 0,014] соответственно), р=0,05. В группе «ОЭ» получен более низкий уровень ОПГ (5,1 [1,5; 5,6] пмоль/л) и соотношения ОПГ/RANKL (0,01 [0,003; 0,014]), чем в группе «Контроль» (12,3 [8,8; 14,2] пмоль/л и 0,34 [0,33; 0,4], р=0,025 и р=0,07 соответственно). Площадь костных балок в зоне эпифиза была наибольшей в группе «Контроль» (42 [39; 45]%), различия достоверны по сравнению с группой «ОЭ» (29 [25; 33]%, p=0,011) и группой «ОЭ+СД» (30 [23; 25]%, p=0,016). Площадь костных балок в зоне метаэпифиза также была наибольшей в группе «Контроль» (49 [46; 52]%) по сравнению с группами «ОЭ» (35 [25; 39]%), «СД» (31 [26; 34]%), «ОЭ+СД» (35 [33; 38]), p <0,001. В толщине костных балок различий между группами не было.
Заключение. СД может значимо угнетать костное ремоделирование у животных без хирургической менопаузы, что выражается в более низком уровне остеокальцина. Костный обмен при СД и менопаузе характеризуется более низким уровнем RANKL и более высоким соотношением ОПГ/RANKL, чем у животных без СД. Влияние ОЭ на костный обмен характеризуется большим снижением площади костных балок, чем при изолированном СД.
Для цитирования:
Тимкина Н.В., Симаненкова А.В., Байрамов А.А., Кокина М.А., Семенова Н.Ю., Гагиев А.З., Каронова Т.Л., Гринева Е.Н. Костное ремоделирование при менопаузе в сочетании с сахарным диабетом у крыс Wistar. Ожирение и метаболизм. 2023;20(3):189-200. https://doi.org/10.14341/omet12961
For citation:
Timkina N.V., Simanenkova A.V., Bayramov A.A., Kokina M.A., Semenova N.Yu., Gagiev A.Z., Karonova T.L., Grineva E.N. Bone remodeling in experimental diabetes mellitus and surgical menopause in Wistar rats. Obesity and metabolism. 2023;20(3):189-200. (In Russ.) https://doi.org/10.14341/omet12961
ОБОСНОВАНИЕ
Остеопороз — хроническое метаболическое заболевание скелета, характеризующееся высокой частотой низкотравматичных переломов вследствие потери костной ткани и нарушения ее микроархитектоники. [1]. По данным ВОЗ, численность больных остеопорозом может достигать 500 млн человек по всему миру, что составляет 6,3% мужчин старше 50 лет и 21,2% женщин в том же возрастном диапазоне [2]. Постменопаузальный остеопороз занимает 80% в структуре причин остеопороза у женщин [3]. Снижение уровня эстрогенов в период менопаузы приводит к уменьшению абсорбции кальция в кишечнике и кальциурии, а также к повышению активности остеокластов [4]. Потеря костной массы за первые 5–7 лет постменопаузы может достигать 12% [5]. Трабекулярная кость особенно подвержена поражению при менопаузальном остеопорозе, что проявляется прогрессирующим истончением и разрежением костных трабекул. Изменения кортикального слоя характеризуются нарастанием его порозности и снижением толщины кости [6].
Согласно оценкам Международной федерации диабета, на 2021 г. 537 млн человек страдают сахарным диабетом (СД), 90% из которых имеют СД2 (СД2). Распространенность СД2 среди мужчин и женщин существенно не отличается и увеличивается с возрастом. Среди женщин в возрасте 50–54 лет около 16% страдают СД2, тогда как к 75 годам распространенность достигает 24% [7]. При СД2 существенно увеличивается риск переломов [8][9], несмотря на нормальную или повышенную минеральную плотность костной ткани (МПКТ) [10]. Причинами этого могут быть хроническая гипергликемия и оксидативный стресс, подавление активности как остеобластов, так и остеокластов, а также снижение инкретинового эффекта. В различных клинических исследованиях показано, что при СД2 риск переломов значимо не изменяется и не зависит от МПКТ, частоты падений и индекса массы тела [11][12], но увеличивается с длительностью СД2 [13].
Дополнительно сахароснижающие препараты могут оказывать разнонаправленное влияние на параметры костного ремоделирования. В частности, современные сахароснижающие препараты, агонисты рецепторов глюкагоноподобного пептида 1 типа, несмотря на снижение массы тела, могут положительно влиять на костный обмен [14][15]. Другая группа сахароснижающих препаратов, ингибиторы натрий-глюкозного ко-транспортера 2 типа, напротив, по результатам некоторых исследований, могут оказывать негативное воздействие на костное ремоделирование [16][17].
Таким образом, представляется актуальным изучение особенностей костного ремоделирования при сочетании СД2 и менопаузы без вмешательства каких-либо внешних факторов, в том числе сахароснижающей терапии. Экспериментальное исследование в данной области позволяет также оценить гистоморфометрические показатели костной ткани.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить параметры фосфорно-кальциевого обмена, маркеры костного ремоделирования и показатели гистоморфометрии костной ткани при сочетании экспериментальной менопаузы и СД2.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Исследование проводилось на базе Центра доклинических и трансляционных исследований Института экспериментальной медицины НМИЦ им. В.А. Алмазова.
Время исследования. Декабрь 2019 г. — сентябрь 2022 г.
Дизайн исследования
В качестве экспериментальной модели использовались самки крыс стока Wistar массой 250–300 г. Акклиматизационный период составлял 14 дней с ежедневным осмотром животных на предмет состояния кожи, слизистых, поведения, двигательной активности, а также с еженедельным взвешиванием. После акклиматизационного периода в клетке содержалось от 2 до 5 крыс, потребление корма и воды было неограниченным. Также поддерживался постоянный температурный (22–25°) и световой (свет с 8 до 20 ч) режимы и влажность воздуха (50–70%). Вес крыс измерялся 1 раз в 2 дня.
Изначально все животные получали стандартный корм (ЗАО «Тосненский комбикормовый завод»). Моделирование менопаузы проводилось путем двусторонней овариэктомии (ОЭ) под анестезией золетилом (тилетамина гидрохлорид 30 мг/кг и золазепама гидрохлорид 30 мг/кг) и ксилазина гидрохлоридом 6 мг/кг. После обработки операционного поля раствором бетадина производился надрез кожи в области поясницы, тупым путем разделялись мышцы, острым путем — париетальная брюшина. После проникновения в брюшную полость захватывались сальник, яичник с яйцеводом и рог матки. Рог матки вместе с окружающей его жировой тканью перевязывался и отрезался вместе с яичником и яйцеводом. Затем процедура повторялась с другой стороны.
Через 2 нед после ОЭ проводилось моделирование СД. В течение 4 нед и далее на протяжении всего эксперимента животные получали высокожировой корм («Про Корм», «БиоПро», г. Новосибирск с обменной энергией 2690 ккал/кг, жир 22%, протеин 20%). Через 4 нед от начала содержания на высокожировой диете внутрибрюшинно вводился раствор панкреатопротектора никотинамида в дозе 230 мг/кг (Nicotimamide, Sigma-Aldrich, St. Louis, MO, США) и через 15 мин — раствор панкреатотоксина стрептозотоцина в дозе 60 мг/кг (Streptozocin, Sigma-Aldrich, St. Louis, MO, США). Данная методика описана ранее и показала свою эффективность [18][19]. На 2-е и 3-и сутки после введения указанных препаратов определялся уровень глюкозы в случайной точке (не натощак, путем пункции хвостовой вены, при помощи прибора определения кетонемии и гликемии (StatStrip, Nova Biomedical, США)). СД диагностировался при гликемии, равной или более 11,1 ммоль/л, зафиксированной в двух измерениях в разные дни. При пограничных значениях гликемии (более или равной 6,1 ммоль/л и менее 11,1 ммоль/л) проводился пероральный глюкозотолерантный тест (ПГТТ). В ходе ПГТТ уровень глюкозы определялся исходно, после чего перорально вводился 40% раствор глюкозы в количестве 3 г/кг. Повторное измерение гликемии проводилось на 15, 30 и 60, 120-й минуте теста. СД диагностировался при гликемии, равной или больше 11,1 ммоль/л в любой из точек. При развитии абсолютной инсулиновой недостаточности или в случае, если СД не развивался, животные исключались из эксперимента. Повторное измерение гликемии производилось через 4 нед после процедур.
Получены следующие группы: «Контроль» (самки без каких-либо вмешательств, получавшие стандартный корм, n=5), «ОЭ» (самки после ОЭ, получавшие стандартный корм, n=5), «CД» (самки с СД, получавшие высокожировой корм, n=4), «ОЭ+CД» (самки после ОЭ с СД, получавшие высокожировой корм, n=4). У животных без СД гликемию измеряли на 4, 8, 10, 12, 14 и 16-й неделе исследования, в группах с СД2 — на 2-й и 3-й день после введения стрептозотоцина, далее — в конце 8, 10, 12, 14 и 16-й недели эксперимента. Измерение гликемии проводилось не натощак. Наблюдение за животными продолжалось еще 8 нед, суммарная длительность опыта — 16 нед.
Через 16 нед от начала эксперимента у животных под общей анестезией (методика описана выше) забирали кровь из каудальной вены. В сыворотке крови исследовались следующие показатели: кальций общий, фосфор неорганический, остеокальцин, остеопротегерин (ОПГ), лиганд активатора рецептора ядерного фактора каппа-В (RANKL) с вычислением соотношения ОПГ/RANKL, склеростин, фактор роста фибробластов-23 (ФРФ-23). После эвтаназии биоматериал бедренных костей исследовался гистологически.
Самки, которые не подвергались ОЭ, перед забором крови тестировались для установления длительности эстрального цикла, отбирались самки, которые имели устойчивый 4-дневный цикл. Далее для синхронизации цикла животным вводили 17β-эстрадиол 0,5 мг/кг, а через 48 ч — прогестерон 1,0 мг/кг. Искусственная синхронизация повторялась дважды, что соответствовало эструсу и диэструсу 4-дневного цикла [20].
Дизайн представлен на рис. 1.
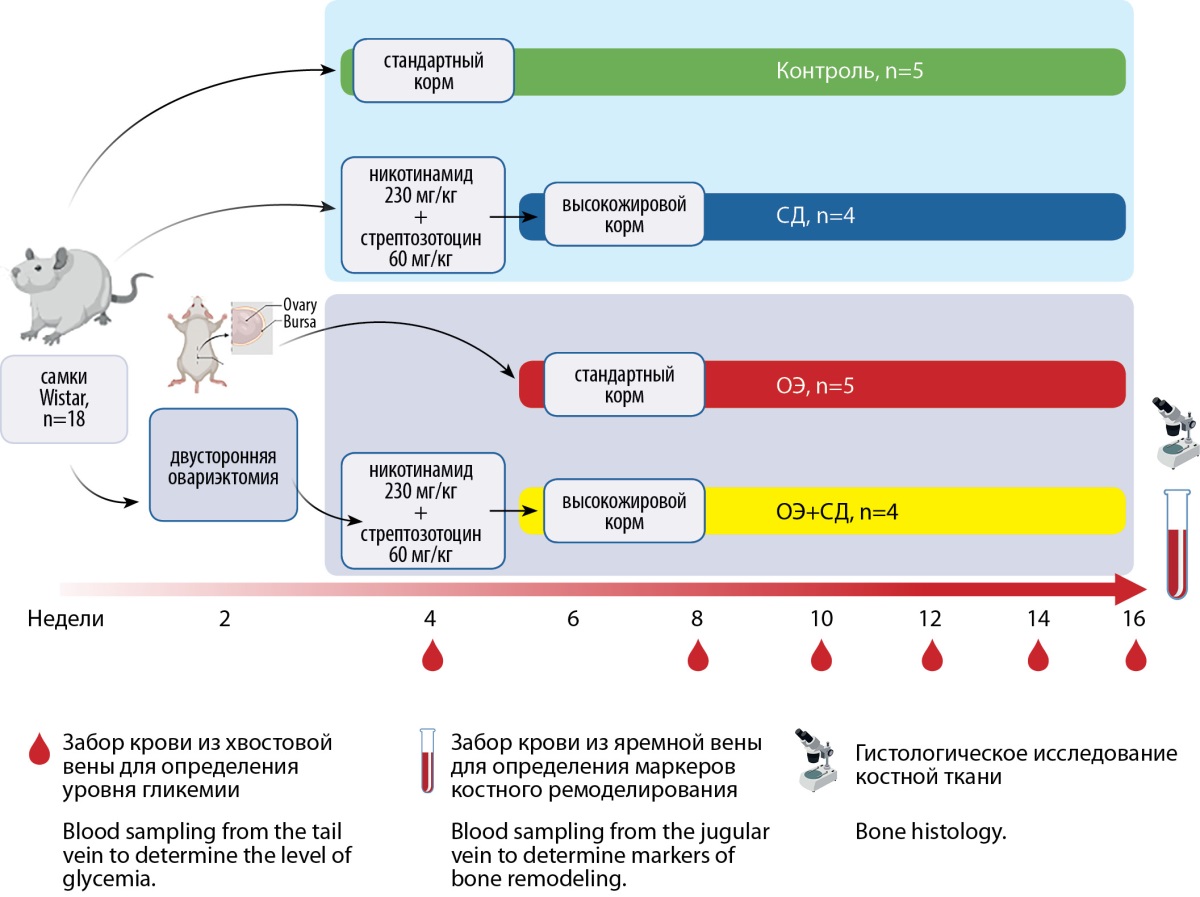
Рисунок 1. Дизайн экспериментального исследования.
Контроль — самки без вмешательств, получавшие стандартный корм;
СД — самки без ОЭ с СД;
ОЭ — самки после ОЭ;
ОЭ+СД — самки после ОЭ с СД.
Figure 1. Study designControl — rats without any intervention.
DM — diabetic rats;
OE — ovariectomized rats;
OE+DM — ovariectomized diabetic rats.
Основными исходами данного исследования являются изменения концентраций маркеров костного ремоделирования и параметров гистоархитектоники костной ткани.
МЕТОДЫ РЕГИСТРАЦИИ ИСХОДОВ
Определение гликемии
Концентрация глюкозы венозной крови измерялась путем пункции хвостовой вены при помощи прибора определения кетонемии и гликемии (StatStrip, Nova Biomedical, США).
Определение показателей фосфорно-кальциевого обмена и маркеров костного ремоделирования
Концентрации общего кальция и неорганического фосфора определялись в сыворотке крови на биохимических анализаторах серии AU (набор реагентов Beckman Coulter, США). Уровень остеокальцина (набор реагентов для количественного определения остеокальцина крысы, Immunodiagnostic Systems, Великобритания), ОПГ (набор реагентов для количественного определения ОПГ, Biomedica, Австрия), RANKL (ProcartaPlex Rat RANKL Simplex, Thermo Fisher Scientific, США), склеростина (Human Sclerostin ELISA, Biomedica, Австрия), ФРФ-23 (набор для количественного определения фактора роста ФРФ-23, Biomedica, Австрия) оценивались при помощи метода иммуноферментного анализа.
Гистологическое исследование биоматериала бедренной кости
Препараты бедренных костей были зафиксированы в течение 72 ч в 10% забуференном формалине (рН 7,4). Затем в декальцинирующем растворе с Трилоном Б в течение 14 дней проводилась декальцинация. Обезвоживание и пропитывание парафином проводились в автоматическом гистопроцессоре Exelsior (Thermo Fischer Scientific, США) в коммерческой среде IsoPREP (Biovitrum, Россия). Образцы заливались парафином HISTOMIX (Biovitrum, Россия), затем на ротационном микротоме НМ325 (Thermo Fisher Scientific, США) изготавливались срезы толщиной 3 мкм. Подготовленные срезы окрашивались гематоксилином-эозином (Biovitrum, Россия) и анализировались с использованием микроскопа Nicon Ni-E (Nicon, Япония) с программным обеспечением NIS-Elements для анализа изображений.
Оценивалась гистоархитектоника костной ткани: толщина костных трабекул в рх, площадь костных трабекул в зоне эпифиза и в зоне метаэпифиза, выраженная в процентах от общей площади полей зрения. Анализ проводился в 5 полях зрения при увеличении ×100. Было рассчитано среднее значение параметра для каждой выборки, а затем среднее значение параметра для группы.
Статистический анализ
Статистический анализ проводился с использованием программы IBM SPSS Statistics v.26 (разработчик — IBM Corporation). Количественные показатели не соответствовали нормальному распределению. Совокупности количественных показателей описывались при помощи значений медианы (Me), нижнего и верхнего квартилей (Q1–Q3). Для сравнения нескольких выборок количественных данных использовался критерий Краскела–Уоллиса с парным сравнением совокупностей при помощи апостериорного критерия Данна. Для исследования корреляции производился расчет коэффициента ранговой корреляции Спирмена.
Этическая экспертиза
Проведение исследования одобрено Комиссией по контролю содержания и использования лабораторных животных (IACUC) Национального медицинского исследовательского цента им. В.А. Алмазова. Протокол № 19-1П3#V1 от 14.01.2019.
РЕЗУЛЬТАТЫ
Показатели уровня гликемии и веса
В группах «СД» и «ОЭ+СД» после введения стрептозотоцина уровень гликемии не отличался и был значимо выше, чем в группах без СД. Гипергликемии в группах «Контроль» и «ОЭ» не отмечалось (рис. 2, А).
Вес животных в группах «СД» и «ОЭ+СД» был значимо выше по сравнению с группами «Контроль» и «ОЭ» на протяжении всего эксперимента, кроме краткого периода после введения стрептозотоцина (рис. 2, Б).Показатели фосфорно-кальциевого обмена
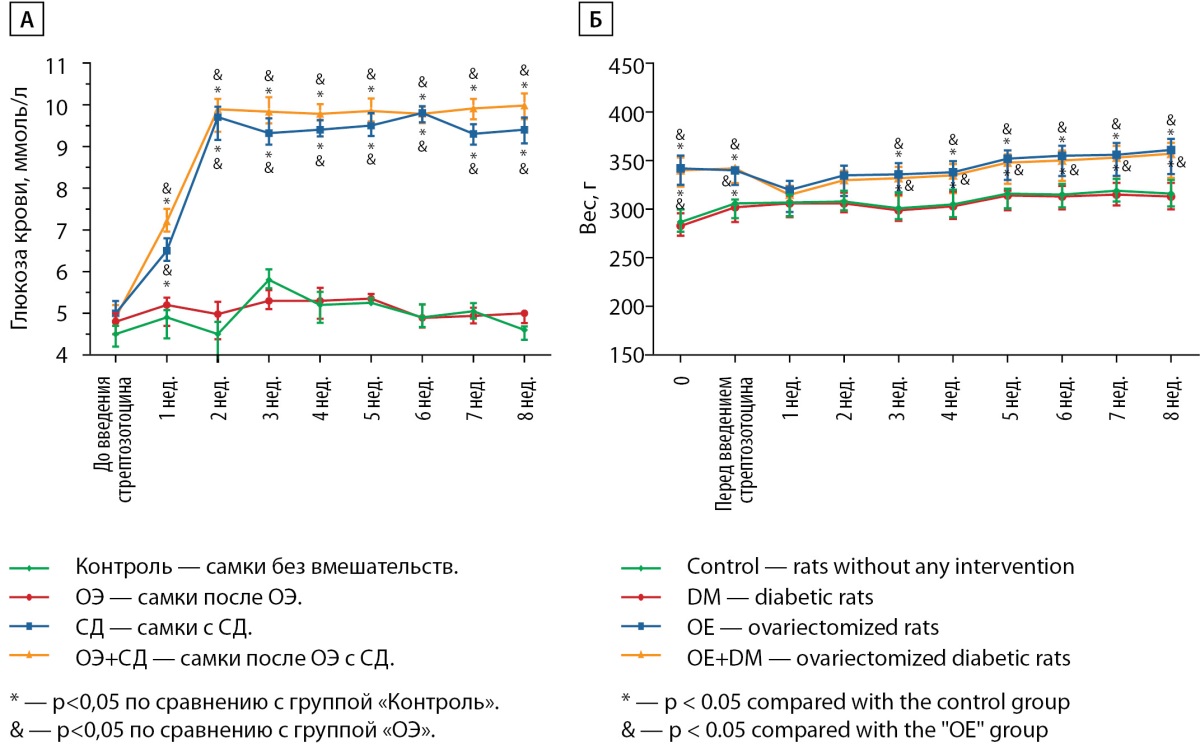
Рисунок 2. Показатели гликемии и веса самок Wistar
на протяжении эксперимента.
Figure 2. Glucose and weight during study.
Достоверных отличий в концентрации общего кальция между группами не было. Уровень фосфора был значимо ниже как в группе «ОЭ» (1,63 [ 1,58; 1,65] ммоль/л), так и в группе «СД» (2,81 [ 2,57; 2,83] ммоль/л) по сравнению с группой «Контроль» (3,12 [ 2,55; 3,24] ммоль/л), р<0,001 и р=0,014 соответственно. Однако данный показатель был значимо выше в группе «ОЭ+СД» (2,79 [ 2,46; 2,81] ммоль/л) по сравнению с группой «ОЭ» (2,79 [ 2,46; 2,81] ммоль/л), р=0,025. Корреляции между концентрацией фосфора и показателем гликемии (а также между уровнем кальция и уровнем глюкозы) найдено не было. Стоит отметить, что изменение уровня фосфора не сопровождалось изменением концентрации ФРФ-23 (рис. 3).
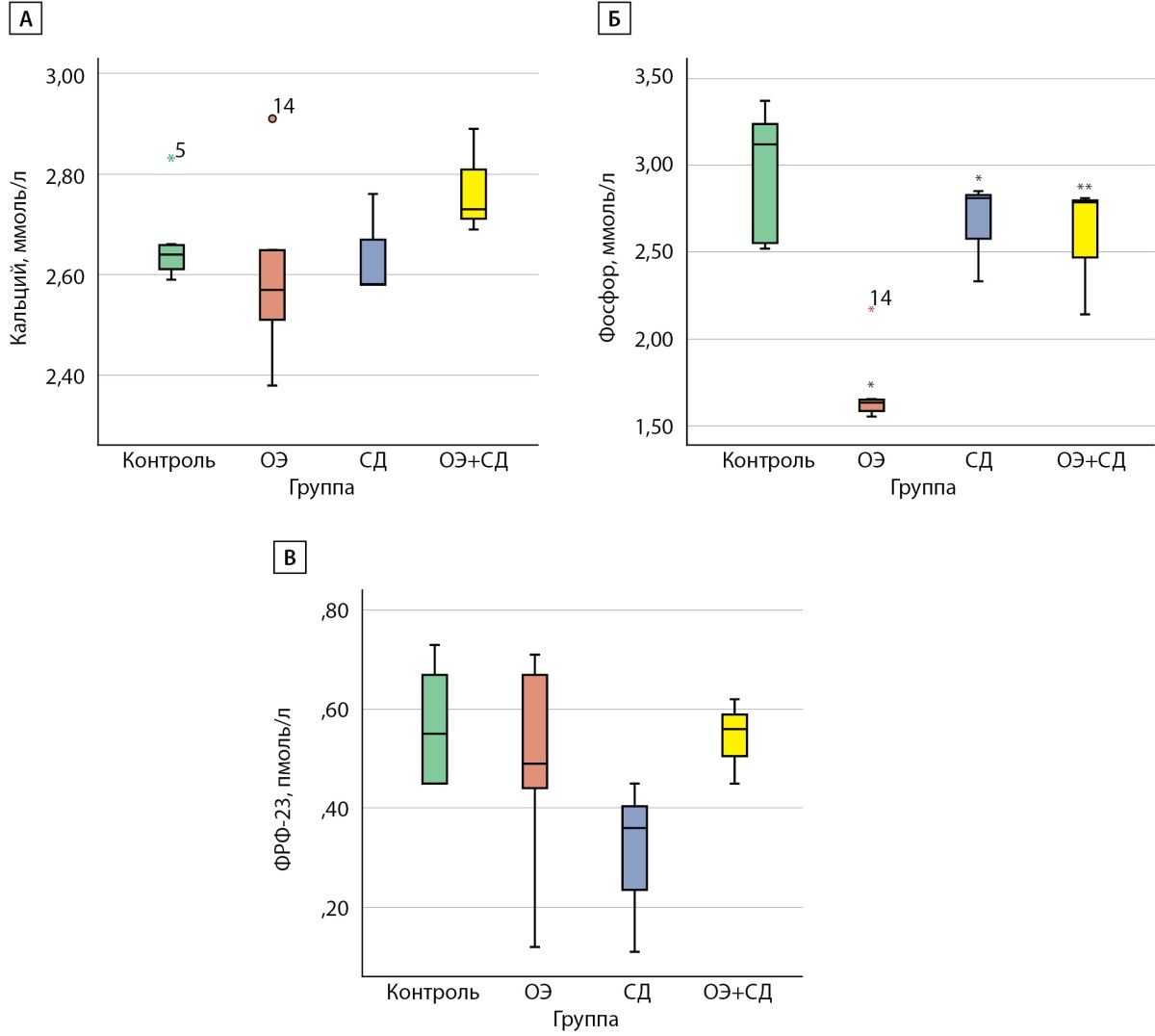
Рисунок 3. Показатели фосфорно-кальциевого обмена крыс Wistar
в конце эксперимента:
А) уровень кальция сыворотки, ммоль/л;
Б) уровень фосфора сыворотки, ммоль/л;
В) уровень ФРФ-23 сыворотки, пмоль/л.
Контроль — самки без вмешательств;
ОЭ — самки после ОЭ;
СД — самки с СД;
ОЭ+СД — самки после ОЭ с СД;
* — p<0,05 по сравнению с группой «Контроль»;
** — p<0,05 по сравнению с группой «ОЭ».
Figure 3. Phosphorus-calcium metabolism in Wistar rats
at the end of the experiment
A) Serum calcium level, mmol/l;
B) Serum phosphorus level, mmol/l;
C) Serum FGF-23 level, pmol/l.
Control — rats without any intervention;
DM — diabetic rats;
OE — ovariectomized rats;
OE+DM — ovariectomized diabetic rats;
* — p <0,05 compared with the control group;
** — p <0,05compared with the OE group.
Параметры костного ремоделирования
Уровень остеокальцина был достоверно ниже в группе «СД» (8,11 [ 7,84; 9,19] нг/мл) по сравнению с группой «Контроль» (16,97 [ 14,07; 17,07] нг/мл), р=0,005). Найдена слабая отрицательная корреляция (-0,536) между уровнем глюкозы и уровнем остеокальцина (р=0,03). Статистически значимых отличий в уровне склеростина между группами установлено не было (рис. 4).
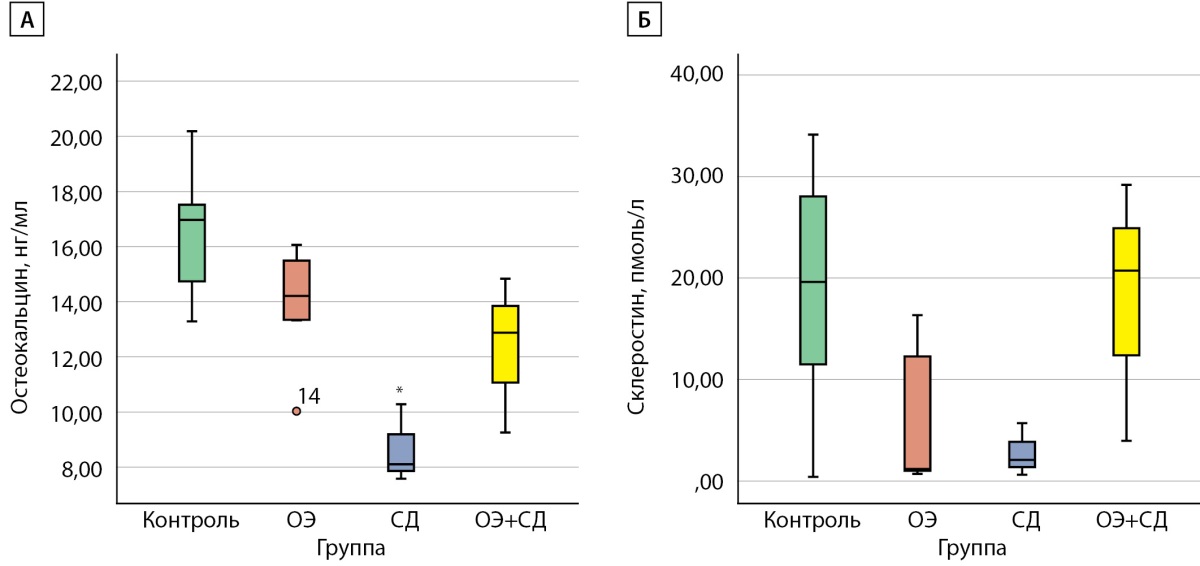
Рисунок 4. Концентрации остеокальцина и склеростина
в сыворотке крови крыс Wistar в конце эксперимента:
А) концентрация остеокальцина, нг/мл;
Б) концентрация склеростина, пмоль/л.
Контроль — самки без вмешательств;
ОЭ — самки после ОЭ;
СД — самки с СД;
ОЭ+СД — самки после ОЭ с СД;
* p<0,05 по сравнению с группой «Контроль».
Figure 4. Serum levels of osteocalcin and sclerostin in Wistar rats
at the end of the experiment:
A) Concentration of osteocalcin, ng/ml;
B) Sclerostin concentration, pmol/l.
Control — rats without any intervention;
DM — diabetic rats;
OE — ovariectomized rats;
OE+DM — ovariectomized diabetic rats;
* — p <0,05 compared with the control group.
Уровень RANKL был значимо ниже в группе «ОЭ+СД» (278,1 [ 273,1; 289,7] пг/мл) по сравнению с группой «ОЭ» (400,6 [ 394,5; 415,1] пг/мл), а соотношение ОПГ/RANKL — выше (0,03 [ 0,02; 0,035] и 0,01 [ 0,004; 0,014] соответственно), р=0,05. В группе «ОЭ» получен более низкий уровень ОПГ (5,1 [ 1,5; 5,6] пмоль/л) и соотношения ОПГ/RANKL (0,01 [ 0,003; 0,014]), чем в группе «Контроль» (12,3 [ 8,8; 14,2] пмоль/л и 0,34 [ 0,33; 0,41]), р=0,025 и р=0,07 соответственно (рис. 5). Корреляции данных показателей с уровнем гликемии не найдено.
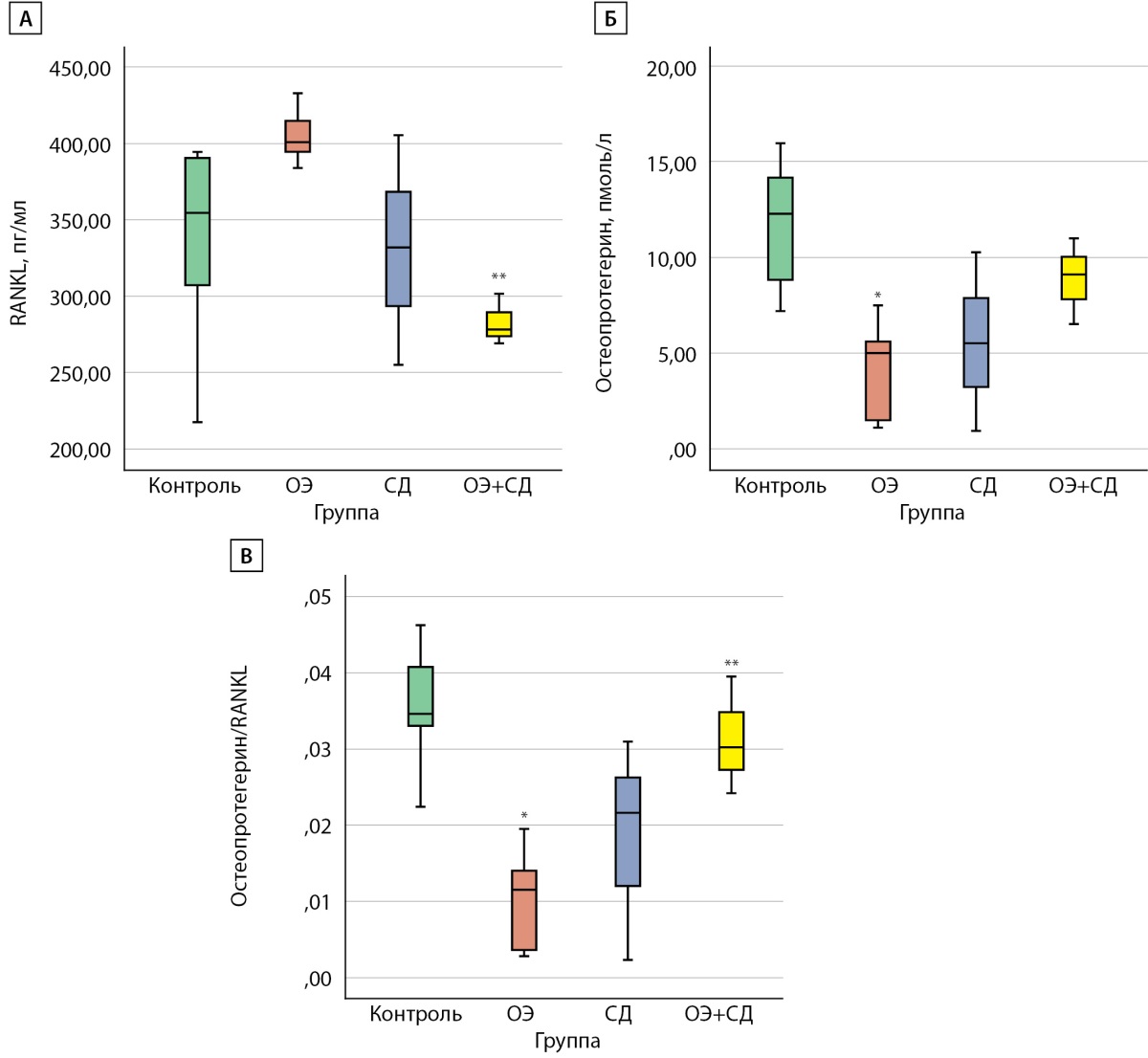
Рисунок 5. Показатели RANKL, остеопротегерина в сыворотке крыс Wistar
и соотношение остеопротегерин/RANKL в конце эксперимента.
А) RANKL, пг/мл;
Б) остеопротегерин, пмоль/л;
В) соотношение остеопротегерин/RANKL.
Контроль — самки без вмешательств;
ОЭ — самки после ОЭ;
СД — самки с СД;
ОЭ+СД — самки после ОЭ с СД;
* — p<0,05 по сравнению с группой «Контроль»;
** — p<0,05 по сравнению с группой «ОЭ».
Figure 5. Serum RANKL, osteoprotegerin in Wistar rats,
and osteoprotegerin/RANKL ratio at the end of the experiment.
A) RANKL, pg/ml,
B) Osteoprotegerin, pmol/l
C) osteoprotegerin/RANKL ratio.
Control — rats without any intervention;
DM — diabetic rats;
OE — ovariectomized rats;
OE+DM — ovariectomized diabetic rats;
* — p <0,05 compared with the control group;
** — p <0,05compared with the OE group.
Гистологическое исследование костной ткани
В группе «Контроль» в зоне эпифиза бедренной кости трабекулярное строение сохранено, костные балки формируют крупно-петлистую сеть, заполняющую пространство всей эпифизарной зоны. Площадь костных балок равна 42%. Метаэпифизарная пластинка выражена, представлена зрелыми и растущими костными балками, преимущественно с ровными краями, выражены линии цементации. Площадь костных балок в зоне метаэпифиза 49%. Средняя толщина костных балок 100,4 рх. Пространство между балками заполнено клеточным костным мозгом и адипоцитами в равном соотношении.
В группе «ОЭ» в зоне эпифиза бедренной кости трабекулярное строение сохранено, костные балки формируют крупно-петлистую сеть, заполняющую пространство всей эпифизарной зоны. Площадь костных балок по данным морфометрического исследования равна 29,3%. Метаэпифизарная пластинка выражена, представлена зрелыми и растущими костными балками, преимущественно с ровными краями. Площадь костных балок в зоне метаэпифиза 35,2%. Средняя толщина костных балок 99,3 рх. Пространство между балками заполнено клеточным костным мозгом и адипоцитами в равном соотношении.
В группе «СД» в зоне эпифиза бедренной кости трабекулярное строение сохранено, костные балки формируют крупно-петлистую сеть, заполняющую пространство всей эпифизарной зоны. Площадь костных балок равна 37,9%. Метаэпифизарная пластинка выражена, преобладают зрелые костные балки. Площадь костных балок в зоне метаэпифиза 31,1%. Средняя толщина костных балок 89,6 рх. Пространство между балками заполнено клеточным костным мозгом и адипоцитами в равном соотношении.
В группе «ОЭ+СД» в зоне эпифиза бедренной кости трабекулярное строение сохранено, костные балки формируют крупно-петлистую сеть. Площадь костных балок равна 30,4%. Метаэпифизарная пластинка выражена, представлена зрелыми костными балками, встречаются балки с неровными краями и трещинами в костном матриксе, растущие балки практически не встречаются. Площадь костных балок в зоне метаэпифиза 35,4%. Средняя толщина костных балок 80,3 рх. Пространство между балками заполнено клеточным костным мозгом и адипоцитами в равном соотношении.
Площадь костных балок в зоне эпифиза была наибольшей в группе «Контроль» (42% [ 39; 45]), различия достоверны по сравнению с группой «ОЭ» (29 % [ 25; 33], p=0,011) и группой «ОЭ+СД» (30 % [ 23; 25], p=0,016). Площадь костных балок в зоне метаэпифиза также была наибольшей в группе «Контроль» (49% [ 46; 52]) по сравнению с группами «ОЭ» (35% [ 25; 39]), «СД» (31% [ 26; 34]), «ОЭ+СД» (35% [ 33; 38]), p<0,001. Различий в толщине костных балок между группами выявлено не было (рис. 6, 7).
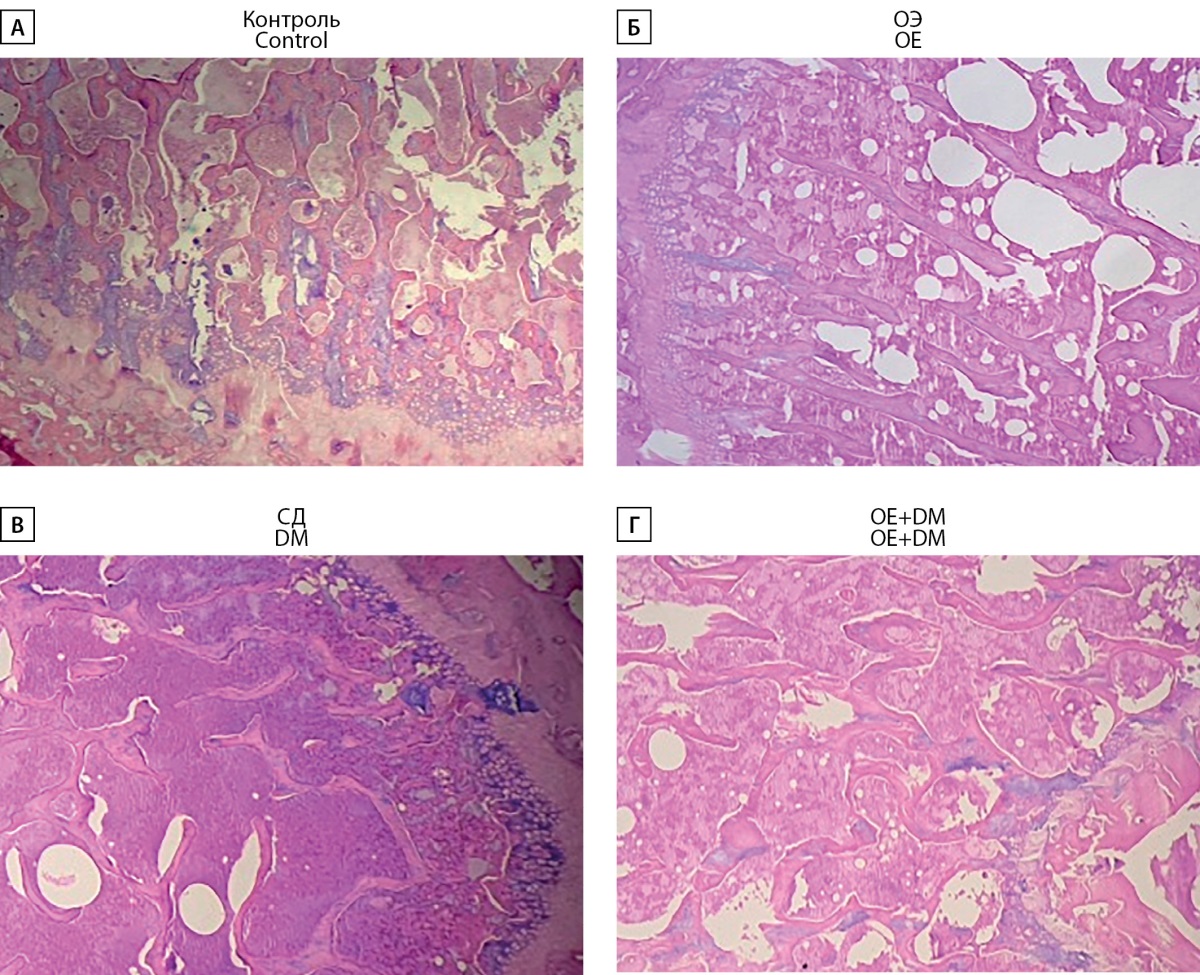
Рисунок 6. Эпифизарная область бедренной кости
с костными балками крыс Wistar в группе «Контроль» (А),
после овариэктомии (Б), с СД (В), после овариэктомии с СД (Г).
Окраска гематоксилином-эозином, ув. ×100.
Figure 6. Epiphyseal region of the femur with bone beams
in Wistar rats in the Control group (A), after ovariectomy (B),
with DM (C), after ovariectomy with DM (D).
Stained with hematoxylin-eosin, uv. ×100.
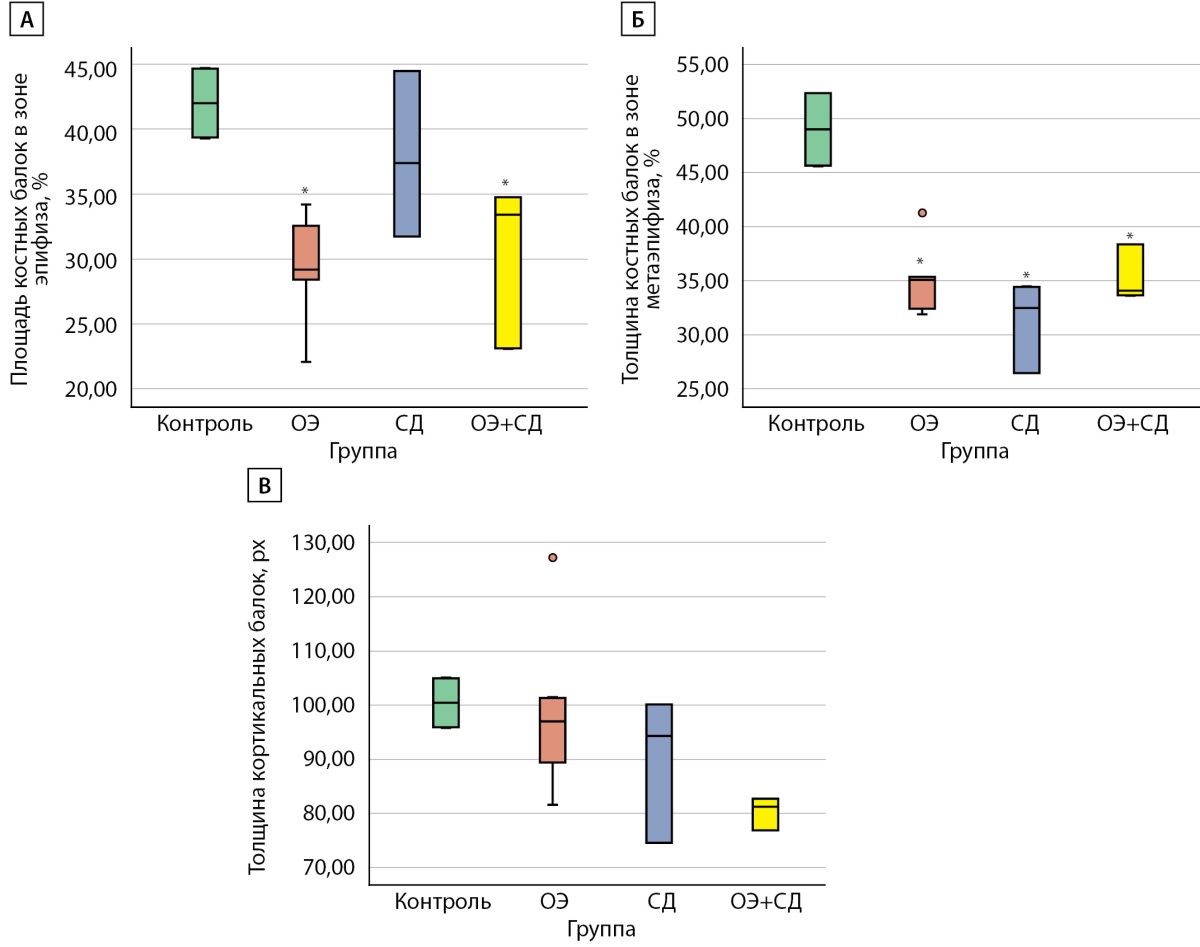
Рисунок 7. Параметры гистоморфометрии костной ткани крыс Wistar.
А) площадь костных балок в зоне эпифиза, %;
Б) площадь костных балок в зоне метаэпифиза;
В) толщина кортикальных балок, px.
ОЭ — самки после ОЭ;
СД — самки с СД;
ОЭ+СД — самки после ОЭ с СД;
* — p<0,05 по сравнению с группой «Контроль».
Figure 7. Histomorphometry parameters of the bone tissue of Wistar rats.
A) Area of bone trabeculae in the epiphyseal area, %
B) Area of osseous trabeculae in the metaepiphyseal area
C) Thickness of cortical trabeculae, px.
Control — rats without any intervention;
DM — diabetic rats;
OE — ovariectomized rats;
OE+DM — ovariectomized diabetic rats;
* — p <0,05 compared with the control group.
ОБСУЖДЕНИЕ
По литературным данным, костный обмен во время экспериментальной менопаузы характеризуется нарастанием маркеров как костеобразования, так и костной резорбции. Влияние менопаузы на костный обмен было описано в ряде работ. Так, через 8 нед после ОЭ у самок крыс было отмечено нарастание уровней остеокальцина и С-концевого телопептида коллагена I типа (что может свидетельствовать об увеличении скорости костного обмена), а также снижение МПКТ и трабекулярного объема костной ткани [21]. Однако изменения в разных отделах скелета, вероятно, не происходят одновременно. В исследовании N. Sims и соавт. после ОЭ у крыс сначала отмечалось повышение экскреции деоксипиридолина (маркера костной резорбции) с мочой, а затем нарастание уровней остеокальцина и щелочной фосфатазы. По данным гистоморфометрии было зафиксировано увеличение количества остеокластов бедра, а трабекулярный костный объем бедренной кости был значимо ниже на 15-й день после операции. В поясничном отделе позвоночника трабекулярный объем не менялся и на 18-й день после операции. Вероятно, после экспериментальной индукции менопаузы активация костной резорбции происходит раньше усиления костного ремоделирования, однако изменения в разных отделах скелета разделены во времени [22].
В нашем исследовании при сравнении животных после ОЭ с группой контроля значимых различий в концентрации кальция получено не было. Уровень фосфора был достоверно ниже в группе «ОЭ» по сравнению с уровнем «Контроль», однако это не сочеталось с изменениями ФРФ-23. Уровни остеокальцина и склеростина также не отличались у крыс с ОЭ по сравнению с животными контрольной группы. Противоречиво, но у крыс после ОЭ не зафиксировано значимого повышения уровня RANKL по сравнению с крысами без вмешательств. Однако уровень ОПГ и соотношение ОПГ/RANKL были ниже у крыс группы «ОЭ» по сравнению с группой «Контроль». Данные изменения подтверждают активацию костной резорбции после хирургической менопаузы.
При сочетании менопаузы и СД скорость костного обмена имеет свои особенности. Нами найдено несколько экспериментальных моделей, воспроизводящих сочетание менопаузы и СД. Так, в экспериментальном исследовании R. Aeimlapa и соавт. параметры костного ремоделирования изучались на модели крыс Goto-Kakizaki. В качестве группы сравнения выступали крысы Wistar. Половине животных из каждой группы выполнена ОЭ. У крыс с СД, несмотря на моделирование менопаузы, отмечено замедление костного ремоделирования, что сопровождалось снижением ПТГ, 1,25(OH)2D, а также инсулиноподобного фактора роста 1 и интерлейкина-1β. В то же время у крыс Wistar без СД ОЭ приводила к более высокому метаболизму костной ткани (увеличение количества как остеобластов, так и остеокластов бедра) [23].
В эксперименте S. Kimura и соавт. также находит подтверждение тезис об угнетении костного ремоделирования у крыс с СД после индукции менопаузы. Авторы использовали крыс линии Torii-Lepr, у которых в раннем возрасте спонтанно развивается дислипидемия, ожирение и СД2, в качестве группы сравнения выступали крысы линии Sprague-Dawley. Половине крыс из обеих групп была проведена ОЭ. Авторами установлено, что уровень остеокальцина и деоксипиридолина мочи были ниже у крыс Torii-Lepr по сравнению с группой контроля, а ОЭ значимо снизила МПКТ только у крыс без СД [24]. В то же время противоречивые данные получены в исследовании S. Herrero и соавт.: при стрептозотоцин-индуцированном СД2 у крыс Wistar МПКТ снижалась независимо от индукции менопаузы. Данный вывод несколько не согласуется со сведениями о нормальной или повышенной МПКТ при СД2. Дополнительно в ходе исследования было показано, что уровень остеокальцина был значительно выше в группе крыс после ОЭ, а наличие СД2 нивелировало этот эффект. Уровень пиридолина в моче также был существенно выше в группе крыс с моделированной менопаузой, в том числе и среди крыс с СД [25].
В нашем исследовании тип СД может быть вариантом СД2, так как предварительно животные находились на высокожировом корме, а перед введением стрептозотоцина вводился никотинамид (панкреатопротектор); таким образом, абсолютной инсулиновой недостаточности не развивалось. Животные с СД2 и ОЭ не показали значимых отличий в концентрациях кальция, фосфора, ФРФ-23, остеокальцина, склеростина, ОПГ по сравнению с животными группы «ОЭ». Однако установлено, что у животных при сочетании ОЭ и СД уровень RANKL более низкий и, соответственно, значение ОПГ/RANKL более высокое, что говорит о снижении скорости костного обмена при СД в условиях менопаузы.
При сравнении животных с СД (без ОЭ) с группой контроля выявлено значимое снижение остеокальцина, что подтверждает замедление костного ремоделирования при СД. При сочетании ОЭ и СД данный эффект не проявился.
Что касается параметров гистоморфометрии в целом, у животных и с менопаузой, и с СД2, и при их сочетании отмечалось снижение площади костных балок без изменения их толщины. Однако повреждение костной ткани в данных группах носит разный характер: при индукции менопаузы площади костных балок как эпифиза, так и метаэпифиза были ниже без значимых различий в толщине костных балок, а при индукции СД была снижена только площадь костных балок.
Ограничения проведенного нами исследования в первую очередь могут быть связаны с небольшим объемом выборки, что зачастую приводило к отсутствию статистической достоверности различий.
ЗАКЛЮЧЕНИЕ
Наличие СД может значимо угнетать костное ремоделирование у животных в менопаузе, что выражается в более низком уровне остеокальцина. Костный обмен при сочетании СД и менопаузы характеризуется более низким уровнем RANKL и более высоким соотношением ОПГ/RANKL. Влияние ОЭ на костный обмен ассоциировано с большим уменьшением площади костных балок, чем при изолированном СД.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено в рамках государственного задания № 122041900088-1 «Персонифицированный подход в выборе сахароснижающей терапии у больных СД2, основанный на нейропротективных и остеопротективных свойствах препаратов».
Подана заявка на оформление патента «Способ экспериментального моделирования сахарного диабета 2 типа в сочетании с менопаузой у самок крыс стока Wistar», регистрационный № 2022133307.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Тимкина Н.В. — проведение эксперимента (осмотр, взвешивание животных, измерение гликемии, индукция экспериментального сахарного диабета, лечение), статистическая обработка данных, графическое представление данных, написание рукописи; Симаненкова А.В. — проведение эксперимента (осмотр, взвешивание животных, измерение гликемии, индукция экспериментального сахарного диабета, лечение), внесение в рукопись существенной правки с целью повышения научной ценности статьи; Байрамов А.А. —планирование эксперимента, проведение эксперимента (двусторонняя овариэктомия); Кокина М.А. — планирование эксперимента, проведение эксперимента (выполнение иммуноферментного анализа); Семенова Н.Ю. — гистологическое исследование костной ткани: подготовка образцов к исследованию, верификация гистологических изменений, внесение в рукопись существенной правки с целью повышения научной ценности статьи; Гагиев А.З. — проведение эксперимента (осмотр, взвешивание животных, измерение гликемии, индукция экспериментального сахарного диабета, лечение), написание рукописи; Каронова Т.Л. — планирование эксперимента, внесение в рукопись существенной правки с целью повышения научной ценности статьи; Гринева Е.Н. — планирование эксперимента, внесение в рукопись существенной правки с целью повышения научной ценности статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Kanis JA. Assessment of osteoporosis at the primary health-care level. World Health Organization Collaborating Centre for Metabolic Bone Diseases, University of Sheffield, UK. 2007. Technical Report. World Health Organization Scientific Group.
2. Kanis JA, Norton N, Harvey NC, et al. SCOPE 2021: a new scorecard for osteoporosis in Europe. Arch Osteoporos. 2021;16(1):82. doi: https://doi.org/10.1007/s11657-020-00871-9
3. Pigarova EA, Rozhinskaya LY, Belaya ZE, et al. Russian Association of Endocrinologists recommendations for diagnosis, treatment and prevention of Vitamin D deficiency in adults. Problems of Endocrinology. 2016;62(4):60-84. doi: https://doi.org/10.14341/probl201662460-84
4. Armas LA, Recker RR. Pathophysiology of osteoporosis: new mechanistic insights. Endocrinol Metab Clin North Am. 2012;41(3):475-486. doi: https://doi.org/10.1016/j.ecl.2012.04.006
5. Recker R, Lappe J, Davies K, Heaney R. Characterization of perimenopausal bone loss: a prospective study. J Bone Miner Res. 2000;15(10):1965-1973. doi: https://doi.org/10.1359/jbmr.2000.15.10.1965
6. Akhter MP, Lappe JM, Davies KM, Recker RR. Transmenopausal changes in the trabecular bone structure. Bone. 2007;41(1):111-116. doi: https://doi.org/10.1016/j.bone.2007.03.019
7. International Diabetes Federation [Internet]. IDF Diabetes Atlas, 10th edn. Brussels, Belgium: 2021. Available at: https://www.diabetesatlas.org
8. Napoli N, Strotmeyer ES, Ensrud KE, et al. Fracture risk in diabetic elderly men: the MrOS study. Diabetologia. 2014;57(10):2057-2065. doi: https://doi.org/10.1007/s00125-014-3289-6
9. Wallander M, Axelsson KF, Nilsson AG, et al. Type 2 diabetes and risk of hip fractures and non-skeletal fall injuries in the elderly: a study from the Fractures and Fall Injuries in the Elderly Cohort (FRAILCO). J Bone Miner Res. 2017;32(3):449-460. doi: https://doi.org/10.1002/jbmr.3002
10. Schwartz AV, Vittinghoff E, Bauer DC, et al. Association of BMD and FRAX score with risk of fracture in older adults with type 2 diabetes. JAMA. 2011;305(21):2184-2192. doi: https://doi.org/10.1001/jama.2011.715
11. Bonds DE, Larson JC, Schwartz AV, et al. Risk of fracture in women with type 2 diabetes: the Women’s Health Initiative Observational Study. J Clin Endocrinol Metab. 2006;91(9):3404-3410. doi: https://doi.org/10.1210/jc.2006-0614
12. Schwartz AV, Sellmeyer DE, Ensrud KE, et al. Older women with diabetes have an increased risk of fracture: a prospective study. J Clin Endocrinol Metab. 2001;86(1):32-38. doi: https://doi.org/10.1210/jcem.86.1.7139
13. Majumdar SR, Leslie WD, Lix LM, et al. Longer duration of diabetes strongly impacts fracture risk assessment: The manitoba BMD cohort. J Clin Endocrinol Metab. 2016;101(11):4489-4496. doi: https://doi.org/10.1210/jc.2016-2569
14. Sanz C, Vázquez P, Blázquez C, et al. Signaling and biological effects of glucagon-like peptide 1 on the differentiation of mesenchymal stem cells from human bone marrow. Am J Physiol Endocrinol Metab. 2010;298(3):E634-E643. doi: https://doi.org/10.1152/ajpendo.00460.2009
15. Lu N, Sun H, Yu J, et al. Glucagon-like peptide-1 receptor agonist Liraglutide has anabolic bone effects in ovariectomized rats without diabetes. PLoS One. 2015;10(7):e0132744. doi: https://doi.org/10.1371/journal.pone.0132744
16. Kohan DE, Fioretto P, Tang W, List JF. Long-term study of patients with type 2 diabetes and moderate renal impairment shows that dapagliflozin reduces weight and blood pressure but does not improve glycemic control. Kidney Int. 2014;85(4):962-971. doi: https://doi.org/10.1038/ki.2013.356
17. Watts NB, Bilezikian JP, Usiskin K, et al. Effects of canagliflozin on fracture risk in patients with type 2 diabetes mellitus. J Clin Endocrinol Metab. 2016;101(1):157-166. doi: https://doi.org/10.1210/jc.2015-3167
18. Bayrasheva VK, Babenko AY, Dobronravov VA, et al. Uninephrectomized high-fat-fed nicotinamide-streptozotocin-induced diabetic rats: A model for the investigation of diabetic nephropathy in type 2 diabetes. J Diabetes Res. 2016;2016(1):1-18. doi: https://doi.org/10.1155/2016/8317850
19. Simanenkova A, Minasian S, Karonova T, et al. Comparative evaluation of metformin and liraglutide cardioprotective effect in rats with impaired glucose tolerance. Sci Rep. 2021;11(1):6700. doi: https://doi.org/10.1038/s41598-021-86132-2
20. Маградзе Р.Н., Лисовский А.Д., Зеленер А.О., и др. Оценка терапевтического потенциала гонадотропина и кисспептина при экспериментальном ишемическом повреждении яичника // Вестник Смоленской государственной медицинской академии. — 2022. — Т. 21. — №2. — С. 5-13. doi: https://doi.org/10.37903/vsgma.2022.2.1
21. Yoon KH, Cho DC, Yu SH, et al. The change of bone metabolism in ovariectomized rats : analyses of microct scan and biochemical markers of bone turnover. J Korean Neurosurg Soc. 2012;51(6):323-327. doi: https://doi.org/10.3340/jkns.2012.51.6.323
22. Sims NA, Morris HA, Moore RJ, Durbridge TC. Increased bone resorption precedes increased bone formation in the ovariectomized rat. Calcif Tissue Int. 1996;59(2):121-127. doi: https://doi.org/10.1007/s002239900098
23. Aeimlapa R, Wongdee K, Tiyasatkulkovit W, et al. Anomalous bone changes in ovariectomized type 2 diabetic rats: inappropriately low bone turnover with bone loss in an estrogen-deficient condition. Am J Physiol Endocrinol Metab. 2019;317(4):E646-E657. doi: https://doi.org/10.1152/ajpendo.00093.2019
24. Kimura S, Sasase T, Ohta T, Matsushita M. Effects of ovariectomy on bone metabolism and bone mineral density in spontaneously diabetic Torii-Lepr(fa) rats. J Vet Med Sci. 2011;73(8):1025-1029. doi: https://doi.org/10.1292/jvms.11-0064
25. Herrero S, Calvo OM, García-Moreno C, et al. Low bone density with normal bone turnover in ovariectomized and streptozotocin-induced diabetic rats. Calcif Tissue Int. 1998;62(3):260-265. doi: https://doi.org/10.1007/s002239900427
Об авторах
Н. В. ТимкинаРоссия
Тимкина Наталья Владимировна
Researcher ID: ABG-3536-2021
Scopus Author ID: 57222553770
eLibrary SPIN: 6259-7745
197341, Санкт-Петербург, улица Аккуратова, д. 2
А. В. Симаненкова
Россия
Симаненкова Анна Владимировна, к.м.н.
eLibrary SPIN 3675-9216
Санкт-Петербург
А. А. Байрамов
Россия
Байрамов Алекбер Азизага оглы, д.м.н.
eLibrary SPIN: 9802-9988
Санкт-Петербург
М. А. Кокина
Россия
Кокина Мария Александровна
eLibrary SPIN: 3522-6052
Санкт-Петербург
Н. Ю. Семенова
Россия
Семенова Наталья Юрьевна, к.б.н.
eLibrary SPIN: 3566-4723
Санкт-Петербург
А. З. Гагиев
Россия
Гагиев Александр Зурабович
eLibrary SPIN: 3054-6383
Санкт-Петербург
Т. Л. Каронова
Россия
Каронова Татьяна Леонидовна, д.м.н., профессор
eLibrary SPIN: 3337-4071
Санкт-Петербург
Е. Н. Гринева
Россия
Гринева Елена Николаевна, д.м.н., профессор
eLibrary SPIN: 2703-0841
Санкт-Петербург
Дополнительные файлы
|
|
1. Рисунок 1. Дизайн экспериментального исследования. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(398KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Показатели гликемии и веса самок Wistar на протяжении эксперимента. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(363KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Показатели фосфорно-кальциевого обмена крыс Wistar в конце эксперимента: А) уровень кальция сыворотки, ммоль/л; Б) уровень фосфора сыворотки, ммоль/л; В) уровень ФРФ-23 сыворотки, пмоль/л. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(247KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Концентрации остеокальцина и склеростина в сыворотке крови крыс Wistar в конце эксперимента: А) концентрация остеокальцина, нг/мл; Б) концентрация склеростина, пмоль/л. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(164KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Показатели RANKL, остеопротегерина в сыворотке крыс Wistar и соотношение остеопротегерин/RANKL в конце эксперимента. А) RANKL, пг/мл; Б) остеопротегерин, пмоль/л; В) соотношение остеопротегерин/RANKL. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(268KB)
|
Метаданные ▾ | |
|
|
6. Рисунок 6. Эпифизарная область бедренной кости с костными балками крыс Wistar в группе «Контроль» (А), после овариэктомии (Б), с СД (В), после овариэктомии с СД (Г). Окраска гематоксилином-эозином, ув. ×100. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(774KB)
|
Метаданные ▾ | |
|
|
7. Рисунок 7. Параметры гистоморфометрии костной ткани крыс Wistar. А) площадь костных балок в зоне эпифиза, %; Б) площадь костных балок в зоне метаэпифиза; В) толщина кортикальных балок, px. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(277KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Тимкина Н.В., Симаненкова А.В., Байрамов А.А., Кокина М.А., Семенова Н.Ю., Гагиев А.З., Каронова Т.Л., Гринева Е.Н. Костное ремоделирование при менопаузе в сочетании с сахарным диабетом у крыс Wistar. Ожирение и метаболизм. 2023;20(3):189-200. https://doi.org/10.14341/omet12961
For citation:
Timkina N.V., Simanenkova A.V., Bayramov A.A., Kokina M.A., Semenova N.Yu., Gagiev A.Z., Karonova T.L., Grineva E.N. Bone remodeling in experimental diabetes mellitus and surgical menopause in Wistar rats. Obesity and metabolism. 2023;20(3):189-200. (In Russ.) https://doi.org/10.14341/omet12961

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































