Перейти к:
Роль гипоталамических нейропептидов в развитии гипонатриемии у пациентов после трансназальной аденомэктомии
https://doi.org/10.14341/omet13209
Аннотация
Обоснование. На сегодняшний день причины и предрасполагающие факторы для развития водно-электролитных нарушений после транссфеноидальной операции по поводу образований гипоталамо-гипофизарной области изучены недостаточно. Открытые в последние десятилетия нейропептиды, такие как апелин, копептин и мозговой натрийуретический пептид, во многих исследованиях демонстрируют свое значимое влияние на регуляцию водно-электролитного обмена и делают их потенциальными гормональными маркерами тяжелых послеоперационных электролитных осложнений.
Цель. Изучить особенности секреции гипоталамических нейропептидов при нормальном водно-солевом обмене периоперационно и при наличии нарушений водно-электролитного обмена.
Материалы и методы. В исследование было включено 122 пациента старше 18 лет, которым планировалось проведение трансназальной аденомэктомии по поводу основного заболевания. Набор пациентов проводился с марта 2021 по март 2022 гг. Всем пациентам исходно и далее в послеоперационном периоде трансназальной аденомэктомии проводился контроль наличия или отсутствия водно-электролитных нарушений с помощью определения натрия крови, а также определение уровней апелина-12, копептина, мозгового натрийуретического пептида и окситоцина в первые 12–24 часа, далее на 2–3, 4–5 и 6–7 сутки после операции. Пациенты заполняли дневник самочувствия и водного баланса.
Результаты. Установлено, что такое водно-электролитное осложнение, как гипонатриемия, отягощает послеоперационный период трансназальной аденомэктомии до 15% случаев. Проведенное нами исследование не выявило значимых изменений уровня апелина и мозгового натрийуретического пептида или их корреляции с уровнем натрия у пациентов в обеих группах, а также связи между нейропептидами. Наиболее интересные эффекты влияния на водно-электролитный обмен демонстрируют нейропептиды окситоцин и копептин, секреция которых носит характер неадекватно повышенных уровней с потерей обратной отрицательной связи с концентрацией натрия крови.
Заключение. Наше исследование выявило высокую частоту гипонатриемии после трансназальной аденомэктомии — порядка 15% случаев, в генезе которой, по-видимому, значимую роль играют гипоталамические нейропептиды копептин и окситоцин. При этом окситоцин имеет потенциал быть гормональным маркером этого тяжелого осложнения.
ения.
Ключевые слова
Для цитирования:
Фаргиева Х.Р., Пигарова Е.А., Дзеранова Л.К., Пржиялковская Е.Г., Платонова Н.М., Трошина Е.А., Григорьев А.Ю. Роль гипоталамических нейропептидов в развитии гипонатриемии у пациентов после трансназальной аденомэктомии. Ожирение и метаболизм. 2025;22(2):60-69. https://doi.org/10.14341/omet13209
For citation:
Fargieva Kh.R., Pigarova E.A., Dzeranova L.K., Przhiyalkovskaya E.G., Platonova N.M., Troshina E.A., Grigoriev A.Yu. Role of hypothalamic neuropeptides in the development of hyponatremia in patients after transnasal adenomectomy. Obesity and metabolism. 2025;22(2):60-69. (In Russ.) https://doi.org/10.14341/omet13209
ОБОСНОВАНИЕ
Гипоталамо-гипофизарная область является местом синтеза и секреции ряда гормонов, имеющих прямое влияние на водно-натриевый обмен, что обуславливает его частое нарушение с развитием центрального несахарного диабета и тяжелой транзиторной гипонатриемии в послеоперационном периоде трансназальной аденомэктомии [1]. Открытые в последние десятилетия нейропептиды, такие как апелин, копептин (часть молекулы пре-про-вазопрессина) и мозговой натрийуретический пептид [2–4], во многих исследованиях демонстрируют свое значимое влияние на регуляцию водно-электролитного обмена и делают их потенциальными гормональными маркерами этих тяжелых осложнений.
Водно-электролитные нарушения осложняют течение трансназальной аденомэктомии по поводу образований гипоталамо-гипофизарной области в 13–30% случаев [5], связаны с высоким риском неврологических осложнений и повышенной смертностью, в связи с чем являются второй по частоте причиной повторной госпитализации больных в нейрохирургические стационары [6][7].
В настоящее время причины и факторы, предрасполагающие к развитию тяжелой транзиторной гипонатриемии или транзиторного/постоянного центрального несахарного диабета, не ясны. Предполагается, что в патогенез может быть вовлечена послеоперационная гиперактивация гипоталамо-гифизарной системы с повышением выброса гормонов гипоталамуса/гипофиза в ответ на локальный стресс [8], или повреждение нейрогипофизарных путей с высвобождением избытка вазопрессина в центральный кровоток [9].
Таким образом, изучение патогенеза нарушений водно-электролитного баланса, факторов риска данных осложнений и разработка методов их ранней диагностики является важной и актуальной задачей современной медицины.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить особенности секреции гипоталамических нейропептидов при нормальном водно-солевом обмене периоперационно и при наличии гипонатриемии вследствие послеоперационного синдрома неадекватной секреции антидиуретического гормона.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Исследование проводилось на базе отделений нейроэндокринологии и нейрохирургии ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России.
Время исследования. Исследование проходило с марта 2021 по март 2022 гг.
Изучаемые популяции
Популяция: всего в исследование включено 122 пациента (41 мужчина и 81 женщина) старше 18 лет, которым планировалось проведение хирургического вмешательства на гипоталамо-гипофизарной области по поводу аденомы гипофиза. Средний возраст участников в исследовании составил 45,9±13,1 года, индекс массы тела (ИМТ) — 30,6±6,5 кг/м2. 28 (23%) пациентов имели клинически гормонально-неактивные опухоли (D35.3). Среди гормонально активных аденом гипофиза было больше всего пациентов с акромегалией — 49% (60/122; Е22.0), меньше с болезнью Иценко-Кушинга — 25% (30/122; Е24.0) и пролактиномами — 4% (5/122; Е22.1). Всем пациентам исходно и далее в послеоперационном периоде трансназальной аденомэктомии проводился контроль наличия или отсутствия водно-электролитных нарушений с помощью определения натрия крови в первые 12–24 часа, далее на 2–3, 4–5 и 6–7 сутки после операции. Пациенты также заполняли дневник самочувствия и водного баланса.
Дизайн исследования: проспективное сравнительное исследование.
Способ формирования выборки из изучаемой популяции: пациенты включались сплошным способом, выборка групп формировалась согласно критериям включения.
Критерии включения: возраст старше 18 лет, плановое проведение трансназальной аденомэктомии по поводу основного заболевания, наличие информированного согласия на обследование согласно требованиям локального этического комитета.
Критерии исключения: установленный диагноз центрального несахарного диабета, этиологически не связанного с образованиями гипофиза или развившегося в результате масс-эффекта/ранее проведенного хирургического лечения образований хиазмально-селлярной области; нефрогенный несахарный диабет; тяжелые соматические заболевания (сердечная, печеночная или почечная недостаточность); декомпенсация нарушений углеводного обмена; выраженная гипокалиемия.
Группы исследования уровней нейропептидов были сформированы из числа пациентов, включенных в исследование: 10 пациентов с гипонатриемией в послеоперационном периоде трансназальной аденомэктомии и 12 пациентов группы-контроля были подобранны по полу, возрасту и ИМТ из 55 пациентов без водно-электролитных нарушений.
Методы
Все лабораторные исследования проводились в клинико-диагностической лаборатории ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России.
Лабораторные биохимические исследования проводились электрохимическим методом на ионоселективном анализаторе Architect i2000 (Abbott, Эббот Парк, Иллинойс, США) с использованием коммерческих наборов фирмы Abbot (Швейцария). Уровни кортизола крови определялись с помощь системы Vitros 3600 (Johnson & Johnson, США), тиреотропного гормона и свободного тироксина — системы Architect (Abbott, США), адренокортикотропного гормона — анализатора “Elecsys” (Roche, Швейцария). Уровни апелина-12, копептина, окситоцина и натрийуретического пептида (proBNP) определялись в плазме крови методом неавтоматизированного твердофазного иммуноферментного анализа наборами Phoenix Pharmaceuticals (Phoenix Pharmaceuticals, Inc., США).
Статистический анализ
Статистический анализ данных выполнялся с использованием пакетов прикладных программ STATISTICA v. 13 (TIBCO Software Inc., США). Распределения количественных признаков представлены медианами и квартилями в формате Ме [Q1; Q3] (для неправильно распределенных параметров) и средними и стандартными отклонениями (для правильно распределенных параметров), качественных — абсолютными и относительными частотами. С помощью критерия Краскела-Уоллиса (KW ANOVA) выполнялось сравнение независимых групп по количественным признакам. Сравнение групп по качественным признакам выполнялось с использованием двустороннего точного критерия Фишера. Сравнение зависимых переменных проводилось с помощью теста Хи-квадрат (χ2) ANOVA.
Критический уровень значимости при проверке статистических гипотез принимался равным 0,05, при выполнении множественных сравнений применялась поправка Бонферрони. Значения Р в диапазоне от скорректированного поправкой порогового уровня значимости до 0,05 рассматривались как статистическая тенденция.
Этическая экспертиза
От каждого из включенных в исследование участников было получено информированное добровольное согласие. Протокол исследования одобрен локальным этическим комитетом ФГБУ «НМИЦ эндокринологии» (выписка из протокола №18 от 12.10.2022 г.).
Результаты
Частота гипонатриемии после трансназальной аденомэктомии
Нами была изучена частота водно-электролитных осложнений у пациентов после трансназальной аденомэктомии. За период наблюдения с 2021 по 2022 гг. проанализировано 122 пациента, им проводился регулярный контроль уровня натрия крови, по результатам которого водно-электролитные осложнения выявлены у 21 (17,2 %), из которых синдром неадекватной секреции антидиуретического гормона (СНСАДГ) диагностирован у 19 (15,6%), центральный несахарный диабет — у 2 (1,6%), что демонстрирует высокую распространенность гипонатриемии среди прооперированных пациентов (рис. 1).
Клинические проявления при послеоперационной гипонатриемии после трансназальной аденомэктомии
В ходе исследования установлено, что гипонатриемия наблюдалась на 5–7 день после хирургического вмешательства с медианой снижения натрия крови 125,2±5,1 ммоль/л. Клинические проявления у пациентов с послеоперационной гипонатриемией представлены на рисунке 2. Наиболее частыми симптомами были выраженная общая слабость (100% против контроля 50%), головная боль (90% против контроля 33%) и тошнота (80% против контроля 13%). Однако при сравнительном анализе после поправки Бонферрони выявленные симптомы не показали различий с группой контроля. Особый интерес представляло течение этих клинических проявлений. Так, в совокупности со снижением натрия в крови выраженная общая слабость сопровождала пациентов с исключенной надпочечниковой недостаточностью (кортизол сыворотки крови утром — более 550 нмоль/л), а головная боль проявлялась совместно с гипонатриемией на 5–7 день после операции.
При сравнении клинико-демографических характеристик пациентов с развившейся гипонатриемией вследствие послеоперационного СНСАДГ и без было показано, что между группами имеется различие в весе и связанном с ним ИМТ, в связи с чем для нивелирования данного потенциального вмешивающегося фактора, подобрана группа сравнения случай-контроль. Клинико-демографические характеристики групп пациентов представлены в таблице 1.
Определение нейропептидов в дооперационном периоде
На дооперационном этапе между пациентами групп гипонатриемии и отсутствия водно-электролитных нарушений не было обнаружено различий в уровнях копептина, окситоцина, апелина и proBNP, а также в уровне натрия сыворотки крови (табл. 2, рис. 3). В исследованных группах также отсутствовала корреляционная связь уровней изучаемых нейропептидов и концентрации натрия крови (табл. 3). При этом анализ корреляций по Спирмену показал, что на исходном этапе исследования отмечались положительные ассоциации между копептином и апелином (R=0,39, p=0,03), копептином и proBNP (R=0,39, p=0,03). Между изначальными уровнями копептина и окситоцина, апелина и окситоцина, окситоцина и proBNP, апелина и proBNP корреляционная связь отсутствовала.
Определение нейропептидов в послеоперационном периоде
Проведен анализ послеоперационной динамики концентраций копептина, окситоцина, апелина и proBNP в группах гипонатриемии и контроля, который показал значимые изменения уровней окситоцина без существенного изменения концентраций других нейропептидов (табл. 4, рис. 4).
Согласно корреляционному анализу по Спирмену между окситоцином и натрием в крови на 2–3 сутки после операции была показана положительная корреляционная связь (R=0,53, р=0,04), в то время как на 4–5 (R=-0,44, р=0,048) и 6–7 дни (R=-0,50, р=0,036) связь была отрицательной. Статистически значимые результаты были получены при сравнении этих параметров в группе гипонатриемии и группе-контроля: медиана концентрации окситоцина в группе гипонатриемии на 6–7 день после операции была в 2,1 раза выше при СНСАДГ послеоперационного периода (6,781 нг/мл против 3,199 нг/мл в группе контроля, р=0,002 для U-теста Манна-Уитни) (рис. 5).
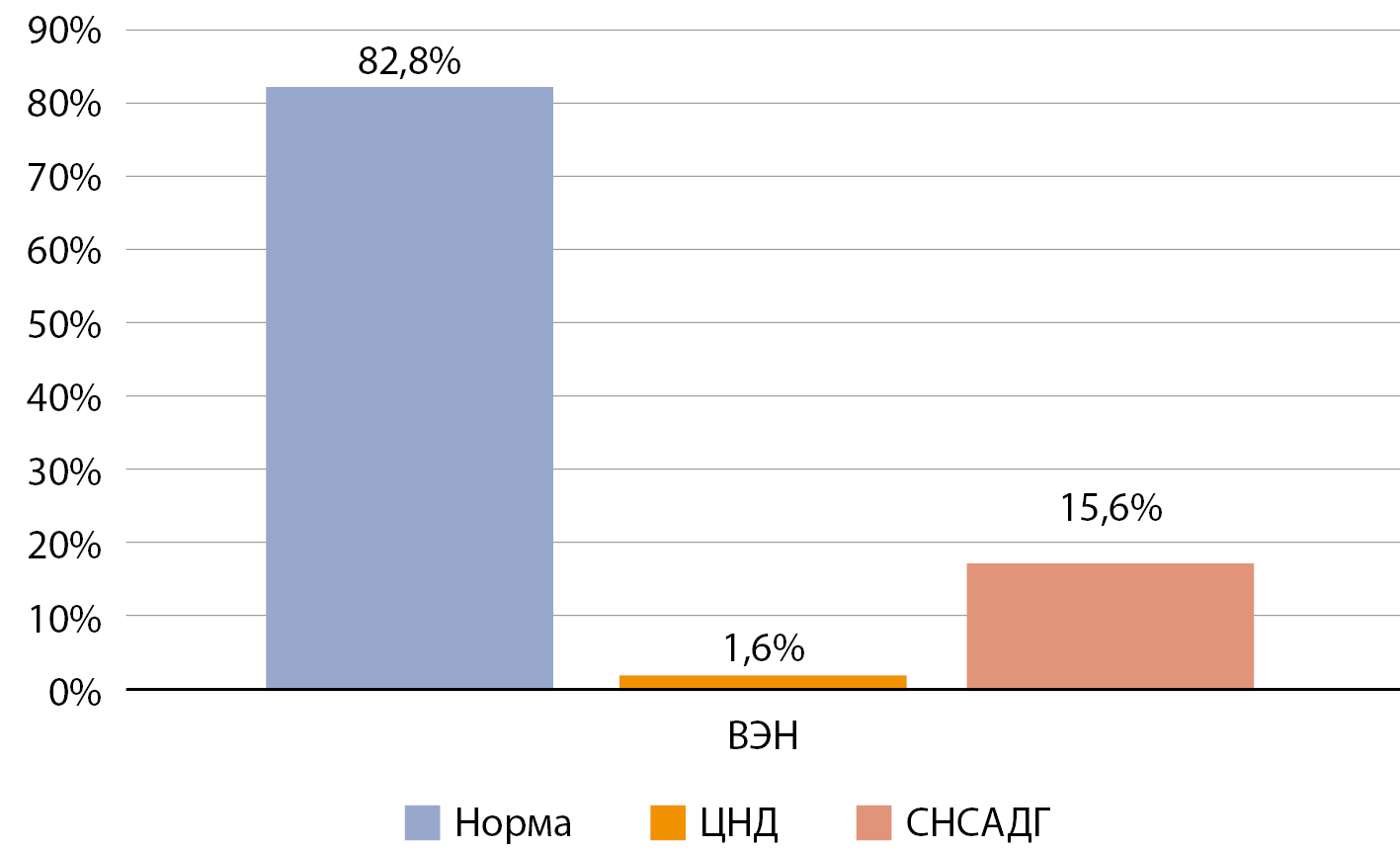
Рисунок 1. Частота гипонатриемии после трансназальной аденомэктомии.
Таблица 1. Клинико-демографические характеристики пациентов
|
Параметр |
Группа 1 Без нарушений (n=55) |
Группа 1А Без нарушений (n = 12) |
Группа 2 Гипонатриемия (n=10) |
Значение р между группами 1 и 2 |
Значение р между группами 1А и 2 |
|
Возраст, годы |
46,5 [ 33,5; 63,5] |
46 [ 39; 57] |
46 [ 39; 57] |
>0,05 |
>0,05 |
|
Пол, м/ж |
19/36 |
2/8 |
2/8 |
>0,05 |
>0,05 |
|
Рост, см |
168 [ 162; 175] |
163 [ 156; 168] |
163 [ 157; 168] |
>0,05 |
>0,05 |
|
Вес, кг |
86 [ 74; 95] |
77,0 [ 62; 84] |
72,2 [ 63; 83] |
0,01 |
>0,05 |
|
ИМТ, кг/м2 |
29,8 [ 26,8; 33,3] |
28,2 [ 23,2; 30,0] |
28,2 [ 23,2; 30,0] |
0,01 |
>0,05 |
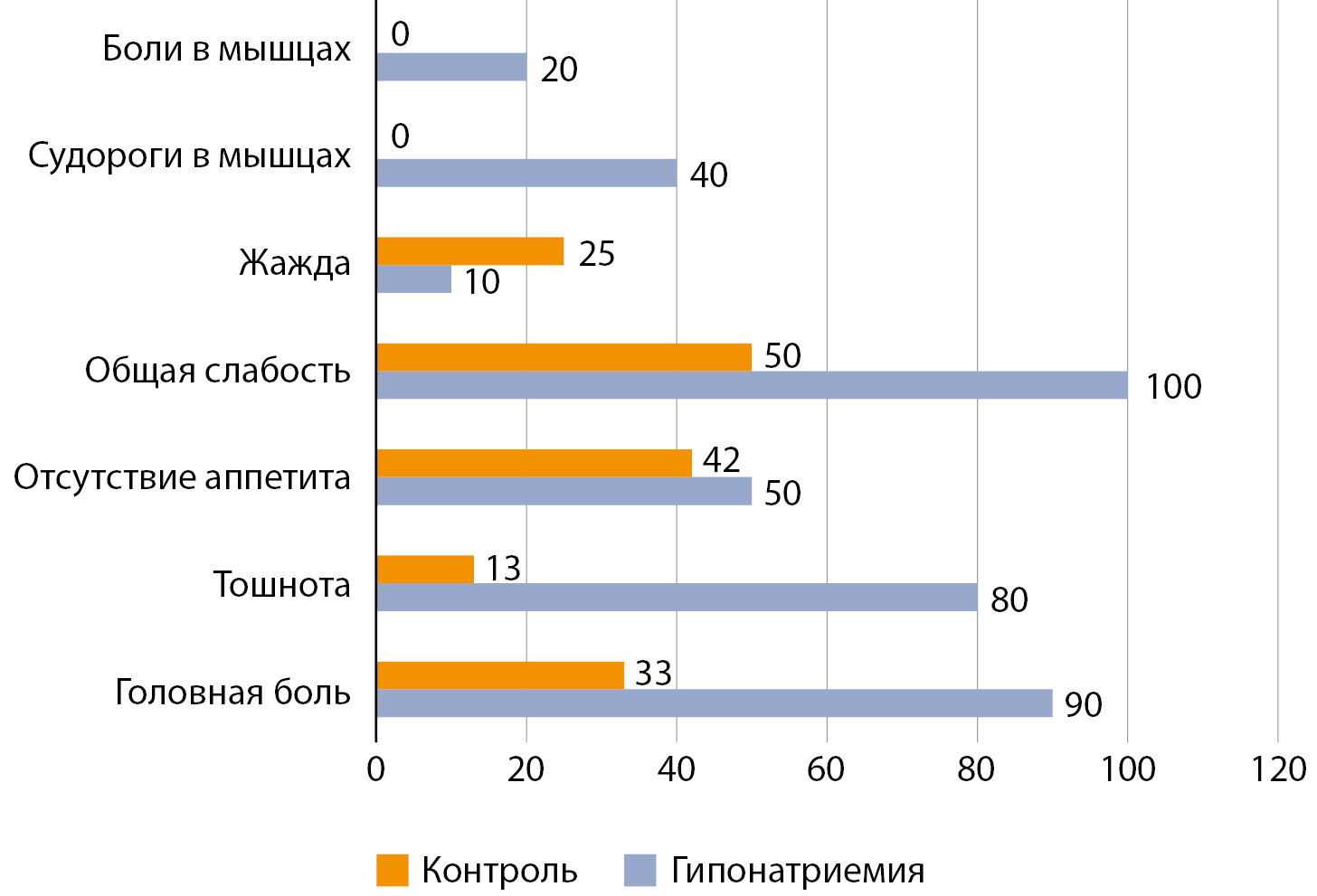
Рисунок 2. Клинические проявления у пациентов с послеоперационной гипонатриемией вследствие СНСАДГ (%).
Таблица 2. Исходные (предоперационные) гормонально-биохимические параметры пациентов
|
Параметр |
Без нарушений |
Гипонатриемия (n=10) |
Значение р* |
|
Копептин, нг/мл |
1,211 [ 1,033; 1,506] |
1,079 [ 0,775; 1,311] |
>0,05 |
|
Окситоцин, нг/мл |
5,213 [ 4,297; 7,88] |
7,109 [ 6,093; 8,901] |
>0,05 |
|
Апелин, нг/мл |
1,227 [ 0,912; 1,502] |
1,168 [ 0,997; 1,966] |
>0,05 |
|
ProBNP, пг/мл |
1386,3 [ 1099,7; 1499,8] |
1299,1 [ 1026,8; 1894,9] |
>0,05 |
|
Натрий, ммоль/л |
141 [ 139; 142] |
141 [ 140; 141] |
>0,05 |
* — значение р для U-теста Манна-Уитни.
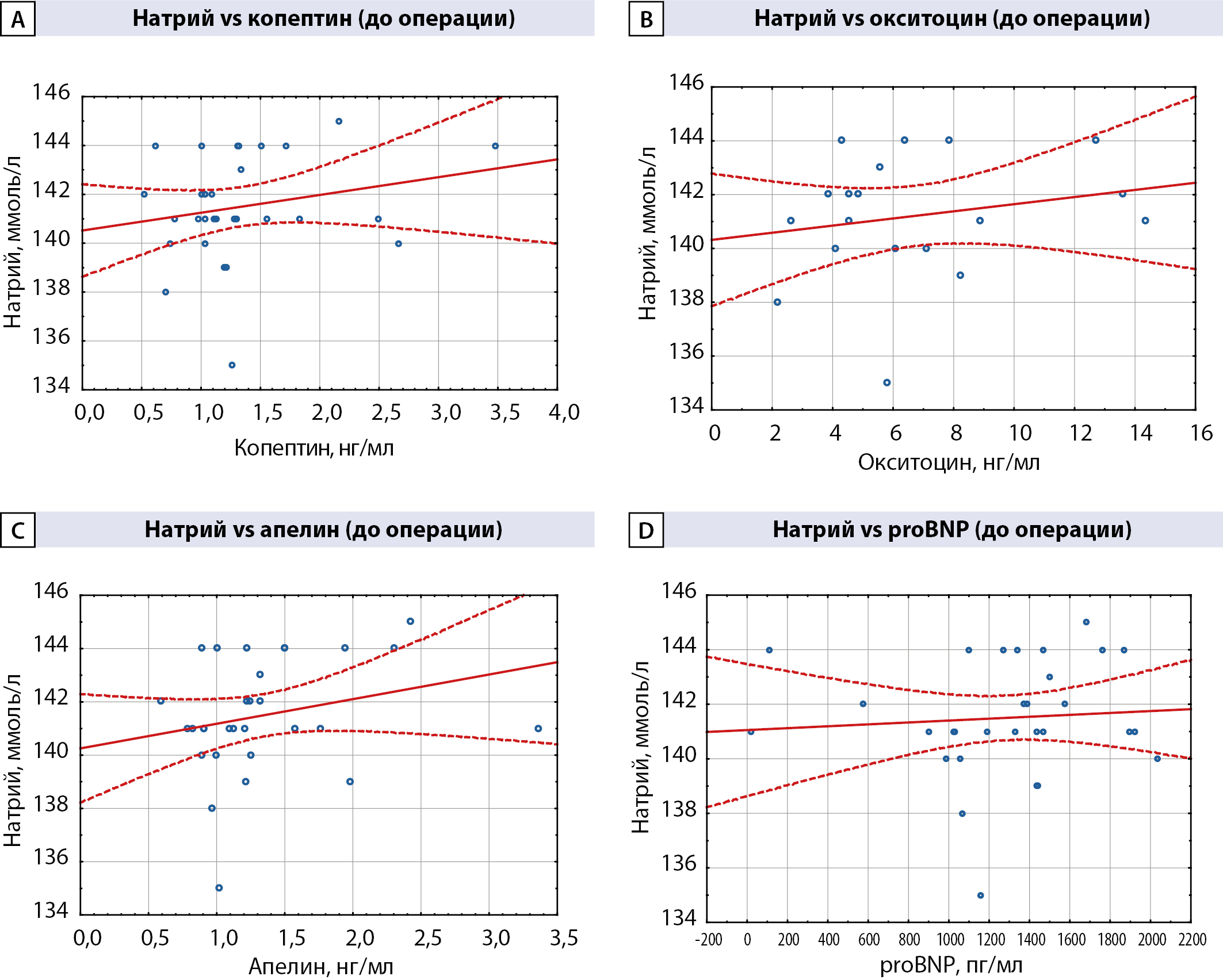
Рисунок 3. Предоперационные уровни копептина (А), окситоцина (В), апелина (С) и proBNP (D) в группах гипонатриемии и без водно-электролитных нарушений.
Таблица 3. Корреляционный анализ по Спирмену изучаемых нейропептидов и уровня натрия крови до оперативного лечения
|
Параметры |
R |
t(N-2) |
Значение р |
|
Копептин vs натрий до операции |
0,20 |
1,10 |
0,28 |
|
Окситоцин vs натрий до операции |
0,15 |
0,62 |
0,54 |
|
Апелин vs натрий до операции |
0,30 |
1,63 |
0,11 |
|
РroBNP vs натрий до операции |
0,17 |
0,93 |
0,36 |
Таблица 4. Послеоперационные концентрации копептина, окситоцина, апелина и proBNP у пациентов и натрия крови в группах гипонатриемии и без водно-электролитных нарушений
|
Параметр |
-1–0 дней |
12–24 часа п/о |
2–3 дня |
4–5 дней |
6–7 дней |
Значение |
|
Без нарушений |
||||||
|
Копептин, нг/мл |
1,211 |
1,065 |
1,188 |
1,164 |
1,211 |
>0,05 |
|
Окситоцин, нг/мл |
5,213 |
3,319 |
6,610 |
1,164 |
3,199 |
<0,014 |
|
Апелин, нг/мл |
1,227 |
1,024 |
1,090 |
1,091 |
1,036 |
>0,05 |
|
ProBNP, пг/мл |
1386,3 [ 1099,7; 1499,8] |
1168,7 [ 878,2; 1516,8] |
1215,1 |
1316,5 |
1215,5 |
>0,05 |
|
Натрий, ммоль/л |
141,0 |
141,3 |
142,5 |
142,9 |
140,8 |
<0,0003 |
|
Гипонатриемия |
||||||
|
Копептин, нг/мл |
1,211,5 |
1,113 |
1,165 |
1,655 |
1,259 |
>0,05 |
|
Окситоцин, нг/мл |
5,213 |
4,464 |
7,017 |
1,655 |
6,781 |
<0,04 |
|
Апелин, нг/мл |
1,227 |
0,887 |
1,210 |
1,150 |
1,109 |
>0,05 |
|
ProBNP, пг/мл |
1386,3 |
1112,4 |
1150,3 |
1523,6 |
1122,2 |
>0,05 |
|
Натрий, ммоль/л |
141 |
140 |
141 |
140,5 |
133 |
<0,02 |
* — Хи-квадрат ANOVA.
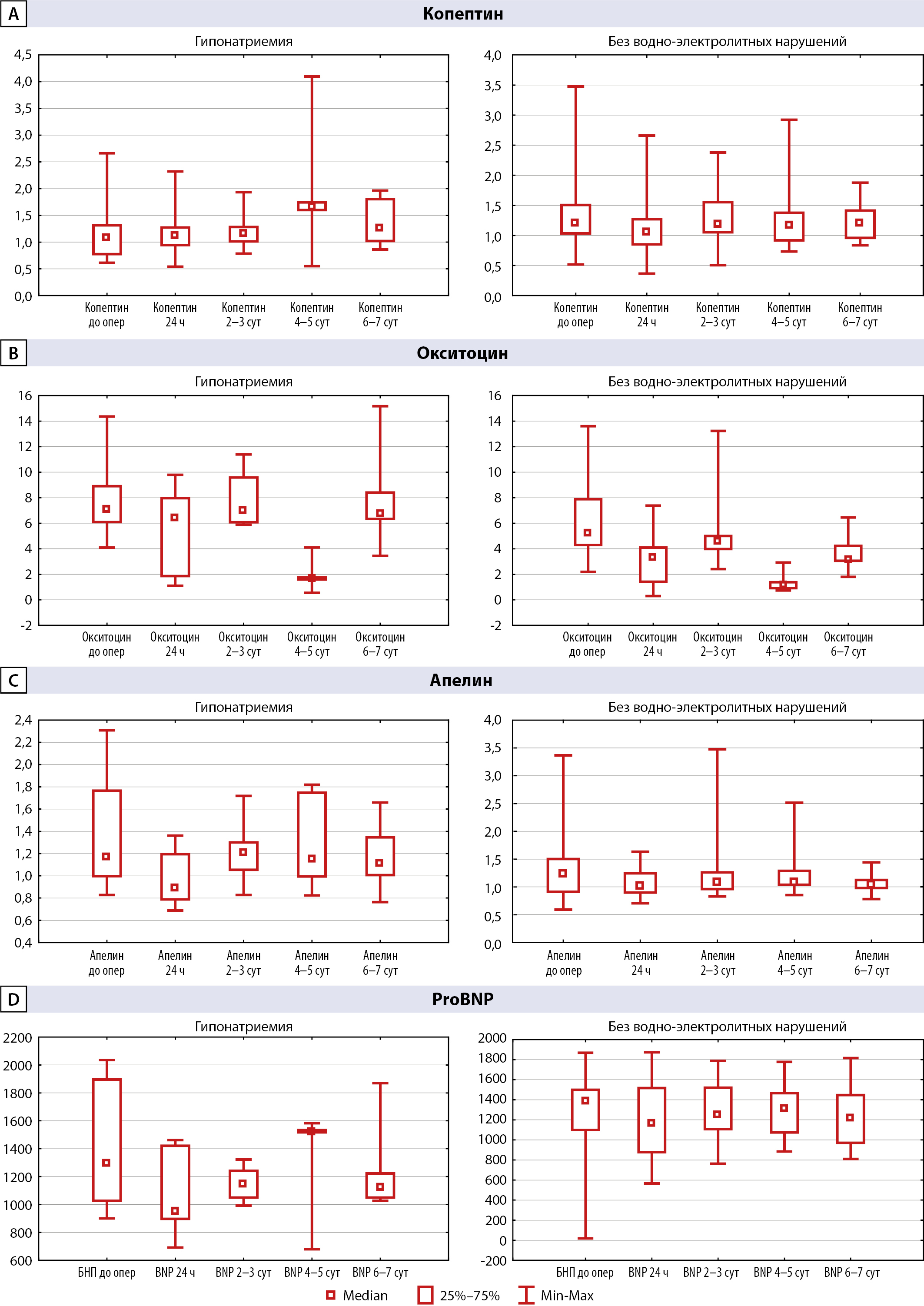
Рисунок 4. Послеоперационные концентрации копептина (А), окситоцина (В), апелина (С) и proBNP (D) у пациентов в группах гипонатриемии и без водно-электролитных нарушений.
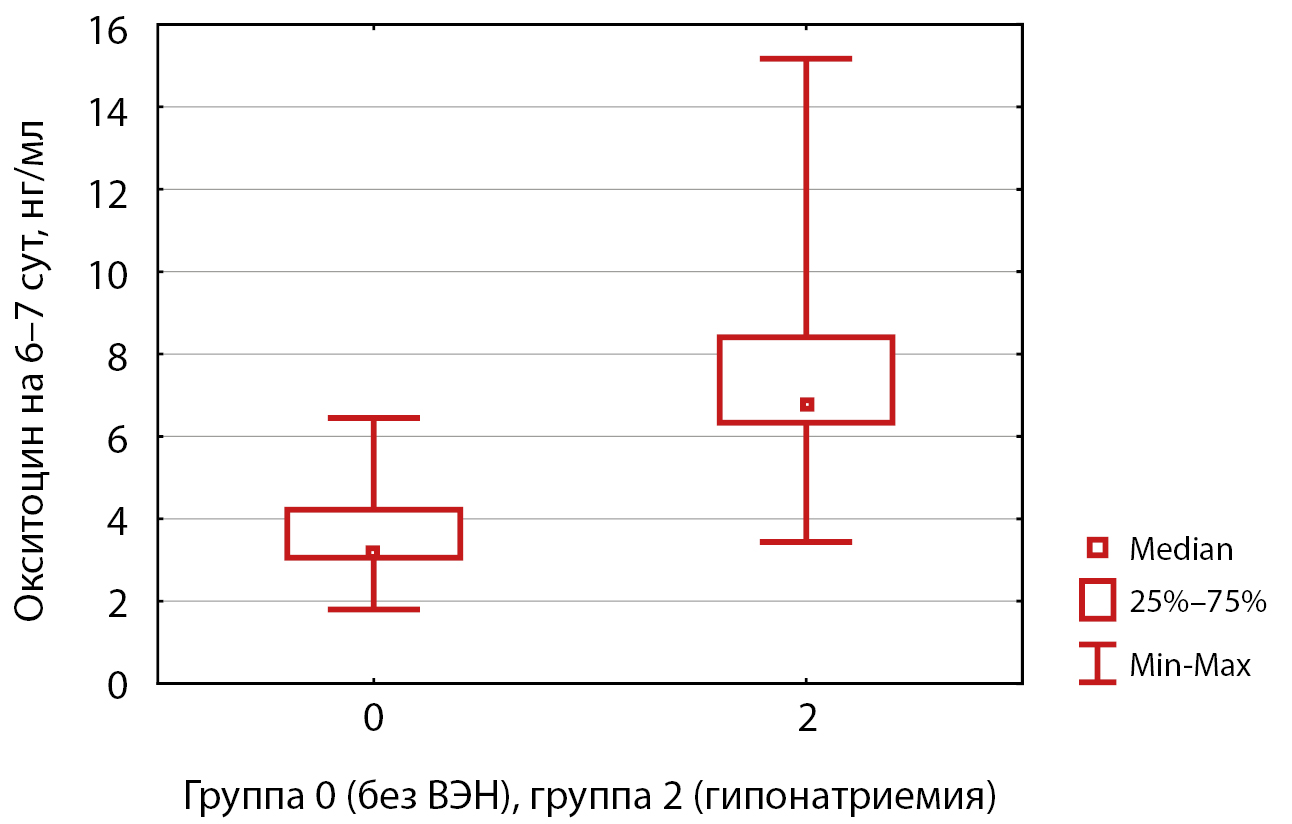
Рисунок 5. Сравнительный анализ уровней окситоцина на 6–7 сутки после трансназальной аденомэктомии у пациентов из групп гипонатриемии и без водно-электролитных нарушений (U-тест Манна-Уитни; р=0,002).
Обсуждение
Репрезентативность выборок
Несмотря на малый объем выборки, обусловленный редкостью патологии, одноцентровой характер исследования, репрезентативность выборок представляется достаточной ввиду сплошного метода формирования выборки и проспективного дизайна исследования.
Сопоставление с другими публикациями
Транссфеноидальная хирургия является лечением первой линии для многих клинически значимых опухолей гипофиза и других объемных образований области турецкого седла. Учитывая то, что частота осложнений данного оперативного лечения невелика при выполнении его в центрах с большим объемом вмешательств, нарушения водно-солевого баланса в послеоперационном периоде встречаются довольно часто, и являются второй по распространенности причиной повторной госпитализации, в том числе вследствие различных неврологических осложнений этого электролитного отклонения [5][6].
Неврологические эффекты низкой концентрации натрия в плазме связаны с тяжестью гипонатриемии и скоростью снижения уровня натрия в плазме. Легкая гипонатриемия (130–135 ммоль/л) традиционно рассматривается как бессимптомная, при этом тошнота, головные боли и анорексия, являющиеся следствием отека головного мозга, могут возникать уже при умеренной гипонатриемии (125–130 ммоль/л), а более тяжелая гипонатриемия (>125 ммоль/л) сопровождается спутанностью сознания, комой, судорогами или даже приводить к смертельному исходу [1][9–11].
В ретроспективном исследовании Jahangiri А. и соавт., объединившим данные о 1045 операций на гипофизе, послеоперационная гипонатриемия возникала у 16% пациентов в среднем через 4 дня после операции [12]. Данные сопоставимы с результатами нашего исследования – порядка 15% случаев гипонатриемии и времени ее возникновения после операции на 5–7 дни. Тошнота также зарегистрирована в данном обзоре в качестве одного из наиболее распространенных послеоперационных симптомов гипонатриемии. Однако данные о характере этих клинических проявлений в литературе отсутствуют.
Послеоперационные нарушения водно-электролитного баланса могут сопровождаться вовлечением гормонов передней доли гипофиза, таких как адренокортикотропный и тиреотропный гормоны [1][9].
Кроме того, механическое повреждение гипоталамо-гипофизарной области может влиять на выведение натрия и реабсорбцию воды посредством регуляции секреции нейропептидов [4][13]. Иногда субклинические или малосимптомные водно-электролитные нарушения могут возникать изолированно или, реже, как часть двухфазного или трехфазного ответа [13].
Несмотря на многочисленные исследования, в том числе нашей группы, по поиску потенциальных ранних предикторов развития послеоперационных водно-электролитных расстройств, прогноз развития СНСАДГ или центрального несахарного диабета все еще является сложной задачей, а вклад этих предикторов до конца не ясен.
Решению данной задачи может существенно помочь в первую очередь понимание патофизиологических механизмов данного водно-электролитного нарушения и измененного периоперационного состояния гормональной секреции гипоталамо-гипофизарной области. Так, Brooks E.K. и соавт. в своей работе предположили, что гипонатриемия после операции на гипофизе связана с антидиурезом вследствие избыточной (неадекватной) секреции вазопрессина, приводящей к гипоосмоляльности и гипонатриемии [13]. Нарушения, в которых задействован вазопрессин, также можно обнаружить с помощью определения более стабильной части пре-про-гормона вазопрессина – копептина, который секретируется с самим гормонов в одинаковых молярных количествах. В исследовании Binu А. и соавт. уровни копептина в сыворотке крови оценивались после операции по удалению аденомы гипофиза у 50 пациентов. В результате у 100% пациентов, у которых развился транзиторный центральный несахарный диабет, наблюдалось относительное снижение копептина при экстубации после операции по сравнению с первоначальным значением, а у 88% пациентов, с развивающейся ранней гипонатриемией, наоборот, увеличение. У 75% пациентов, у которых развилась отсроченная гипонатриемия, наблюдалось относительное увеличение копептина на 4-й день по сравнению с уровнем до операции [14].
В последние десятилетия в научном сообществе активно обсуждается влияние гипоталамических нейропептидов: апелина, копептина, окситоцина и мозгового натрийуретического пептида на развитие послеоперационных водно-электролитных нарушений.
Роль апелина в патофизиологии гипонатриемии интенсивно изучается, но несмотря на немногочисленные исследования, проведенные на животных [15–17] и на здоровых добровольцах [18], свидетельствующие о значительном разнонаправленном влиянии апелина на диурез, в нашем исследовании существенного воздействия апелина на развитие гипонатриемии не выявлено.
Многие работы показали, что высвобождение окситоцина из гипофиза способствует секреции предсердного и мозгового натрийуретических пептидов [19]. Это могло бы оказать влияние на возникновение гипонатриемии, однако результаты нашего исследования не подтверждают вовлеченность proBNP в процесс развития гипонатриемии после операций на гипофизе.
В исследовании Constanthin P.E. и соавт., проведенном на пациентах после транссфеноидальной аденомэктомии (n=21), окситоцин значительно повышался через 4 дня после операции у пациентов с гипонатриемией [11]. Аналогичный результат получен в нашем исследовании с пиком концентрации окситоцина на 3 день исследования. Это может быть свидетельством того, что аномальная секреция окситоцина предшествует появлению дисбаланса натрия у пациентов с гипонатриемией.
Таким образом, патогенез гипонатриемии, возникающей после трансназальной аденомэктомии по поводу аденом гипофиза, предполагает повышение концентрации окситоцина, который имеет потенциал быть гормональным маркером этого тяжелого осложнения.
Клиническая значимость результатов
Изучение патогенеза и диагностических маркеров послеоперационной гипонатриемии у пациентов после трансназальной аденомэктомии позволит разработать пути по профилактике и лечению этого жизненно опасного осложнения.
Ограничения исследования
Ограничения исследования обусловлены малым объемом выборки, связанным с редкостью изучаемой патологии.
Направления дальнейших исследований
В продолжении проведенного исследования планируется изучить динамику нейропептидов гипоталамуса (апелин, окситоцин, копептин) до и динамически после трансназальной аденомэктомии по поводу аденом гипофиза с оценкой их диагностической значимости для прогноза послеоперационных водно-электролитных нарушений на большей выборке пациентов.
Заключение
Наше исследование выявило высокую частоту гипонатриемии после трансназальной аденомэктомии — порядка 15% случаев, в генезе которой, по-видимому, значимую роль играет неадекватная секреция гипоталамического нейропептида окситоцина, имеющего потенциал быть гормональным маркером этого тяжелого осложнения.
Дополнительная информация
Источники финансирования. Работа выполнена в рамках государственного задания «Эндокринно-опосредованные нарушения осмотического гомеостаза: изучение этиологических и патогенетических факторов, разработка персонализированных подходов дифференциальной диагностики». Индекс УДК 616-008.9; 616.39. Рег. № НИОКТР АААА-А17-117012610108-6.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Все авторы внесли равный вклад в работу: анализ данных и их интерпретацию, написание статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Пигарова Е.А., Дзеранова Л.К., Жуков А.Ю., Григорьев А.Ю., Азизян В.Н., Иващенко О.В., Дедов И.И. Водно-электролитные нарушения после эндоскопических трансназальных нейрохирургических вмешательств. Эндокринная хирургия. 2019;13(1):42-55 doi: https://doi.org/10.14341/serg10205.
2. Wong P.C.Y., Guo J., Zhang A. The renal and cardiovascular effects of natriuretic peptides // Adv Physiol Educ. 2017. Vol. 41, № 2. P. 179–185. doi: https://doi.org/10.1152/advan.00177.2016.
3. Dabla P.K., Dabla V., Arora S. Copeptin: Role as a novel biomarker in clinical practice. Clin Chim Acta. 2011;412(1-2):22-8. doi: https://doi.org/10.1016/j.cca.2010.09.034.
4. Girault-Sotias P.-E. et al. Apelin and Vasopressin: The Yin and Yang of Water Balance // Front Endocrinol (Lausanne). 2021. Vol. 12. P. 735515. doi: https://doi.org/10.3389/fendo.2021.735515.
5. Бадмаева И.Н., Астафьева Л.И., Калинин П.Л., Кадашев Б.А., Кутин М.А. Центральный несахарный диабет после удаления опухолей хиазмально-селлярной области: распространенность и предикторы манифестации. // Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. — 2021. — Т.85. — №6. — С.111-118. doi: https://doi.org/10.17116/neiro202185051111.
6. Adrogué H.J., Tucker B.M., Madias N.E. Diagnosis and Management of Hyponatremia: A Review // JAMA. 2022. Vol. 328, № 3. P. 280–291. doi: https://doi.org/10.1001/jama.2022.11176.
7. Patel K.S. et al. Prediction of post-operative delayed hyponatremia after endoscopic transsphenoidal surgery // Clin Neurol Neurosurg. 2019. Vol. 182. P. 87–91. doi: https://doi.org/10.1016/j.clineuro.2019.05.007.
8. Finnerty C.C. et al. The Surgically Induced Stress Response // JPEN J Parenter Enteral Nutr. 2013. Vol. 37, № 5 0. P. 21S-29S. doi: https://doi.org/10.1177/0148607113496117.
9. Chasseloup F., Tabarin A., Chanson P. Diabetes insipidus: Vasopressin deficiency… // Ann Endocrinol (Paris). 2024. Vol. 85, № 4. P. 294–299. doi: https://doi.org/10.1016/j.ando.2023.11.006.
10. Prete A., Corsello S.M., Salvatori R. Current best practice in the management of patients after pituitary surgery // Ther Adv Endocrinol Metab. 2017. Vol. 8, № 3. P. 33–48. doi: https://doi.org/10.1177/2042018816687240.
11. Constanthin P.E. et al. Increased oxytocin release precedes hyponatremia after pituitary surgery // Pituitary. 2021. Vol. 24, № 3. P. 420–428. doi: https://doi.org/10.1007/s11102-020-01121-4.
12. Jahangiri A. et al. Factors predicting postoperative hyponatremia and efficacy of hyponatremia management strategies after more than 1000 pituitary operations // J Neurosurg. 2013. Vol. 119, № 6. P. 1478–1483. doi: https://doi.org/10.3171/2013.7.JNS13273.
13. Brooks E.K., Inder W.J. Disorders of Salt and Water Balance After Pituitary Surgery // J Clin Endocrinol Metab. 2022. Vol. 108, № 1. P. 198–208. doi: https://doi.org/10.1210/clinem/dgac622.
14. Binu A. et al. Role of Copeptin in Predicting Postoperative Hyponatremia and Hypernatremia in Patients Undergoing Endoscopic Pituitary Adenoma Surgery // Neurosurgery. 2024. Vol. 95, № 3. P. 641–650. doi: https://doi.org/10.1227/neu.0000000000002927.
15. Flahault A. et al. Role of the Vasopressin/Apelin Balance and Potential Use of Metabolically Stable Apelin Analogs in Water Metabolism Disorders // Front Endocrinol (Lausanne). 2017. Vol. 8. P. 120. doi: https://doi.org/10.3389/fendo.2017.00120.
16. Roberts E.M. et al. Abnormal fluid homeostasis in apelin receptor knockout mice // J Endocrinol. 2009. Vol. 202, № 3. P. 453–462. doi: https://doi.org/10.1677/JOE-09-0134.
17. Hus-Citharel A. et al. Apelin Counteracts Vasopressin-Induced Water Reabsorption via Cross Talk Between Apelin and Vasopressin Receptor Signaling Pathways in the Rat Collecting Duct // Endocrinology. 2014. Vol. 155, № 11. P. 4483–4493. doi: https://doi.org/10.1210/en.2014-1257.
18. Azizi M. et al. Reciprocal regulation of plasma apelin and vasopressin by osmotic stimuli // J Am Soc Nephrol. 2008. Vol. 19, № 5. P. 1015–1024. doi: https://doi.org/10.1681/ASN.2007070816.
19. Gutkowska J. et al. Oxytocin releases atrial natriuretic peptide by combining with oxytocin receptors in the heart // Proc Natl Acad Sci U S A. 1997. Vol. 94, № 21. P. 11704–11709. doi: https://doi.org/10.1073/pnas.94.21.11704.
Об авторах
Х. Р. ФаргиеваРоссия
Фаргиева Хава Романовна
117036, Москва, ул. Дмитрия Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Е. А. Пигарова
Россия
Пигарова Екатерина Александровна - д.м.н.; Scopus Author ID: 55655098500; Researcher ID: T-9424-2018.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Л. К. Дзеранова
Россия
Дзеранова Лариса Константиновна - д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Е. Г. Пржиялковская
Россия
Пржиялковская Елена Георгиевна - к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Н. М. Платонова
Россия
Платонова Надежда Михайловна - д.м.н., профессор.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Е. А. Трошина
Россия
Трошина Екатерина Анатольевна - д.м.н., профессор, член-корр. РАН.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
А. Ю. Григорьев
Россия
Григорьев Андрей Юрьевич - д.м.н., профессор; Scopus ID 57190411198
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Частота гипонатриемии после трансназальной аденомэктомии. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(161KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Клинические проявления у пациентов с послеоперационной гипонатриемией вследствие СНСАДГ (%). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(232KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Предоперационные уровни копептина (А), окситоцина (В), апелина (С) и proBNP (D) в группах гипонатриемии и без водно-электролитных нарушений. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(884KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Послеоперационные концентрации копептина (А), окситоцина (В), апелина (С) и proBNP (D) у пациентов в группах гипонатриемии и без водно-электролитных нарушений. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Сравнительный анализ уровней окситоцина на 6–7 сутки после трансназальной аденомэктомии у пациентов из групп гипонатриемии и без водно-электролитных нарушений (U-тест Манна-Уитни; р=0,002). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(177KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Фаргиева Х.Р., Пигарова Е.А., Дзеранова Л.К., Пржиялковская Е.Г., Платонова Н.М., Трошина Е.А., Григорьев А.Ю. Роль гипоталамических нейропептидов в развитии гипонатриемии у пациентов после трансназальной аденомэктомии. Ожирение и метаболизм. 2025;22(2):60-69. https://doi.org/10.14341/omet13209
For citation:
Fargieva Kh.R., Pigarova E.A., Dzeranova L.K., Przhiyalkovskaya E.G., Platonova N.M., Troshina E.A., Grigoriev A.Yu. Role of hypothalamic neuropeptides in the development of hyponatremia in patients after transnasal adenomectomy. Obesity and metabolism. 2025;22(2):60-69. (In Russ.) https://doi.org/10.14341/omet13209
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































