Перейти к:
Морбидное ожирение у пациента с акромегалией: клинический случай
https://doi.org/10.14341/omet13182
Аннотация
Акромегалия — тяжелое нейроэндокринное заболевание, характеризующееся гиперпродукцией соматотропного гормона (СТГ). Медленно прогрессирующая симптоматика увеличивает сроки диагностического поиска вплоть до 15 лет. Постоянное воздействие избытка СТГ на организм человека может вызывать структурные и функциональные нарушения органов. К основным осложнениям акромегалии относятся поражения сердечно-сосудистой, дыхательной, опорно-двигательной систем, а также нарушение углеводного обмена и повышенный риск развития неоплазий.
Зачастую неспецифические симптомы акромегалии могут маскироваться под другие патологии или их осложнения, такие как ожирение. Увеличение подкожно-жировой клетчатки, повышение артериального давления, боли в суставах, отеки, нарушение углеводного, липидного обменов наблюдаются как при акромегалии, так и при ожирении. При этом дополнительным фактором возникновения ожирения как осложнения акромегалии является развитие апноэ сна, запускающее череду патологических процессов, в итоге приводящих к синдрому Пиквика.
Нами представлен клинический случай пациента с акромегалией и морбидным ожирением, обсуждаются особенности влияния повышенной массы тела на течение основного заболевания, наличия осложнений и индивидуальный подход в лечении.
Для цитирования:
Габаидзе Г.Д., Перепелова М.А., Пржиялковская Е.Г., Пигарова Е.А., Кузьмин А.Г., Венгржиновская О.И., Лапшина А.М., Дзеранова Л.К. Морбидное ожирение у пациента с акромегалией: клинический случай. Ожирение и метаболизм. 2024;21(3):331-338. https://doi.org/10.14341/omet13182
For citation:
Gabaidze G.D., Perepelova M.A., Przhiyalkovskaya E.G., Pigarova E.A., Kuzmin A.G., Vengrzhinovskaya O.I., Lapshina A.M., Dzeranova L.K. Obesity in a patient with acromegaly: a case report. Obesity and metabolism. 2024;21(3):331-338. (In Russ.) https://doi.org/10.14341/omet13182
АКТУАЛЬНОСТЬ
Распространенность ожирения в современном мире растет. По опубликованным Всемирной организацией здравоохранения сведениям, в 2016 г. более 1,9 млрд жителей планеты старше 18 лет имели избыточную массу тела, причем свыше 650 млн человек из этой когорты страдали ожирением. В России ежегодно в эту категорию попадают около 517 тысяч, примечательно, что 340 тысяч человек из них — это граждане трудоспособного возраста [1].
Акромегалия является орфанным заболеванием, распространенность, по разным оценкам, варьирует от 28 до 137 случаев на 1 млн населения. От первых признаков заболевания до установления диагноза может проходить до 15 лет, когда уже развиваются осложнения вследствие хронической гиперпродукции СТГ [2]. Поэтому необходимо вовремя диагностировать эту патологию.
СТГ подавляет липогенез, индуцирует липолиз в жировой ткани, кроме того, нарушает экспрессию адипокинов. Эпидемиологические исследования выявили, что снижение уровня адипонектина в сыворотке крови является независимым фактором риска для возникновения сахарного диабета 2 типа (СД2) и сердечно-сосудистых заболеваний [3].
Сочетание акромегалии и ожирения создает порочный круг, способствуя прогрессированию осложнений этих патологий, что демонстрируется в нашем клиническом случае.
ОПИСАНИЕ СЛУЧАЯ
Пациент Д. в 28 лет отметил увеличение размера стоп, изменение внешности, появление кожных складок на голове, изменение прикуса, расхождение зубов, выступание нижней челюсти вперед, появление нарушений дикции за счет увеличения языка. Тогда же пациент начал отмечать увеличение массы тела, составившее 60 кг за 1,5 года с момента начала заболевания (с 80 до 140 кг).
Только через 7 лет обратился к эндокринологу, заподозрена акромегалия, по данным лабораторных исследований, инсулиноподобный фактор роста-1 (ИФР-1) — 845 нг/мл (82–283), направлен в ГНЦ ФГБУ «НМИЦ эндокринологии» Минздрава России для определения дальнейшей тактики лечения.
При поступлении пациент предъявлял жалобы на повышенную потливость, отечность лица и нижних конечностей к вечеру, нарушение дикции, изменение прикуса, храп. При объективном осмотре отмечались изменения в виде увеличения языка, выступания грудной клетки и нижней челюсти несколько вперед, расхождение зубов, формирование кожных складок по всей поверхности головы. Телосложение гиперстеничное, масса тела составляла 142 кг при росте 181 см, индекс массы тела (ИМТ) — 43,3 кг/м2.
Во время госпитализации подтверждена активная стадия акромегалии: выявлено повышение уровня ИФР-1 до 1341 нг/мл (82–283), по результатам магнитно-резонансной томографии (МРТ) головного мозга визуализирована макроаденома гипофиза размерами 36×33×26 мм (рис. 1). Консультирован нейрохирургом, рекомендовано оперативное лечение.
Из анамнеза известно, что пациент страдает гипертонической болезнью более 5 лет с максимальным повышением артериального давления до 190/100 мм рт.ст. При обследовании впервые выявлен гипогонадотропный гипогонадизм: лютеинизирующий гормон (ЛГ) 2,2 Ед/л (2,5–11), фолликулостимулирующий гормон (ФСГ) — 3,94 Ед/л (1,6—9,7), тестостерон 7,42 нмоль/л (11–28,2). По результатам лабораторных анализов крови, данных за вторичную надпочечниковую недостаточность, вторичный гипотиреоз, несахарный диабет, нарушение липидного, углеводного, пуринового обменов не получено.
Пациенту Д. выполнена трансназальная транссфеноидальная аденомэктомия. В послеоперационном периоде при проведении СТГ в ходе ОГГТ максимальное подавление до 6,1 нг/мл на 90 минуте. По данным иммуногистохимического исследования определена редкогранулированная соматотропинома: очаговое, слабо выраженное окрашивание цитоплазмы опухолевых клеток с антителами к СТГ, экспрессия САМ 5.2 в виде фиброзных телец, индекс метки Ki-67 6,0%, выявлена выраженная экспрессия рецепторов соматостатина 2 подтипа на мембране более 80% опухолевых клеток (12 баллов по IRS), экспрессия Pit1 в большинстве опухолевых клеток, экспрессия пролактина в опухолевых клетках не обнаружена (рис. 2а, 2б).
Через полгода после оперативного лечения пациент отметил незначительное улучшение самочувствия, исчезновение храпа. При контроле выявлено отсутствие ремиссии акромегалии: СТГ — 6,3 нг/мл (0,06–3), ИФР-1 — 1079 нг/мл (82,0–283,0). По данным МРТ головного мозга, в селлярной области сохранялось объемное образование неправильно-округлой формы размерами 24×24,5×27 мм, распространяющееся в основную пазуху, охватывающее сифон правой внутренней сонной артерии, примыкающее к сифону левой внутренней сонной артерии, хиазма зрительных нервов не компримирована.
В связи с отсутствием ремиссии рекомендована медикаментозная терапия аналогами соматостатина — октреотидом пролонгированного действия в дозе 20 мг 1 раз в 28 дней.
В ходе госпитализации в 2024 г. (37 лет) в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России пациент предъявлял жалобы на прибавку в массе тела на 10 кг с момента операции, повышенную потливость, нарушение дикции.
При объективном осмотре отмечалось укрупнение черт лица, пальцев рук, стоп, гиперстеническое телосложение. Масса тела составила 152 кг при росте 181 см — ИМТ 46,4 кг/м2 (рис. 3а, 3б, 3в).
По результатам лабораторных исследований подтверждено отсутствие ремиссии акромегалии на фоне медикаментозного лечения: ИФР-1 — 527,0 нг/мл (82,0–283,0), по данным МРТ головного мозга с контрастным усилением — объемное кистозно-солидное образование с пара-, анте-, инфраселлярным распространением размерами до 18×14×20 мм (положительная динамика) (рис. 4).
Учитывая частичную резистентность к терапии аналогами соматостатина, редкогранулированную аденому гипофиза по данным гистологического исследования, в стационаре к лечению добавлен пэгвисомант 15 мг п/к ежедневно. Консультирован нейрохирургом, в связи с топографическими особенностями расположения опухоли, рекомендована консультация радиолога для решения вопроса о лучевой терапии.
Во время госпитализации оценен состав тела (по данным биоимпедансометрии): жировая масса тела — 67,6 кг (7,2–14,5 кг); скелетно-мышечная масса — 40,1 кг (27,3–35,7 кг); общая вода организма — 64,0 кг (35,0–52,3 кг); отношение внеклеточной и клеточной жидкостей 0,68 (0,62–0,65); внеклеточная жидкость организма — 25,9 кг (15,3–18,6 кг); индекс «талия-бедра» — 0,93 (0,81–0,96); процент жировой массы — 43,6% (18,6–24,2%). При оценке мышечного тонуса при помощи миотона показатели соответствовали нормальным значениям. Пациенту выданы рекомендации по лечебной физкультуре и диетотерапии.
Обращало на себя внимание, что при поступлении пациент не предъявлял жалоб на нарушение сна, хотя до операции его беспокоил храп. В связи с наличием морбидного ожирения выполнен кардиореспираторный мониторинг. Индекс апноэ-гипопноэ составил 47,6 событий/ч при норме до 5 событий/ч, что соответствует тяжелой степени апноэ (из них 39,2 обструктивных событий/ч). Храп составил всего лишь 3% от всей записи. Среднее значение насыщения крови кислородом составило 92% (при норме 94–98% в ночное время), минимальное снижение сатурации — до 70%. Средняя длительность апноэ по 16 сек., максимально — до 53 сек (рис. 5).
Пациенту рекомендована терапия двухуровневым положительным давлением в дыхательных путях либо постоянным положительным давлением.
Проведен скрининг осложнений акромегалии и ожирения, подтвержден вторичный гипогонадотропный гипогонадизм: ЛГ — 1,5 Ед/л (2,511,0), ФСГ — 4,8 Ед/л (1,6–9,7), тестостерон — 6,37 нмоль/л (11,00–28,2). Рекомендован контроль после нормализации массы тела. В биохимическом анализе крови отмечалось повышение уровня мочевой кислоты — 478,4 мкмоль/л (202,0–416,0), рекомендовано ограничение продуктов, содержащих пуриновые основания. Данных за наличие вторичного гипотиреоза, вторичной надпочечниковой недостаточности, нарушение углеводного, липидного обменов не получено.

Рисунок 1. МРТ головного мозга пациента Д. с внутривенным контрастированием:
в полости турецкого седла, в супраселлярной цистерне, в области дна третьего желудочка, в правом кавернозном синусе, в пазухах основной кости имеется многоузловое объемное образование неоднородной структуры размерами: вертикальный — 36 мм, поперечный — 33 мм, переднезадний — 26 мм, образование деформирует, смещает и компримирует хиазму, деформирует медиальную стенку левого кавернозного синуса; при контрастном усилении характеризуется сниженным (по сравнению с тканью аденогипофиза) накоплением контрастного препарата.
Figure 1. Brain MRI scan with intravenous contrast of the parient D.:
Multinodular tumor of nonhomogenous structure in the sella, suprasellar cistern, bottom of the 3rd ventricle, right cavernous sinus, sinuses of the sphenoid bone, 36x33x26 mm in size (vertical – transverse – anteroposterior), the tumor deforms, displaces and compresses the optic chiasm, deforms th medial wall of the left cavernous sinus, with less intensive contrast accumulation compared to the anterior pituitary.
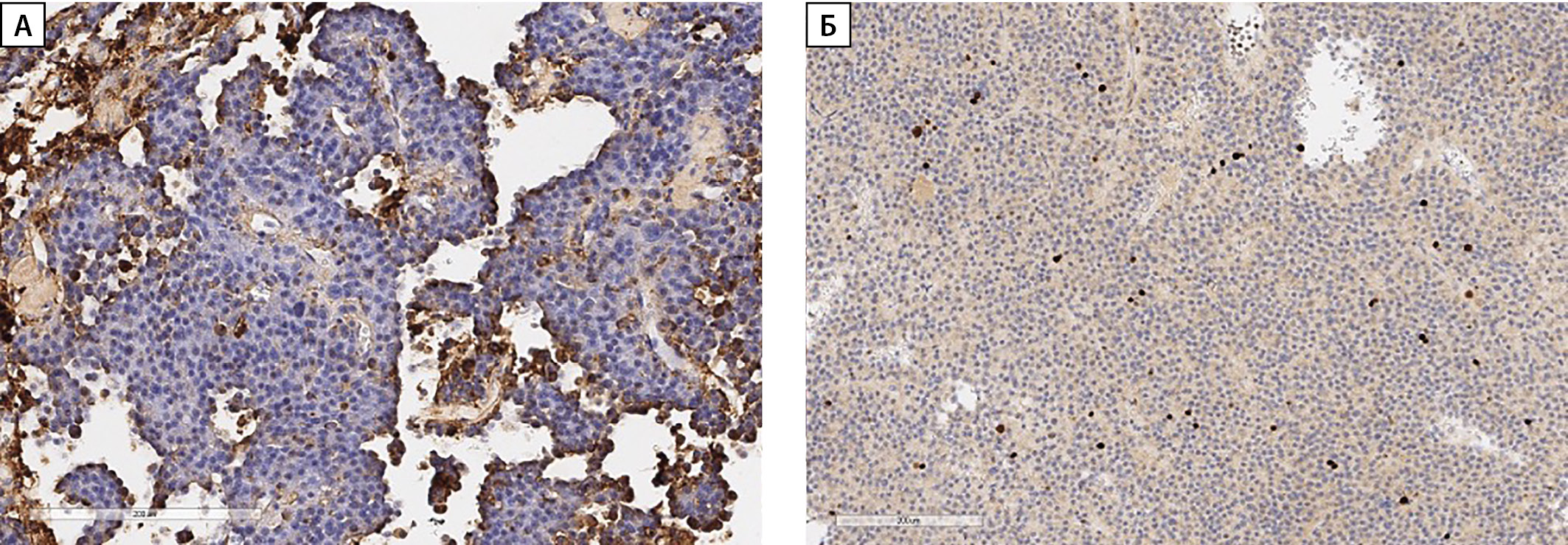
Рисунок 2. Иммуногистохимическое исследование ткани аденомы гипофиза пациента Д.
а — окрашивание цитоплазмы опухолевых клеток с антителами к СТГ; б — Ki-67.
Figure 2. Immunohistochemical analysis of the tissue of the pituitary adenoma of the patient D.
a — staining of the cytoplasm of the tumor cells with GH antibodies; b — Ki-67.

Рисунок 3. а, в — изменения внешности пациента Д. по типу «акромегалоидных»; б — избыточное развитие подкожно-жировой клетчатки и висцерального жира.
Figure 3. a, c — “acromegaloid” appearance changes of the patient D; b — excessive subcutaneous and visceral fat.

Рисунок 4. МРТ головного мозга с внутривенным контрастированием пациента Д: в полости турецкого седла с пара- (D, Knosp 2), анте-, инфраселлярным распространением определяется объемное кистозно-солидное образование неправильной формы (кистозный компонент преобладает) размерами до (вертикальный — поперечный — переднезадний) 18×14×20 мм, при контрастном усилении солидный компонент замедленно накапливает контрастный препарат (относительно ткани аденогипофиза).
Figure 4. Brain MRI scan with intravenous contrast of the patient D: cystic-solid tumor of irregular shape (with predominance of cystic compenent) in the sella with para-(D, Knosp 2), ante- infrasellar growth, 18x14x20 mm in size (vertical – transverse – anteroposterior), the solid component accumulates the contrast slower than the anterior pituitary.

Рисунок 5. Запись кардиореспираторного мониторинга пациента Д. с помощью прибора SOMNOcheck micro CARDIO с регистрацией назального дыхания с помощью назальной канюли, храпа, пульса и сатурации.
Figure 5. Cardiorespiratory test of the patient D. with SOMNOcheck micro CARDIO device with the registration of the nasal breathing with the nasal cannula, snoring, pulse and saturation.
ОБСУЖДЕНИЕ
В доступной нам литературе недостаточно данных о распространенности ожирения при гиперпродукции СТГ и корреляции ИМТ в зависимости от активности акромегалии.
Коморбидность пациентов с акромегалией и ожирением может проявляться в виде метаболических нарушений, поражения сердечно-сосудистой, дыхательной систем и опорно-двигательного аппарата.
В нашем клиническом случае демонстрируется сочетание наличия гипогонадизма, нарушения пуринового обмена и синдром обструктивного апноэ сна тяжелой степени. Пациенты с акромегалией обладают особенностями композиционного состава тела, что требует не только расчета ИМТ, но и привлечения инструментальных методов обследования. К такому способу относится биоимпедансометрия, при помощи которой можно проанализировать не только наличие жировой массы тела, но и количество жидкости в организме, мышц, что и оценено у нашего пациента. По результатам биоимпедансометрии наблюдается выраженная задержка воды (64,0 кг), преобладание не только жира, но и скелетно-мышечной массы (40,1 кг). Необходимо учитывать данные особенности при подборе диетотерапии, индивидуальной физической нагрузки и оценки динамики снижения массы тела у пациентов с акромегалией.
Особенности повышенной массы тела у данной когорты пациентов обусловлены различными эффектами гормона роста на органы и ткани. Так, натрий-удерживающее действие СТГ и ИФР-1 в дистальных канальцах почек ответственно за увеличение внеклеточного объема, что способствует отеку мягких тканей у пациентов с акромегалией [4]. СТГ относится к одному из гормонов, являющихся «регуляторами» жирового обмена, наряду с инсулином, простагландинами, вазопрессином, катехоламинами, глюкагоном и адренокортикотропным гормоном [5]. В частности, СТГ обладает доказанным липолитическим эффектом [6], тем самым способствуя увеличению массы висцерального жира и прогрессированию ожирения у пациентов с акромегалией.
Инсулинорезистентность (ИР) при этом нейроэндокринном заболевании развивается вне зависимости от наличия повышенной массы тела, обусловлена в первую очередь инсулин-антагонистическими и липолитическими эффектами СТГ [7]. Древаль А.В. и соавт. проанализировали особенности углеводного обмена у пациентов с акромегалией и выявили, что в активной стадии даже при отсутствии нарушений углеводного обмена наблюдаются выраженное увеличение печеночной ИР и снижение периферической чувствительности к инсулину [8].
Акромегалия влияет и на другие виды обмена веществ, в том числе метаболизм пуриновых оснований, что демонстрируется и в нашем клиническом случае. Обращает на себя внимание, что уровень мочевой кислоты (МК) у пациента до операции был в референсном диапазоне. Можно выдвинуть предположение, что набор массы тела на 10 кг с момента хирургического лечения сыграл непосредственную роль в ухудшении пуринового обмена. Это наглядно показывает взаимосвязь активной стадии акромегалии в прогрессировании ожирения, что повлекло за собой метаболические нарушения.
МК является конечным продуктом метаболизма пуринов в организме человека, и дисбаланс между выработкой и выведением приводит к нарушению уровня МК в сыворотке крови. В немногих исследованиях изучался молекулярный механизм СТГ и ИФР-1, лежащий в основе влияния метаболизма МК. Ранее было высказано предположение, что в печени и почках мышей импульсный СТГ подавляет экспрессию GLUT9 по пути JAK2/STAT5b. Однако необходимо учитывать различия в функции и локализации GLUT9 в печени мыши и человека. Что касается ИФР-1, недавнее исследование показало, что он стимулирует транспорт МК, опосредованный GLUT9, OAT1, OAT3, ABCG2 и ABCC4 через пути Akt и ERK, одновременно ингибируя влияние инсулина на GLUT9a [9].
Известно, что СТГ стимулирует рост костей и мышц, увеличивая синтез и тормозя распад белка, уменьшает содержание жира (особенно в области живота) за счет стимуляции высвобождения и окисления свободных жирных кислот (СЖК), что, в свою очередь, ведет к сохранению нежировой массы тела. Таким образом, наиболее выраженным эффектом СТГ на жировой обмен является заметное усиление липолиза с высвобождением СЖК, что подтверждается наличием ожирения при дефиците СТГ и повышением нежировой массы тела при его избытке [10], как в случае большинства пациентов с акромегалией.
Изменения композиционного состава тела у пациентов так уникально, что в одном из исследований предложен специфический термин — акромегалическая липодистрофия. Липодистрофия, инициируемая характерной дисрегуляцией жировой ткани, вызванной СТГ, обусловлена резистентностью к инсулину при сниженной висцеральной жировой массе, внутрипеченочных липидов и их перераспределением, что приводит к эктопическому отложению липидов в мышцах [11].
Повышенная масса тела у пациентов с акромегалией в свою очередь усугубляет течение уже существующих осложнений или увеличивает риск возникновения новых.
Ожирение является одним из основных факторов риска апноэ сна, с отношением шансов возникновения заболевания 4:10 по сравнению с общей популяцией [12]. В то же время значительная часть пациентов с акромегалией (до 80% по данным Celik et al.) имеют значимые нарушения, прежде всего синдром обструктивного апноэ сна (СОАС). В отличие от популяции пациентов с ожирением, СОАС у пациентов с акромегалией обусловлен не избыточным отложением жировой ткани в области верхних дыхательных путей, а макроглоссией и утолщением голосовых складок, вызванных избытком СТГ [13]. Деформации скелета лица (в основном увеличение нижней челюсти) и утолщение глотки/языка обусловлены отложением гликозаминогликанов и увеличением выработки коллагена соединительной тканью. Отек тканей также способствует возникновению СОАС и вызван повышенной почечной реабсорбцией натрия из-за прямой стимуляции эпителиальных натриевых каналов СТГ и ИФР-1 [14].
Синдром гиповентиляции при ожирении (синдром Пиквика) — это состояние, при котором люди с избыточным весом не могут дышать достаточно быстро или глубоко, что приводит к низкому уровню кислорода и высокому уровню углекислого газа в крови. Синдром часто связан с СОАС, которое вызывает периоды отсутствия или снижения дыхания во сне, что приводит к многочисленным частичным пробуждениям ночью и сонливости днем. Наличие гиповентиляции и гиперкапнии предрасполагает к дальнейшему прогрессированию ожирения за счет гиперфагии, повышенной сонливости днем и, таким образом, сниженной физической активности [15].
Lecube А. et al. представили интересный клинический случай пациентки с акромегалией и морбидным ожирением, у которой наблюдалось нарушение углеводного обмена и СОАС. Ей было проведено бариатрическое лечение, вследствие которого в дальнейшем отменены сахароснижающие препараты и лечение двухуровневым положительным давлением в дыхательных путях [16]. Данное наблюдение демонстрирует возможность компенсации осложнений акромегалии и ожирения с помощью хирургического лечения ожирения, что требует дополнительных исследований. В нашем клиническом случае стоит обратить внимание, что, несмотря на отсутствие жалоб на храп, у пациента, по данным кардиореспираторного мониторинга, выявлены снижение сатурации максимально до 70% и апноэ продолжительностью до 53 секунд. Таким пациентам необходимо рекомендовать дальнейшее лечение двухуровневым положительным давлением в дыхательных путях либо постоянным положительным давлением с наблюдением сомнолога.
Гипогонадизм у мужчин — состояние, связанное с пониженным уровнем тестостерона, способное оказывать негативное воздействие на множество органов и систем, ухудшающее качество жизни. Это частое осложнение акромегалии, наблюдающееся у 30–50% пациентов с СТГ-продуцирующей аденомой гипофиза [17]. Одним из эффектов андрогенов является мобилизация жировой ткани, что противодействует увеличению висцерального жира. У пациентов с гипогонадизмом низкий уровень тестостерона ухудшает липолиз в адипоцитах и способствует увеличению жировых отложений, прежде всего висцеральных [18]. В то же время повышенная конверсия тестостерона в эстрадиол ферментом ароматазой жировой ткани ведет к дальнейшему снижению уровня тестостерона и усугублению гипогонадизма [19]. Известно, что акромегалия способна послужить причиной снижения уровня тестостерона посредством различных механизмов, таких как масс-эффект образований гипофиза на гонадотрофы, а также за счет повышения уровня пролактина сыворотки крови. Это создает необходимость в мультидисциплинарном подходе при лечении гипогонадизма у пациентов с акромегалией, направленном как на устранение клинических симптомов основного заболевания и ликвидацию источника повышенной секреции СТГ, так и на планомерное снижение массы тела пациентов с целью снижения конверсии тестостерона в эстрадиол [20].
Помимо коррекции осложнений, обусловленных наличием ожирения, необходимо учитывать особенности медикаментозного лечения акромегалии.
Нашему пациенту во время госпитализации инициирована терапия антагонистом гормона роста в дозировке 40 мг однократно, с дальнейшим переходом, учитывая ИМТ, на 15 мг в сутки. По данным литературы, вопрос зависимости дозы пэгвисоманта от степени ожирения уже вызывал интерес у исследователей. Так, в исследовании Ragonese M. et al. продемонстрирована необходимость введения повышенных доз пэгвисоманта пациентам с ИМТ более 30 кг/м2 в сравнении с пациентами с избыточной или нормальной массой тела, следствием чего была более низкая частота достижения контроля заболевания у лиц с ожирением [21]. Известно, что СТГ снижает экспрессию гена лептина при висцеральном ожирении, а при акромегалии уровни циркулирующего лептина низкие и повышаются после хирургического лечения или терапии пэгвисомантом [22].
В исследовании Bredella M.A. et al. выявлено, что биохимический контроль акромегалии улучшил чувствительность к инсулину, но привел к менее благоприятному антропометрическому фенотипу с повышенным уровнем внутрипеченочных липидов с абдоминальным ожирением и снижением мышечной массы [23]. некоторых исследованиях указано, что изменение в составе тела у пациентов с акромегалией после лечения зависит от пола. Так, в исследовании Reyes-Vidal C.M. количество висцеральной и подкожной жировой клетчатки увеличилjсь в большей степени у мужчин, чем у женщин, и в то же время у мужчин снизилась скелетная мышечная масса после оперативного вмешательства [24].
Заключение
Несмотря на известные патофизиологические механизмы, обуславливающие развитие осложнений акромегалии, возникающая сопутствующая патология, в том числе морбидное ожирение и синдром гиповентиляции, оказывают значительное влияние на тяжесть состояния пациента.
Представленный клинический случай демонстрирует необходимость проведения дополнительных методов обследования, в т.ч. кардиореспираторного мониторинга при акромегалии, даже при условии отсутствия характерных жалоб пациента, а также необходимость мультимодального лечения, направленного на различные патогенетические пути.
Дополнительная информация
Источники финансирования. Работа выполнена в рамках НИОКТР №122012100180-0.
Конфликт интересов. Л.К. Дзеранова — заведующая редакцией журнала «Ожирение и метаболизм»; Е.А. Пигарова — член редакционной коллегии журнала «Ожирение и метаболизм».
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациента. Авторы настоящей статьи получили письменное согласие от пациента на публикацию фотографий и медицинских данных, упоминаемых в статье, в журнале «Ожирение и мметаболизм».
Список литературы
1. Мокрышева Н.Г. Борьба с ожирением как фокус развития здравоохранения // Ожирение и метаболизм. — 2022. — Т. 19. — №1. — С. 4-6. doi: https://doi.org/10.14341/omet12865
2. Пржиялковская Е.Г., Мокрышева Н.Г., Трошина Е.А., Мельниченко Г.А., Дедов И.И., и др. Клинические рекомендации «Акромегалия» (проект) // Ожирение и метаболизм. — 2024. — Т. 21. — №2. — С. 215-249. doi: https://doi.org/10.14341/omet13153
3. Kubota N, Yano W, Kubota T, Yamauchi T, Itoh S, et al. Adiponectin stimulates AMP-activated protein kinase in the hypothalamus and increases food intake. Cell Metab. 2007;6(1):55-68. doi: https://doi.org/10.1016/j.cmet.2007.06.003
4. Kamenický P, Mazziotti G, Lombès M, Giustina A, Chanson P. Growth hormone, insulin-like growth factor-1, and the kidney: pathophysiological and clinical implications. Endocr Rev. 2014;35(2):234-81. doi: https://doi.org/10.1210/er.2013-1071
5. Zhang D, Wei Y, Huang Q, et al. Important Hormones Regulating Lipid Metabolism. Molecules. 2022. doi: https://doi.org/10.3390/molecules27207052
6. Kopchick JJ, Berryman DE, Puri V, Lee KY, Jorgensen JOL. The effects of growth hormone on adipose tissue: old observations, new mechanisms. Nat Rev Endocrinol. 2020;16(3):135-146. doi: https://doi.org/10.1038/s41574-019-0280-9
7. Esposito D, Boguszewski CL, Colao A, Fleseriu M, Gatto F, et al. Diabetes mellitus in patients with acromegaly: pathophysiology, clinical challenges and management. Nat Rev Endocrinol. 2024;20(9):541-552. doi: https://doi.org/10.1038/s41574-024-00993-x
8. Древаль А.В., Триголосова И.В., Виноградова А.В., Иловайская И.А., Тишенина Р.С. Особенности нарушения углеводного обмена при акромегалии в зависимости от проводимого лечения // Ожирение и метаболизм. — 2013. — Т. 10. — №4. — С. 21-25. doi: https://doi.org/10.14341/omet2013421-25
9. Mandal AK, Leask MP, Sumpter NA, Choi HK, Merriman TR, Mount DB. Genetic and physiological effects of insulin-like growth factor-1 (IGF-1) on human urate homeostasis. J Am Soc Nephrol. 2023;34(3):451–466. doi: https://doi.org/10.1681/ASN.0000000000000054
10. Yuen KC, Dunger DB. Therapeutic aspects of growth hormone and insulin-like growth factor-I treatment on visceral fat and insulin sensitivity in adults. Diabetes Obes Metab. 2007;9(1):11-22. doi: https://doi.org/10.1111/j.1463-1326.2006.00591.x.
11. Freda PU. The acromegaly lipodystrophy. Front Endocrinol (Lausanne). 2022;13:933039. doi: https://doi.org/10.3389/fendo.2022.933039
12. Gottlieb DJ, Punjabi NM. Diagnosis and management of obstructive sleep apnoea: a review. JAMA. 2020; 323(14): 1389-1400
13. Khiyami A, Fazeli P, Mahmud H, Gardner P, Zenonos G. ODP319 IGF-1 and BMI are Associated in Obese Patients with Acromegaly. J Endocr Soc. 2022;6(Supplement_1):A494-A495. doi: https://doi.org/10.1210/jendso/bvac150.1028
14. Akset M, Poppe KG, Kleynen P, Bold I, Bruyneel M. Endocrine disorders in obstructive sleep apnoea syndrome: A bidirectional relationship. Clin Endocrinol (Oxf). 2023;98(1):3-13. doi: https://doi.org/10.1111/cen.14685
15. Khan SA, Ram N, Masood MQ, Islam N. Prevalence of comorbidities among patients with Acromegaly. Pak J Med Sci. 2021;37:1758–61
16. Lecube A, Vilallonga R, Sturniolo G, Obiols G, Fort JM. Renaissance of acromegaly after bariatric surgery. Endocrine. 2013;43(1):239-41. doi: https://doi.org/10.1007/s12020-012-9759-z
17. Pasquali R. Obesity and androgens: facts and perspectives. Fertil Steril. 2006;85(5):1319-1340. doi: https://doi.org/10.1016/j.fertnstert.2005.10.054
18. Genchi VA, Rossi E, Lauriola C, D’Oria R, Palma G, et al. Adipose Tissue Dysfunction and Obesity-Related Male Hypogonadism. Int J Mol Sci. 2022;23(15):8194. doi: https://doi.org/10.3390/ijms23158194
19. Salvio G, Martino M, Balercia G, et al. Acromegaly and male sexual health. Rev Endocr Metab Disord. 2022;23:671–678. doi: https://doi.org/10.1007/s11154-022-09721-0
20. Mokhlesi B. Obesity hypoventilation syndrome: a state-of-the-art review. Respir Care. 2010;55(10):1347-62
21. Ragonese M, Grottoli S, Maffei P, Alibrandi A, Ambrosio MR, et al. How to improve effectiveness of pegvisomant treatment in acromegalic patients. J Endocrinol Invest. 2018;41(5):575-581. doi: https://doi.org/10.1007/s40618-017-0773-0
22. Parkinson C, Whatmore AJ, Yates AP, Drake WM, Brabant G, et al. The effect of pegvisomant-induced serum IGF-I normalization on serum leptin levels in patients with acromegaly. Clin Endocrinol (Oxf). 2003;59(2):168-74. doi: https://doi.org/10.1046/j.1365-2265.2003.01795.x
23. Bredella MA, Schorr M, Dichtel LE, Gerweck AV, Young BJ, et al. Body Composition and Ectopic Lipid Changes With Biochemical Control of Acromegaly. J Clin Endocrinol Metab. 2017;102(11):4218-4225. doi: https://doi.org/10.1210/jc.2017-01210
24. Reyes-Vidal CM, Mojahed H, Shen W, Jin Z, Arias-Mendoza F, et al. Adipose Tissue Redistribution and Ectopic Lipid Deposition in Active Acromegaly and Effects of Surgical Treatment. J Clin Endocrinol Metab. 2015;100(8):2946-55. doi: https://doi.org/10.1210/jc.2015-1917
Об авторах
Г. Д. ГабаидзеРоссия
Габаидзе Георгий Джемалович.
117292, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Нет
М. А. Перепелова
Россия
Перепелова Маргарита Александровна.
Москва
Конфликт интересов:
Нет
Е. Г. Пржиялковская
Россия
Пржиялковская Елена Георгиевна - к.м.н.
Москва
Конфликт интересов:
Нет
Е. А. Пигарова
Россия
Пигарова Екатерина Александровна - д.м.н.
Москва
Конфликт интересов:
Е.А. Пигарова — член редакционной коллегии журнала «Ожирение и метаболизм»
А. Г. Кузьмин
Россия
Кузьмин Анатолий Геннадьевич - к.м.н.
Москва
Конфликт интересов:
Нет
О. И. Венгржиновская
Россия
Венгржиновская Оксана Игоревна.
Москва
Конфликт интересов:
Нет
А. М. Лапшина
Россия
Лапшина Анастасия Михайловна - к.м.н.
Москва
Конфликт интересов:
Нет
Л. К. Дзеранова
Россия
Дзеранова Лариса Константиновна - д.м.н.
Москва
Конфликт интересов:
Л.К. Дзеранова — заведующая редакцией журнала «Ожирение и метаболизм»
Дополнительные файлы
|
|
1. Рисунок 1. МРТ головного мозга пациента Д. с внутривенным контрастированием: в полости турецкого седла, в супраселлярной цистерне, в области дна третьего желудочка, в правом кавернозном синусе, в пазухах основной кости имеется многоузловое объемное образование неоднородной структуры размерами: вертикальный — 36 мм, поперечный — 33 мм, переднезадний — 26 мм, образование деформирует, смещает и компримирует хиазму, деформирует медиальную стенку левого кавернозного синуса; при контрастном усилении характеризуется сниженным (по сравнению с тканью аденогипофиза) накоплением контрастного препарата. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(224KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Иммуногистохимическое исследование ткани аденомы гипофиза пациента Д. а — окрашивание цитоплазмы опухолевых клеток с антителами к СТГ; б — Ki-67. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(553KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. а, в — изменения внешности пациента Д. по типу «акромегалоидных»; б — избыточное развитие подкожно-жировой клетчатки и висцерального жира | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(365KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. МРТ головного мозга с внутривенным контрастированием пациента Д: в полости турецкого седла с пара- (D, Knosp 2), анте-, инфраселлярным распространением определяется объемное кистозно-солидное образование неправильной формы (кистозный компонент преобладает) размерами до (вертикальный — поперечный — переднезадний) 18×14×20 мм, при контрастном усилении солидный компонент замедленно накапливает контрастный препарат (относительно ткани аденогипофиза) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(275KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Запись кардиореспираторного мониторинга пациента Д. с помощью прибора SOMNOcheck micro CARDIO с регистрацией назального дыхания с помощью назальной канюли, храпа, пульса и сатурации | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(260KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Габаидзе Г.Д., Перепелова М.А., Пржиялковская Е.Г., Пигарова Е.А., Кузьмин А.Г., Венгржиновская О.И., Лапшина А.М., Дзеранова Л.К. Морбидное ожирение у пациента с акромегалией: клинический случай. Ожирение и метаболизм. 2024;21(3):331-338. https://doi.org/10.14341/omet13182
For citation:
Gabaidze G.D., Perepelova M.A., Przhiyalkovskaya E.G., Pigarova E.A., Kuzmin A.G., Vengrzhinovskaya O.I., Lapshina A.M., Dzeranova L.K. Obesity in a patient with acromegaly: a case report. Obesity and metabolism. 2024;21(3):331-338. (In Russ.) https://doi.org/10.14341/omet13182

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































