Перейти к:
Клинические рекомендации «Акромегалия» (проект)
https://doi.org/10.14341/omet13153
Аннотация
Всем пациентам с характерными изменениями внешности рекомендуется исключать акромегалию (А3). Всем пациентам без характерных изменений внешности при наличии нескольких подозрительных в отношении акромегалии клинических признаков рекомендуется исключать акромегалию (B3). Всем пациентам c аденомой гипофиза рекомендуется исключать акромегалию (B3). У всех пациентов с пролактин-секретирующими аденомами рекомендуется исключать акромегалию (C4). Всем пациентам для лабораторного подтверждения акромегалии рекомендуется исследование уровня инсулиноподобного фактора роста-1 (ИФР-1, соматомедина С) в крови (A3). У пациентов без явных клинических признаков акромегалии и/или с умеренным повышением уровня ИФР-1 (ИФР-1 индекс менее 1,3), для лабораторного подтверждения акромегалии рекомендуется определение реакции соматотропного гормона (СТГ) на гипергликемию (СТГ в ходе перорального глюкозотолерантного теста) (B3). Всем пациентам при лабораторном подтверждении акромегалии рекомендуется проведение магнитно-резонансной томографии гипофиза с внутривенным контрастированием для определения размера, расположения и характера роста аденомы гипофиза (A3). Всем пациентам с подтвержденной акромегалией рекомендуется исследование уровня глюкозы в крови и исследование уровня гликированного гемоглобина в крови для выявления нарушений углеводного обмена (B3). Всем пациентам с акромегалией рекомендуется исследование уровня пролактина в крови для исключения гиперпролактинемии (B3).
Всем пациентам с акромегалией и аденомой гипофиза в качестве первой линии лечения рекомендуется проведение трансназальной транссфеноидальной аденомэктомии при согласии пациента и отсутствии противопоказаний (A1). Всем пациентам с акромегалией, которым показано нейрохирургическое лечение, проведение оперативного вмешательства рекомендуется в специализирующихся на заболеваниях гипофиза медицинских учреждениях нейрохирургами, выполняющими не менее 50 подобных операций в год (A3). Всем пациентам с акромегалией после нейрохирургического лечения рекомендуется морфологическое и иммуногистохимическое исследование удаленной аденомы гипофиза (A3). Рутинное назначение медикаментозной терапии акромегалии перед проведением оперативного вмешательства для уменьшения размера опухоли не рекомендуется (B2).
Пациентам с акромегалией, у которых нейрохирургическое лечение было невозможно, неэффективно, а также ожидающим эффект лучевой терапии рекомендована медикаментозная терапия (A1). В качестве первой линии медикаментозной терапии акромегалии рекомендуется применение аналогов соматостатина пролонгированного действия первого поколения (A1). При частичной/полной резистентности к аналогам соматостатина или их непереносимости в качестве второй линии медикаментозной терапии акромегалии рекомендуется назначение пэгвисоманта (A1). Пациентам с акромегалией для инициации терапии пэгвисомантом рекомендуется однократно ввести нагрузочную дозу 40–80 мг в сутки подкожно, далее продолжать инъекции в стартовой дозе 10 или 15 мг в сутки с контролем уровня ИФР-1 через 4–6 недель и коррекцией дозы при необходимости (B2). Пациентам с акромегалией и умеренным повышением уровня ИФР-1 рекомендуется назначение каберголина в качестве медикаментозной монотерапии или при неэффективности аналогов соматостатина — в комбинации с ними (B2).
Пациентам с акромегалией в случаях сохранения активности заболевания после хирургического лечения, при недоступности, непереносимости или неэффективности медикаментозного лечения и нецелесообразности повторного нейрохирургического вмешательства рекомендуется проводить лучевую терапию (A1). Рекомендуется мультидисциплинарный подход в лечении осложнений акромегалии (C3).
Ключевые слова
Для цитирования:
Пржиялковская Е.Г., Мокрышева Н.Г., Трошина Е.А., Мельниченко Г.А., Дедов И.И., Анциферов М.Б., Астафьева Л.И., Бардымова Т.П., Белая Ж.Е., Вагапова Г.Р., Воротникова С.Ю., Григорьев А.Ю., Гринева Е.Н., Дзеранова Л.К., Иловайская И.А., Калинин П.Л., Лапшина А.М., Луценко А.С., Мамедова Е.О., Марова Е.И., Перепелова М.А., Пигарова Е.А., Пронин В.С., Рожинская Л.Я., Трунин Ю.Ю., Шутова А.С. Клинические рекомендации «Акромегалия» (проект). Ожирение и метаболизм. 2024;21(2):215-249. https://doi.org/10.14341/omet13153
For citation:
Przhiyalkovskaya E.G., Mokrysheva N.G., Troshina E.A., Melnichenko G.A., Dedov I.I., Antsiferov M.B., Astafieva L.I., Bardymova T.P., Belaya Zh.E., Vagapova G.R., Vorotnikova S.Yu., Grigoriev A.Yu., Grineva E.N., Dzeranova L.K., Ilovaiskaya I.A., Kalinin P.L., Lapshina A.M., Lutsenko A.S., Mamedova E.O., Marova E.I., Perepelova M.A., Pigarova E.A., Pronin V.S., Rozhinskaya L.Ya., Trunin Yu.Yu., Shutova A.S. Guidelines on diagnostics and treatment of acromegaly (draft). Obesity and metabolism. 2024;21(2):215-249. (In Russ.) https://doi.org/10.14341/omet13153
СПИСОК СОКРАЩЕНИЙ
- АГ — артериальная гипертензия
- ДР2 — дофаминовые рецепторы 2 типа
- ИФР-1 — инсулиноподобный фактор роста 1
- КТ — компьютерная томография
- ЛГ — лютеинизирующий гормон
- ЛПНП — липопротеиды низкой плотности
- ЛПВП — липопротеиды высокой плотности
- МКБ 10 — Международная классификация 10 пересмотра
- МРТ — магнитно-резонансная томография
- МЭН-1 — синдром множественной эндокринной неоплазии 1 типа
- МЭН-4 — синдром множественной эндокринной неоплазии 4 типа
- ПГТТ — пероральный глюкозотолерантный тест
- свТ4 — свободный тироксин
- СР2 — соматостатиновые рецепторы 2 подтипа
- СТГ — соматотропный гормон (гормон роста)
- ФСГ — фолликулостимулирующий гормон
- 3DCRT — трехмерная конформная лучевая терапия
- CPAP — терапия — метод лечения ночного апноэ посредством создания постоянного положительного давления в дыхательных путях (Continuous Positive Airway Pressure)
- FIPA — семейные изолированные аденомы гипофиза (Familial Isolated Pituitary Adenomas)
- HbA1c — гликированный гемоглобин
- ** — двумя звездочками выделено наименование лекарственного препарата, если он внесен в перечень «Жизненно необходимые и важнейшие лекарственные препараты»
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Акромегалия — это тяжелое нейроэндокринное заболевание, обусловленное хронической гиперпродукцией гормона роста (СТГ, соматотропного гормона) у лиц с закончившимся физиологическим ростом.
Аналоги соматостатина — клинико-фармакологическая группа лекарственных препаратов, являющихся синтетическими производными естественного гормона соматостатина. Аналоги соматостатина подавляют повышенную секрецию гормонов гипофиза, а также секрецию пептидов гастро-энтеропанкреатической системы.
Гипофизарный гигантизм — заболевание, обусловленное хронической гиперпродукцией СТГ, возникшей в детстве или в подростковом возрасте, когда эпифизарные зоны роста еще открыты. При гигантизме происходит избыточный пропорциональный рост костей скелета в длину, что ведет к значительному увеличению линейного роста пациента.
Дискордантность — несоответствие лабораторных показателей активности акромегалии (СТГ и ИФР-1). Выделяют два вида дискордантности: повышение уровня ИФР-1 при целевых цифрах СТГ и повышение содержания СТГ/отсутствие подавления СТГ в ходе ПГТТ при достижении референсных показателей ИФР-1.
Инциденталома гипофиза — объёмное образование гипофиза, случайно выявленное с помощью лучевых методов диагностики, не сопровождающееся явными клиническими симптомами нарушения гормональной секреции.
ИФР-1 индекс — соотношение уровня ИФР-1 к верхнему референсному значению в соответствии с полом и возрастом. Применение ИФР-1 индекса позволяет унифицировать оценку активности акромегалии с учетом возрастных изменений уровня ИФР-1 и межлабораторных референсных различий.
Карни комплекс — это наследственный синдром, для которого характерна пигментация кожи, миксомы сердца, узелковая гиперплазия надпочечников с развитием синдрома Иценко-Кушинга, опухоли гипофиза, патология яичек, шванномы и другие проявления. Около 75% пациентов с Карни комплексом имеют гиперсекрецию гормона роста, однако не всегда она клинически проявляется акромегалией
Макроаденома гипофиза — доброкачественная опухоль из клеток аденогипофиза, максимальный диаметр которой равен или превышает 10 мм, с возможным развитием компрессии соседних структур.
Масс-эффект опухоли — сдавление опухолевой тканью окружающих здоровых тканей с развитием патологических процессов.
Микроаденома гипофиза — доброкачественная опухоль из клеток аденогипофиза, максимальный диаметр которой не превышает 10 мм.
Прогнатизм — это зубочелюстная аномалия, при которой верхние и нижние резцы перекрываются. Для акромегалии характерен мандибулярный прогнатизм — выдвижение нижней челюсти вперед.
Антагонист рецептора гормона роста — лекарственный препарат для лечения акромегалии, представляющий собой генно-инженерную модифицированную молекулу гормона роста, которая активно взаимодействует с одной из субъединиц димеризованного рецептора СТГ и блокирует стимуляцию другой субъединицы, препятствуя, таким образом, нормальному функционированию рецептора, передаче сигнала и биологическому действию гормона роста в периферических тканях.
Синдром МакКьюна-Олбрайта — наследственный синдром, для которого характерна фиброзная дисплазия, пятна «кофе с молоком» на коже и различные эндокринные заболевания. Акромегалия встречается у 20% пациентов с этим синдромом. Причиной заболевания является стимулирующая мутация в гене GNAS, кодирующем стимулирующую альфа-субъединицу G-белка. Соматотропиномы в рамках этого синдрома редко имеют инвазивный рост и чувствительны к лечению. Методом выбора является медикаментозная терапия, так как нейрохирургическое вмешательство технически затруднено в связи с патологией костей черепа. Лучевая терапия сопряжена с риском развития саркомы костей.
Синдром множественной эндокринной неоплазии типа 1 (МЭН-1) или синдром Вермера — наследственный аутосомно-доминантный синдром, обусловленный опухолями или гиперплазией нескольких эндокринных желез. Наиболее типичными компонентами МЭН-1 являются первичный гиперпаратиреоз, опухоли аденогипофиза, опухоли островковых клеток поджелудочной железы, реже опухоли надпочечников, заболевания щитовидной железы. Причиной заболевания является мутация в гене MEN1, однако примерно в 10–15% случаев у пациентов с клинической картиной МЭН-1 эта мутация не выявляется.
Синдром множественной эндокринной неоплазии типа 4 (МЭН-4) — наследственный аутосомно-доминантный синдром, обусловленный опухолями или гиперплазией нескольких эндокринных желез. Наиболее типичными компонентами МЭН-4, как и МЭН-1, являются первичный гиперпаратиреоз, опухоли аденогипофиза, другие нейроэндокринные опухоли. МЭН-4 встречается гораздо реже, чем МЭН-1. МЭН-4 развивается из-за инактивирующей мутации гена CDKN1B.
Эндоскопическая эндоназальная транссфеноидальная аденомэктомия — хирургическое удаление аденомы гипофиза с доступом через носовой ход, клиновидную пазуху и дно турецкого седла под визуальным контролем эндоскопа.
AIP — ген, кодирующий белок AIP, взаимодействующий с арилуглеводородным рецептором (Аryl-hydrocarbon Interacting Protein). Мутации в гене AIP выявляются в 40–50% семей с акромегалией в рамках семейных изолированных аденом гипофиза FIPA (Familiar Isolated Pituitary Adenoma). FIPA встречается в семьях, члены которых имеют аденомы гипофиза различной гормональной активности в отсутствии других выявленных эндокринных опухолей. Для пациентов с мутацией в гене AIP характерны ранний возраст дебюта, агрессивный и инвазивный рост опухоли с редкогранулированным типом и резистентность к терапии аналогами соматостатина первого поколения.
FIPA (Familial Isolated Pituitary Adenomas, семейные изолированные аденомы гипофиза) — это заболевание, которое характеризуются наличием аденом гипофиза у двух и более членов одной семьи в отсутствие других синдромов, ассоциированных с множественными эндокринными опухолями.
X-сцепленный акрогигантизм (X-LAG) — это вариант акрогигантизма, причиной которого является герминальная или соматическая мозаичная дупликация в гене GPR101. Для детей с этой мутацией характерен ускоренный рост в возрасте младше 5 лет, акромегалоидные черты лица, повышенный аппетит. Заболевание носит прогрессирующий характер и трудно поддается как хирургическому, так и медикаментозному лечению.
КРАТКАЯ ИНФОРМАЦИЯ ПО ЗАБОЛЕВАНИЮ
ОПРЕДЕЛЕНИЕ
Акромегалия — это медленно прогрессирующее нейроэндокринное заболевание, обусловленное избыточной секрецией гормона роста (СТГ, соматотропный гормон) и, как следствие, повышением инсулиноподобного фактора роста 1 (ИФР-1/соматомедин С) у лиц с законченным физиологическим ростом [1]. Заболевание характеризуется патологическим диспропорциональным периостальным ростом костей, хрящей, мягких тканей, внутренних органов, а также нарушением морфо-функционального состояния сердечно-сосудистой, легочной системы, периферических эндокринных желез, различных видов метаболизма [2]
При возникновении заболевания в детстве или в подростковом возрасте, когда эпифизарные зоны роста еще открыты, происходит избыточный пропорциональный рост костей скелета в длину, что ведет к значительному увеличению линейного роста пациента. Такой клинический синдром получил название гипофизарного гигантизма. Если эти пациенты не получают своевременное и адекватное лечение, то после завершения пубертатного периода у них, помимо гигантизма, развиваются все типичные симптомы акромегалии и синдром акрогигантизма [2–4].
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Более 98% пациентов с акромегалией имеют спорадическую СТГ-продуцирующую доброкачественную аденому гипофиза, возникающую из соматотрофных клеток, либо из клеток, одновременно секретирующих СТГ и пролактин [5]. Примерно в 1–2% случаев причиной акромегалии является избыточная секреция соматолиберина опухолью гипоталамуса, эктопической нейроэндокринной опухолью (наиболее часто с локализацией в легких или поджелудочной железе), а также внегипофизарная секреция СТГ (с локализацией опухоли в брюшной полости или костном мозге). Наследственные формы акромегалии, на которые приходится около 5% всех случаев, включают синдром МЭН-1, Карни комплекс, синдром Мак-Кьюна Олбрайта, семейные изолированные аденомы гипофиза (FIPA) [2][3].
Патогенез образования аденом гипофиза точно неизвестен. Имеются данные о влиянии изменения генов клеточного цикла, регулирующих передачу внутриклеточного сигнала, нарушений экспрессии факторов роста и снижения экспрессии генов-супрессоров опухолевого роста [1].
Гиперсекреция СТГ стимулирует продукцию печенью ИФР-1. ИФР-1 опосредует основные патологические эффекты СТГ. Синтез и секреция СТГ подавляются соматостатином в основном за счет его взаимодействия с соматостатиновыми рецепторами 2 подтипа (СР2) и 5 подтипа (СР5), что объясняет эффективность лечения акромегалии аналогами соматостатина первого и второго поколения [1].
ЭПИДЕМИОЛОГИЯ
Точную цифру распространенности акромегалии трудно указать в связи с тем, что от появления первых признаков акромегалии до установления диагноза проходит от 5 до 15 лет. Объединенная распространенность акромегалии по обращаемости, согласно недавнему мета-анализу составляет в среднем 5,9 (95% доверительный интервал 4,4–7,9) случаев на сто тысяч населения, а заболеваемость — 3,8 (95% доверительный интервал 3,2–4,4) случаев на миллион населения в год [6]. По данным Всероссийского регистра опухолей гипоталамо-гипофизарной области распространенность акромегалии по обращаемости варьирует в различных регионах Российской Федерации и достигает 8,65 случаев на сто тысяч жителей [7]. При активном скрининге фактическая распространенность акромегалии в 15–20 раз превышает привычные расчетные значения, следовательно, существует большая доля нераспознанных случаев акромегалии [8].
Постепенное появление симптоматики и часто медленное развитие заболевания может быть одной из причин того, что акромегалия впервые диагностируется лишь в достаточно зрелые годы, средний возраст на момент первичной диагностики заболевания составляет 50 лет [9].
Акромегалия характеризуется прогрессирующей инвалидизацией и сокращением продолжительности жизни в среднем на 10 лет. Смертность среди пациентов с акромегалией при отсутствии лечения в два раза превышает общепопуляционный уровень. Основными причинами ранней смертности и сокращения продолжительности жизни являются осложнения, вызванные длительной гиперпродукцией гормона роста: сердечно-сосудистая патология, сахарный диабет и его осложнения, заболевания органов дыхания, злокачественные новообразования желудочно-кишечного тракта и некоторых других органов. В свою очередь, своевременная диагностика и адекватное лечение акромегалии позволяют приблизить выживаемость пациентов с акромегалией к общепопуляционному уровню [10].
ОСОБЕННОСТИ КОДИРОВАНИЯ
Е22.0 — Акромегалия и гипофизарный гигантизм
D35.2 — Доброкачественное новообразование гипофиза
E31.1 — Полигландулярная гиперфункция (в случае акромегалии в рамках синдромов МЭН-1, МЭН-4, Карни комплекса)
Q78.1 — Полиостозная фиброзная дисплазия (в случае акромегалии в рамках cиндрома МакКьюна–Олбрайта)
КЛАССИФИКАЦИЯ
Акромегалию можно классифицировать в зависимости от причины возникновения, аденому гипофиза — в зависимости от размера, характера роста и морфологического строения.
В зависимости от причин различают:
- спорадическую форму;
- наследственную форму;
- эктопическую акромегалию [11].
По размеру аденом гипофиза выделяют:
- микроаденома (<10 мм);
- макроаденома (≥10 мм);
- гигантская аденома (более 60 мм) [12].
По топографо-анатомическим характеристикам аденомы гипофиза могут быть:
- эндоселлярные;
- с экстраселлярным характером роста: эндосупраселлярный рост (со зрительными нарушениями и без них), параселлярный (латероселлярный), инфраселлярный, антеселлярный, ретроселлярный.
По морфологическому строению аденомы гипофиза, согласно последней классификации опухолей ВОЗ от 2022 года, относят к нейроэндокринным опухолям гипофиза (PitNET):
- нейроэндокринная плотногранулированная соматотропная опухоль;
- нейроэндокринная редкогранулированная соматотропная опухоль;
- нейроэндокринная маммосоматотропная опухоль;
- нейроэндокринная смешанная соматотропная и лактотропная опухоль;
- нейроэндокринная зрелая плюригормональная опухоль PIT1-линии;
- нейроэндокринная незрелая плюригормональная опухоль PIT1-линии;
- нейроэндокринная ацидофильная опухоль из стволовых клеток [13].
КЛИНИЧЕСКАЯ КАРТИНА АКРОМЕГАЛИИ
Клиническая картина акромегалии складывается из множественных системных проявлений, обусловленных длительной гиперпродукцией СТГ и ИФР-1, и последствий давления (масс-эффекта) соматотропиномы на окружающие ткани. Наиболее яркими клиническими проявлениями акромегалии являются изменения внешности: огрубление черт лица, кожные складки, увеличение размера и расширение кистей, стоп, увеличение межзубных промежутков (диастема), изменение прикуса (прогнатизм). Неспецифические проявления акромегалии включают головную боль, повышенную потливость, общую слабость и утомляемость, онемение в кончиках пальцев, боли в суставах, нарушения менструального цикла у женщин [14]. Распространенность клинических проявлений акромегалии представлена на рисунке 1.
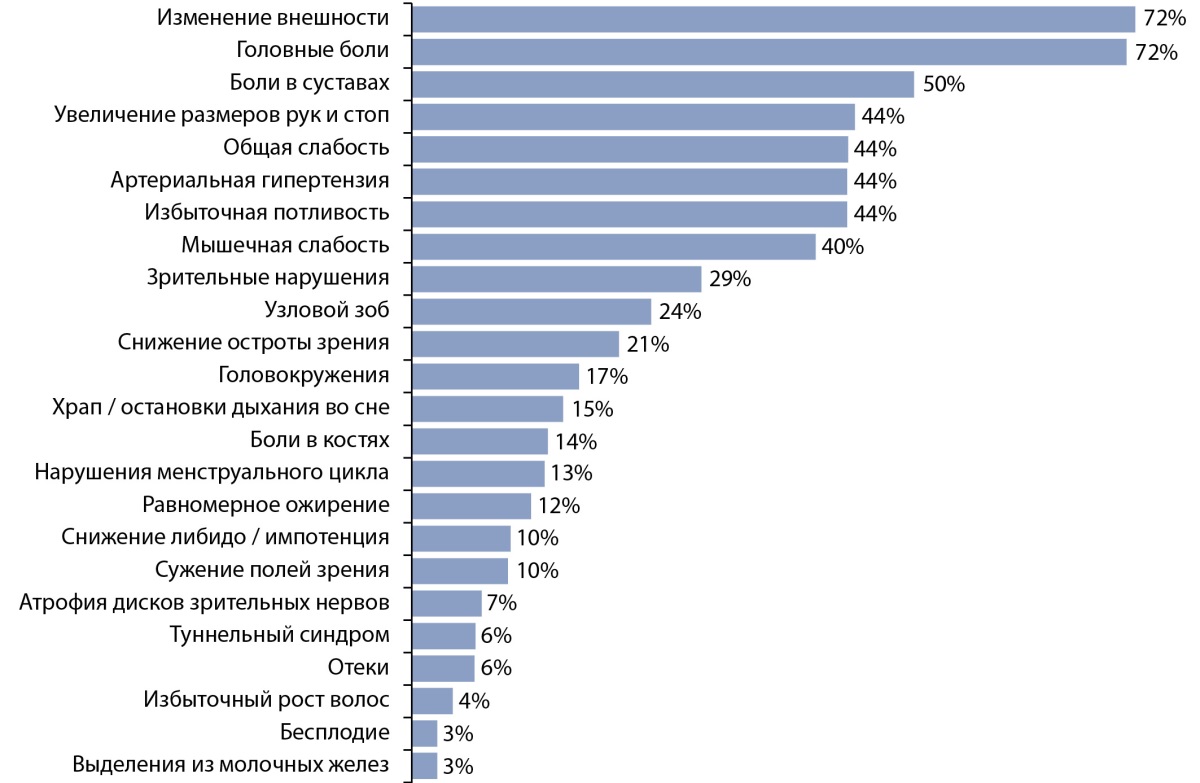
Рисунок 1. Распространенность клинических проявлений у пациентов с акромегалией,
проживающих на территории Российской Федерации [7].
Figure 1. Clinical manifestations in patients with acromegaly in Russian Federation [7].
Из-за медленного развития изменений внешности, заболевание может оставаться нераспознанным в течение многих лет.
На момент диагностики акромегалии у многих пациентов могут присутствовать осложнения, такие как сахарный диабет или нарушение толерантности к глюкозе, артериальная гипертензия, акромегалическая кардиомиопатия, нарушения ритма и проводимости сердца, сердечная недостаточность, увеличение/новообразования щитовидной железы, апноэ сна, остеопороз с компрессионными переломами позвонков, синдром запястного канала, артрозы, полипы/новообразования толстой кишки, гипопитуитаризм [1]. Основные осложнения акромегалии и частота их встречаемости представлены в таблице 1.
Таблица 1. Частота встречаемости осложнений акромегалии
(общее количество пациентов — 1175) [15]
Table 1. Frequency of acromegaly complications (n = 1175) [15]
Осложнения акромегалии | Частота встречаемости, % |
Заболевания сердечно-сосудистой системы | 67,6 |
Гипопитуитаризм | 26,3 |
Апноэ сна | 24,9 |
Злокачественные новообразования | 22,6 |
Артропатии | 19,0 |
Патологические изменения скелета | 8,2 |
К наиболее характерным для акромегалии признакам, которые позволяют заподозрить наличие заболевания при первичном обращении к эндокринологу, относят типичные изменения внешности в сочетании с эндокринными заболеваниями (нарушение углеводного обмена, патология щитовидной железы, ожирение), кардиальной и неврологической симптоматикой (рисунок 2).

Рисунок 2. Основные клинические проявления и осложнения акромегалии
(адаптировано из [1]).
Figure 2. Primary clinical manifestations and complications of acromegaly
(adapted from [1]).
ДИАГНОСТИКА,
МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ
К ПРИМЕНЕНИЮ МЕТОДОВ ДИАГНОСТИКИ
Запоздалая диагностика приводит к росту осложнений и смертности при акромегалии [15][16]. Диагностика акромегалии не представляет трудностей при наличии яркой клинической картины заболевания. Основные проблемы диагностики заключаются в выявлении акромегалии на ранних этапах или при «мягкой» форме заболевания в отсутствии выраженных изменений внешности.
Критерии установления диагноза:
- наличие клинических проявлений акромегалии;
- наличие лабораторного подтверждения хронической гиперсекреции гормона роста;
- визуализация опухоли.
ЖАЛОБЫ И АНАМНЕЗ
- Всем пациентам с характерными изменениями внешности (см. рисунок 2) рекомендуется исключать акромегалию [7].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 3).
Комментарии: Диагноз акромегалии необходимо заподозрить у пациентов с увеличением размера кистей, стоп, нижней челюсти, надбровных дуг, огрублением черт лица. При расспросе пациенты могут отмечать изменение размера обуви, колец, перчаток, головных уборов. Данная рекомендация касается врачей любых специальностей, так как пациенты с акромегалией часто впервые обращаются к неврологам, офтальмологам, гинекологам, кардиологам, стоматологам, ревматологам и другим специалистам.
- Всем пациентам без характерных изменений внешности при наличии нескольких подозрительных в отношении акромегалии клинических признаков рекомендуется исключать акромегалию [17].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: Различные опросники показали высокую пользу для ранней диагностики акромегалии [18][19]. Селективный скрининг акромегалии целесообразен среди пациентов с сахарным диабетом, артериальной гипертензией (особенно молодого возраста), апноэ сна, ожирением, отеками при наличии жалоб на головную боль, повышенную потливость. Разработанная отечественными исследователями, анкета ACROSCREEN предназначена для заполнения пациентом и включает вопросы по клиническим проявлениям, изменениям внешности и ранее диагностированным заболеваниям. Бланк анкеты ACROSCREEN представлен в Приложении 1. При получении более 18 баллов по результатам заполнения, пациента необходимо обследовать на предмет наличия акромегалии [20].
- Всем пациентам c аденомой гипофиза рекомендуется исключать акромегалию [3].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: Аденома гипофиза, выявленная в ходе неспециализированного обследования (инциденталома), требует клинико-лабораторной диагностики для исключения гормональной активности, в том числе — СТГ-секретирующей, особенно при диаметре образования более 10 мм, так как при акромегалии на момент постановки диагноза у 75–80% пациентов с акромегалий выявляются макроаденомы гипофиза [21].
- У всех пациентов с пролактин-секретирующими аденомами рекомендуется исключать акромегалию [22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Пациенты с акромегалией и гиперпролактинемией могут длительно ошибочно вестись как пациенты с пролактиномами. Гиперпролактинемия различной степени выраженности наблюдается приблизительно у 40% пациентов с акромегалией и может иметь как первичный (вследствие сочетанной секреции СТГ и пролактина опухолью), так и вторичный (вследствие масс-эффекта опухоли) характер [22–24].
- У всех пациентов с установленным диагнозом акромегалия рекомендуется сбор семейного анамнеза [25].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: В 5% случаев акромегалия встречается в рамках наследственных синдромов, к которым относятся синдромы множественных эндокринных неоплазий 1 и 4 типа (МЭН-1, МЭН-4), изолированные семейные аденомы гипофиза (FIPA), синдром Х-сцепленного акрогигантизма (X-LAG), синдром МакКьюна–Олбрайта и Карни комплекс. Известными причинами возникновения данных синдромов являются мутации в генах MEN1, CDKN1B, PRKA1A, AIP, GPR101, SDH и GNAS. Гены, задействованные в FIPA, МЭН-1 и МЭН-4 обладают пониженной пенетрантностью, в связи с чем родственники первой линии могут быть носителями и не иметь клинических проявлений. Генетическое обследование целесообразно проводить у пациентов моложе 30 лет с гигантизмом и акромегалией даже при отсутствии явного семейного анамнеза аденом гипофиза [25]. Своевременное выявление генетической причины акромегалии влияет на выбор метода лечения, раннюю диагностику свойственной синдромам патологии у пациента и его родственников, репродуктивные планы.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
При осмотре необходимо обращать внимание на характерные для акромегалии изменения внешности: грубые черты лица, увеличение носа и надбровных дуг, расширение межзубных промежутков (диастема) (см. раздел 2.1.). Следует помнить, что несмотря на выраженность клинических проявлений на момент постановки диагноза, пациенты могут не обращать внимание на изменение собственной внешности в связи с длительным течением заболевания.
- У всех пациентов с установленным диагнозом акромегалия рекомендуется исключать артериальную гипертензию (АГ) [26].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 3).
Комментарии: АГ — одно из самых частых осложнений акромегалии, вносящее вклад в повышенную сердечно-сосудистую смертность при данном заболевании. Особенностью АГ при акромегалии является преимущественное повышение диастолического давления, более молодой возраст дебюта [27][28].
ЛАБОРАТОРНЫЕ ДИАГНОСТИЧЕСКИЕ ИССЛЕДОВАНИЯ
- Всем пациентам для лабораторного подтверждения акромегалии рекомендуется исследование уровня ИФР-1 (Соматомедина С) в крови [29][30].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 3).
Комментарии: Исследование ИФР-1 в крови является основным методом лабораторной диагностики акромегалии, так как его уровень отражает интегрированную секрецию СТГ; ИФР-1 имеет более длительный период полужизни, чем СТГ; и даже минимальная гиперсекреция СТГ приводит к повышению уровня ИФР-1 [29][30]. Различные состояния могут приводить к ложному повышению или снижению уровня ИФР-1: ИФР-1 повышается во время пубертата, снижается во время беременности, при печеночной или почечной недостаточности, декомпенсированном гипотиреозе, недостаточности питания, острых инфекционных заболеваниях, декомпенсированном сахарном диабете, на фоне приема эстрогенов [31–33]. В физиологических условиях после достижения пубертата уровень ИФР-1 постепенно снижается, в связи с чем показатель необходимо оценивать относительно возраст-специфических референсных диапазонов. Кроме того, существует значимая вариабельность имеющихся наборов для определения ИФР-1, в связи с чем необходима валидация лабораторных наборов согласно международному консенсусу [34]. Учитывая зависимость референсного значения ИФР-1 от возраста и лабораторных наборов, целесообразно использовать ИФР-1 индекс — соотношение уровня ИФР-1 к верхней границе нормы в соответствии с полом и возрастом. Применение ИФР-1 индекса позволит унифицировать оценку эффективности различных методов лечения акромегалии, объективно сравнивать результаты научных исследований.
- У пациентов без явных клинических признаков акромегалии и/или с умеренным повышением уровня ИФР-1 (ИФР-1 индекс менее 1,3), для лабораторного подтверждения акромегалии рекомендуется определение реакции СТГ на гипергликемию (СТГ в ходе перорального глюкозотолерантного теста (ПГТТ)) [3][35][36].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарий: В ходе ПГТТ забор крови на СТГ производится исходно, на 30, 60, 90 и 120 минуте после приема 75 грамм безводной глюкозы, растворенной в одном стакане воды. Подавление СТГ в ходе ПГТТ менее 1.0 нг/мл хотя бы в одной точке, кроме исходной, позволяет исключить акромегалию. При использовании высокочувствительного хемилюминесцентного метода измерения СТГ используется отрезное значение 0.4 нг/мл. Коэффициент для пересчета концентрации СТГ: нг/мл х 3 = мМЕ/л [37]. СТГ в ходе ПГТТ не проводится у пациентов, получающих терапию аналогами соматостатина или пэгвисомантом**. Не рекомендуется проводить СТГ в ходе ПГТТ у пациентов с декомпенсированным сахарным диабетом (уровень гликированного гемоглобина более 8%) [38]. Различные состояния могут приводить к отсутствию подавления СТГ в ходе ПГТТ: пубертат, нервная анорексия, хронический гепатит, тиреотоксикоз, ожирение, почечная недостаточность, сахарный диабет, прием оральных контрацептивов [39]. С другой стороны, следует помнить о «мягкой» форме акромегалии (так называемой «микромегалии»), при которой несмотря на явные клинические проявления заболевания и значимо повышенный уровень ИФР-1 может наблюдаться подавление СТГ в ходе ПГТТ [40].
- У пациентов с подозрением на акромегалию для лабораторного подтверждения диагноза не рекомендуется проводить случайное исследование уровня СТГ в крови [3][41][42].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: Секреция СТГ в течение дня имеет пульсовой характер как в физиологических условиях, так и при акромегалии, в связи с чем однократное измерение не имеет диагностической ценности [41][42]. Кроме того, измерение СТГ сыворотки сопряжено с трудностями, обусловленными низкой воспроизводимостью при использовании разных лабораторных наборов, отсутствием стандартизации и точных контрольных показателей для иммунометрических наборов [43].
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
- Всем пациентам при лабораторном подтверждении акромегалии рекомендуется проведение магнитно-резонансной томографии (МРТ) гипофиза с внутривенным контрастированием для определения размера, расположения и характера роста аденомы гипофиза [44].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 3).
Комментарий: В большинстве случаев акромегалии (82%) на момент проведения МРТ выявляются аденомы гипофиза диаметром более 10 мм — макроаденомы [7]. Рекомендуемая напряженность магнитного поля МРТ-аппарата — 1,5–3 Тесла. Оптимальная толщина срезов для МРТ гипофиза — не менее 2 мм. Для получения максимальной информации протокол описания МРТ должен содержать: размеры аденомы гипофиза (ширина, высота, толщина), характер ее распространения (классификация по Knosp), структуры, накопления контраста и оценку интенсивности сигнала при Т2-взвешанном режиме. При наличии противопоказаний к проведению МРТ (установленный кардиостимулятор, металлические конструкции в теле, клаустрофобия, вес пациента, превышающий возможности аппарата) необходимо проведение компьютерной томографии (КТ) головного мозга с внутривенным контрастированием для определения размера, расположения и характера роста аденомы гипофиза [45].
- Всем пациентам при лабораторном подтверждении акромегалии и отсутствии визуализации аденомы гипофиза при МРТ гипофиза с контрастным усилением рекомендуется КТ органов грудной полости с внутривенным контрастированием и КТ органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием (или МРТ органов брюшной полости с внутривенным контрастированием и МРТ забрюшинного пространства с внутривенным контрастированием) для исключения внегипофизарной опухоли, продуцирующей СТГ или соматолиберин [46].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарии: В литературе описано 127 случаев эктопической акромегалии. Наиболее часто соматолиберин-продуцирующие опухоли встречаются в легких и поджелудочной железе. Клиническая картина заболевания не отличается от классической акромегалии. Чаще всего эктопическую акромегалию подозревают при отсутствии визуализации аденомы гипофиза при МРТ с контрастированием, однако недостижение ремиссии заболевания после радикальной транссфеноиадальной аденомэктомии тоже может свидетельствовать об иной локализации опухоли. Выявление повышенного уровня соматолиберина в крови (более 250 нг/л) помогает установить верный диагноз [46]. Данное исследование не доступно в клинической практике на территории Российской Федерации.
- У пациентов с подозрением на акромегалию не рекомендуется проведение рентгенографии турецкого седла и рентгенографии стопы в одной проекции для диагностики акромегалии [47].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 3).
Комментарии: Данные методы диагностики акромегалии являются устаревшими и не применяются ввиду наличия более современных [47].
ИНЫЕ ДИАГНОСТИЧЕСКИЕ ИССЛЕДОВАНИЯ
После биохимического подтверждения акромегалии и визуализации аденомы гипофиза требуется исключение осложнений и сопутствующей патологии, влияющей на выбор метода лечения.
- Всем пациентам с подтвержденной акромегалией рекомендуется исследование уровня глюкозы в крови и исследование уровня гликированного гемоглобина в крови для выявления нарушений углеводного обмена [48].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: Нарушения углеводного обмена при акромегалии выявляются более, чем в 50% случаев, преимущественно у пациентов пожилого возраста, с высоким индексом массы тела, наследственным анамнезом сахарного диабета [48]. Наличие сахарного диабета у пациентов с акромегалией ассоциировано с повышением общей и сердечно-сосудистой смертностью [49] .
- Всем пациентам с акромегалией рекомендуется исследование уровня пролактина в крови для исключения гиперпролактинемии [22][24].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: Гиперпролактинемия выявляется приблизительно у 40% пациентов с акромегалией. Причиной гиперпролактинемии может быть смешанный характер секреции аденомы гипофиза или сдавление опухолью ножки гипофиза. Длительная гиперпролактинемия может приводить к развитию осложнений (например, вторичного гипогонадизма) и снижать качество жизни пациентов [23]. У пациентов с бессимптомной гиперпролактинемией рекомендуется исключение феномена макропролактинемии [50]. При наличии показаний (синусовая тахикардия, фибрилляция предсердий) целесообразно исследование всей панели тиреоидных гормонов для исключения смешанной СТГ/ТТГ-секретирующей опухоли — тиреотропиномы [51].
- Всем пациентам с акромегалией рекомендуется исключать гипопитуитаризм (исследование уровня общего кортизола в крови, исследование уровня свободного тироксина сыворотки крови (свТ4), исследование уровня тиреотропного гормона (ТТГ) в крови, исследование уровня фолликулостимулирующего гормона в сыворотке крови (ФСГ), исследование уровня лютеинизирующего гормона (ЛГ) в сыворотке крови, у мужчин — исследование уровня общего тестостерона в крови, у женщин репродуктивного возраста с нарушениями менструального цикла — исследование уровня общего эстрадиола в крови) [23].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: Гипопитуитаризм встречается примерно в 35% случаев акромегалии и может возникать как исходно (по причине масс-эффекта опухоли), так и после проведенного нейрохирургического или лучевого лечения. Несвоевременное выявление гипопитуитаризма и отсутствие адекватной терапии приводит к развитию осложнений и преждевременной смертности [52].
- Всем пациентам с акромегалией и подтверждением воздействия аденомы гипофиза на перекрест зрительных нервов при МРТ/КТ рекомендован прием (осмотр, консультация) врача-офтальмолога первичный и компьютерная периметрия для исключения зрительных нарушений [53].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 3).
Комментарии: Зрительные нарушения при акромегалии встречаются с частотой до 35%. Выпадение полей зрения (битемпоральная гемианопсия) развиваются чаще, чем снижение остроты зрения [53]. Хиазмальный синдром является абсолютным показанием к нейрохирургическому лечению. Гораздо реже может наблюдаться вовлечение в патологический процесс черепно-мозговых нервов, проходящих через кавернозный синус.
ЛЕЧЕНИЕ
Своевременное и адекватное лечение акромегалии позволяет уменьшить риск инвалидизации и снизить смертность пациентов до общепопуляционного уровня [54]. Основные трудности в лечении акромегалии возникают при ведении пациентов с агрессивным, резистентным течением заболевания, при ведении коморбидных пациентов, а также при оценке эффективности различных методов лечения акромегалии в случаях дискордантности лабораторных показателей, которая встречается у 39% пациентов с акромегалией [55].
Цели лечения акромегалии:
1. достижение целевых гормональных показателей:
- базальный уровень СТГ менее 2,5 нг/мл (менее 1 нг/мл при высокочувствительном методе определения);
- минимальный уровень СТГ в ходе ПГТТ менее 1 нг/мл (менее 0,4 нг/мл при высокочувствительном методе определения);
- уровень ИФР-1 в пределах референсных диапазонов по полу и возрасту (величина ИФР-1 индекса ≤1);
2. удаление опухоли, при невозможности — уменьшение объема опухоли и устранение масс-эффекта;
3. контроль системных осложнений и устранение обратимых симптомов заболевания;
4. минимизация риска преждевременной смерти (что достигается нормализацией гормональных показателей и контролем осложнений акромегалии, прежде всего в отношении углеводного обмена и изменений со стороны сердечно-сосудистой системы) [56].
В цели лечения также входит улучшение самочувствия пациента и повышение качества его жизни как за счет достижения ремиссии акромегалии, так и вследствие коррекции сопутствующих заболеваний и метаболических нарушений [57].
Для достижения целей лечения необходима персонализированная эффективная терапия, направленная на достижение целевых уровней СТГ и ИФР-1, устранение/уменьшение объема опухоли, а также пожизненная регулярная клиническая оценка и лечение сопутствующих заболеваний (системных проявлений акромегалии).
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- Всем пациентам с акромегалией и аденомой гипофиза в качестве первой линии лечения рекомендуется проведение трансназальной транссфеноидальной аденомэктомии при согласии пациента и отсутствии противопоказаний [3][58].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Хирургическое лечение является методом выбора при акромегалии, так как позволяет полностью удалить опухолевую ткань и, соответственно, достичь стойкой ремиссии акромегалии сразу после проведенного вмешательства; является эффективным, безопасным, экономически выгодным методом лечения [3][58]. В подавляющем большинстве случаев рекомендуется использовать трансназальный транссфеноидальный доступ. Несмотря на то, что эндоскопическая техника не имеет существенных преимуществ перед микроскопической в отношении радикальности хирургического вмешательства, применение эндоскопа позволяет значительно сократить время операции и риск осложнений [59][60]. Использование транскраниального доступа может быть оправданно при гигантских соматотропиномах, однако риски послеоперационных осложнений после таких операций значительно выше [61]. В специализированных центрах ремиссия акромегалии после нейрохирургического лечения достигается у 80–90% пациентов с микроаденомами гипофиза и в 50–75% случаев с макроаденомами гипофиза. Вероятность радикального лечения значительно снижается при опухолях больших размеров (при размере аденомы более 20 мм составляет 20%) и инвазивном характере роста [58][62].
Показания к хирургическому лечению
Хирургическое лечение акромегалии рекомендуется как первый метод лечения акромегалии практически всем пациентам, особенно:
- с микроаденомами гипофиза;
- с макроаденомами гипофиза, характер роста которых предполагает возможность полного их удаления;
- при наличии сдавления перекреста зрительных нервов/наличии зрительных нарушений;
- при наличии сдавления других черепно-мозговых нервов;
- при наличии гипопитуитаризма;
- при массивном кровоизлиянии в аденому гипофиза (в остром периоде);
- при отсутствии эффекта от других видов лечения (медикаментозного, лучевой терапии);
- при макроаденомах гипофиза, характер роста которых предполагает низкую вероятность их полного удаления, так как проведение хирургического вмешательства позволяет уменьшить объем опухоли (debulking) и улучшить чувствительность к последующей медикаментозной терапии [59][61][63][64].
При отсутствии ремиссии акромегалии после первого хирургического вмешательства и наличии остаточной опухолевой ткани, которая потенциально может быть радикально удалена, показано повторное хирургическое вмешательство. Следует учитывать, что вероятность наступления ремиссии после повторного хирургического лечения ниже, чем после первичной операции [65–67].
Относительные противопоказания к хирургическому лечению
При тяжелой сердечно-сосудистой патологии, декомпенсации сахарного диабета и гипопитуитаризма, а также выраженном разрастании мягких тканей верхних дыхательных путей, затрудняющем проведение интубации оперативное лечение может быть отложено до компенсации указанных состояний [58].
- Всем пациентам с акромегалией, которым показано нейрохирургическое лечение, проведение оперативного вмешательства рекомендуется в специализирующихся на заболеваниях гипофиза медицинских учреждениях нейрохирургами, выполняющими не менее 50 подобных операций в год [66][68][69].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 3).
Комментарии: Опыт нейрохирурга играет немаловажную роль в достижении ремиссии акромегалии [67–70]. Согласно рекомендациям Общества по изучению гипофиза (Pituitary Society), опытный нейрохирург должен выполнять не менее 50 аденомэктомий в год [66]. Кроме того, предложено использовать термин «минимальный порог опыта оперирующего на гипофизе нейрохирурга», составляющий 200 операций [71].
- Всем пациентам с акромегалией после нейрохирургического лечения рекомендуется морфологическое и иммуногистохимическое исследование удаленной аденомы гипофиза [13].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 3).
Комментарии: Гистологическое исследование позволяет подтвердить диагноз аденомы гипофиза, определить гистологический подтип и степень инвазии в твердую мозговую оболочку [72][73]. Для оценки иммунофенотипа опухоли и степени ее агрессивности необходимо проведение иммуногистохимического (ИГХ) исследования удаленной аденомы гипофиза (индекс пролиферации Ki-67, экспрессия СТГ, пролактина, СР2, цитокератина CAM 5.2). В последующем данные ИГХ исследования возможно использовать в качестве предикторов эффективности медикаментозного лечения. Так, редкогранулированные соматотропиномы и опухоли с низкой экспрессией СР2 менее чувствительны к аналогам соматостатина длительного действия первого поколения [13][74–76].
- Рутинное назначение медикаментозной терапии акромегалии перед проведением оперативного вмешательства для уменьшения размера опухоли не рекомендуется [77][78].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: 35 лет назад была выдвинута гипотеза, согласно которой уменьшение размера макроаденом гипофиза, продуцирующих СТГ, под действием аналогов соматостатина может улучшить исход хирургического лечения. Преобладающее большинство проведенных позже исследований не подтвердили эту гипотезу. Хотя все проспективные исследования указывают на улучшение хирургического исхода через 3 месяца после операции при проведении предоперационной подготовки аналогами соматостатина, различия по частоте ремиссии между пациентами, получавшими лечение до операции, и нелечеными пациентами из группы контроля исчезают через 6–12 месяцев. Таким образом, предоперационная терапия макросоматотропином аналогами соматостатина с целью достижения полного удаления опухоли не оправдывает ожиданий и не может быть рекомендована [77–80]. При этом терапия аналогами соматостатина потенциально может снизить/нормализовать уровни СТГ и ИФР-1, и, таким образом, улучшить общее состояние пациента, снизить риски общей анестезии и хирургического вмешательства. Поэтому целесообразно применение медикаментозной терапии акромегалии в предоперационном периоде для достижения целевых уровней артериального давления и показателей гликемии, компенсации сердечной недостаточности, уменьшения отечности тканей верхних дыхательных путей, с целью купирования головной боли и контроля других осложнений акромегалии [81–84].
- Всем пациентам с акромегалией, перенесшим нейрохирургическое лечение, для предварительной оценки эффективности оперативного вмешательства рекомендуется исследование базального уровня СТГ на 1–2 сутки и проведение пробы СТГ в ходе ПГТТ через 1–2 недели после оперативного вмешательства [58].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: С целью предварительной оценки эффективности оперативного вмешательства в раннем послеоперационном периоде пациентам с акромегалией рекомендуется исследование базального уровня СТГ на 1–2 сутки после хирургического лечения. Уровень СТГ в первый день после операции менее 1 нг/мл коррелирует с долгосрочной ремиссией акромегалии [58]. Определение СТГ в ходе ПГТТ может быть проведено на 1–2 неделе после оперативного вмешательства. Подавление СТГ менее 1 нг/мл свидетельствует о ранней ремиссии акромегалии. Пороговое значение СТГ может быть снижено до менее 0,4 нг/мл при использовании высокочувствительного метода определения [85–87]. Интерпретация результатов исследований в раннем послеоперационном периоде затруднена у пациентов, получавших медикаментозную терапию незадолго до нейрохирургического вмешательства.
- Пациентам с акромегалией после нейрохирургического лечения для оценки эффективности оперативного вмешательства рекомендуется определение уровня ИФР-1 через 3 месяца после операции [64][85].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Для окончательной оценки эффективности оперативного вмешательства рекомендуется определение уровня ИФР-1 через 3 месяца после операции [64][85]. Уровень ИФР-1 снижается медленнее, чем уровень СТГ, что связано с особенностью периода полужизни белков, связывающих ИФР-1 в крови [88]. При снижении уровня ИФР-1 через 3 месяца относительно исходного, но отсутствии его нормализации, рекомендуется определение СТГ в ходе ПГТТ и при достаточном подавлении — проведение повторного исследования ИФР-1 в интервале последующих 2–3 месяцев в связи с возможностью отдаленной биохимической ремиссии [85]. В ряде случаев, возможны дискордантные результаты показателей ИФР-1 и СТГ в ходе ПГТТ в отдаленном послеоперационном периоде, при этом отсутствие подавления СТГ в ходе ПГТТ при нормальном уровне ИФР-1 может быть предиктором рецидива акромегалии и требует более активного наблюдения [89][90]. В случае, если во время оперативного вмешательства была выявлена инвазия опухоли, или интраоперационно сделан вывод о невозможности тотального удаления опухоли, рекомендуется назначение медикаментозной терапии на основании результатов базального СТГ и СТГ в ходе ПГТТ в раннем послеоперационном периоде, не дожидаясь динамики уровня ИФР-1 через 3 месяца.
- Пациентам с акромегалией после нейрохирургического лечения для оценки эффективности оперативного вмешательства рекомендуется проведение МРТ головного мозга с внутривенным контрастированием не ранее, чем через 3 месяца, оптимально — через 6 месяцев после операции [91][92].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 1)
Комментарии: Проведение МРТ головного мозга в раннем послеоперационном периоде не рекомендуется в связи с наличием факторов, затрудняющих интерпретацию снимков: отек слизистой, отек аденогипофиза, наличие гемостатических губок или другого материала, используемого при тампонаде турецкого седла при большом объеме удаленной опухоли (аутожир и пр.). В интервале от 3 до 6 месяцев происходит нормализация размеров аденогипофиза, рассасывание гемостатического материала [91]. При невозможности проведения МРТ или при противопоказаниях к его проведению рекомендуется проведение МСКТ головного мозга с контрастированием.
- Пациентам с акромегалией, достигших ремиссии после нейрохирургического лечения, рекомендуется пожизненное ежегодное исследование уровня ИФР-1 для исключения рецидива заболевания [93].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4)
Комментарии: Рецидив акромегалии после успешного нейрохирургического лечения наблюдается в 2–3% случаев [93].
К предикторам рецидива акромегалии относят:
- молодой возраст пациентов;
- высокий предоперационный уровень гормональной активности;
- признаки инвазивного роста опухоли;
- сохранение псевдокапсулы опухоли;
- наличие агрессивного морфологического подтипа;
- отсутствие подавления СТГ в ходе ПГТТ при нормальном уровне ИФР-1 [89][94].
- Пациентам с акромегалией после нейрохирургического лечения рекомендуется лабораторное обследование для исключения гипопитуитаризма и водно-электролитных нарушений в раннем и отсроченном послеоперационном периоде [95].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 3)
Комментарии: Осложнения после транссфеноидальной аденомэктомии, в целом, встречаются достаточно редко и зависят от опыта оперирующих хирургов, наличия мультидисциплинарной команды, а также от размеров аденомы гипофиза и степени ее инвазии [71]. Осложнения после операции включают кровотечение, назальную ликворею (истечение спинномозговой жидкости) (2–3%), гипопитуитаризм (5–10%) [96], водно-электролитные нарушения (несахарный диабет/гипонатриемия) (2%) [97][98], менингит (2%), паралич глазодвигательных нервов [99]. Такие тяжелые осложнения как повреждение внутренней сонной артерии и повреждение зрительных нервов встречаются крайне редко [100][101]. Риск летального исхода после оперативного лечения составляет 0,2–0,8% [102]. Осложнения после транссфеноидальной аденомэктомии требуют своевременной диагностики и лечения (см Таблице 2). Необходимость медикаментозной коррекции СТГ-дефицита, который может развиваться у 15% пациентов с акромегалией после хирургического вмешательства, остается спорным вопросом [103].
Таблица 2. Послеоперационные осложнения
после транссфеноидальной аденомэктомии у пациентов с акромегалией
Table 2. Postoperative complications in patients with acromegaly
after transsphenoidal adenomectomy
Клинические проявления | Диагностика | Лечение | |
Вторичная надпочечниковая недостаточность | Тошнота, рвота, боли в животе, головные боли, повышение температуры, снижение артериального давления, гипогликемия | Анализ крови на кортизол (на 1–2 сутки после операции, через 3, 6 и 12 месяцев или при появлении симптомов) | Заместительная терапия глюкокортикоидами |
Вторичный гипогонадизм | Отсутствие менструаций у женщин репродуктивного возраста, снижение половой функции у мужчин | Анализ крови на пролактин, ФСГ, ЛГ, эстрадиол (у женщин), тестостерон (у мужчин) через 3, 6 и 12 месяцев или при появлении симптомов | Заместительная терапия половыми стероидами |
Вторичный гипотиреоз | Общая слабость, отеки, запоры, непереносимость холода, сонливость | Анализ крови на свТ4 через 3, 6 и 12 месяцев после операции | Заместительная терапия левотироксином натрия |
Послеоперационный несахарный диабет | Полиурия, жажда, сухость во рту | Анализ крови на натрий, анализ мочи на осмоляльность на 5–7 сутки после операции, через 3 месяца или при появлении симптомов | Заместительная терапия десмопрессином |
Синдром неадекватной секреции антидиуретического гормона | Головная боль, тошнота, рвота, боли в животе, отеки | Анализ крови на натрий, осмоляльность на 9–10 день после операции или при появлении симптомов | Ограничение жидкости, в/в введение 3% раствора NaCl |
Ликворея | Истечение прозрачной жидкости из носа, повышение температуры тела, головная боль | Осмотр отоларинголога через 5–7 суток после операции или при появлении симптомов | Повторное нейрохирургическое вмешательство |
Острый синусит | Головная боль, повышение температуры, заложенность носа, гнойные выделения из носа | Осмотр отоларинголога через 5–7 суток после операции или при появлении симптомов | Антибиотикопрофилактика, антибактериальная и симптоматическая терапия |
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Несмотря на совершенствование нейрохирургических технологий в последние 15 лет, даже в экспертных нейрохирургических центрах до 50% пациентов не достигают послеоперационной ремиссии и нуждаются в дополнительной терапии [104][105]. В этом случае назначается медикаментозное лечение [3][36]. В настоящее время для терапии акромегалии доступны три класса лекарственных средств: аналоги соматостатина (первого и второго поколений), агонисты дофаминовых рецепторов и антагонисты рецептора гормона роста. Указанные препараты могут применяться как в качестве монотерапии, так и в комбинации друг с другом. Агонисты дофаминовых рецепторов не имеют зарегистрированных показаний для лечения акромегалии. Аналоги соматостатина второго поколения (мультилигандные) для терапии акромегалии не зарегистрированы в Российской Федерации.
- Пациентам с акромегалией, у которых нейрохирургическое лечение было невозможно, неэффективно, а также ожидающим эффект лучевой терапии рекомендована медикаментозная терапия [106].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Медикаментозное лечение акромегалии рекомендуется при сохранении активности акромегалии после операции, если оперативное вмешательство противопоказано, его проведение отложено более, чем на 3 месяца, необходима предоперационная подготовка в отношении осложнений акромегалии для снижения хирургического риска или при отказе пациента от нейрохирургического лечения. Медикаментозное лечение акромегалии рекомендуется в период ожидания максимального эффекта после лучевой терапии.
Аналоги соматостатина
Аналоги соматостатина — это синтетические производные природного гипоталамического нейропептида соматостатина, который в норме подавляет секрецию СТГ и некоторых других гормонов. В зависимости от периода полувыведения различают аналоги соматостатина короткого и пролонгированного действия. Аналоги соматостатина взаимодействуют с трансмембранными рецепторами, сопряженными с G-белками — соматостатиновыми рецепторами на соматотропиномах. Активация соматостатиновых рецепторов приводит к снижению гормональной опухолевой секреции и пролиферации, стимуляции апоптоза и угнетению синтеза различных белков, включая факторы ангиогенеза. Различают пять классических подтипов соматостатиновых рецепторов (СР1–5) [107]. Аналоги соматостатина первого поколения с наибольшей аффинностью связываются с СР2, в то время как мультилигандные аналоги соматостатина связываются с СР1, СР2, СР3 и СР5.
- В качестве первой линии медикаментозной терапии акромегалии рекомендуется применение аналогов соматостатина пролонгированного действия первого поколения [108].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1)
Комментарии: На территории Российской Федерации зарегистрированы препараты аналогов соматостатина пролонгированного действия: октреотид** и ланреотид**. В целом октреотид** и ланреотид** обладают сопоставимым профилем эффективности и безопасности [109]. При этом инъекция внутримышечной формы октреотида** пролонгированного действия требует подготовки (разведения препарата) и участия обученного медицинского персонала, в то время как ланреотид** пролонгированного действия — это готовая форма для самостоятельного подкожного введения пациентом в виде геля, которая может применяться с увеличенным интервалом, что положительно влияет на приверженность пациентов к лечению [110]. От 30 до 55% пациентов с акромегалией достигают нормализации уровня ИФР-1 на фоне лечения аналогами соматостатина первого поколения [111–114]. Кроме того, при использовании медикаментозной терапии аналогами соматостатина в качестве первой линии лечения наблюдается значимое уменьшение объема опухоли (более, чем на 20%) у 60–70% пациентов [115][116]. Октреотид** короткого действия может применяться дополнительно к пролонгированным формам при акромегалии для купирования головной боли [117].
Аналоги соматостатина второго поколения пролонгированного действия не зарегистрированы на территории Российской Федерации. Мультилигандный аналог соматостатина взаимодействует с четырьмя типами соматостатиновых рецепторов (СР1, СР2, СР3, СР5). У 54% пациентов с акромегалией была достигнута нормализация уровня ИФР-1 на фоне лечения аналогами соматостатина второго поколения, в 63% случаев отмечено уменьшение объема опухоли. Наиболее частым побочным эффектом явилась гипергликемия (63%) [118].
- Начинать терапию аналогами соматостатина пациентам с акромегалией рекомендуется в дозе 20 мг 1 раз в 28 дней внутримышечно для октреотида** пролонгированного действия и 120 мг 1 раз в 28 дней глубоко подкожно для ланреотида** пролонгированного действия с контролем уровня ИФР-1 каждые 3 месяца и коррекцией дозы при необходимости [113][119].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2)
Комментарии: Согласно данным клинических исследований, наиболее часто применяемой дозой октреотида** пролонгированного действия была 20 мг 1 раз в 28 дней, а ланреотида** пролонгированного действия - 120 мг 1 раз в 28 дней [113][119]. Несмотря на то, что дозе октреотида** 20 мг соответствует доза ланреотида** 90 мг, применение единой стартовой дозы ланреотида** 120 мг 1 раз в 28 дней с изменением в дальнейшем частоты введения удобнее с экономической точки зрения. Длительность развития эффекта терапии аналогами соматостатина может занять от 6 до 12 месяцев [120], однако необходимо проводить оценку эффективности терапии уже через 3 месяца лечения для своевременной коррекции (Таблицы 3, 4). Классические критерии чувствительности к терапии аналогами сосматостатина были предложены Colao A.M. с соавторами: полная чувствительность — достижение целевого уровня СТГ (менее 2,5 нг/мл) и ИФР-1 (согласно референсным значениям), а также уменьшение размера опухоли более, чем на 20% при первичном лечении или стабилизация роста остаточной опухолевой ткани, если терапия аналогами соматостатина проводится после нерадикального нейрохирургического лечения. Частичная резистентность означает снижение уровня СТГ и ИФР-1 более, чем на 50%, но отсутствие нормализации и/или уменьшения размера опухоли более, чем на 20%. Полная резистентность — это отсутствие значимого снижения уровня СТГ и ИФР-1 и уменьшения размера опухоли. В первоначальном определении резистентности к аналогам соматостатина не было указания дозы препаратов (терапевтическая) и эффект лечения оценивался минимум через 12 месяцев терапии [121]. В дальнейшем критерии были пересмотрены: указана необходимость применения максимальной дозы аналогов соматостатина и сокращена длительность терапии до 6 месяцев [122].
Таблица 3. Дозирование октреотида** и ланреотида** пролонгированного действия
при лечении акромегалии
Table 3. Dose titration for octreotide** and extended-release lanreotide**
in treatment of acromegaly
Этап терапии | Доза Октреотида** | Доза Ланреотида** |
Начальная доза | Октреотид** пролонгированного действия 20 мг в/м 1 раз в 28 дней | Ланреотид** пролонгированного действия 120 мг п/к 1 раз в 28 дней |
Увеличение дозы, если ИФР-1 индекс более 1 | ||
Субмаксимальная доза | Октреотид** пролонгированного действия 30 мг в/м 1 раз в 28 дней | Ланреотид** пролонгированного действия 120 мг п/к 1 раз в 28 дней* |
Максимальная доза | Октреотид** пролонгированного действия 40 мг* в/м 1 раз в 28 дней | Ланреотид** пролонгированного действия 120 мг п/к 1 раз в 21 день* |
Уменьшение дозы, если ИФР-1 меньше нижней границы нормы ИЛИ побочные явления | ||
Минимальная доза | Октреотид** пролонгированного действия 10 мг в/м 1 раз в 28 дней | Ланреотид** пролонгированного действия 120 мг п/к 1 раз в 42-56 дней |
Примечания: * вне инструкции по применению
Notes: * off-label
Таблица 4. Оценка эффективности и коррекция терапии
аналогами соматостатина 1 поколения
Table 4. Evaluation of first generation somatostatin analogue treatment effectiveness
and correction of therapy
Время | Диагностические исследования | Критерии эффективности терапии | Алгоритм терапии и наблюдения |
Начало терапии | - | - | Начальные дозы октреотида** или ланреотида** |
3 месяца терапии | Контроль уровня ИФР-1 | Медикаментозный контроль (индекс ИФР-1 менее/равен 1) | Продолжить терапию аналогами соматостатина в прежних дозах; контроль уровня ИФР-1 1 раз в 6 месяцев; контроль МРТ через 3 месяца, далее 1 раз в 12 месяцев |
Отсутствие ремиссии (ИФР-1 индекс более 1) | Увеличение (сохранение) дозы аналогов соматостатина до субмаксимальной | ||
6 месяцев терапии аналогами сомато-статина в субмакси-мальной дозе | Контроль уровня ИФР-1, МРТ | Частичная резистентность: отсутствие нормализации ИФР-1 индекса, но снижение более, чем на 50% от исходного и/или уменьшение объема аденомы гипофиза более, чем на 20% | Возможна следующая тактика: •увеличение дозы пролонгированной формы октреотида** до 40 мг 1 раз в 28 дней [122][123]; •укорочение интервалов между введениями для пролонгированного ланреотида** до 21 дня (офф-лейбл) [123]; •переключение на другой аналог соматостатина (октреотид**/ланреотид**) [124]; •комбинированная терапия с каберголином** (оптимально при ИФР-1 индексе менее 1,5) [126] •комбинированная терапия с пэгвисомантом (оптимально при сохранении значительно повышенного уровня ИФР-1, наличии некомпенсированного сахарного диабета) [127] |
Полная резистентность: снижение ИФР-1 индекса менее, чем на 50% от исходного и отсутствие уменьшения объема аденомы гипофиза более, чем на 20% | Возможна следующая тактика: •при большом объеме опухоли - нейрохирургическое лечение, в том числе повторное, даже при невозможности радикального удаления аденомы [58][59]; •лучевая терапия [128]; •комбинированная терапия с пэгвисомантом** (при большом объеме опухолевой ткани) [127]; •перевод на монотерапию пэгвисомантом** при отсутствии риска роста аденомы гипофиза [127]. |
Основные трудности в выборе тактики лечения при акромегалии возникают при частичной/полной резистентности пациентов к терапии аналогами соматостатина. В рамках персонализированного подхода целесообразно использовать предикторы чувствительности к терапии аналогами соматостатина для выбора оптимального пути преодоления резистентности к ним [123–125]. К наиболее надежным факторам, предсказывающим низкую чувствительность к лечению аналогами соматостатина при акромегалии относят: гиперинтенсивный сигнал при Т2-взвешанном изображении МРТ [126]; редкогранулированный тип соматотропиномы [76]; отсутствие или низкую иммуноэкспрессию СР2 в удаленной опухолевой ткани [127][128] низкое соотношение экспрессии СР2 к СР5 [129] наличие герминальной мутации в гене AIP или низкую экспрессию белка AIP в опухоли [130][131]. Более подробная информация о предикторах чувствительности и резистентности к различным методам лечения акромегалии представлена в таблице 5.
- Пациентам, получающим лечение аналогами соматостатина, рекомендуется регулярно контролировать показатели углеводного обмена и состояние желчного пузыря [108].
Таблица 5. Предикторы чувствительности и резистентности
к медикаментозному лечению акромегалии [156]
Table 5. Predictors of response and resistance
to medical treatment in acromegaly [156]
Фармакологический класс препаратов | Предикторы чувствительности | Предикторы резистентности |
Аналоги соматостатина первого поколения (октреотид**, ланреотид**) | Высокий уровень экспрессии ССР 2А | Низкий уровень экспрессии ССР 2А |
Высокое соотношение ССР 2/ССР 5 | Низкое соотношение ССР 2/ССР 5 | |
Плотногранулированные опухоли | Редкогранулированные и смешанные опухоли | |
Низкий индекс Ki-67 | Высокий индекс Ki-67 | |
Предшествующая лучевая терапия | Инвазивный рост опухоли, препятствующий возможности ее полной резекции | |
- | Низкая экспрессия белка AIP или мутации в гене AIP | |
Низкая экспрессия белка Zac-1 | ||
Потеря экспрессии белка Е-кадгерина | ||
Низкая экспрессия белка β-аррестина и высокое соотношение ССР 2/β-аррестин | Высокая экспрессия белка β-аррестина и низкое соотношение ССР 2/β-аррестин | |
Гипоинтенсивный МР-сигнал на Т2-взвешенных изображениях | Гиперинтенсивный МР-сигнал на Т2-взвешенных изображениях | |
Снижение ИФР-1 >60% от исходного уровня через 3 дня введения октреотида короткого действия 100 мкг п/к 3 р/сут | Снижение ИФР-1<30% от исходного уровня через 3 дня введения октреотида короткого действия 100 мкг п/к 3 р/сут | |
Аналог соматостатина второго поколения | Высокая экспрессия ССР 5 | Низкая экспрессия ССР 5 |
Агонисты дофаминовых рецепторов | Высокая экспрессия дофаминовых D2-рецепторов | Низкая экспрессия дофаминовых D2-рецепторов |
Исходный уровень ИФР-1, не превышающий верхнюю границу референсного интервала более чем в 1,5 раза | Высокий исходный уровень ИФР-1, превышающий верхнюю границу референсного интервала более чем в 1,5 раза | |
Предикторы, ассоциированные с лучшим ответом на лечение | ||
Антагонист рецепторов СТГ (пэгвисомант**) | Мужской пол, низкий ИМТ, более низкие значения ИФР-1 на момент постановки диагноза, предшествующая лучевая терапия, отсутствие нарушений углеводного обмена | |
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 3)
Комментарии: Возможные побочные эффекты аналогов соматостатина: симптомы со стороны желудочного тракта (чаще диарея, значительно реже — запоры, метеоризм и другие), гепатобилиарной системы (расширение желчных протоков, образование взвеси, камней желчного пузыря), выпадение волос, брадикардия, нарушение углеводного обмена, которые чаще всего не являются клинически значимыми и не требуют отмены препарата [132]. Аналоги соматостатина могут оказывать противоположное влияние на углеводный обмен: улучшать показатели углеводного обмена за счет снижения концентрации и эффекта СТГ и ИФР-1 и, наоборот, ухудшать/вызывать нарушения углеводного обмена за счет подавляющего влияния аналогов соматостатина на секрецию инсулина [133]. Таким образом, необходим контроль гликемии натощак, гликированного гемоглобина не реже 1 раза в 6 месяцев на фоне лечения. Аналоги соматостатина снижают сократимость желчного пузыря после еды и замедляют его опорожнение. В связи с этим примерно у 35% пациентов возникают бессимптомные камни желчного пузыря или билиарный сладж [134]. Соответственно до лечения и каждые 6 месяцев на фоне приема препарата необходимо проведение УЗИ желчного пузыря. У пациентов с непереносимостью одного из аналогов возможно эффективное и безопасное применение другого препарата из класса аналогов соматостатина.
Антагонист рецептора гормона роста
Пэгвисомант** представляет собой генно-инженерную модифицированную молекулу СТГ, которая активно и селективно взаимодействует с одной из субъединиц димеризованного рецептора СТГ и блокирует стимуляцию второй субъединицы, препятствуя, таким образом, нормальному функционированию рецептора, передаче сигнала и биологическому действию СТГ в периферических тканях. Этот препарат имеет дозировки 10, 15, 20 мг, выпускается в форме лиофилизата или лиофилизированного порошка, требует разведения и вводится подкожно 1 раз в сутки.
- При частичной/полной резистентности к аналогам соматостатина или их непереносимости в качестве второй линии медикаментозной терапии акромегалии рекомендуется назначение пэгвисоманта** [108][135].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1).
Комментарии: Cогласно исследованию ACROSTUDY, которое оценивало эффективность и безопасность терапии пэгвисомантом** в реальной клинической практике и включило 2221 пациента с акромегалией, получавшего лечение пэгвисомантом** в течение 9,3 лет, данный вид лечения позволил достичь нормализации уровня ИФР-1 у 75,4% пациентов [136]. В 16,5% случаев возникли нежелательные явления, наиболее частые из них: повышение печеночных ферментов (4,4%) и местная реакция в области инъекций (3,2%) [136]. Терапия пэгвисомантом** в большинстве случаев позволяет нормализовать состояние углеводного обмена, что является его неоспоримым преимуществом перед другими препаратами в лечении акромегалии [137]. Пэгвисомант** может применяться как в качестве монотерапии, так и в комбинации с аналогами соматостатина. Комбинированная терапия целесообразна при частичной резистентности к аналогам соматостатина и при большом объеме остаточной опухолевой ткани для предотвращения ее роста. Комбинированная терапия аналогами соматостатина и пэгвисомантом** обладает высокой эффективностью, позволяет нивелировать неблагоприятное влияние аналогов соматостатина на углеводный обмен, стабилизировать рост опухоли, при этом требует меньших доз [138].
- Пациентам с акромегалией для инициации терапии пэгвисомантом** рекомендуется однократно ввести нагрузочную дозу 40–80 мг в сутки подкожно, далее продолжать инъекции в стартовой дозе 10 или 15 мг в сутки с контролем уровня ИФР-1 через 4–6 недель и коррекцией дозы при необходимости [139].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2)
Комментарии: В исследовании ACROSTUDY стартовая доза у большинства пациентов с акромегалией в реальной клинической практике составила 10 мг в сутки (66,8%), в то время как уже через год лечения доля пациентов, получающих такую дозу, значительно уменьшилась (31,1%) [136]. Поэтому при выраженном превышении уровня ИФР-1 верхней границы референса целесообразно начинать с дозы 15 мг в сутки. Нагрузочная доза 40–80 мг при инициации лечения, указанная в инструкции, способствует более быстрому развитию эффекта лечения и обусловлена длительной абсорбцией пэгвисоманта**. Коррекция дозы пэгвисоманта** с шагом 5–10 мг проводится каждые 4–6 недель под контролем уровня ИФР-1. Максимальная доза, согласно инструкции по применению, составляет 30 мг в сутки, однако более высокие дозы (40–60 мг в сутки) успешно применялись в клинической практике «оффлейбл» у пациентов молодого возраста, с сахарным диабетом, избыточной массой тела или более высокими исходными значениями ИФР-1, так как потребность в пэгвисоманте** у данной категории пациентов выше [140].
- Пациентам, получающим лечение пэгвисомантом**, рекомендуется контролировать уровни печеночных ферментов и размер аденомы гипофиза до начала терапии и в ходе лечения [105].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 3)
Комментарии: На фоне лечения пэгвисомантом** может наблюдаться головная боль, боли в суставах, липодистрофия в местах инъекций, повышение печеночных ферментов [135][139] . Для снижения риска возможной липодистрофии рекомендуется регулярная смена мест введения препарата. Повышение печеночных ферментов наблюдается у 4,4%, протекает обычно бессимптомно, обратимо после прекращения терапии пэгвисомантом** или снижения дозы. У некоторых пациентов после возобновления лечения пэгвисомантом** повторно могут возникать нарушения функции печени. В течение первых 6 месяцев лечения рекомендована оценка печеночных ферментов каждые 4–6 недель или при возникновении симптомов нарушения функции печени. При повышении уровня трансаминаз более, чем в 5 раз выше верхней границы нормы, появлении клинических признаков гепатита, повышении других лабораторных показателей печеночной функции лечение пэгвисомантом** должно быть прекращено [141]. Более подробная информация о тактике коррекции доз пэгвисоманта** при повышении печеночных ферментов представлена в инструкции. Безопасность терапии пэгвисомантом** при почечной недостаточности не известна. Почечная недостаточность является противопоказанием к инициации терапии пэгвисомантом**. Пэгвисомант** — это препарат периферического действия, он не оказывает прямого антипролиферативного эффекта на аденому гипофиза [142]. Поэтому монотерапия пэгвисомантом** не подходит пациентам с акромегалией, не получивших нейрохирургического лечения, с большим объемом остаточной опухолевой ткани после нерадикального хирургического вмешательства без предшествующей лучевой терапии, или с растущей аденомой гипофиза. Поскольку терапия пэгвисомантом** нарушает отрицательную обратную связь, регулирующую секрецию СТГ, возникло опасение, что это лечение может способствовать росту опухоли. Согласно систематическому обзору Leonart L.P с соавторами, частота роста опухоли на фоне терапии пэгвисомантом** составила 7,3% случаев [135]. Необходимо помнить, что прогрессия аденомы может быть обусловлена прекращением терапии аналогами соматостатина или естественной агрессивной природой опухоли при некомпенсированной акромегалии. Однако контроль размеров аденомы с помощью МРТ необходим до начала лечения пэгвисомантом**, через 6 месяцев после инициации терапии и затем каждые 12 месяцев на фоне лечения [143].
Агонисты дофаминовых рецепторов
Агонисты дофаминовых рецепторов — это первые лекарственные препараты, которые начали применять для лечения акромегалии еще в 70-х годах прошлого века. Эти препараты взаимодействуют со специфическими дофаминовыми рецепторами 2 типа (ДР2), которые представлены на поверхности клеток здорового гипофиза и аденом различного типа секреции. Хотя у здоровых людей введение агонистов дофаминовых рецепторов вызывает повышение секреции СТГ, у некоторых пациентов с акромегалией наблюдается парадоксальное снижение его секреции. Эффективность препаратов первого поколения (неселективных агонистов дофаминовых рецепторов короткого действия) при акромегалии не превышала 10%. Современный препарат из этой группы, каберголин** обладает практически полной селективностью по отношению ДР2, пролонгированным действием, более высокой эффективностью и лучшей переносимостью [144]. Однако он не занял заметного места в структуре медикаментозной терапии акромегалии, что связано в основном с отсутствием рандомизированных контролируемых исследований эффективности каберголина** при акромегалии. Кроме того, в инструкции к препарату нет такого показания, как лечение акромегалии.
- Пациентам с акромегалией и умеренным повышением уровня ИФР-1 рекомендуется назначение каберголина** в качестве медикаментозной монотерапии или при неэффективности аналогов соматостатина — в комбинации с ними [145].
Уровень убедительности рекомендаций 2 (уровень достоверности доказательств — B)
Комментарии: Согласно мета-анализу Sandret L. с соавторами, монотерапия каберголином** позволила достичь нормализации ИФР-1 у 34% пациентов с акромегалией, а комбинированная терапия с аналогами соматостатина — в 52% случаев. Уменьшение размера аденомы гипофиза было отмечено у трети пациентов. Cредняя доза каберголина** в обоих случаях составила 2,5 мг в неделю [145], что превышает средние дозы каберголина**, применяемые при пролактин-секретирующих аденомах гипофиза. Одним из основных предикторов чувствительности к каберголину** является исходный уровень ИФР-1. Шансы достичь нормализации ИФР-1 на фоне лечения каберголином** были значительно выше (около 50%), если уровень ИФР-1 превышал верхнюю границу нормы менее, чем в 1,5 раза, чем в группе пациентов с акромегалией у которых концентрация ИФР-1 превышала норму более, чем в 1,5 раза (30%) [145]. Более поздние исследования демонстрируют более низкую эффективность каберголина** как в качестве монотерапии (21–36%) [146–149], так и в комбинации с аналогами соматостатина (30–40%) [146–149]. Существуют также небольшие наблюдения, демонстрирующие достижение ремиссии акромегалии на фоне комбинированной терапии каберголином** и пэгвисомантом**[150]. Вопрос о предиктивном значении гиперпролактинемии в лечении акромегалии каберголином** остается спорным [145]. Показано, что терапия каберголином** при акромегалии может быть эффективна и у пациентов с нормальным уровнем пролактина крови [151][152]. Скорее всего, противоречивые данные исследований обусловлены тем, что гиперпролактинемия, которая встречается у 30–40% пациентов с акромегалией, может быть вызвана как масс-эффектом опухоли, так и смешанным характером секреции аденомы. С другой стороны, при смешанной СТГ/пролактин-секретирующей опухоли уровень пролактина крови может быть нормальным [22].
- Пациентам с акромегалией, получившим каберголин** в кумулятивной дозе более 300 мг рекомендуется проведение эхокардиографии для исключения поражения клапанов сердца [153][154]
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: Каберголин** обычно хорошо переносится, особенно, когда недельная доза принимается в несколько приемов и препарат назначется на ночь. Необходимо информировать пациентов о возможных побочных эффектах каберголина**, таких как: нарушения функции желудочно-кишечного тракта (тошнота, боли в животе, запоры), ортостатическая гипотензия, головная боль, заложенность носа. Терапия каберголином** может вызывать брадикардию и синдром слабости синусового узла у пациентов с акромегалией, так как эти пациенты предрасположены к нарушениям ритма и проводимости сердца. Известно, что терапия каберголином** в высоких дозах у пациентов с болезнью Паркинсона может вызывать поражение клапанов сердца. У пациентов с акромегалией патология клапанного аппарата может встречаться в рамках осложнений основного заболевания. Несмотря на то, что проводимые исследования указывают на безопасность терапии каберголином** у пациентов с акромегалии [155], долгосрочных данных о влиянии каберголина на состояние клапанов сердца при акромегалии нет, что требует динамического наблюдения у пациентов, получающих высокие дозы каберголина** или при длительной терапии [153].
ЛУЧЕВЫЕ МЕТОДЫ ЛЕЧЕНИЯ
Облучение — метод третьей линии в лечении акромегалии. Он преимущественно используется, если хирургическое и/или медикаментозное лечение неэффективно или противопоказано. Для лечения акромегалии существует два основных вида лучевой терапии: традиционная фракционная радиотерапия и стереотаксическая радиохирургия. Традиционная фракционная радиотерапия изначально проводилась с помощью линейных ускорителей с двумя пучками излучения. Ограничением данного метода являлась невозможность точной фокусировки и возможность лучевого повреждения окружающих тканей, в связи с чем на смену данному методу пришла трехмерная конформная лучевая терапия (3DCRT). При проведении 3DCRT с помощью данных КТ или МРТ получают трехмерное изображение, используемое со специальным программным обеспечением, что позволяет подобрать оптимальное количество пучков излучения и использовать большую дозу при меньшем повреждении окружающих тканей. К стереотаксической радиохирургии относятся гамма-нож, кибер-нож и линейный ускоритель с применением высокоэнергетических фотонов и облучение тяжёлыми частицами (например, протонотерапия). При использовании аппарата гамма-ножа голова пациента фиксируется с помощью рамы для иммобилизации, после чего проводится высокоточное излучение 201 источником излучения. Для применения кибер-ножа используется небольшой линейный ускоритель, установленный на двигающемся кронштейне, позволяющий небольшой диапазон движений пациента, под который можно подстраиваться во время процедуры. Линейный ускоритель относится к стереотаксическому виду облучения, но он использует не гамма-излучение, а фотонные пучки. Преимуществом стереотаксической радиохирургии является возможность провести процедуру одномоментно или за небольшое количество сеансов, в отличие от длительного лечения при традиционной фракционной радиотерапии.
- Пациентам с акромегалией в случаях сохранения активности заболевания после хирургического лечения, при недоступности, непереносимости или неэффективности медикаментозного лечения и нецелесообразности повторного нейрохирургического вмешательства рекомендуется проводить лучевую терапию [157–160].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1)
Комментарии: Согласно недавнему метаанализу, при облучении пациентов с акромегалией контроль роста опухоли был достигнут в 97% случаев, биохимическая ремиссии акромегалии — у 44% пациентов, гипопитуитаризм развился в 17% [161]. Сроки наступления ремиссии варьируют в зависимости от метода облучения и составляют от 1,5 до 20 лет. Облучение рассматривается как запасной метод в лечении акромегалии, так как хирургическое лечение, по сравнению с лучевой терапией, приводит к ремиссии значительно быстрее, реже приводит к гипопитуитаризму, и позволяет исследовать морфологические признаки опухоли, влияющие на выбор медикаментозной терапии и прогноз. Медикаментозная терапия также дает более быстрый эффект, чем лучевая терапия и не приводит к развитию гипопитуитаризма. Кроме того, в нескольких исследованиях было показано, что смертность пациентов с акромегалией, перенесших лучевую терапию, выше, чем у тех пациентов, которым данный вид лечения не проводился, это влияние не зависело от достижения ремиссии акромегалии [162–167]. Необходимо учитывать, что пациенты, включенные в эти исследования, получили лучевую терапию 15–20 лет назад, технологии с тех пор были усовершенствованы и, возможно, взгляд на лучевую терапию в будущем изменится.
Показания к лучевой терапии
Лучевая терапия рекомендована пациентам, у которых нейрохирургическое вмешательство не позволило радикально удалить опухоль и имеется резистентность/непереносимость медикаментозной терапии. Также применение лучевой терапии целесообразно при неполном хирургическом удалении аденомы гипофиза вследствие труднодоступности опухолевой ткани (инвазия в окружающие структуры, включая кавернозные синусы) [168], агрессивном характере роста аденомы гипофиза (рецидивирование после хирургического удаления), особенно в сочетании с неблагоприятной гистологической картиной (индекс клеточной пролиферации Ki-67 более 3%) [169], необходимости сокращения длительности медикаментозной терапии после неэффективного нейрохирургического лечения (для уменьшения стоимости лечения, либо при плохой переносимости терапии) [58].
Противопоказания к лучевой терапии
Проведение лучевой терапии противопоказано при близком расположении аденомы к перекресту зрительных нервов (менее 3 мм для гамма-ножа и менее 6 мм для кибер-ножа), особенно при наличии дефектов полей зрения, так как после проведения лучевой терапии возникает отек, способный усугублять имеющиеся нарушения зрения [170]. При таком расположении аденомы, перед планируемым облучением целесообразно провести хирургическое лечение с целью удаления супраселлярного компонента опухоли. У пациентов с акромегалией и синдромом МакКьюна–Олбрайта лучевая терапия может вызвать злокачественные опухоли костей черепа [171]. Повторную лучевую терапию желательно проводить не ранее, чем через 5 лет после предыдущей в связи с высоким риском постлучевых некрозов, сосудистых, зрительных, неврологических и эндокринных нарушений [172].
- При выборе метода облучения при акромегалии рекомендуется отдавать предпочтение стереотаксической радиохирургии, в связи с большей эффективностью и меньшим риском развития гипопитуитаризма [173]
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2)
Комментарии: Эффективность применения стереотаксической радиохирургии выше по сравнению с фракционной радиотерапией (52%, по сравнению с 36%), а частота развития гипопитуитаризма ниже: 32% при стереотаксической радиохирургии и 51% при фракционной радиотерапии [173]. Роль длительно действующих аналогов соматостатина и в меньшей степени агонистов дофаминовых рецепторов в качестве радиопротективных агентов во время проведения лучевой терапии до сих пор полностью не доказана, поэтому при наличии показаний возможно продолжение терапии данными препаратами в процессе облучения [174][175]
- Всем пациентам с акромегалией после лучевой терапии рекомендуется регулярное обследование для оценки достижения ремиссии заболевания и исключения развития гипопитуитаризма [176]
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 3)
Комментарии: Развитие как ремиссии акромегалии, так и гипопитуитаризма после лучевой терапии может быть отсрочено [161], поэтому необходимо информировать пациентов о возможных симптомах надпочечниковой недостаточности, гипотиреоза, гипогонадизма и проводить лабораторное исследование для исключения этих осложнений 1 раз в 6 месяцев в постлучевом периоде (см. Таблица 2) [95]. Кроме того, при достижении биохимической ремиссии акромегалии после облучения на фоне медикаментозной терапии, если ранее отмечалась резистентность к проводимой терапии, или при выраженном снижении уровня ИФР-1 даже в пределах референсных значений необходим более частый контроль уровня ИФР-1 (1 раз в 3 месяца) для своевременного уменьшения объема консервативной терапии.
Клинические рекомендации касаются только самых общих, часто встречающихся методов ведения пациентов с акромегалией и не могут охватить все возможные ситуации. При сложных диагностических случаях, необходимости ведения коморбидных пациентов, резистентности пациента к проводимому лечению, акромегалии в детском возрасте, для применения персонализированного подхода показана госпитализация пациента в Федеральные центры, имеющие большой опыт ведения пациентов с акромегалией [68].
МЕДИЦИНСКАЯ РЕАБИЛИТАЦИЯ,
МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ
К ПРИМЕНЕНИЮ МЕТОДОВ МЕДИЦИНСКОЙ РЕАБИЛИТАЦИИ
Одним из частых осложнений акромегалии, которое значительно ухудшает качество жизни, является поражение опорно-двигательного аппарата и челюстно-лицевого скелета. Распространенность артропатий при акромегалии, даже при достижении ремиссии заболевания, выше, чем в общей популяции. У большинства пациентов есть жалобы на боли в суставах, почти у всех наблюдаются рентгенологические признаки остеоартрита [97]. Кроме того, акромегалия приводит к изменениям как силы периферических мышц, так и выносливости, наблюдается снижение мышечной силы, несмотря на выраженную мышечную гипертрофию.
Такие проявления акромегалии как прогнатизм и диастема приводят к нарушению прикуса, сложностям в пережевывании пищи, вторичным поражениям височно-нижнечелюстного сустава и ранней потере зубов [177].
Реабилитация пациентов с акромегалией должна быть основана на общеизвестных принципах: раннее начало, непрерывность, последовательность, комплексность, а также индивидуальный подход в проведении лечебных мероприятий.
- Пациентам с акромегалией, жалующимся на боли в позвоночнике, нарушение походки и равновесия или поражение коленных, тазобедренных суставов, рекомендована консультация врача по лечебной физкультуре для определения интенсивности и объема реабилитационных мероприятий [98][178–180].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4).
Комментарии: Пациентам с акромегалией и поражением коленных суставов полезны регулярные физические упражнения не менее 3-х раз в неделю для укрепления силы четырехглавой мышцы бедра и увеличения объема движений, аэробные нагрузки [179]. При поражении тазобедренных суставов также требуется выполнение лечебной физкультуры, особенно силовых упражнений. Регулярные физические упражнения и социальная адаптация не только улучшают самочувствие пациента с акромегалией, снижают интенсивность боли, но и положительно воздействуют на самовосприятие и эмоциональный фон [98]. При болях и/или деформациях суставов стоп рекомендуется использовать ортопедические стельки и ортопедическую обувь. Пациентам с жалобами на боли в позвоночнике, нарушения походки и равновесия или с длительным анамнезом заболевания рекомендованы упражнения для коррекции осанки и постурального тонуса [181][182]. Для укрепления мышц спины пациентам может проводиться физиотерапия [183]. Ортезы улучшают качество жизни, осанку и предотвращают увеличение угла кифоза [184]. При остеопорозе у пациентов с акромегалией возможна реабилитация согласно клиническим рекомендациям по остеопорозу. Выбор вида ортопедического корсета зависит от степени деформации позвоночника и проводится в индивидуальном порядке.
- Пациентам с акромегалией, жалующимся на боли в области височно-нижнечелюстного сустава в покое или при жевании, а также имеющим прогнатизм, диастему и ограничение открывания рта, рекомендован прием (осмотр, консультация) врача-стоматолога-ортопеда или прием (осмотр, консультация) врача-челюстно-лицевого хирурга для определения объема реабилитационных мероприятий [177][185]
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4).
Комментарии: Симптомы челюстно-лицевых осложнений возникают у значительного числа пациентов с акромегалией и часто требуют обращения к стоматологам. Лечение включает ортодонтическую помощь с установкой сложных ортодонтических несъёмных конструкций (аппаратов) для коррекции положения зубов при нарушениях прикуса и неровности зубного ряда, а также хирургическую коррекцию размеров и положения нижней челюсти. Лечение целесообразно проводить после достижения ремиссии акромегалии [186–188].
ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ,
МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ
К ПРИМЕНЕНИЮ МЕТОДОВ ПРОФИЛАКТИКИ
Первичной профилактики для акромегалии не разработано. Вторичная профилактика заключается в предотвращении рецидива заболевания, чему способствует максимально радикальное удаление аденомы гипофиза и пожизненное ежегодное наблюдение за пациентом.
ОРГАНИЗАЦИЯ ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ
АМБУЛАТОРНЫЙ ЭТАП ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ:
- проведение лабораторного обследования с определением гормональных показателей в крови (СТГ, ИФР-1, СТГ в ходе ПГПТ, пролактин, ТТГ, свТ4, ФСГ, ЛГ, эстрадиол, тестостерон, кортизол, гликированный гемоглобин, биохимический общетерапевтический анализ крови, кальций общий, альбумин, клинический анализ крови) при доступности на амбулаторном этапе;
- проведение МРТ головного мозга с контрастным усилением при доступности на амбулаторном этапе;
- консультации смежных специалистов по показаниям;
- назначение и коррекция медикаментозной терапии при выборе консервативной тактики ведения;
- послеоперационная реабилитация.
ПОКАЗАНИЯ ДЛЯ ПЛАНОВОЙ ГОСПИТАЛИЗАЦИИ В МЕДИЦИНСКУЮ ОРГАНИЗАЦИЮ:
- необходимость проведения лабораторного обследования при недоступности на амбулаторном этапе;
- необходимость проведения МРТ головного мозга при недоступности на амбулаторном этапе или при необходимости проведения МРТ с седацией;
- необходимость проведения комплексного обследования в сложных диагностических случаях;
- необходимость проведения комплексного обследования для решения вопроса об оптимальной лечебной тактике;
- необходимость проведения нейрохирургического лечения в высокоспециализированном стационаре;
- необходимость проведения комплексного лабораторно-инструментального обследования для оценки эффективности проводимого лечения.
ПОКАЗАНИЯ К ВЫПИСКЕ ПАЦИЕНТА ИЗ СТАЦИОНАРА:
- стойкое улучшение состояния, когда пациент может без ущерба для здоровья продолжить лечение в амбулаторно-поликлиническом учреждении или домашних условиях, или стабильное состояние пациента с последующей плановой госпитализацией в хирургическое отделение для оперативного лечения;
- при необходимости перевода пациента в другую организацию здравоохранения;
- грубое нарушение пациентом госпитального режима;
- по письменному требованию пациента либо его законного представителя, если выписка не угрожает жизни и не представляет опасности для окружающих. В этом случае выписка из стационара может быть произведена только с разрешения главного врача больницы или его заместителя по лечебной работе.
Критерии качества оказания медицинской помощи при акромегалии представлены в таблице 6.
Таблица 6. Критерии оценки качества медицинской помощи
Table 6. Criteria for medical care quality assessment
№ | Критерии качества | Оценка выполнения (да/нет) |
1 | Выполнено исследование инсулиноподобного ростового фактора 1 в крови | Да/нет |
2 | При уровне инсулиноподобного ростового фактора 1 в крови менее, чем в 1,5 раза превышающем верхнюю границу нормы, и отсутствии явных клинических проявлений акромегалии, выполнено исследование соматотропного гормона в ходе перорального глюкозо-толерантного теста | Да/нет |
3 | Выполнена магнитно-резонансная томография головного мозга с внутривенным контрастированием | Да/нет |
4 | Исследован уровень глюкозы крови и HbA1c | Да/нет |
5 | Выполнен анализ крови биохимический общетерапевтический | Да/нет |
6 | Выполнен анализ крови на кальций общий, альбумин | Да/нет |
7 | Выполнено лабораторное исследование для исключения/подтверждения гипопитуитаризма | Да/нет |
8 | Проведена трансфеноидальная аденомэктомия | Да/нет |
9 | Проведено иммуногистохимическое исследование удаленной опухолевой ткани | Да/нет |
10 | Назначено лечение при подтверждении/сохранении активной стадии акромегалии | Да/нет |
11 | Скорректировано лечение при отсутствии эффекта от проводимой терапии через 6 месяцев от начала лечения | Да/нет |
12 | Достигнут контроль акромегалии (ИФР-1 индекс менее 1) | Да/нет |
ОСЛОЖНЕНИЯ АКРОМЕГАЛИИ
Избыточная секреция СТГ и ИФР-1 при акромегалии пагубно влияет на различные органы и системы и обусловливает многообразие клинических проявлений и осложнений заболевания. При ведении пациентов с акромегалией осложнениям необходимо уделять особое внимание по нескольким причинам: именно осложнения могут существенно сокращать продолжительность жизни и снижать ее качество, осложнения могут влиять на выбор оптимального метода лечения. Несмотря на то, что часто изменения при акромегалии необратимы, своевременная диагностика и адекватное лечение акромегалии в некоторых случаях все же позволяют предотвратить осложнения, замедлить их прогрессирование и даже подвергнуть обратному развитию.
Нарушения углеводного обмена — это самое частое метаболическое осложнение акромегалии, которое выявляется у 12–37% пациентов [14][48] и является важным предиктором повышенной смертности [189]. Инсулинорезистентность, гиперинсулинемия и повышенный глюконеогенез — ключевые звенья патогенеза нарушений углеводного обмена при акромегалии [133]. С целью диагностики определяют уровень глюкозы в крови натощак, гликированный гемоглобин (HbA1c), проводят ПГТТ. В случае подтверждения нарушений углеводного обмена (нарушение толерантности к глюкозе, нарушение гликемии натощак) и сахарного диабета первой линией терапии признается метформин. При недостижении целевых показателей гликемического контроля возможна интенсификация терапии с присоединением агонистов глюкагоноподобного пептида 1 и ингибиторов дипептидилпептидазы 4, инсулинотерапии. Использования ингибиторов натрий-глюкозного ко-транспортера, согласно некоторым наблюдениям, следует избегать в связи с повышенным риском кетоацидоза у пациентов с акромегалией [133][190]. Терапия аналогами соматостатина может оказывать противоположное действие на углеводный обмен при акромегалии: за счет подавления избыточной секреции СТГ и ИФР-1 приводить к улучшению углеводного обмена или за счет снижения выброса инсулина вызывать нарушения углеводного обмена (особенно применение аналогов соматостатина второго поколения [191]. Лечение пэгвисомантом** улучшает все показатели углеводного обмена: снижает уровни глюкозы в плазме и гликированного гемоглобина, улучшает чувствительность тканей к инсулину, снижает потребность в сахароснижающих препаратах [192]
Распространенность нарушений липидного обмена при акромегалии не превышает общепопуляционной. Диагностика включает в себя определение уровней общего холестерина, липопротеидов низкой плотности (ЛПНП), липопротеидов высокой плотности (ЛПВП) в сыворотке крови. Алгоритм лечения предполагает модификацию образа жизни, назначение статинов (возможно, в комбинации с эзетимибом), фибратов и ингибиторов синтеза белка PCSK9 для достижения целевых показателей липидного спектра крови [193].
Артериальная гипертензия встречается примерно у 35% пациентов с акромегалией и играет ключевую роль в развитии сердечно-сосудистых осложнений, что подчеркивает необходимость ее выявления и медикаментозного контроля [194]. Подходы к ведению пациентов с акромегалией, имеющих артериальную гипертензию, аналогичны таковым в общей популяции. Терапия включает в себя назначение ингибиторов АПФ, препаратов группы сартанов, блокаторов кальциевых каналов, бета-адреноблокаторов, агонистов I1-имидазолиновых рецепторов [195].
Акромегалическая кардиомиопатия — специфическое поражение сердца, обусловленное длительной гиперпродукцией СТГ и ИФР-1. Данное осложнение характеризуется кардиомегалией, бивентрикулярной гипертрофией миокарда, фиброзом и дегенерацией кардиомиоцитов [196]. При тяжелом течении акромегалическая кардиомиопатия приводит к развитию сердечной недостаточности с низкой фракцией выброса. Основным диагностическим тестом является эхокардиография. Важнейший фактор положительного прогноза в лечении акромегалической кардиомиопатии — ремиссия основного заболевания, при невозможности ее достижения показано применение медикаментозной терапии в соответствии с клиническими рекомендациями. Однако медикаментозная терапия аналогами соматостатина и пэгвисомантом** позволяет достичь улучшения показателей сердечно-сосудистой системы даже при отсутствии нормализации гормональных показателей [197].
Нарушения ритма и проводимости сердца встречаются у 7–40% пациентов с акромегалией и являются основной причиной внезапной смерти пациентов с акромегалией [198]. Развитие аритмий связано с прогрессированием фиброза миокарда, что обусловливает его электрическую неоднородность и нестабильность. Для диагностики рекомендуется выполнение суточного мониторирования электрокардиографии, а также динамический мониторинг показателей до и после инициации медикаментозной терапии акромегалии, так как применение аналогов соматостатина и каберголина** могут повышать частоту нарушений ритма при акромегалии.
Апноэ сна встречается у 80% пациентов с акромегалией [199]. Алгоритм диагностики включает в себя сбор анамнеза с расспросом супруга/партнера об особенностях сна пациента, использование специализированных опросников, таких как шкала Эпворта, Питтсбургский индекс качества сна, а также проведение полисомнографии [200]. Значительный вклад в разрешение дыхательных нарушений вносит достижение ремиссии основного заболевания, в случае сохранения обструктивного апноэ, показано проведение искусственной вентиляции лёгких постоянным положительным давлением методом CPAP (Constant Positive Airway Pressure) [201].
Гипопитуитаризм при акромегалии может быть обусловлен масс-эффектом соматотропиномы и/или сопутствующей гиперпролактинемией [202][203], проведенным нейрохирургическим лечением и облучением. Диагностика предполагает исследование уровней ЛГ, ФСГ, эстрадиола у женщин с нарушениями менструального цикла, тестостерона у мужчин, свободных фракций Т4, утреннего кортизола в крови, пролактина, оценку осмоляльности крови и мочи с контролем баланса потребления и выделения жидкости в сутки, при необходимости — проведение пробы с водной депривацией. Лечение заключается в медикаментозном восполнении выявленного гормонального дефицита [95].
Злокачественные новообразования при акромегалии выходят на первое место в структуре смертности. В случае акромегалии встречаемость рака толстой кишки и щитовидной железы выше по сравнению с общей популяцией [204]. При этом не все исследователи подтверждают ассоциацию между акромегалией и уровнем смертности от рака толстой кишки [205]. Несмотря на это, тактика ведения пациентов с акромегалией включает в себя проведение колоноскопии, учитывая известный ростостимулирующий эффект СТГ и ИФР-1 [206][207]. В отношении патологии щитовидной железы при акромегалии рутинный скрининг рака не показан, однако в случае выявления факторов риска и/или узловых образований щитовидной железы рекомендуется проведение УЗ-исследования, оценка уровня кальцитонина в сыворотке крови, выполнение тонкоигольной аспирационной биопсии (по показаниям) [208][209].
Остеопороз и низкотравматические переломы встречаются при акромегалии чаще, чем в популяции, в том числе и в молодом возрасте. Повышенное содержание СТГ и ИФР-1 в сыворотке крови пациентов с акромегалией вызывает ускорение костного метаболизма с нарушением архитектоники кортикальной и трабекулярной структуры костной ткани [210][211]. Для оценки ее минеральной плотности показано проведение рентгеновской денситометрии, для исключения компрессионных переломов — рентгенография грудного и поясничного отделов позвоночника в боковой проекции. При выявлении остеопороза рекомендуется назначение антирезорбтивной терапии на фоне коррекции гипогонадизма, являющегося независимым фактором риска переломов [212].
Остеоартриты при акромегалии возникают вследствие специфического поражения суставов избытком СТГ и ИФР-1, заключающегося в гипертрофии хрящей и формировании остеофитов [213][214]. Наиболее точным методом диагностики артропатии является МРТ, но на первых этапах достаточно проведения рентгенографии пораженного сустава. Главной составляющей лечения является достижение ремиссии акромегалии, также показано проведение комплексных реабилитационных мероприятий: физиотерапии, системной и/или внутрисуставной противовоспалительной и анальгетической терапии, при наличии показаний — выполнение корригирующих хирургических вмешательств после достижения ремиссии основного заболевания [215][216].
Орофациальные дисфункции при акромегалии проявляются при запоздалой диагностике изменением прикуса, прогнатизмом, диастемой, асимметрией лица, патологией височно-челюстных суставов, нарушением речи, что снижает качество жизни пациентов. Эти осложнения обусловлены разрастанием мягких тканей, костей и хрящей. К сожалению, изменения костной и хрящевой ткани при акромегалии необратимы и могут требовать корректирующего хирургического лечения, которое проводится только после достижения биохимической ремиссии основного заболевания [57][217].
Депрессивные расстройства при акромегалии возникают с большей частотой по сравнении с общей популяцией, выражаются тревожностью, сниженной самооценкой, депрессией, эмоциональной лабильностью и являются одним из факторов, снижающих качество жизни [218]. Учитывая наибольший вклад клинических проявлений акромегалии и ассоциированного с ними снижения качества жизни в возникновение депрессивных расстройств, лечебные мероприятия должны быть направлены на достижение ремиссии основного заболевания и нивелирование его осложнений [219].
Алгоритм наблюдения пациентов с акромегалией с фокусом на осложнения представлен в таблице 7.
- Рекомендуется мультидисциплинарный подход в лечении осложнений акромегалии [58].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 3)
Комментарии: Доступность различных методов лечения акромегалии, а также разнообразие хронических осложнений обуславливают необходимость мультидисциплинарного подхода в ведении пациентов с акромегалией, включающего активное участие врачей смежных специальностей [58].
Таблица 7. Алгоритм наблюдения пациентов с акромегалией
Table 7. Management algorithm for patients with acromegaly
Метод диагностики | Частота применения | Комментарии |
Активность акромегалии | ||
Исследование уровня ИФР-1 | 1 раз в 1,5 месяца | При подборе медикаментозной терапии пэгвисомантом** до нормализации уровня ИФР-1 |
1 раз в 3 месяца | После нейрохирургического лечения или при подборе медикаментозной терапии аналогами соматостатина до нормализации уровня ИФР-1; в ожидании эффекта лучевой терапии | |
1 раз в 6 месяцев | На фоне медикаментозной терапии при стойкой нормализации уровня ИФР-1 | |
1 раз в 12 месяцев | В случае радикального хирургического или лучевого лечения | |
МРТ гипофиза | 1 раз в 6 месяцев | При отсутствии ремиссии после нейрохирургического лечения и при инициации медикаментозной терапии |
1 раз в 12 месяцев | При наблюдении на фоне медикаментозной терапии и наличии остаточной опухолевой ткани, после лучевой терапии | |
Сердечно-сосудистые осложнения | ||
Измерение АД | При каждом визите к врачу | |
ЭКГ | При установлении диагноза акромегалии, затем 1 раз в 12 месяцев | |
Суточное мониторирование ЭКГ | При установлении диагноза акромегалии | Если длительность заболевания более 5 лет |
1 раз в 6-12 месяцев | При выявлении изменений | |
Эхокардиография | При установлении диагноза акромегалии | Если длительность заболевания более 5 лет |
1 раз в 6-12 месяцев | При выявлении изменений | |
Эндокринные и метаболические осложнения | ||
Показатели углеводного обмена | Глюкоза крови натощак, HbA1c — 1 раз в 12 месяцев | При нормальном углеводном обмене |
Глюкоза крови натощак, HbA1c — каждые 6 месяцев | При нарушенном углеводном обмене, на фоне терапии аналогами соматостатина | |
Показатели липидного обмена | Общий холестерин, триглицериды, холестерин ЛПНП, холестерин ЛПВП 1 раз в 12 месяцев | При нормальном липидном обмене |
Общий холестерин, триглицериды, холестерин ЛПНП, холестерин ЛПВП 1 раз в 6 месяцев | При нарушенном липидном обмене | |
Опросники апноэ (шкала Эпворта, Питтсбургский индекс качества сна), полисомнография | При установлении диагноза акромегалии, затем 1 раз в 12 месяцев | Дополнительно — в рамках предоперационной подготовки, полисомнография — при показаниях |
Анализ крови на пролактин, ФСГ, ЛГ, эстрадиол (у женщин при нарушении менструального цикла), тестостерон (у мужчин) | При установлении диагноза акромегалии | |
1 раз в 6 месяцев | При выявлении нарушений | |
Через 3, 6 и 12 месяцев или при появлении симптомов | После нейрохирургического лечения | |
1 раз в 6 месяцев или при появлении симптомов | После лучевой терапии | |
Анализ крови на свТ4 | 1 раз в 6 месяцев | При наличии аденомы гипофиза размером более 8 мм |
Через 3, 6 и 12 месяцев | После нейрохирургического лечения | |
1 раз в 6 месяцев | После лучевой терапии | |
Анализ крови на кортизол с 7 до 9 утра | 1 раз в 6 месяцев | При наличии аденомы гипофиза размером более 8 мм |
Через 3, 6 и 12 месяцев или при появлении симптомов | После нейрохирургического лечения | |
1 раз в 6 месяцев или при появлении симптомов | После лучевой терапии | |
Пальпация щитовидной железы | При каждом визите | При увеличении щитовидной железы, пальпируемых узловых образованиях или выявленных ранее по УЗИ узловых образованиях щитовидной железы — УЗИ щитовидной железы, анализ крови на кальцитонин, ТТГ |
Осложнения со стороны костной системы | ||
Рентгенография грудного и поясничного отделов позвоночника в боковой проекции; рентгеновская денситометрия поясничного отдела позвоночника и проксимального отдела бедренной кости | 1 раз в 2 года | При наличии факторов риска переломов |
1 раз в 12 месяцев | При наличии остеопороза, переломов позвонков, отсутствии заместительной терапии гипогонадизма, отсутствии ремиссии акромегалии | |
Онконастороженность | ||
УЗИ щитовидной железы, контроль уровня ТТГ и свТ4 крови | 1 раз в год | При увеличении щитовидной железы или узловых образованиях |
Колоноскопия | При установлении диагноза акромегалии | Возраст старше 40 лет |
1 раз в 10 лет | Возраст старше 40 лет | |
1 раз в 12 месяцев | При выявлении изменений на колоноскопии | |
1 раз в 5 лет | При сохранении активной стадии акромегалии или отягощенном наследственном анамнезе по раку толстой кишки | |
Оценка качества жизни | ||
Опросник качества жизни AcroQoL | 1 раз в 12 месяцев | |
АКРОМЕГАЛИЯ И БЕРЕМЕННОСТЬ
ПОДГОТОВКА ПАЦИЕНТОК С АКРОМЕГАЛИЕЙ К БЕРЕМЕННОСТИ
Акромегалия приводит к развитию бесплодия за счет следующих механизмов: гипопитуитаризм, гиперпролактинемия на фоне смешанной секреции опухоли или сдавления ножки гипофиза и прямые негативные эффекты ИФР-1 и СТГ на регуляцию и функционирование оси гипоталамус-гипофиз-яичники [202]. Беременность у пациенток с акромегалией может повышать риски роста опухоли, развития артериальной гипертензии, гестационного сахарного диабета или ухудшать имеющиеся осложнения.
- Пациенткам с впервые выявленной акромегалией, планирующим беременность, рекомендуется хирургическое лечение в качестве метода первого выбора [220].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 4)
Комментарий: При отсутствии ремиссии акромегалии после хирургического лечения или на фоне медикаментозной терапии, умеренно повышенном уровне ИФР-1, без осложнений, при регулярном менструальном цикле возможно планирование беременности с проведением дальнейшего лечения акромегалии после родоразрешения. Беременность в большинстве случаев не способствует прогрессии роста опухоли, также при гестации не наблюдается значимого повышения уровня ИФР-1 или ухудшения клинической симптоматики заболевания вследствие развития резистентности клеток печени к СТГ в условиях высокой гиперэстрогении [221–224].
- Беременным женщинам с акромегалией не рекомендуется измерять уровни ИФР-1 и СТГ с целью оценки функциональной активности аденомы гипофиза в период гестации [3][221–228].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарий: В период беременности в первом триместре наблюдается снижение уровня ИФР-1 вследствие резистентности к СТГ, при этом во втором и третьем триместре может наблюдаться его повышение на фоне секреции плацентарного гормона роста, имеющего перекрестную реакцию с материнским СТГ при использовании большинства лабораторных наборов. В условиях вариабельности секреторной активности плаценты и индивидуальных особенностей гормональной гестационной трансформации измерение ИФР-1, СТГ не является критерием оценки морфофункциональной активности опухоли. Рекомендована лабораторно-инструментальная оценка акромегалии после родоразрешения [222–224][227].
- Беременным женщинам с акромегалией при подозрении на рост аденомы гипофиза рекомендуется проведение МРТ головного мозга без контрастирования [229–231].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 2)
Комментарий: Клиническими проявлениями роста опухоли гипофиза являются головная боль, нарушения полей зрения, очаговая неврологическая симптоматика. С целью динамического контроля беременным женщинам с акромегалией показано наблюдение врача-акушера-гинеколога, врача-эндокринолога и врача-офтальмолога. Беременным с акромегалией показано клиническое обследование, включающее в себя сбор жалоб, осмотр врача-эндокринолога и врача-офтальмолога с проведением периметрии 1 раз в триместр.
- При подтверждении факта наступления беременности рекомендуется отменить медикаментозную терапию акромегалии [232].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5)
Комментарий: Согласно литературным данным, не выявлено повышения частоты пороков развития плода на фоне лечения аналогами соматостатина и каберголином** при отмене терапии до или в течение первого триместра беременности. Данные по применению пэгвисоманта** во время беременности малочисленны и также не содержат негативных последствий в отношении исходов гестации.
- Беременным с акромегалией при выявлении роста аденомы гипофиза по данным МРТ головного мозга и прогрессировании клинических симптомов акромегалии рекомендуется возобновить терапию аналогами соматостатина во время беременности [222][233–236].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5)
- Беременным с акромегалией при прогрессивном снижении зрения и отсутствии эффекта от медикаментозной терапии рекомендуется проведение транссфеноидальной аденомэктомии во втором триместре беременности [237][238].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5)
ВЕДЕНИЕ ПАЦИЕНТОК С АКРОМЕГАЛИЕЙ ПОСЛЕ РОДОРАЗРЕШЕНИЯ
- Пациенткам с акромегалией при отсутствии клинических признаков роста аденомы во время беременности грудное вскармливание не противопоказано [222][227][232][239].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5)
Комментарии: В литературе отсутствуют данные, указывающие на прогрессирование аденом во время грудного вскармливания.
- Пациенткам с акромегалией в период грудного вскармливания не рекомендована медикаментозная терапия аналогами соматостатина и пэгвисомантом** [222][227][232][239].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов.
Дедов И.И. — главный редактор журнала «Ожирение и метаболизм». Мельниченко Г.А. — заместитель главного редактора журнала «Ожирение и метаболизм». Дзеранова Л.К. — заведующий редакцией журнала «Ожирение и метаболизм». Мокрышева Н.Г., Трошина Е.А., Пигарова Е.А. — члены редакционной коллегии журнала «Ожирение и метаболизм». Анциферов М.Б., Марова Е.И. — члены редакционного совета журнала «Ожирение и метаболизм».
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
ПРИЛОЖЕНИЕ 1.
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
Должность медицинского работника — врач-эндокринолог (медицинская специальность — эндокринология);
Должность медицинского работника — врач-нейрохирург (медицинская специальность — нейрохирургия);
Должность медицинского работника — врач-терапевт, врач-терапевт участковый (медицинская специальность — терапия);
Должность медицинского работника — врач общей практики (семейный врач) (медицинская специальность — общая врачебная практика (семейная медицина)).
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД)
для методов диагностики (диагностических вмешательств)
Table 1. Evidence level assessment scale for diagnostic methods (diagnostic interventions)
УДД | Расшифровка |
1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
4 | Несравнительные исследования, описание клинического случая |
5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД)
для методов профилактики, лечения и реабилитации
(профилактических, лечебных, реабилитационных вмешательств)
Table 2. Evidence level assessment scale for prevention, treatment and rehabilitation
(preventative, treatment and rehabilitative interventions)
УДД | Расшифровка |
1 | Систематический обзор РКИ с применением мета-анализа |
2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
3 | Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР)
для методов профилактики, диагностики, лечения и реабилитации
(профилактических, диагностических, лечебных, реабилитационных вмешательств)
Table 3. Confidence level assessment scale for prevention, treatment and rehabilitation
(preventative, treatment and rehabilitative interventions)
УУР | Расшифровка |
A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
B | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
C | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
ПОРЯДОК ОБНОВЛЕНИЯ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию — не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Список литературы
1. Colao A, Grasso LFS, Giustina A, et al. Acromegaly. Nat Rev Dis Primers. 2019;5(1). doi: https://doi.org/10.1038/s41572-019-0071-6
2. Дедов И.И., Мельниченко Г.А. Акромегалия: Патогенез, Клиника, Диагностика, Дифференциальная Диагностика, Методы Лечения. Пособие Для Врачей. — М.; 2012.
3. Katznelson L, Laws ER, Melmed S, et al. Acromegaly: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2014;99(11):3933-3951. doi: https://doi.org/10.1210/JC.2014-2700
4. Пронин В.С., Молитвословова Н.Н. Акромегалия. Этиология, Патогенез, Клиника, Диагностика, Лечение. / Под ред. Дедова И.И., Мельниченко Г.А. М; 2009.
5. Cuevas-Ramos D, Carmichael JD, Cooper O, et al. A structural and functional acromegaly classification. J Clin Endocrinol Metab. 2015;100(1):122-131. doi: https://doi.org/10.1210/jc.2014-2468
6. Crisafulli S, Luxi N, Sultana J, et al. Global epidemiology of acromegaly: a systematic review and meta-analysis. Eur J Endocrinol. 2021;185(2):251-263. doi: https://doi.org/10.1530/EJE-21-0216
7. Белая Ж.Е., Голоунина О.О., Рожинская Л.Я., и др. Эпидемиология, клинические проявления и эффективность различных методов лечения акромегалии по данным единого российского регистра опухолей гипоталамо-гипофизарной системы. Проблемы Эндокринологии. 2020;66(1):93-103. doi: https://doi.org/10.14341/PROBL10333
8. Schneider HJ, Sievers C, Saller B, Wittchen HU, Stalla GK. High prevalence of biochemical acromegaly in primary care patients with elevated IGF-1 levels. Clin Endocrinol (Oxf). 2008;69(3):432-435. doi: https://doi.org/10.1111/J.1365-2265.2008.03221.X
9. Lavrentaki A, Paluzzi A, Wass JAH, Karavitaki N. Epidemiology of acromegaly: review of population studies. Pituitary. 2017;20(1):4-9. doi: https://doi.org/10.1007/s11102-016-0754-x
10. Esposito D, Ragnarsson O, Granfeldt D, Marlow T, Johannsson G, Olsson DS. Decreasing mortality and changes in treatment patterns in patients with acromegaly from a nationwide study. Eur J Endocrinol. 2018;178(5):459-469. doi: https://doi.org/10.1530/EJE-18-0015
11. Gadelha MR, Kasuki L, Korbonits M. The genetic background of acromegaly. Pituitary. 2017;20(1):10. doi: https://doi.org/10.1007/S11102-017-0789-7
12. Аденомы Гипофиза : Клиника, Диагностика, Лечение. / под ред. Кадашева Б.А. – М.: Издательство Триада; 2007.
13. Asa SL, Mete O, Perry A, Osamura RY. Overview of the 2022 WHO Classification of Pituitary Tumors. Endocr Pathol. 2022 Mar;33(1):6-26. doi: https://doi.org/10.1007/s12022-022-09703-7
14. Petrossians P, Daly AF, Natchev E, et al. Acromegaly at diagnosis in 3173 patients from the Liège Acromegaly Survey (LAS) Database. Published online 2017. doi: https://doi.org/10.1530/ERC-17-0253
15. Fleseriu M, Barkan A, del Pilar Schneider M, et al. Prevalence of comorbidities and concomitant medication use in acromegaly: analysis of real-world data from the United States. Pituitary. 2022;25(2):296-307. doi: https://doi.org/10.1007/s11102-021-01198-5
16. Esposito D, Ragnarsson O, Johannsson G, Olsson DS. Prolonged diagnostic delay in acromegaly is associated with increased morbidity and mortality. Eur J Endocrinol. 2020;182(6):523-531. doi: https://doi.org/10.1530/EJE-20-0019
17. Пронин В.С., Гитель Е.П., Васильева И.В., и др. Прогностические факторы эффективности медикаментозного лечения акромегалии. Врач. 2010;2:39-43.
18. Rosario PW, Calsolari MR. Screening for acromegaly by application of a simple questionnaire evaluating the enlargement of extremities in adult patients seen at primary health care units. Pituitary. 2012;15(2):179-183. doi: https://doi.org/10.1007/S11102-011-0302-7/FIGURES/2
19. Prencipe N, Floriani I, Guaraldi F, et al. ACROSCORE: a new and simple tool for the diagnosis of acromegaly, a rare and underdiagnosed disease. Clin Endocrinol (Oxf). 2016;84(3):380-385. doi: https://doi.org/10.1111/CEN.12959
20. Анциферов М.Б., Пронин В.С., Алексеева Т.М., Ионова О.А., Мартынова Е.Ю., Потешкин Ю.Е., Чуброва Н.А. ЖКЮ. Селективный скрининг пациентов с ассоциированными соматическими заболеваниями как метод раннего выявления акромегалии. Проблемы эндокринологии. 2021;67(1):20-30. doi: https://doi.org/10.14341/probl12699
21. Sakharova AA, Dimaraki E V., Chandler WF, Barkan AL. Clinically silent somatotropinomas may be biochemically active. J Clin Endocrinol Metab. 2005;90(4):2117-2121. doi: https://doi.org/10.1210/JC.2004-0875
22. Wang M, Mou C, Jiang M, et al. The characteristics of acromegalic patients with hyperprolactinemia and the differences in patients with merely GH-secreting adenomas: clinical analysis of 279 cases. Eur J Endocrinol. 2012;166(5):797-802. doi: https://doi.org/10.1530/EJE-11-1119
23. Guo X, Zhang R, Zhang D, et al. Hyperprolactinemia and Hypopituitarism in Acromegaly and Effect of Pituitary Surgery: Long-Term Follow-up on 529 Patients. Front Endocrinol (Lausanne). 2022;12:1979. doi: https://doi.org/10.3389/FENDO.2021.807054/BIBTEX
24. Dehghani M, Davoodi Z, Bidari F, et al. Association of different pathologic subtypes of growth hormone producing pituitary adenoma and remission in acromegaly patients: a retrospective cohort study. BMC Endocr Disord. 2021;21(1). doi: https://doi.org/10.1186/S12902-021-00850-2
25. Hannah-Shmouni F, Trivellin G, Stratakis CA. Genetics of gigantism and acromegaly. Growth Hormone and IGF Research. 2016;30-31:37-41. doi: https://doi.org/10.1016/J.GHIR.2016.08.002
26. Parolin M, Dassie F, Martini C, et al. Preclinical markers of atherosclerosis in acromegaly: a systematic review and meta-analysis. 2018;21:653-662. doi: https://doi.org/10.1007/s11102-018-0911-5
27. Vitale G, Pivonello R, Auriemma RS, et al. Hypertension in acromegaly and in the normal population: prevalence and determinants. Clin Endocrinol (Oxf). 2005;63(4):470-476. doi: https://doi.org/10.1111/J.1365-2265.2005.02370.X
28. Berg C, Petersenn S, Lahner H, et al. Cardiovascular risk factors in patients with uncontrolled and long-term acromegaly: comparison with matched data from the general population and the effect of disease control. J Clin Endocrinol Metab. 2010;95(8):3648-3656. doi: https://doi.org/10.1210/JC.2009-2570
29. Barkan AL, Beitins IZ, Kelch RP. Plasma insulin-like growth factor-I/somatomedin-C in acromegaly: correlation with the degree of growth hormone hypersecretion. J Clin Endocrinol Metab. 1988;67(1):69-73. doi: https://doi.org/10.1210/JCEM-67-1-69
30. Faje AT, Barkan AL. Basal, but not pulsatile, growth hormone secretion determines the ambient circulating levels of insulin-like growth factor-I. J Clin Endocrinol Metab. 2010;95(5):2486-2491. doi: https://doi.org/10.1210/JC.2009-2634
31. Weber MM, Auernhammer CJ, Lee PDK, Engelhardt D, Zachoval R. Insulin-like growth factors and insulin-like growth factor binding proteins in adult patients with severe liver disease before and after orthotopic liver transplantation. Horm Res. 2002;57(3-4):105-112. doi: https://doi.org/10.1159/000057960
32. Clayton KL, Holly JMP, Carlsson LMS, et al. Loss of the normal relationships between growth hormone, growth hormone-binding protein and insulin-like growth factor-I in adolescents with insulin-dependent diabetes mellitus. Clin Endocrinol (Oxf). 1994;41(4):517-524. doi: https://doi.org/10.1111/J.1365-2265.1994.TB02584.X
33. Caregaro L, Favaro A, Santonastaso P, et al. Insulin-like growth factor 1 (IGF-1), a nutritional marker in patients with eating disorders. Clin Nutr. 2001;20(3):251-257. doi: https://doi.org/10.1054/CLNU.2001.0397
34. Bidlingmaier M, Friedrich N, Emeny RT, et al. Reference intervals for insulin-like growth factor-1 (igf-i) from birth to senescence: results from a multicenter study using a new automated chemiluminescence IGF-I immunoassay conforming to recent international recommendations. J Clin Endocrinol Metab. 2014;99(5):1712-1721. doi: https://doi.org/10.1210/JC.2013-3059
35. Freda PU, Nuruzzaman AT, Reyes CM, Sundeen RE, Post KD. Significance of “Abnormal” Nadir Growth Hormone Levels after Oral Glucose in Postoperative Patients with Acromegaly in Remission with Normal Insulin-Like Growth Factor-I Levels. Journal of Clinical Endocrinology and Metabolism. 2004;89(2):495-500. doi: https://doi.org/10.1210/jc.2003-031316
36. Giustina A, Chanson P, Kleinberg D, et al. Expert consensus document: A consensus on the medical treatment of acromegaly. Nat Rev Endocrinol. 2014;10(4):243-248. doi: https://doi.org/10.1038/nrendo.2014.21
37. Barth JH, Sibley PEC. Standardization of the IMMULITE systems growth hormone assay with the recombinant IS 98/574. Ann Clin Biochem. 2008;45(Pt 6):598-600. doi: https://doi.org/10.1258/ACB.2008.008074
38. de Pablos-Velasco P, Venegas EM, Álvarez Escolá C, et al. Diagnosis, treatment and follow-up of patients with acromegaly in a clinical practice setting in Spain: the ACROPRAXIS program Delphi survey. Pituitary. 2020;23(2). doi: https://doi.org/10.1007/s11102-019-01012-3
39. Hage M, Kamenický P, Chanson P. Growth Hormone Response to Oral Glucose Load: From Normal to Pathological Conditions. Neuroendocrinology. 2019;108(3):244-255. doi: https://doi.org/10.1159/000497214
40. Butz LB, Sullivan SE, Chandler WF, Barkan AL. “Micromegaly”: an update on the prevalence of acromegaly with apparently normal GH secretion in the modern era. Pituitary. 2016;19(6):547-551. doi: https://doi.org/10.1007/s11102-016-0735-0
41. Prank K, Kloppstech M, Nowlan SJ, Sejnowski TJ, Brabant G. Random Secretion of Growth Hormone in Humans. Phys Rev Lett. 1996;77(9):1909-1911. doi: https://doi.org/10.1103/PHYSREVLETT.77.1909
42. Dimaraki E V., Jaffe CA, Demott-Friberg R, Chandler WF, Barkan AL. Acromegaly with apparently normal GH secretion: implications for diagnosis and follow-up. J Clin Endocrinol Metab. 2002;87(8):3537-3542. doi: https://doi.org/10.1210/JCEM.87.8.8658
43. Clemmons DR. Consensus statement on the standardization and evaluation of growth hormone and insulin-like growth factor assays. Clin Chem. 2011;57(4):555-559. doi: https://doi.org/10.1373/CLINCHEM.2010.150631
44. Famini P, Maya MM, Melmed S. Pituitary magnetic resonance imaging for sellar and parasellar masses: ten-year experience in 2598 patients. J Clin Endocrinol Metab. 2011;96(6):1633-1641. doi: https://doi.org/10.1210/JC.2011-0168
45. Stein AL, Levenick MN, Kletzky OA. Computed tomography versus magnetic resonance imaging for the evaluation of suspected pituitary adenomas. Obstetrics and gynecology. 1989;73(6):996-999. doi: https://doi.org/10.1097/00006250-198906000-00018
46. Zendran I, Gut G, Kałużny M, Zawadzka K, Bolanowski M. Acromegaly Caused by Ectopic Growth Hormone Releasing Hormone Secretion: A Review. Front Endocrinol (Lausanne). 2022;13. doi: https://doi.org/10.3389/FENDO.2022.867965
47. Pressman BD. Pituitary Imaging. Endocrinol Metab Clin North Am. 2017;46(3):713-740. doi: https://doi.org/10.1016/J.ECL.2017.04.012
48. Alexopoulou O, Bex M, Kamenicky P, Mvoula AB, Chanson P, Maiter D. Prevalence and risk factors of impaired glucose tolerance and diabetes mellitus at diagnosis of acromegaly: a study in 148 patients. Pituitary. 2014;17(1):81-89. doi: https://doi.org/10.1007/S11102-013-0471-7
49. Esposito D, Olsson DS, Franzén S, et al. Effect of Diabetes on Morbidity and Mortality in Patients With Acromegaly. J Clin Endocrinol Metab. 2022;107(9):2483-2492. doi: https://doi.org/10.1210/CLINEM/DGAC400
50. Дзеранова Л.К., Табеева К.И., Гончаров Н.П., и др. Макропролактинемия. Проблемы репродукции. 2005;11(2):60-65.
51. Yoon JH, Choi W, Park JY, et al. A challenging TSH/GH co-secreting pituitary adenoma with concomitant thyroid cancer; a case report and literature review. BMC Endocr Disord. 2021;21(1). doi: https://doi.org/10.1186/S12902-021-00839-X
52. Jasim S, Alahdab F, Ahmed AT, et al. Mortality in adults with hypopituitarism: a systematic review and meta-analysis. Endocrine. 2017;56(1):33-42. doi: https://doi.org/10.1007/S12020-016-1159-3
53. Kan E, Kan EK, Atmaca A, Atmaca H, Colak R. Visual field defects in 23 acromegalic patients. Int Ophthalmol. 2013;33(5):521-525. doi: https://doi.org/10.1007/s10792-013-9733-7
54. Alhawyan FS. Mortality in Acromegalic Patients: Etiology, Trends, and Risk Factors. Cureus. 2021;13(4). doi: https://doi.org/10.7759/CUREUS.14265
55. Machado EO, Taboada GF, Neto LV, et al. Prevalence of discordant GH and IGF-I levels in acromegalics at diagnosis, after surgical treatment and during treatment with octreotide LAR®. Growth Hormone and IGF Research. 2008;18(5):389-393. doi: https://doi.org/10.1016/j.ghir.2008.02.001
56. Holdaway IM, Bolland MJ, Gamble GD. A meta-analysis of the effect of lowering serum levels of GH and IGF-I on mortality in acromegaly. Eur J Endocrinol. 2008;159(2):89-95. doi: https://doi.org/10.1530/EJE-08-0267
57. Abreu A, Tovar AP, Castellanos R, et al. Challenges in the diagnosis and management of acromegaly: a focus on comorbidities. Pituitary. 2016;19(4):448-457. doi: https://doi.org/10.1007/s11102-016-0725-2
58. Giustina A, Barkhoudarian G, Beckers A, et al. Multidisciplinary management of acromegaly: A consensus. Rev Endocr Metab Disord. 2020;21(4):667-678. doi: https://doi.org/10.1007/s11154-020-09588-z
59. Karavitaki N, Turner HE, Adams CBT, et al. Surgical debulking of pituitary macroadenomas causing acromegaly improves control by lanreotide. Clin Endocrinol (Oxf). 2008;68(6):970-975. doi: https://doi.org/10.1111/J.1365-2265.2007.03139.X
60. Fahlbusch R, Kleinberg D, Biller B, et al. Surgical debulking of pituitary adenomas improves responsiveness to octreotide lar in the treatment of acromegaly. Pituitary. 2017;20(6):668-675. doi: https://doi.org/10.1007/S11102-017-0832-8
61. Buchfelder M, Schlaffer SM, Zhao Y. The optimal surgical techniques for pituitary tumors. Best Pract Res Clin Endocrinol Metab. 2019;33(2). doi: https://doi.org/10.1016/J.BEEM.2019.101299
62. Shimon L, Cohen ZR, Ram Z, Hadani M. Transsphenoidal surgery for acromegaly: Endocrinological follow-up of 98 patients. Neurosurgery. 2001;48(6). doi: https://doi.org/10.1097/00006123-200106000-00008
63. Jallad RS, Musolino NR, Kodaira S, Cescato VA, Bronstein MD. Does partial surgical tumour removal influence the response to octreotide-LAR in acromegalic patients previously resistant to the somatostatin analogue? Clin Endocrinol (Oxf). 2007;67(2):310-315. doi: https://doi.org/10.1111/J.1365-2265.2007.02885.X
64. Laws ER. Surgery for acromegaly: evolution of the techniques and outcomes. Rev Endocr Metab Disord. 2008;9(1):67-70. doi: https://doi.org/10.1007/S11154-007-9064-Y
65. De Los Monteros ALE, González B, Vargas G, Sosa E, Guinto G, Mercado M. Surgical reintervention in acromegaly: is it still worth trying? Endocr Pract. 2009;15(5):431-437. doi: https://doi.org/10.4158/EP09066.ORR
66. Casanueva FF, Barkan AL, Buchfelder M, et al. Criteria for the definition of Pituitary Tumor Centers of Excellence (PTCOE): A Pituitary Society Statement. Pituitary. 2017;20(5):489-498. doi: https://doi.org/10.1007/S11102-017-0838-2
67. Ahmed S, Elsheikh M, Stratton IM, Page RCL, Adams CBT, Wass JAH. Outcome of transphenoidal surgery for acromegaly and its relationship to surgical experience. Clin Endocrinol (Oxf). 1999;50(5):561-567. doi: https://doi.org/10.1046/J.1365-2265.1999.00760.X
68. McLaughlin N, Laws ER, Oyesiku NM, Katznelson L, Kelly DF. Pituitary centers of excellence. Neurosurgery. 2012;71(5):916-924. doi: https://doi.org/10.1227/NEU.0B013E31826D5D06
69. Wass JAH, Turner HE, Adams CBT. The importance of locating a good pituitary surgeon. Pituitary. 1999;2(1):51-54. doi: https://doi.org/10.1023/A:1009982232672
70. Lissett CA, Peacey SR, Laing I, Tetlow L, Davis JRE, Shalet SM. The outcome of surgery for acromegaly: the need for a specialist pituitary surgeon for all types of growth hormone (GH) secreting adenoma. Clin Endocrinol (Oxf). 1998;49(5):653-657. doi: https://doi.org/10.1046/J.1365-2265.1998.00581.X
71. Mortini P, Nocera G, Roncelli F, Losa M, Formenti AM, Giustina A. The optimal numerosity of the referral population of pituitary tumors centers of excellence (PTCOE): A surgical perspective. Rev Endocr Metab Disord. 2020;21(4):527-536. doi: https://doi.org/10.1007/S11154-020-09564-7
72. Meij BP, Lopes MBS, Ellegala DB, Alden TD, Laws ER. The long-term significance of microscopic dural invasion in 354 patients with pituitary adenomas treated with transsphenoidal surgery. J Neurosurg. 2002;96(2):195-208. doi: https://doi.org/10.3171/JNS.2002.96.2.0195
73. Rieger A, Rainov NG, Ebel H, et al. Factors predicting pituitary adenoma invasiveness in acromegalic patients. Neurosurg Rev. 1997;20(3):182-187. doi: https://doi.org/10.1007/BF01105562
74. Soukup J, Hornychova H, Manethova M, et al. Predictive and prognostic significance of tumour subtype, SSTR1-5 and e-cadherin expression in a well-defined cohort of patients with acromegaly. J Cell Mol Med. 2021;25(5):2484-2492. doi: https://doi.org/10.1111/JCMM.16173
75. Mori R, Inoshita N, Takahashi-Fujigasaki J, et al. Clinicopathological Features of Growth Hormone-Producing Pituitary Adenomas in 242 Acromegaly Patients: Classification according to Hormone Production and Cytokeratin Distribution. ISRN Endocrinol. 2013;2013:1-8. doi: https://doi.org/10.1155/2013/723432
76. Fougner SL, Casar-Borota O, Heck A, Berg JP, Bollerslev J. Adenoma granulation pattern correlates with clinical variables and effect of somatostatin analogue treatment in a large series of patients with acromegaly. Clin Endocrinol (Oxf). 2012;76(1):96-102. doi: https://doi.org/10.1111/J.1365-2265.2011.04163.X
77. Yang C, Li G, Jiang S, Bao X, Wang R. Preoperative Somatostatin Analogues in Patients with Newly-diagnosed Acromegaly: A Systematic Review and Meta-analysis of Comparative Studies. Sci Rep. 2019;9(1). doi: https://doi.org/10.1038/S41598-019-50639-6
78. Nunes VS, Correa JMS, Puga MES, Silva EMK, Boguszewski CL. Preoperative somatostatin analogues versus direct transsphenoidal surgery for newly-diagnosed acromegaly patients: a systematic review and meta-analysis using the GRADE system. Pituitary. 2015;18(4):500-508. doi: https://doi.org/10.1007/S11102-014-0602-9
79. Zhang L, Wu X, Yan Y, Qian J, Lu Y, Luo C. Preoperative somatostatin analogs treatment in acromegalic patients with macroadenomas. A meta-analysis. Brain Dev. 2015;37(2):181-190. doi: https://doi.org/10.1016/J.BRAINDEV.2014.04.009
80. Fougner SL, Bollerslev J, Svartberg J, Øksnes M, Cooper J, Carlsen SM. Preoperative octreotide treatment of acromegaly: long-term results of a randomised controlled trial. Eur J Endocrinol. 2014;171(2):229-235. doi: https://doi.org/10.1530/EJE-14-0249
81. Annamalai AK, Webb A, Kandasamy N, et al. A comprehensive study of clinical, biochemical, radiological, vascular, cardiac, and sleep parameters in an unselected cohort of patients with acromegaly undergoing presurgical somatostatin receptor ligand therapy. J Clin Endocrinol Metab. 2013;98(3):1040-1050. doi: https://doi.org/10.1210/JC.2012-3072
82. García-Álvarez M, Climent V. Sleep apnea and cardiovascular complications of the acromegaly. Response to the medical treatment. Minerva Endocrinol. 2019;44(2). doi: https://doi.org/10.23736/S0391-1977.18.02930-9
83. Albarel F, Cuny T, Graillon T, Dufour H, Brue T, Castinetti F. Preoperative Medical Treatment for Patients With Acromegaly: Yes or No? J Endocr Soc. 2022;6(9). doi: https://doi.org/10.1210/JENDSO/BVAC114
84. Fleseriu M, Hoffman AR, Katznelson L. American Association of Clinical Endocrinologists and American College of Endocrinology Disease state clinical review: management of acromegaly patients: what is the role of pre-operative medical therapy? Endocr Pract. 2015;21(6):668-673. doi: https://doi.org/10.4158/EP14575.DSCR
85. Katznelson L, Atkinson JLD, Cook DM, et al. American Association of Clinical Endocrinologists Medical Guidelines for Clinical Practice for the Diagnosis and Treatment of Acromegaly--2011 update: executive summary. Endocr Pract. 2011;17(4):636-646. doi: https://doi.org/10.4158/EP.17.4.636
86. Feelders RA, Bidlingmaier M, Strasburger CJ, et al. Postoperative evaluation of patients with acromegaly: clinical significance and timing of oral glucose tolerance testing and measurement of (free) insulin-like growth factor I, acid-labile subunit, and growth hormone-binding protein levels. J Clin Endocrinol Metab. 2005;90(12):6480-6489. doi: https://doi.org/10.1210/JC.2005-0901
87. Espinosa-De-Los-Monteros AL, Sosa E, Cheng S, et al. Biochemical evaluation of disease activity after pituitary surgery in acromegaly: a critical analysis of patients who spontaneously change disease status. Clin Endocrinol (Oxf). 2006;64(3):245-249. doi: https://doi.org/10.1111/J.1365-2265.2006.02430.X
88. Peacey SR, Shalet SM. Insulin-like growth factor 1 measurement in diagnosis and management of acromegaly. Ann Clin Biochem. 2001;38(Pt 4):297-303. doi: https://doi.org/10.1258/0004563011900678
89. Freda PU, Bruce JN, Reyes-Vidal C, et al. Prognostic value of nadir GH levels for long-term biochemical remission or recurrence in surgically treated acromegaly. Pituitary. 2021;24(2):170-183. doi: https://doi.org/10.1007/S11102-020-01094-4
90. Shen M, Chen Z, Shou X, et al. 2010 versus the 2000 consensus criteria in patients with normalised insulin-like growth factor 1 after transsphenoidal surgery has high predictive values for long-term recurrence-free survival in acromegaly. J Neuroendocrinol. 2021;33(5). doi: https://doi.org/10.1111/JNE.12958
91. Dina TS, Feaster SH, Laws ER, Davis DO. MR of the pituitary gland postsurgery: serial MR studies following transsphenoidal resection. AJNR Am J Neuroradiol. 14(3):763-769.
92. Rodríguez O, Mateos B, De La Pedraja R, et al. Postoperative follow-up of pituitary adenomas after trans-sphenoidal resection: MRI and clinical correlation. Neuroradiology. 1996;38(8):747-754. doi: https://doi.org/10.1007/s002340050341
93. Del Porto LA, Liubinas S V., Kaye AH. Treatment of persistent and recurrent acromegaly. Journal of Clinical Neuroscience. 2011;18(2). doi: https://doi.org/10.1016/j.jocn.2010.10.003
94. Lu L, Wan X, Xu Y, Chen J, Shu K, Lei T. Prognostic Factors for Recurrence in Pituitary Adenomas: Recent Progress and Future Directions. Diagnostics. 2022;12(4). doi: https://doi.org/10.3390/diagnostics12040977
95. Fleseriu M, Hashim IA, Karavitaki N, et al. Hormonal Replacement in Hypopituitarism in Adults: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2016;101(11):3888-3921. doi: https://doi.org/10.1210/JC.2016-2118
96. Chen CJ, Ironside N, Pomeraniec IJ, et al. Microsurgical versus endoscopic transsphenoidal resection for acromegaly: a systematic review of outcomes and complications. Acta Neurochir (Wien). 2017;159(11):2193-2207. doi: https://doi.org/10.1007/S00701-017-3318-6
97. Pelsma ICM, Biermasz NR, Van Furth WR, et al. Progression of acromegalic arthropathy in long-term controlled acromegaly patients: 9 years of longitudinal follow-up. Journal of Clinical Endocrinology and Metabolism. 2021;106(1). doi: https://doi.org/10.1210/clinem/dgaa747
98. Hatipoglu E, Topsakal N, Atilgan OE, et al. Impact of exercise on quality of life and body-self perception of patients with acromegaly. Pituitary. 2014;17(1). doi: https://doi.org/10.1007/s11102-013-0463-7
99. Jane JA, Starke RM, Elzoghby MA, et al. Endoscopic Transsphenoidal Surgery for Acromegaly: Remission Using Modern Criteria, Complications, and Predictors of Outcome. J Clin Endocrinol Metab. 2011;96(9):2732-2740. doi: https://doi.org/10.1210/jc.2011-0554
100. Cappabianca P, Cavallo LM, Colao AM, De Divitiis E. Surgical complications associated with the endoscopic endonasal transsphenoidal approach for pituitary adenomas. J Neurosurg. 2002;97(2):293-298. doi: https://doi.org/10.3171/JNS.2002.97.2.0293
101. Pagliano P, Caggiano C, Ascione T, et al. Characteristics of meningitis following transsphenoidal endoscopic surgery: a case series and a systematic literature review. Infection. 2017;45(6):841-848. doi: https://doi.org/10.1007/S15010-017-1056-6
102. Barker FG, Klibanski A, Swearingen B. Transsphenoidal Surgery for Pituitary Tumors in the United States, 1996-2000: Mortality, Morbidity, and the Effects of Hospital and Surgeon Volume. Journal of Clinical Endocrinology and Metabolism. 2003;88(10). doi: https://doi.org/10.1210/jc.2003-030461
103. Yamada S, Fukuhara N, Nishioka H, et al. GH deficiency in patients after cure of acromegaly by surgery alone. Eur J Endocrinol. 2011;165(6). doi: https://doi.org/10.1530/EJE-11-0657
104. Fathalla H, Cusimano MD, Di Ieva A, et al. Endoscopic versus microscopic approach for surgical treatment of acromegaly. Neurosurg Rev. 2015;38(3):541-548; discussion 548-9. doi: https://doi.org/10.1007/s10143-015-0613-7
105. Nomikos P, Buchfelder M, Fahlbusch R. The outcome of surgery in 668 patients with acromegaly using current criteria of biochemical “cure.” Eur J Endocrinol. Published online 2005. doi: https://doi.org/10.1530/eje.1.01863
106. Abu Dabrh AM, Mohammed K, Asi N, et al. Surgical Interventions and Medical Treatments in Treatment-Naïve Patients With Acromegaly: Systematic Review and Meta-Analysis. J Clin Endocrinol Metab. 2014;99(11):4003-4014. doi: https://doi.org/10.1210/jc.2014-2900
107. Taboada GF, Luque RM, Neto LV, et al. Quantitative analysis of somatostatin receptor subtypes (1-5) gene expression levels in somatotropinomas and correlation to in vivo hormonal and tumor volume responses to treatment with octreotide LAR. Eur J Endocrinol. Published online 2008. doi: https://doi.org/10.1530/EJE-07-0562
108. Leonart LP, Ferreira VL, Tonin FS, Fernandez-Llimos F, Pontarolo R. Medical Treatments for Acromegaly: A Systematic Review and Network Meta-Analysis. Value in Health. 2018;21(7). doi: https://doi.org/10.1016/j.jval.2017.12.014
109. Ronchi CL, Boschetti M, Uberti ECD, et al. Efficacy of a slow-release formulation of lanreotide (Autogel® 120 mg) in patients with acromegaly previously treated with octreotide long acting release (LAR): an open, multicentre longitudinal study. Clin Endocrinol (Oxf). 2007;67(4):512-519. doi: https://doi.org/10.1111/j.1365-2265.2007.02917.x
110. Adelman DT, Van Genechten D, Megret CM, Truong Thanh XMT, Hand P, Martin WA. Co-Creation of a Lanreotide Autogel/Depot Syringe for the Treatment of Acromegaly and Neuroendocrine Tumours Through Collaborative Human Factor Studies. Adv Ther. 2019;36(12). doi: https://doi.org/10.1007/s12325-019-01112-3
111. Colao A, Auriemma RS, Pivonello R, Kasuki L, Gadelha MR. Interpreting biochemical control response rates with first-generation somatostatin analogues in acromegaly. Pituitary. 2016;19(3):235-247. doi: https://doi.org/10.1007/s11102-015-0684-z
112. Lamberts SWJ, Hofland LJ. ANNIVERSARY REVIEW: Octreotide, 40 years later. Eur J Endocrinol. 2019;181(5). doi: https://doi.org/10.1530/eje-19-0074
113. Alquraini H, del Pilar Schneider M, Mirakhur B, Barkan A. Biochemical efficacy of long-acting lanreotide depot/Autogel in patients with acromegaly naïve to somatostatin-receptor ligands: analysis of three multicenter clinical trials. Pituitary. 2018;21(3). doi: https://doi.org/10.1007/s11102-018-0867-5
114. Giustina A, Bronstein MD, Casanueva FF, et al. Current management practices for acromegaly: An international survey. Pituitary. 2011;14(2). doi: https://doi.org/10.1007/s11102-010-0269-9
115. Caron PJ, Bevan JS, Petersenn S, et al. Tumor shrinkage with lanreotide autogel 120 mg as primary therapy in acromegaly: Results of a prospective multicenter clinical trial. Journal of Clinical Endocrinology and Metabolism. 2014;99(4). doi: https://doi.org/10.1210/jc.2013-3318
116. Mazziotti G, Giustina A. Effects of lanreotide SR and Autogel on tumor mass in patients with acromegaly: A systematic review. Pituitary. 2010;13(1). doi: https://doi.org/10.1007/s11102-009-0169-z
117. Matharu MS, Levy MJ, Meeran K, Goadsby PJ. Subcutaneous octreotide in cluster headache: Randomized placebo-controlled double-blind crossover study. Ann Neurol. 2004;56(4). doi: https://doi.org/10.1002/ana.20210
118. Gadelha M, Marques NV, Fialho C, et al. Long-term Efficacy and Safety of Pasireotide in Patients With Acromegaly: 14 Years of Single-Center Real-World Experience. J Clin Endocrinol Metab. Published online 2023. doi: https://doi.org/10.1210/clinem/dgad378
119. Freda PU, Katznelson L, van der Lely AJ, Reyes CM, Zhao S, Rabinowitz D. Long-Acting Somatostatin Analog Therapy of Acromegaly: A Meta-Analysis. J Clin Endocrinol Metab. 2005;90(8):4465-4473. doi: https://doi.org/10.1210/jc.2005-0260
120. Colao A, Ferone D, Marzullo P, et al. Long-Term Effects of Depot Long-Acting Somatostatin Analog Octreotide on Hormone Levels and Tumor Mass in Acromegaly 1 . J Clin Endocrinol Metab. 2001;86(6). doi: https://doi.org/10.1210/jcem.86.6.7556
121. Colao A, Auriemma RS, Lombardi G, Pivonello R. Resistance to somatostatin analogs in acromegaly. Endocr Rev. 2011;32(2):247-271. doi: https://doi.org/10.1210/er.2010-0002
122. Berton AM, Prencipe N, Bertero L, et al. Resistance to Somatostatin Analogs in Italian Acromegaly Patients: The MISS Study. J Clin Med. 2023;12(1). doi: https://doi.org/10.3390/jcm12010025
123. Giustina A, Mazziotti G, Cannavò S, et al. High-Dose and High-Frequency Lanreotide Autogel in Acromegaly: A Randomized, Multicenter Study. J Clin Endocrinol Metab. 2017;102(7):2454-2464. doi: https://doi.org/10.1210/jc.2017-00142
124. Fleseriu M, Biller BMK, Freda PU, et al. A Pituitary Society update to acromegaly management guidelines. Pituitary. 2021;24(1):1-13. doi: https://doi.org/10.1007/s11102-020-01091-7
125. Kasuki L, Wildemberg LE, Gadelha MR. MANAGEMENT OF ENDOCRINE DISEASE: Personalized medicine in the treatment of acromegaly. Eur J Endocrinol. 2018;(January):R89-R100. doi: https://doi.org/10.1530/eje-17-1006
126. Akkaya E, Akgun MY, Sebnem Durmaz E, et al. T2-weighted magnetic resonance imaging as a novel predictor of surgical remission in newly diagnosed pituitary macroadenomas presenting as acromegaly. Journal of Clinical Neuroscience. 2021;90. doi: https://doi.org/10.1016/j.jocn.2021.05.058
127. Gadelha MR, Wildemberg LE, Bronstein MD, Gatto F, Ferone D. Somatostatin receptor ligands in the treatment of acromegaly. Pituitary. 2017;20(1):100-108. doi: https://doi.org/10.1007/s11102-017-0791-0
128. Gatto F, Feelders RA, Van Der Pas R, et al. Immunoreactivity score using an anti-sst2A receptor monoclonal antibody strongly predicts the biochemical response to adjuvant treatment with somatostatin analogs in acromegaly. Journal of Clinical Endocrinology and Metabolism. Published online 2013. doi: https://doi.org/10.1210/jc.2012-2609
129. Taboada GF, Luque RM, Neto LV, et al. Quantitative analysis of somatostatin receptor subtypes (1-5) gene expression levels in somatotropinomas and correlation to in vivo hormonal and tumor volume responses to treatment with octreotide LAR. Eur J Endocrinol. 2008;158(3):295-303. doi: https://doi.org/10.1530/EJE-07-0562
130. Daly AF, Tichomirowa MA, Petrossians P, et al. Clinical characteristics and therapeutic responses in patients with germ-line AIP mutations and pituitary adenomas: An international collaborative study. Journal of Clinical Endocrinology and Metabolism. 2010;95(11). doi: https://doi.org/10.1210/jc.2009-2556
131. Kasuki L, Neto LV, Wildemberg LEA, et al. AIP expression in sporadic somatotropinomas is a predictor of the response to octreotide LAR therapy independent of SSTR2 expression. Endocr Relat Cancer. Published online 2012. doi: https://doi.org/10.1530/ERC-12-0020
132. Bevan JS, Newell-Price J, Wass JAH, et al. Home administration of lanreotide Autogel by patients with acromegaly, or their partners, is safe and effective. Clin Endocrinol (Oxf). Published online September 2007:070924020649001-??? doi: https://doi.org/10.1111/j.1365-2265.2007.03044.x
133. Hannon AM, Thompson CJ, Sherlock M. Diabetes in Patients With Acromegaly. Curr Diab Rep. 2017;17(2). doi: https://doi.org/10.1007/s11892-017-0838-7
134. Attanasio R, Mainolfi A, Grimaldi F, et al. Somatostatin analogs and gallstones: A retrospective survey on a large series of acromegalic patients. J Endocrinol Invest. 2008;31(8). doi: https://doi.org/10.1007/BF03346419
135. Leonart LP, Tonin FS, Ferreira VL, Fernandez-Llimos F, Pontarolo R. Effectiveness and safety of pegvisomant: a systematic review and meta-analysis of observational longitudinal studies. Endocrine. 2019;63(1). doi: https://doi.org/10.1007/s12020-018-1729-7
136. Fleseriu M, Führer-Sakel D, van der Lely AJ, et al. More than a decade of real-world experience of pegvisomant for acromegaly: ACROSTUDY. Eur J Endocrinol. 2021;185(4). doi: https://doi.org/10.1530/EJE-21-0239
137. Feola T, Cozzolino A, Simonelli I, et al. Pegvisomant Improves Glucose Metabolism in Acromegaly: A Meta-Analysis of Prospective Interventional Studies. Journal of Clinical Endocrinology and Metabolism. 2019;104(7). doi: https://doi.org/10.1210/jc.2018-02281
138. Ma L, Luo D, Yang T, et al. Combined therapy of somatostatin analogues with pegvisomant for the treatment of acromegaly: A meta-analysis of prospective studies. BMC Endocr Disord. 2020;20(1). doi: https://doi.org/10.1186/s12902-020-0545-2
139. Trainer PJ, Drake WM, Katznelson L, et al. Treatment of Acromegaly with the Growth Hormone–Receptor Antagonist Pegvisomant. New England Journal of Medicine. 2000;342(16). doi: https://doi.org/10.1056/nejm200004203421604
140. Van Der Lely AJ, Jönsson P, Wilton P, Åkerblad AC, Cara J, Ghigo E. Treatment with high doses of pegvisomant in 56 patients with acromegaly: Experience from ACROSTUDY. Eur J Endocrinol. 2016;175(4). doi: https://doi.org/10.1530/EJE-16-0008
141. Tritos NA, Biller BMK. Pegvisomant: a growth hormone receptor antagonist used in the treatment of acromegaly. Pituitary. 2017;20(1). doi: https://doi.org/10.1007/s11102-016-0753-y
142. Kopchick JJ, Parkinson C, Stevens EC, Trainer PJ. Growth hormone receptor antagonists: Discovery, development, and use in patients with acromegaly. Endocr Rev. 2002;23(5). doi: https://doi.org/10.1210/er.2001-0022
143. Giustina A, Arnaldi G, Bogazzi F, et al. Pegvisomant in acromegaly: an update. J Endocrinol Invest. 2017;40(6):577-589. doi: https://doi.org/10.1007/s40618-017-0614-1
144. Chiu CE, Carmichael JD. Use of Dopamine Agonists for Acromegaly. In: Contemporary Endocrinology; 2022. doi: https://doi.org/10.1007/978-3-031-16258-9_17
145. Sandret L, Maison P, Chanson P. Place of cabergoline in acromegaly: A meta-analysis. Journal of Clinical Endocrinology and Metabolism. 2011;96(5):1327-1335. doi: https://doi.org/10.1210/jc.2010-2443
146. Kasuki L, Dalmolin MD, Wildemberg LE, Gadelha MR. Treatment escape reduces the effectiveness of cabergoline during long-term treatment of acromegaly in monotherapy or in association with first-generation somatostatin receptor ligands. Clin Endocrinol (Oxf). 2018;88(6). doi: https://doi.org/10.1111/cen.13595
147. Vilar L, Azevedo MF, Naves LA, et al. Role of the addition of cabergoline to the management of acromegalic patients resistant to longterm treatment with octreotide LAR. Pituitary. 2011;14(2). doi: https://doi.org/10.1007/s11102-010-0272-1
148. Mattar P, Alves Martins MR, Abucham J. Short-and long-term efficacy of combined cabergoline and octreotide treatment in controlling IGF-I levels in acromegaly. Neuroendocrinology. 2010;92(2). doi: https://doi.org/10.1159/000317314
149. Suda K, Inoshita N, Iguchi G, et al. Efficacy of combined octreotide and cabergoline treatment in patients with acromegaly: a retrospective clinical study and review of the literature. Endocr J. 2013;60(4):507-515. Accessed November 23, 2019. http://www.ncbi.nlm.nih.gov/pubmed/23291436
150. Higham CE, Atkinson AB, Aylwin S, et al. Effective combination treatment with cabergoline and low-dose pegvisomant in active acromegaly: A prospective clinical trial. Journal of Clinical Endocrinology and Metabolism. 2012;97(4). doi: https://doi.org/10.1210/jc.2011-2603
151. Cozzi R, Attanasio R, Lodrini S, Lasio G. Cabergoline addition to depot somatostatin analogues in resistant acromegalic patients: Efficacy and lack of predictive value of prolactin status. Clin Endocrinol (Oxf). Published online 2004. doi: https://doi.org/10.1111/j.1365-2265.2004.02082.x
152. Moyes VJ, Metcalfe KA, Drake WM. Clinical use of cabergoline as primary and adjunctive treatment for acromegaly. Eur J Endocrinol. 2008;159(5):541-545. doi: https://doi.org/10.1530/EJE-08-0306
153. Halperin Rabinovich I, Cámara Gómez R, García Mouriz M, Ollero García-Agulló D. Clinical guidelines for diagnosis and treatment of prolactinoma and hyperprolactinemia. Endocrinología y Nutrición (English Edition). 2013;60(6). doi: https://doi.org/10.1016/j.endoen.2012.11.009
154. Khare S, Lila A, Patil R, et al. Long-term cardiac (valvulopathy) safety of cabergoline in prolactinoma. Indian J Endocrinol Metab. 2017;21(1). doi: https://doi.org/10.4103/2230-8210.196010
155. Maione L, Garcia C, Bouchachi A, et al. No evidence of a detrimental effect of cabergoline therapy on cardiac valves in patients with acromegaly. Journal of Clinical Endocrinology and Metabolism. 2012;97(9). doi: https://doi.org/10.1210/jc.2012-1833
156. Голоунина О.О., Дзеранова Л.К., Пигарова Е.А., Белая Ж.Е. Резистентность к медикаментозному лечению акромегалии и пути ее преодоления. Ожирение и метаболизм. 2021;18(2):150-162. doi: https://doi.org/10.14341/omet12710
157. Nie D, Fang Q, Wong W, et al. The effect of endoscopic transsphenoidal somatotroph tumors resection on pituitary hormones: systematic review and meta-analysis. World J Surg Oncol. 2023;21(1). doi: https://doi.org/10.1186/s12957-023-02958-2
158. Yamada S, Fukuhara N, Oyama K, Takeshita A, Takeuchi Y. Repeat transsphenoidal surgery for the treatment of remaining or recurring pituitary tumors in acromegaly. Neurosurgery. 2010;67(4):949-956. doi: https://doi.org/10.1227/NEU.0B013E3181EC4379
159. Qiao N, He M, Shen M, et al. Comparative efficacy of medical treatment for acromegaly: A systematic review and network meta-analysis of integrated randomized trials and observational studies. Endocrine Practice. 2020;26(4). doi: https://doi.org/10.4158/EP-2019-0528
160. Zheng Q, Huang Y, Lin W, Cai L, Wen J, Chen G. Comparing Stereotactic Radiosurgery and Fractionated Stereotactic Radiotherapy in Treating patients with Growth Hormone-Secreting Adenomas: A Systematic Review and Meta-analysis. Endocrine Practice. Published online 2020. doi: https://doi.org/10.4158/ep-2020-0110
161. Mathieu D, Kotecha R, Sahgal A, et al. Stereotactic radiosurgery for secretory pituitary adenomas: systematic review and International Stereotactic Radiosurgery Society practice recommendations. In: Journal of Neurosurgery. Vol 136. ; 2022. doi: https://doi.org/10.3171/2021.2.JNS204440
162. Colao A, Vandeva S, Pivonello R, et al. Could different treatment approaches in acromegaly influence life expectancy? A comparative study between Bulgaria and Campania (Italy). Eur J Endocrinol. 2014;171(2). doi: https://doi.org/10.1530/EJE-13-1022
163. Bogazzi F, Colao A, Rossi G, et al. Comparison of the effects of primary somatostatin analogue therapy and pituitary adenomectomy on survival in patients with acromegaly: A retrospective cohort study. Eur J Endocrinol. 2013;169(3). doi: https://doi.org/10.1530/EJE-13-0166
164. McCabe J, Ayuk J, Sherlock M. Treatment Factors That Influence Mortality in Acromegaly. Neuroendocrinology. 2016;103(1). doi: https://doi.org/10.1159/000375163
165. Kauppinen-Mäkelin R, Sane T, Reunanen A, et al. A nationwide survey of mortality in acromegaly. Journal of Clinical Endocrinology and Metabolism. 2005;90(7). doi: https://doi.org/10.1210/jc.2004-1381
166. Sherlock M, Ayuk J, Tomlinson JW, et al. Mortality in patients with pituitary disease. Endocr Rev. 2010;31(3). doi: https://doi.org/10.1210/er.2009-0033
167. Mestrón A, Webb SM, Astorga R, et al. Epidemiology, clinical characteristics, outcome, morbidity and mortality in acromegaly based on the Spanish Acromegaly Registry (Registro Español de Acromegalia, REA). Eur J Endocrinol. 2004;151(4). doi: https://doi.org/10.1530/eje.0.1510439
168. Castinetti F, Nagai M, Morange I, et al. Long-Term Results of Stereotactic Radiosurgery in Secretory Pituitary Adenomas. J Clin Endocrinol Metab. 2009;94(9):3400-3407. doi: https://doi.org/10.1210/jc.2008-2772
169. Castinetti F, Morange I, Dufour H, Regis J, Brue T. Radiotherapy and radiosurgery in acromegaly. Pituitary. 2009;12(1):3-10. doi: https://doi.org/10.1007/s11102-007-0078-y
170. Hannon MJ, Barkan AL, Drake WM. The Role of Radiotherapy in Acromegaly. Neuroendocrinology. 2016;103(1). doi: https://doi.org/10.1159/000435776
171. Hansen MR, Moffat JC. Osteosarcoma of the skull base after radiation therapy in a patient with McCune-Albright syndrome: Case report. Skull Base. 2003;13(2). doi: https://doi.org/10.1055/s-2003-40597
172. Alonso CE, Bunevicius A, Trifiletti DM, et al. Safety and efficacy of repeat radiosurgery for acromegaly: an International Multi-Institutional Study. J Neurooncol. 2019;145(2). doi: https://doi.org/10.1007/s11060-019-03296-8
173. Abu Dabrh A, Asi N, Farah W, et al. Radiotherapy vs. Radiosurgery in Treating Patients with Acromegaly: Systematic Review and Meta-Analysis. Endocrine Practice. 2015;(aop):1-33. doi: https://doi.org/10.4158/EP14574.RA
174. Castinetti F, Taieb D, Kuhn J-M, et al. Outcome of Gamma Knife Radiosurgery in 82 Patients with Acromegaly: Correlation with Initial Hypersecretion. J Clin Endocrinol Metab. 2005;90(8):4483-4488. doi: https://doi.org/10.1210/jc.2005-0311
175. Attanasio R, Epaminonda P, Motti E, et al. Gamma-Knife Radiosurgery in Acromegaly: A 4-Year Follow-Up Study. J Clin Endocrinol Metab. 2003;88(7):3105-3112. doi: https://doi.org/10.1210/jc.2002-021663
176. Sims‐Williams HP, Rajapaksa K, Yianni J, et al. Long-term safety of gamma knife radiosurgery (SRS) for acromegaly. Pituitary. 2021;24(5). doi: https://doi.org/10.1007/s11102-021-01149-0
177. De Stefani A, Dassie F, Wennberg A, et al. Oral Manifestations and Maxillo-Facial Features in the Acromegalic Patient: A Literature Review. J Clin Med. 2022;11(4). doi: https://doi.org/10.3390/jcm11041092
178. Lopes AJ, da Silva DPG, Kasuki L, Gadelha MôR, Camilo GB, Guimarães FS. Posture and balance control in patients with acromegaly: Results of a cross-sectional study. Gait Posture. 2014;40(1). doi: https://doi.org/10.1016/j.gaitpost.2014.03.014
179. Lima TRL, Kasuki L, Gadelha M, Lopes AJ. Physical exercise improves functional capacity and quality of life in patients with acromegaly: a 12-week follow-up study. Endocrine. 2019;66(2). doi: https://doi.org/10.1007/s12020-019-02011-x
180. Lima TRL, Kasuki L, Gadelha MR, Lopes AJ. The effectiveness of a therapist-oriented home rehabilitation program for a patient with acromegaly: A case study. J Bodyw Mov Ther. 2019;23(3). doi: https://doi.org/10.1016/j.jbmt.2019.01.006
181. Homem TS, Guimarães FS, Soares MS, Kasuki L, Gadelha MR, Lopes AJ. Balance control and peripheral muscle function in aging: A comparison between individuals with acromegaly and healthy subjects. J Aging Phys Act. 2017;25(2). doi: https://doi.org/10.1123/japa.2016-0100
182. Atmaca A, Tander B, Kan EK, et al. Assessment of balance performance and fear of falling in acromegalic patients: A comparative study. J Endocrinol Invest. 2013;36(9). doi: https://doi.org/10.3275/8944
183. Goodman C, Fuller K. Pathology Implications for the Physical Therapist (3rdedn) St. Louis: Saunders. Published online 2009.
184. Choo YJ, Chang MC. Effectiveness of orthoses for treatment in patients with spinal pain. Yeungnam Univ J Med. 2020;37(2). doi: https://doi.org/10.12701/yujm.2020.00150
185. Preo G, De Stefani A, Dassie F, et al. The role of the dentist and orthodontist in recognizing oro-facial manifestations of acromegaly: a questionnaire-based study. Pituitary. 2022;25(1). doi: https://doi.org/10.1007/s11102-021-01183-y
186. Polley JW, Figueroa AA. Orthognathic positioning system: Intraoperative system to transfer virtual surgical plan to operating field during orthognathic surgery. Journal of Oral and Maxillofacial Surgery. 2013;71(5). doi: https://doi.org/10.1016/j.joms.2012.11.004
187. Hågensli N, Stenvik A, Espeland L. Extraoral vertical subcondylar osteotomy with rigid fixation for correction of mandibular prognathism. Comparison with bilateral sagittal split osteotomy and surgical technique. Journal of Cranio-Maxillofacial Surgery. 2013;41(3). doi: https://doi.org/10.1016/j.jcms.2012.09.002
188. Suojanen J, Hodzic Z, Palotie T, Stoor P. CAD/CAM Engineered Patient-Specific Impants as a Reposition Device in Le Fort I and Modified Subcondylar Osteotomies: Case Report of Facial Deformity Correction in Acromegaly. Craniomaxillofac Trauma Reconstr. 2020;13(3). doi: https://doi.org/10.1177/1943387520924521
189. Dreval A V, Trigolosova I V, Misnikova I V, et al. Prevalence of diabetes mellitus in patients with acromegaly. Endocr Connect. 2014;3(2). doi: https://doi.org/10.1530/ec-14-0021
190. Quarella M, Walser D, Brändle M, Fournier JY, Bilz S. Rapid Onset of Diabetic Ketoacidosis after SGLT2 inhibition in a patient with unrecognized acromegaly. Journal of Clinical Endocrinology and Metabolism. 2017;102(5). doi: https://doi.org/10.1210/jc.2017-00082
191. Sheppard M, Bronstein MD, Freda P, et al. Pasireotide LAR maintains inhibition of GH and IGF-1 in patients with acromegaly for up to 25 months: results from the blinded extension phase of a randomized, double-blind, multicenter, Phase III study. Pituitary. 2015;18(3). doi: https://doi.org/10.1007/s11102-014-0585-6
192. Hannon AM, Thompson CJ, Sherlock M. Diabetes in Patients With Acromegaly. Curr Diab Rep. 2017;17(2). doi: https://doi.org/10.1007/s11892-017-0838-7
193. Ежов М.В., Кухарчук В.В., Сергиенко И.В., и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. doi: https://doi.org/10.15829/1560-4071-2023-5471
194. Bondanelli M, Ambrosio MR, degli Uberti EC. Pathogenesis and prevalence of hypertension in acromegaly. Pituitary. 2001;4(4):239-249. doi: https://doi.org/10.1023/A:1020798430884
195. Клинические рекомендации «Артериальная гипертензия у взрослых» 2020. Министерство здравоохранения Российской Федерации. 2020.
196. Sharma AN, Tan M, Amsterdam EA, Singh GD. Acromegalic cardiomyopathy: Epidemiology, diagnosis, and management. Clin Cardiol. 2018;41(3). doi: https://doi.org/10.1002/clc.22867
197. De Marinis L, Bianchi A, Mazziotti G, et al. The long-term cardiovascular outcome of different GH-lowering treatments in acromegaly. Pituitary. 2008;11(1). doi: https://doi.org/10.1007/s11102-007-0062-6
198. Мелкозёров К.В., Пржиялковская Е.Г., Тарбаева Н.В., и др. Нарушение ритма и проводимости сердца у больных акромегалией: роль магнитно-резонансной томографии сердца. Терапевтический архив. 2020;92(10):70-77. doi: https://doi.org/10.26442/00403660.2020.10.000787
199. van Haute FRB, Taboada GF, Corrêa LL, et al. Prevalence of sleep apnea and metabolic abnormalities in patients with acromegaly and analysis of cephalometric parameters by magnetic resonance imaging. Eur J Endocrinol. 2008;158(4). doi: https://doi.org/10.1530/EJE-07-0753
200. Guo X, Gao L, Zhao Y, et al. Characteristics of the upper respiratory tract in patients with acromegaly and correlations with obstructive sleep apnoea/hypopnea syndrome. Sleep Med. 2018;48. doi: https://doi.org/10.1016/j.sleep.2018.04.011
201. Chemla D, Attal P, Maione L, et al. Impact of successful treatment of acromegaly on overnight heart rate variability and sleep apnea. Journal of Clinical Endocrinology and Metabolism. 2014;99(8). doi: https://doi.org/10.1210/jc.2013-4288
202. Grynberg M, Salenave S, Young J, Chanson P. Female gonadal function before and after treatment of acromegaly. Journal of Clinical Endocrinology and Metabolism. 2010;95(10). doi: https://doi.org/10.1210/jc.2009-2815
203. Drange MR, Fram NR, Herman-Bonert V, Melmed S. Pituitary tumor registry: A novel clinical resource. Journal of Clinical Endocrinology and Metabolism. 2000;85(1). doi: https://doi.org/10.1210/jc.85.1.168
204. Dal J, Leisner MZ, Hermansen K, et al. Cancer Incidence in Patients with Acromegaly: A Cohort Study and Meta-Analysis of the Literature. Journal of Clinical Endocrinology and Metabolism. 2018;103(6). doi: https://doi.org/10.1210/jc.2017-02457
205. Boguszewski CL, Boguszewski MCDS. Growth hormone’s links to cancer. Endocr Rev. 2019;40(2). doi: https://doi.org/10.1210/er.2018-00166
206. Chesnokova V, Zonis S, Barrett R, et al. Excess growth hormone suppresses DNA damage repair in epithelial cells. JCI Insight. 2019;4(3). doi: https://doi.org/10.1172/jci.insight.125762
207. Chesnokova V, Zonis S, Zhou C, et al. Growth hormone is permissive for neoplastic colon growth. Proc Natl Acad Sci U S A. 2016;113(23). doi: https://doi.org/10.1073/pnas.1600561113
208. Reverter JL, Fajardo C, Resmini E, et al. Benign and malignant nodular thyroid disease in acromegaly. Is a routine thyroid ultrasound evaluation advisable? PLoS One. 2014;9(8). doi: https://doi.org/10.1371/journal.pone.0104174
209. Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016;26(1). doi: https://doi.org/10.1089/thy.2015.0020
210. Mazziotti G, Frara S, Giustina A. Pituitary diseases and bone. Endocr Rev. 2018;39(4). doi: https://doi.org/10.1210/er.2018-00005
211. Carbonare LD, Micheletti V, Cosaro E, et al. Bone histomorphometry in acromegaly patients with fragility vertebral fractures. Pituitary. 2018;21(1). doi: https://doi.org/10.1007/s11102-017-0847-1
212. Mazziotti G, Bianchi A, Porcelli T, et al. Vertebral fractures in patients with acromegaly: A 3-year prospective study. Journal of Clinical Endocrinology and Metabolism. 2013;98(8). doi: https://doi.org/10.1210/jc.2013-1460
213. Claessen KMJA, Mazziotti G, Biermasz NR, Giustina A. Bone and Joint Disorders in Acromegaly. Neuroendocrinology. 2016;103(1). doi: https://doi.org/10.1159/000375450
214. Wassenaar MJE, Biermasz NR, van Duinen N, et al. High prevalence of arthropathy, according to the definitions of radiological and clinical osteoarthritis, in patients with long-term cure of acromegaly: A case-control study. Eur J Endocrinol. 2009;160(3). doi: https://doi.org/10.1530/EJE-08-0845
215. Claessen KMJA, Ramautar SR, Pereira AM, et al. Increased clinical symptoms of acromegalic arthropathy in patients with long-term disease control: A prospective follow-up study. Pituitary. 2014;17(1). doi: https://doi.org/10.1007/s11102-013-0464-6
216. Miller A, Doll H, David J, Wass J. Impact of musculoskeletal disease on quality of life in long-standing acromegaly. Eur J Endocrinol. 2008;158(5). doi: https://doi.org/10.1530/EJE-07-0838
217. Sugata T, Myoken Y, Tanaka S. Acromegaly identified in a patient with a complaint of malocclusion. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998;85(1). doi: https://doi.org/10.1016/S1079-2104(98)90396-1
218. Sievers C, Dimopoulou C, Pfister H, et al. Prevalence of mental disorders in acromegaly: A cross-sectional study in 81 acromegalic patients. Clin Endocrinol (Oxf). 2009;71(5). doi: https://doi.org/10.1111/j.1365-2265.2009.03555.x
219. Matta MP, Couture E, Cazals L, Vezzosi D, Bennet A, Caron P. Impaired quality of life of patients with acromegaly: Control of GH/IGF-I excess improves psychological subscale appearance. Eur J Endocrinol. 2008;158(3). doi: https://doi.org/10.1530/EJE-07-0697
220. Buchfelder M, Schlaffer SM. The surgical treatment of acromegaly. Pituitary. Published online 2017. doi: https://doi.org/10.1007/s11102-016-0765-7
221. Hannon AM, O’Shea T, Thompson CA, et al. Pregnancy in acromegaly is safe and is associated with improvements in IGF-1 concentrations. Eur J Endocrinol. 2019;180(4). doi: https://doi.org/10.1530/EJE-18-0688
222. Dias M, Bouszewski C, Gadelha M, et al. Acromegaly and pregnancy: A prospective study. Eur J Endocrinol. 2014;170(2). doi: https://doi.org/10.1530/EJE-13-0460
223. Jallad RS, Shimon I, Fraenkel M, et al. Outcome of pregnancies in a large cohort of women with acromegaly. Clin Endocrinol (Oxf). 2018;88(6). doi: https://doi.org/10.1111/cen.13599
224. Caron P, Broussaud S, Bertherat J, et al. Acromegaly and Pregnancy: A Retrospective Multicenter Study of 59 Pregnancies in 46 Women. J Clin Endocrinol Metab. 2010;95(10):4680-4687. doi: https://doi.org/10.1210/jc.2009-2331
225. Liao S, Vickers MH, Stanley JL, Baker PN, Perry JK. Human Placental Growth Hormone Variant in Pathological Pregnancies. Endocrinology. 2018;159(5). doi: https://doi.org/10.1210/en.2018-00037
226. Abucham J, Bronstein MD, Dias ML. MANAGEMENT OF ENDOCRINE DISEASE: Acromegaly and pregnancy: a contemporary review. Eur J Endocrinol. 2017;177(1). doi: https://doi.org/10.1530/eje-16-1059
227. Persechini ML, Gennero I, Grunenwald S, Vezzosi D, Bennet A, Caron P. Decreased IGF-1 concentration during the first trimester of pregnancy in women with normal somatotroph function. Pituitary. 2015;18(4). doi: https://doi.org/10.1007/s11102-014-0596-3
228. Chellakooty M, Vangsgaard K, Larsen T, et al. A Longitudinal Study of Intrauterine Growth and the Placental Growth Hormone (GH)-Insulin-Like Growth Factor I Axis in Maternal Circulation: Association between Placental GH and Fetal Growth. Journal of Clinical Endocrinology and Metabolism. 2004;89(1). doi: https://doi.org/10.1210/jc.2003-030282
229. Copel J, El-Sayed Y, Heine RP, Wharton KR. Guidelines for Diagnostic Imaging During Pregnancy and Lactation. Obstetrics and Gynecology. 2017;130(4). doi: https://doi.org/10.1097/AOG.0000000000002350
230. Patenaude Y, Pugash D, Lim K, et al. The Use of Magnetic Resonance Imaging in the Obstetric Patient. Journal of Obstetrics and Gynaecology Canada. 2014;36(4). doi: https://doi.org/10.1016/S1701-2163(15)30612-5
231. Prayer D, Malinger G, Brugger PC, et al. ISUOG Practice Guidelines: performance of fetal magnetic resonance imaging. Ultrasound in Obstetrics and Gynecology. 2017;49(5). doi: https://doi.org/10.1002/uog.17412
232. Chanson P, Vialon M, Caron P. An update on clinical care for pregnant women with acromegaly. Expert Rev Endocrinol Metab. 2019;14(2). doi: https://doi.org/10.1080/17446651.2019.1571909
233. Fassnacht M, Capeller B, Arlt W, Steck T, Allolio B. Octreotide LAR® treatment throughout pregnancy in an acromegalic woman. Clin Endocrinol (Oxf). 2001;55(3). doi: https://doi.org/10.1046/j.1365-2265.2001.01304.x
234. Hannon AM, Frizelle I, Kaar G, et al. Octreotide use for rescue of vision in a pregnant patient with acromegaly. Endocrinol Diabetes Metab Case Rep. 2019;2019(1). doi: https://doi.org/10.1530/EDM-19-0019
235. Kasuki L, Neto LV, Takiya CM, Gadelha MR. Growth of an aggressive tumor during pregnancy in an acromegalic patient. Endocr J. 2012;59(4). doi: https://doi.org/10.1507/endocrj.EJ11-0306
236. Vialon M, Grunenwald S, Mouly C, et al. Gestational diabetes and acromegaly: Single-centre experience of 14 pregnancies. Clin Endocrinol (Oxf). 2019;91(6). doi: https://doi.org/10.1111/cen.14097
237. Huang W, Molitch ME. Pituitary Tumors in Pregnancy. Endocrinol Metab Clin North Am. 2019;48(3). doi: https://doi.org/10.1016/j.ecl.2019.05.004
238. Graillon T, Cuny T, Castinetti F, et al. Surgical indications for pituitary tumors during pregnancy: a literature review. Pituitary. 2020;23(2). doi: https://doi.org/10.1007/s11102-019-01004-3
239. Atmaca A, Dagdelen S, Erbas T. Follow-up of pregnancy in acromegalic women: Different presentations and outcomes. Experimental and Clinical Endocrinology and Diabetes. 2006;114(3). doi: https://doi.org/10.1055/s-2005-873004
Об авторах
Е. Г. ПржиялковскаяРоссия
Пржиялковская Елена Георгиевна, к.м.н.
117036, Москва, ул. Дм. Ульянова, д. 11
Н. Г. Мокрышева
Россия
Мокрышева Наталья Георгиевна, д.м.н., профессор
Москва
Е. А. Трошина
Россия
Трошина Екатерина Анатольевна, д.м.н., профессор
Москва
Г. А. Мельниченко
Россия
Мельниченко Галина Афанасьевна, д.м.н., профессор
Москва
И. И. Дедов
Россия
Дедов Иван Иванович, д.м.н., профессор, академик
Москва
М. Б. Анциферов
Россия
Анциферов Михаил Борисович, д.м.н., профессор
Москва
Л. И. Астафьева
Россия
Астафьева Людмила Игоревна, д.м.н.
Москва
Т. П. Бардымова
Россия
Бардымова Татьяна Прокопьевна, д.м.н., профессор
Иркутск
Ж. Е. Белая
Россия
Белая Жанна Евгеньевна, д.м.н.
Москва
Г. Р. Вагапова
Россия
Вагапова Гульнара Рифатовна, д.м.н., проф.
Казань
С. Ю. Воротникова
Россия
Воротникова Светлана Юрьевна, к.м.н.
Москва
А. Ю. Григорьев
Россия
Григорьев Андрей Юрьевич, д.м.н., профессор
Москва
Е. Н. Гринева
Россия
Гринева Елена Николаевна, д.м.н., профессор
Санкт-Петербург
Л. К. Дзеранова
Россия
Дзеранова Лариса Константиновна, д.м.н.
Москва
И. А. Иловайская
Россия
Иловайская Ирэна Адольфовна, д.м.н., доцент
Москва
П. Л. Калинин
Россия
Калинин Павел Львович, д.м.н.
Москва
А. М. Лапшина
Россия
Лапшина Анастасия Михайловна, к.м.н.
Москва
А. С. Луценко
Россия
Луценко Александр Сергеевич
117036, Москва, ул. Дм. Ульянова, д. 11
Е. О. Мамедова
Россия
Мамедова Елизавета Октаевна, к.м.н.
Москва
Е. И. Марова
Россия
Марова Евгения Ивановна, д.м.н., профессор
Москва
М. А. Перепелова
Россия
Перепелова Маргарита Александровна, аспирант
Москва
Е. А. Пигарова
Россия
Пигарова Екатерина Александровна, д.м.н.
Москва
В. С. Пронин
Россия
Пронин Вячеслав Сергеевич, д.м.н., профессор
Москва
Л. Я. Рожинская
Россия
Рожинская Людмила Яковлевна, д.м.н., профессор
Москва
Ю. Ю. Трунин
Россия
Трунин Юрий Юрьевич, д.м.н.
Москва
А. С. Шутова
Россия
Шутова Александра Сергеевна
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Распространенность клинических проявлений у пациентов с акромегалией, проживающих на территории Российской Федерации [7]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(339KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Основные клинические проявления и осложнения акромегалии (адаптировано из [1]). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(625KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Пржиялковская Е.Г., Мокрышева Н.Г., Трошина Е.А., Мельниченко Г.А., Дедов И.И., Анциферов М.Б., Астафьева Л.И., Бардымова Т.П., Белая Ж.Е., Вагапова Г.Р., Воротникова С.Ю., Григорьев А.Ю., Гринева Е.Н., Дзеранова Л.К., Иловайская И.А., Калинин П.Л., Лапшина А.М., Луценко А.С., Мамедова Е.О., Марова Е.И., Перепелова М.А., Пигарова Е.А., Пронин В.С., Рожинская Л.Я., Трунин Ю.Ю., Шутова А.С. Клинические рекомендации «Акромегалия» (проект). Ожирение и метаболизм. 2024;21(2):215-249. https://doi.org/10.14341/omet13153
For citation:
Przhiyalkovskaya E.G., Mokrysheva N.G., Troshina E.A., Melnichenko G.A., Dedov I.I., Antsiferov M.B., Astafieva L.I., Bardymova T.P., Belaya Zh.E., Vagapova G.R., Vorotnikova S.Yu., Grigoriev A.Yu., Grineva E.N., Dzeranova L.K., Ilovaiskaya I.A., Kalinin P.L., Lapshina A.M., Lutsenko A.S., Mamedova E.O., Marova E.I., Perepelova M.A., Pigarova E.A., Pronin V.S., Rozhinskaya L.Ya., Trunin Yu.Yu., Shutova A.S. Guidelines on diagnostics and treatment of acromegaly (draft). Obesity and metabolism. 2024;21(2):215-249. (In Russ.) https://doi.org/10.14341/omet13153

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































