Перейти к:
Артериальная гипертензия у молодых пациентов с сахарным диабетом 1 типа. Дисбиоз и повышение парацеллюлярной кишечной проницаемости как потенциальные звенья патогенеза
https://doi.org/10.14341/omet13137
Аннотация
Заболеваемость сахарным диабетом 1 типа (СД1) неуклонно растет во всем мире, особенно среди пациентов молодого возраста. Данная тенденция является весьма неблагоприятной, поскольку риск смерти пациентов с диабетом от сердечно-сосудистых и других сопутствующих заболеваний в пять раз превышает таковой у пациентов без СД1 в анамнезе. Основными причинами преждевременной смертности являются микро- и макрососудистые осложнения, усугубляемые сопутствующими заболеваниями, одним из которых является артериальная гипертензия (АГ). Риск таких осложнений, как острые нарушения мозгового кровообращения, инфаркт миокарда, ампутации конечностей, сердечная недостаточность и внезапная сердечная смерть, возрастает с увеличением продолжительности и тяжести АГ, особенно при ее неконтролируемом течении. Больные с СД1, находящиеся на стационарном или амбулаторном наблюдении и лечении, в своем большинстве не контролируют артериальное давление (АД) либо руководствуются данными домашнего/офисного измерения АД. По нашему мнению, стоит обратить особое внимание на скрининговую диагностику, раннее выявление, а также профили повышения АД у пациентов с СД1, так как это позволит рассмотреть возможность ранней инициации антигипертензивного лечения с целью оптимизации терапевтических подходов к ведению данной группы пациентов, а также имеет ключевое значение для снижения риска неблагоприятных исходов данного заболевания.
Ключевые слова
Для цитирования:
Усеинова Р.Х., Белоглазов В.А., Репинская И.Н., Яцков И.А. Артериальная гипертензия у молодых пациентов с сахарным диабетом 1 типа. Дисбиоз и повышение парацеллюлярной кишечной проницаемости как потенциальные звенья патогенеза. Ожирение и метаболизм. 2025;22(3):214-221. https://doi.org/10.14341/omet13137
For citation:
Useinova R.Kh., Beloglazov V.A., Repinskaya I.N., Yatskov I.A. Arterial hypertension in young patients with type 1 diabetes mellitus. Dysbiosis and increased paracellular intestinal permeability as potential links of pathogenesis. Obesity and metabolism. 2025;22(3):214-221. (In Russ.) https://doi.org/10.14341/omet13137
Сахарный диабет 1 типа (СД1) на сегодняшний день является одним из заболеваний, имеющих многогранные клинико-патофизиологические проявления, а также разнообразный спектр множественных осложнений. Пациенты с СД1 имеют более высокий пожизненный риск микрососудистых осложнений и наряду с этим сердечно-сосудистых заболеваний (ССЗ) [1]. Неоптимальный контроль модифицируемых факторов риска, таких как гипергликемия, повышение артериального давления (АД), дислипидемия, ожирение, курение и альбуминурия, непосредственно связан с этими осложнениями [2]. Примечательно, что недавние исследования показали важность интенсивных многофакторных вмешательств, нацеленных на основные маркеры риска. Выявлено, что чем больше число факторов риска находятся на уровне ниже определенных целевых значений, тем вероятность развития осложнений сахарного диабета достоверно снижается [3]. Артериальная гипертензия (АГ) является одним из ведущих модифицируемых факторов риска, способствующих развитию микрососудистых осложнений и ССЗ у лиц с СД1. Риск сердечно-сосудистых заболеваний особенно возрастает у пациентов с диабетической нефропатией, но также выше у пациентов с СД1 без диабетического поражения почек. Было установлено, что пациенты с СД1 имеют более жесткие артерии, чем пациенты контрольной группы того же возраста, не страдающие диабетом, и что развитие артериальной жесткости начинается до того, как могут быть обнаружены какие-либо признаки микрососудистых или макрососудистых заболеваний [4]. Несмотря на убедительные доказательства того, что интенсивный контроль АД снижает риск диабетических осложнений и улучшает прогноз диабетической нефропатии, крайне малое число пациентов с СД1 достигает целевых показателей лечения АД, несмотря на регулярное наблюдение. Около 80% больных СД1 страдают микроальбуминурией и диабетической нефропатией, которая обычно играет ключевую роль в развитии АГ у данной группы пациентов [5]. Резистентная АГ чаще встречается у пациентов с СД1, чем у лиц с недиабетической гипертензией, и эта резистентность связана с более высоким риском прогрессирования диабетической нефропатии.
ЭТИОПАТОГЕНЕЗ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ У ПАЦИЕНТОВ С САХАРНЫМ ДИАБЕТОМ 1 ТИПА
Патогенез АГ у пациентов с СД1, несмотря на преобладающую роль диабетической нефропатии, является многофакторным и тесно связан с метаболическим контролем диабета. В то время, как окислительный стресс, воспаление, аномальное высвобождение внеклеточных везикул и связанных с ними микроРНК, а также дисбаланс кишечной микробиоты и почечного SGLT2 (натрий-глюкозного котранспортера 2 типа) становятся основными механизмами развития инсулинорезистентности и гипертонии, вызванной сахарным диабетом 2 типа [6], диабетическая нефропатия, неадекватная активация ренин-ангиотензин-альдостероновой системы (РААС) и симпатической нервной системы (СНС), дисфункция митохондрий являются основными факторами развития артериальной гипертензии при СД1 [7].
Метаболические действия инсулина зависят от нормальной функции митохондрий, которая играет ключевую роль в энергетическом гомеостазе путем метаболизма питательных веществ, выработки АТФ и клеточной энергии. Например, дефекты биогенеза митохондрий и динамики в эндотелиальных клетках оказывают пагубное воздействие на их биоэнергетическое обеспечение, и эти нарушения способствуют эндотелиальной дисфункции и гипертонии [8].
Митохондрии являются основным источником внутриклеточных активных форм кислорода (АФК), а повышенное содержание АФК участвует в патогенезе инсулинорезистентности, диабета и гипертонии. Известно, что почти все сосудистые клетки, включая эндотелиоциты, клетки гладкой мускулатуры сосудов и адвентициальные клетки, обладают способностью вырабатывать АФК [9]. При диабете избыточная выработка АФК может вызвать повреждение ДНК, белков и липидов, что приводит к митохондриальной дисфункции. НАДФН (никотинамидадениндинуклеотидфосфат)-оксидазы также являются важным источником избыточной выработки АФК в сосудистой сети при инсулинорезистентности и АГ. Течение СД связано с повышенной активацией сосудистых НАДФН-оксидаз, тем самым индуцируя избыточную выработку АФК, которая вызывает дисбаланс между релаксирующими и сократительными факторами, производимыми эндотелием, что приводит к ассоциированному повышению сосудистого тонуса [9][10]. Избыточные АФК снижают выработку и усиливают разрушение оксида азота, что приводит к снижению его биодоступности, что способствует ригидности артерий и развитию гипертонии. Следовательно, митохондриальная дисфункция и окислительный стресс потенциально являются важными механизмами развития гипертензии при СД.
Причиной повреждения почек при диабете 1 типа являются гипергликемия и протеинурия, которые, влияя на выработку гуморальных факторов, цитокинов и факторов роста, приводят к увеличению внеклеточного матрикса и увеличению проницаемости базальной мембраны. Заболевания почек на начальных стадиях не приводят к повышению АД, однако с появлением микроальбуминурии и снижением скорости почечной фильтрации приводят к развитию гипертонии [11].
В настоящее время существует большой интерес к роли микробиома кишечника в развитии гипертонии и другой сердечно-сосудистой патологии, а также индукции и самоподдержании системного хронического воспаления. В основе нынешнего представления о микробиоме лежит мнение, что последний представляет собой гораздо больший объем клеточного и генетического материала, чем собственные клетки организма, и что биом играет ключевую роль в поддержании иммунного гомеостаза [12]. Так, например, в исследовании Harrison D., Coffman T. и соавт. показано, что изменения в микробиоте кишечника (дисбиоз) связаны с гипертонией у пациентов и в нескольких доклинических моделях [13]. Более того, согласно результатам исследования Chen X., Li P., перенос фекального материала от пациентов с гипертонической болезнью, включая женщин с преэклампсией, связан с повышением АД и воспалением у стерильных мышей-реципиентов, что позволяет предположить механистическую роль биома кишечника [14][15]. В связи с этим Santisteban M. и его коллеги предполагают, что дисбактериоз кишечника является причинным фактором развития гипертонии, которая может возникнуть в результате повышенного симпатического тонуса, снижения мезентериального кровотока и усиления системного воспаления [16]. Эта стимулированная воспалительная система может отражать изменения в соединении эпителиальных клеток, которые приводят к повышенной проницаемости эндотоксина-липополисахарида (ЛПС), мембранного компонента грамотрицательных бактерий, которые составляют большинство кишечных бактерий, а также других патогенов. Стоит отметить, что роль кишечного микробиома в патогенезе СД1 начала изучаться сравнительно недавно. Ранее проведенные исследования с использованием высокотехнологичной методики секвенирования показали значительную разницу в микробном профиле здоровых людей и пациентов с СД1, что позволяет предположить корреляцию между развитием СД1 и профилем микробиоты кишечника [17] (рис. 1).
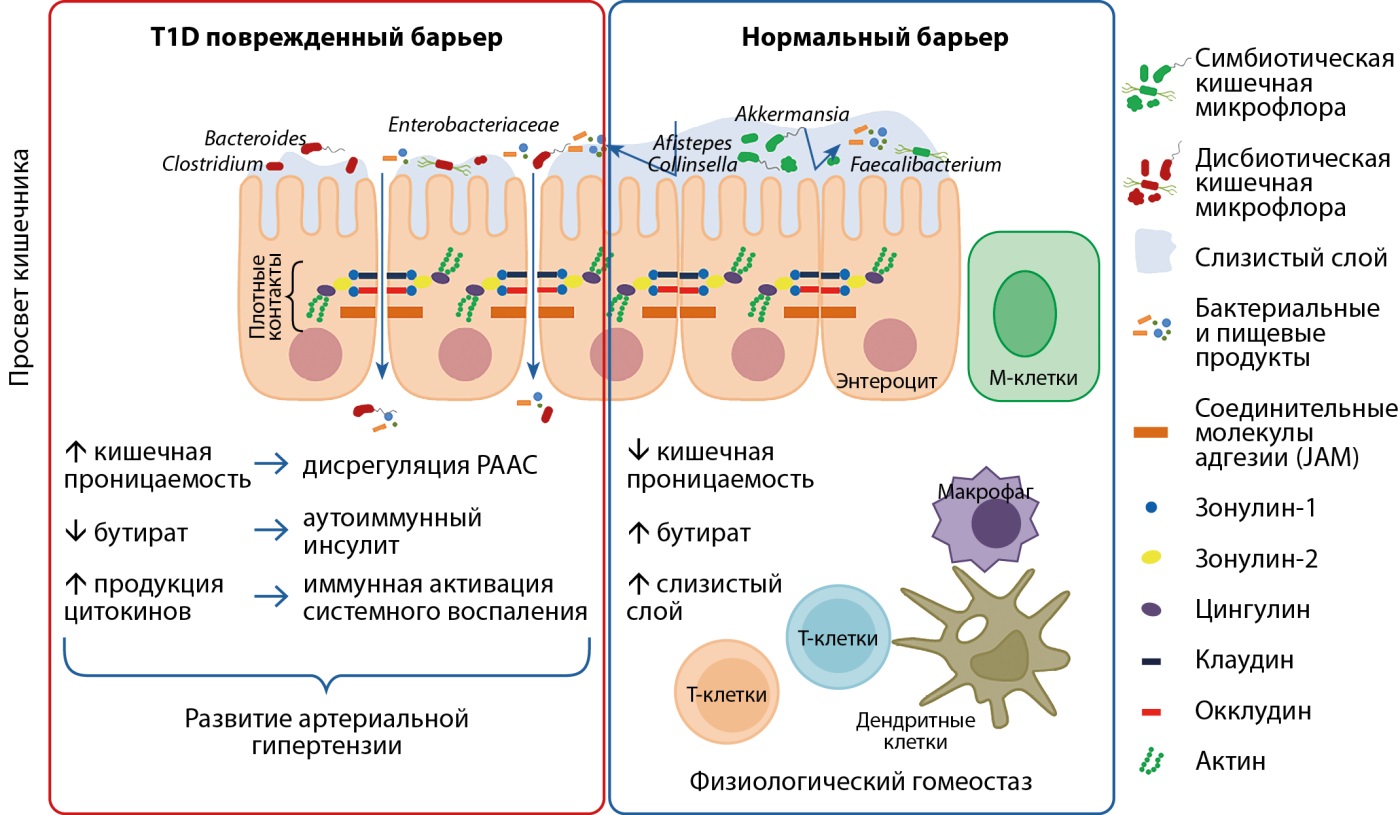
Рисунок 1. Повышение парацеллюлярной проницаемости кишечника у пациентов с сахарным диабетом 1 типа.
Примечание. Изменение белков плотного контакта приводит к увеличению проницаемости кишечника, обеспечивая доступ к собственной оболочке для чужеродных агентов (например, бактерий, эндо- и экзотоксинов, ксенобиотиков и нутриентов) и бактериальных и диетических продуктов. Накопление этих бактерий и молекул может запускать воспалительные процессы, индуцировать системное воспаление, активировать аутореактивные клоны Т и В-лимфоцитов в лимфоидной ткани, ассоциированной с кишечником, индуцировать развитие аутоиммунного инсулита.
Интересно, что увеличение проницаемости тонкой кишки также обнаружено у индивидов с риском развития СД1, что подтверждает гипотезу о том, что изменения в барьере слизистой оболочки кишечника могут быть связаны с аутоиммунным процессом, который способствует началу заболевания [18]. В настоящее время крупные исследования, демонстрирующие взаимосвязь дисбаланса липополисахаридсвязывающих систем и АГ в группе пациентов с СД1, отсутствуют. Стоит отметить, что общий баланс состава микробиоты кишечника также может влиять на регуляцию АД. Также, вероятно, снижение численности лактобактерий связано с гипертонией и может отражать дефицит выработки пептидов, полученных из Lactobacillus, которые проявляют ингибирующую активность по отношению к ангиотензин-превращающему ферменту (АПФ) [19]. И, наконец, в исследованиях ряда авторов у детей с аутоантителами к β-клеткам поджелудочной железы была обнаружена повышенная численность Bacteroides и низкая численность микробиоты, продуцирующей бутират [20][21]. Основные микроорганизмы, продуцирующие бутират, представлены на рисунке 2.
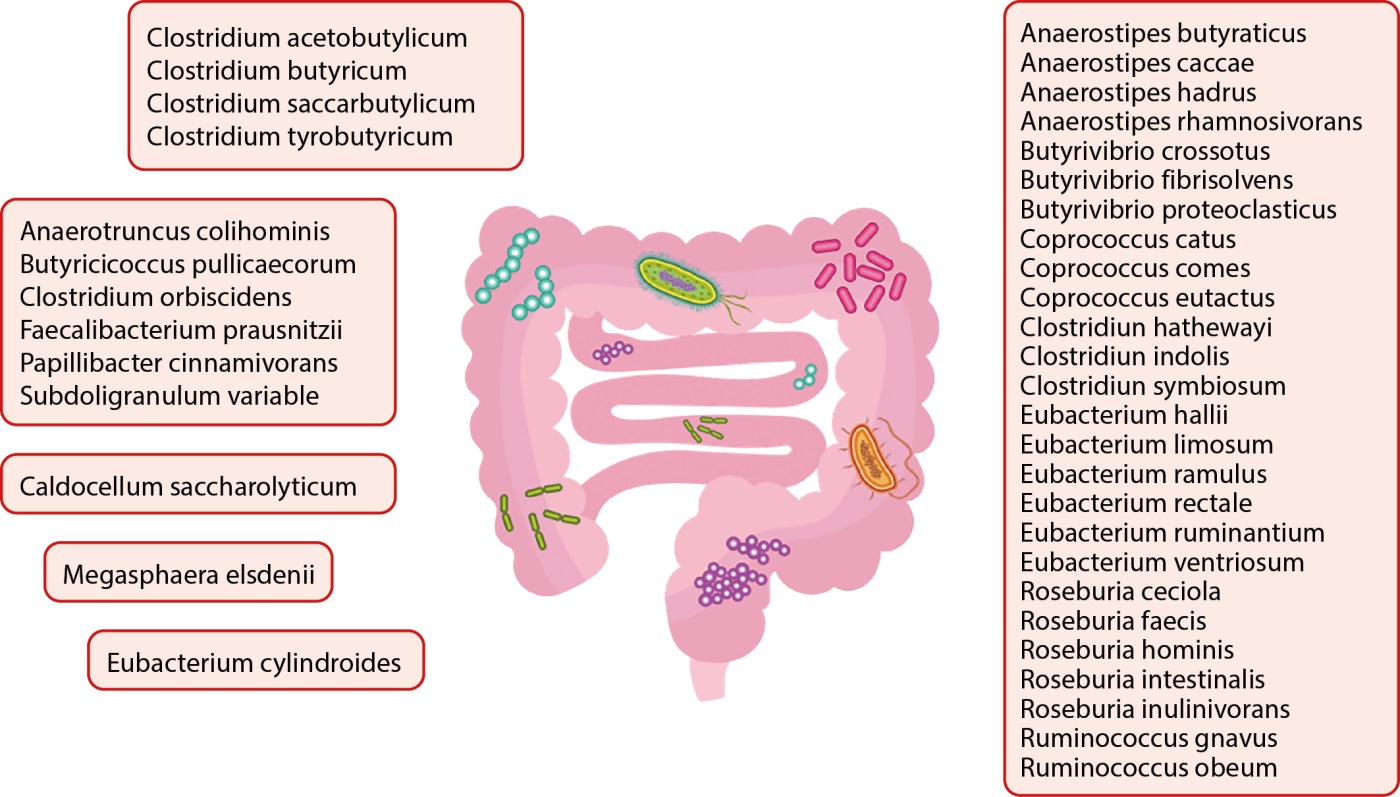
Рисунок 2. Основные представители кишечной микробиоты, продуцирующей бутират.
Сообщалось об отрицательной корреляции между продуцентами бутирата, кишечной проницаемостью и риском развития СД1 [22]. Однако даже на поздней стадии преддиабета было обнаружено небольшое количество продуцентов бутирата, что позволяет предположить роль микробиоты как регулятора аутоиммунитета β-клеток в прогрессировании заболевания [23].
ПРОФИЛИ ИЗМЕНЕНИЯ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ У ПАЦИЕНТОВ С САХАРНЫМ ДАБЕТОМ 1 ТИПА
По мере развития персонализированной медицины в различных отраслях врачебной практики укоренилось понятие «фенотипы». Разделение пациентов на фенотипы изменения АД позволяет оптимизировать диагностический и лечебный подходы к ведению больных, определять терапевтический алгоритм и необходимые аспекты контроля над АГ и ее профилактики. При проведении полного обследования (комбинируя офисное измерение АД и суточное мониторирование артериального давления (СМАД) пациентов с СД1, можно выявить различные фенотипы изменения АД. К ним относятся: истинная нормотензия (отсутствие повышения АД при офисном измерении и по результатам СМАД), устойчивая артериальная гипертензия (наличие повышения АД при офисном измерении и при проведении СМАД), гипертензия белого халата (гипертензия при офисном измерении АД, нормотензия по результатам СМАД) и маскированная (скрытая) артериальная гипертензия (нормотензия при офисном измерении, гипертензия по данным СМАД). В настоящее время данные о целевом уровне АД среди пациентов с СД1 варьируют. Действующие рекомендации Европейской ассоциации по изучению диабета регламентируют общие целевые значения АД для пациентов с СД1 менее 140/90 мм рт.ст., в то время как Американская диабетическая ассоциация рекомендует определять более строгое офисное целевое значение АД — менее 130/80 мм рт.ст. [24].
В настоящее время СМАД считается золотым стандартом в диагностике АГ, поскольку превосходит другие методы в чувствительности и специфичности [25]. Только на основании результатов СМАД могут быть получены некоторые важные с клинической точки зрения показатели АД. Однако начать следует с усредненного значения АД за 24 часа — важнейшего интегрального показателя, отражающего воздействие на пациента психосоциальных факторов и окружающей среды в течение суток. Главными собственно расчетными индексами являются вариабельность (краткосрочная) АД (ВАД), величина утреннего подъема (ВУП) АД и степень его ночного снижения (СНС). Также СМАД позволяет оценить такие важнейшие показатели, как среднеинтегральное АД, индекс времени САД и ДАД, а также некоторые косвенные показатели гемодинамики, такие как скорость пульсовой волны, время ее распространения, индекс ригидности артерий, индекс отражения и аугментации, линейная и объемная скорость кровотока и др.
Разработка и внедрение неинвазивных амбулаторных устройств для измерения АД позволила круглосуточно отслеживать изменение АД и идентифицировать несколько паттернов нарушенной суточной вариабельности АД, таких как аномальное снижение АД или ночная гипертензия [26]. Согласно классическим определениям, индивиды обозначаются как дипперы (dipper), когда ночное падение АД составляет ≥10% от дневных значений (т.е. нормальный циркадный ритм), и нондипперы, когда индекс вариабельности АД в ночные и дневные часы составляет <10% (патологический циркадный ритм) [27]. Совсем недавно эта классификация была расширена до четырех категорий: диппер (нормальная степень ночного снижения АД), овер-диппер (избыточное ночное снижение АД — >20% от дневных значений), нон-диппер (недостаточная степень снижения АД в ночные часы), найт-пикер (устойчивое повышение АД в ночное время) (табл. 1).
Таблица 1. Профили изменения артериального давления в течение суток
|
Профиль изменения АД |
Определение |
Суточный индекс САД |
|
Диппер |
Нормальная степень ночного снижения АД |
10–20% |
|
Нон-диппер |
Недостаточное снижение АД в ночные часы |
≥0%–<10% |
|
Овер-диппер |
Чрезмерное снижение АД в ночные часы |
<0% |
|
Найт-пикер |
Устойчивое повышение АД в ночные часы |
>20% |
Примечание: АД — артериальное давление, САД — систолическое артериальное давление.
Несмотря на убедительные доказательства того, что интенсивный контроль АД снижает риск диабетических осложнений и улучшает прогноз у лиц с диабетической нефропатией, удивительно малое число пациентов с СД1 достигают целевых показателей лечения АД, несмотря на регулярные последующие визиты [27]. Исследование большой и репрезентативной когорты пациентов с СД1 из финского регистра FinnDiane (n=3678) показало, что 60% пациентов не достигли целевого уровня АД менее 130/85 мм рт.ст. при лечении, а доля недостижения целевого уровня АД при его значении менее 130/80 мм рт.ст. была близка к 70% (табл. 2). В исследовании Кобалава Ж.Д. и соавт., где был обследован 81 пациент с СД1, частота АГ на основании клинического измерения и СМАД составила 44,5% (36 пациентов), а среди профилей изменения АД у пациентов со всеми фенотипами изменения АД преобладали нон-дипперы (16,6%) и найт-пикеры (16,6%) [28]. В работе Dost A., Klinkert C. и соавт. распространенность нарушения циркадного профиля АД по типу нон-диппер была особенно высока в определенных подгруппах, например, у пожилых людей, у лиц с хронической болезнью почек, у лиц с положительным резус-фактором и у пациентов с сахарным диабетом [29]. У детей и подростков с СД1 (n=2105) распространенность паттерна нон-диппер составила около 49% для систолического АД и 17,5% для диастолического АД [29].
Таблица 2. Определение и распространенность различных фенотипов артериального давления в четырех различных когортах лиц с сахарным диабетом 1 типа
|
Фенотип изменения АД |
Офисное АД |
АД по данным СМАД |
Распространенность |
||
|
Finn Diane |
Steno |
Бразильское исследование |
|||
|
Нормотония |
<140/<90 |
<140/<90 |
38% |
18% |
47% |
|
Гипертония «белого халата» |
≥140/≥90 |
<140/<90 |
6% |
27% |
10% |
|
Скрытая АГ |
<140/<90 |
≥140/≥90 |
23% |
10% |
7% |
|
Устойчивая АГ |
≥140/≥90 |
≥140/≥90 |
33% |
45% |
35% |
Примечание: АД — артериальное давление, АГ — артериальная гипертензия, СМАД — суточное мониторирование артериального давления.
Все большее количество данных показывает, что пациенты, как с недостаточным снижением АД в ночные часы, так и лица с ночным повышением АД, имеют больший риск развития неблагоприятных сердечно-сосудистых событий и повреждения органов-мишеней, чем пациенты с нормальным суточным уровнем АД [30]. В литературе имеются также убедительные доказательства того, что ночное АД является более сильным предиктором неблагоприятных исходов и более точным при стратификации сердечно-сосудистого риска, чем дневное АД [31]. При СД1 паттерн нон-диппер был продемонстрирован как клинический маркер диабетической автономной нейропатии [32] и повреждения почек, и, таким образом, это подчеркивает важность определения характера ночного профиля АД с помощью СМАД у лиц с СД1. В начале 1990-х годов уже была продемонстрирована связь между недостаточным снижением АД в ночные часы и микроальбуминурией (n=90), а также между более низкими суточными колебаниями систолического АД и сердечно-сосудистой автономной нейропатией (n=87) [33]. Позже, в проспективном исследовании (n=75), было показано, что повышение САД во время сна предшествует развитию микроальбуминурии [34]. При СД1 распространены множественные нарушения показателей АД, которые могут указывать на развитие осложнений в будущем [35]. Эти показатели могут отражать различия между офисным измерением АД и его колебаниями вне медицинского учреждения, например, «гипертензия белого халата» (маскированная гипертензия), нарушение циркадной вариабельности АД (например, аномальные колебания АД или ночная гипертензия) или невозможность контролировать АД, несмотря на многократную антигипертензивную терапию (т.е. резистентная к лечению артериальная гипертензия). Офисные измерения АД основаны на ограниченном количестве данных: полученные только в единичных случаях, они не отражают реальных изменений АД в повседневной активности пациента и, следовательно, могут привести к неадекватной диагностике и лечению артериальной гипертензии, поскольку, как правило, лечение направлено на нормализацию офисного АД.
ЗАКЛЮЧЕНИЕ
- В настоящее время стоит акцентировать внимание на том, что патогенез СД1, и в частности гипертензии у пациентов с СД1, изучен недостаточно. Развитие СД1 можно объяснить вмешательством генетических, эпигенетических и экологических факторов, и, по нашему мнению, помимо роли диабетической нефропатии и дисрегуляции РААС на системном уровне и митохондриальной дисфункции на клеточном уровне, одним из ключевых таких факторов является желудочно-кишечная микробиота и роль системного воспаления, развитие которого приводит к дисбалансу иммунных реакций в организме человека. Ключевой вопрос, касающийся роли микробиома при гипертонии и других ССЗ, заключается в том, является ли дисбиоз кишечника первопричинным фактором, приводящим к устойчивому повышению АД, или же гипертония влияет на микробиом таким образом, что способствует прогрессированию тяжести АГ.
- Нарушения показателей АД в течение суток, вероятно, указывая на развитие диабетических осложнений, являются неотъемлемым параметром, необходимым для более детального и пациентоориентированного подхода к обследованию лиц с СД1. СМАД является важным и точным инструментом для выявления ночной артериальной гипертензии и других паттернов изменения АД, в первую очередь для снижения вероятности ложноположительных результатов в контексте диагностики «гипертонии белого халата» и ложноотрицательных результатов при диагностике скрытой АГ. Проведение СМАД актуально для подтверждения истинного фенотипа АГ и установления адекватного контроля АД с помощью назначения антигипертензивной терапии, ориентируясь на циркадные колебания АД.
- По нашему мнению, существует нереализованная потребность в оптимизации диагностики и лечения различных видов нарушенного контроля АД у лиц с СД1. Отсутствие крупных клинических исследований, рассматривающих эту проблему, приводит к тому, что лечение артериальной гипертензии у данной группы пациентов носит эмпирический характер. Поэтому при выборе антигипертензивных препаратов у этих пациентов мы должны учитывать, помимо выводов исследований по сахарному диабету 2 типа, также этиопатогенез заболевания и как правило молодой возраст этих пациентов, а также особые условия (интенсивная инсулинотерапия) и клинические ситуации, типичные для этой группы пациентов, например более высокий риск гипогликемии и возможность реализации репродуктивных планов у женщин, что значительно сокращает спектр выбора гипотензивных препаратов. При оказании медицинской помощи пациентам с СД1 и нарушениями артериального давления необходимо сотрудничество между диабетологами и специалистами по артериальной гипертензии, а также развитие персонифицированного подхода к диагностике и лечению АГ у данной группы пациентов, прежде всего реализованного в стремлении выявить колебания АД как можно ранее, определив целевые значения АД, и рекомендовать антигипертензивную терапию, основанную на тщательной оценке пользы и риска назначения данных препаратов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Усеинова Р.Х. — анализ литературных источников, поиск актуальной информации, написание текста статьи; Белоглазов В.А. — анализ актуальности работы, внесение в рукопись существенной правки с целью повышения научной ценности статьи; Репинская И.Н. — поиск актуальной информации, написание текста статьи; Яцков И.А. — написание текста статьи, внесение в рукопись существенной правки с целью повышения научной ценности статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Kheriji N, Dakhlaoui T, Kamoun Rebai W, et al. Prevalence and risk factors of diabetes mellitus and hypertension in North East Tunisia calling for efficient and effective actions. Sci Rep. 2023;13(1):12706. doi: https://doi.org/10.1038/s41598-023-39197-0
2. Avogaro A, Fadini GP. Microvascular complications in diabetes: A growing concern for cardiologists. Int J Cardiol. 2019;291:29-35. doi: https://doi.org/10.1016/j.ijcard.2019.02.030
3. Harjutsalo V, Pongrac Barlovic D, Groop PH. Longterm population-based trends in the incidence of cardiovascular disease in individuals with type 1 diabetes from Finland: a retrospective, nationwide, cohort study. Lancet Diabetes Endocrinol. 2021;9:575–85. doi: https://doi.org/10.1016/S2213-8587(21)00172-8
4. Jansson Sigfrids F, Groop PH, Harjutsalo V. Incidence rate patterns, cumulative incidence, and time trends for moderate and severe albuminuria in individuals diagnosed with type 1 diabetes aged 0-14 years: a population-based retrospective cohort study. Lancet Diabetes Endocrinol. 2022;10:489–98. doi: https://doi.org/10.1016/S2213-8587(22)00099-7
5. Mogensen CE. Microalbuminuria and hypertension with focus on type 1 and type 2 diabetes. J Intern Med 2003;254:45–66. doi: https://doi.org/10.1046/j.1365-2796.2003.01157.x
6. Sugandh F, Chandio M, Raveena F, et al. Advances in the Management of Diabetes Mellitus: A Focus on Personalized Medicine. Cureus. 2023;15(8):e43697. doi: https://doi.org/10.7759/cureus.43697
7. Yun JS, Ko SH. Current trends in epidemiology of cardiovascular disease and cardiovascular risk management in type 2 diabetes. Metabolism. 2021;123:154838. doi: https://doi.org/10.1016/j.metabol.2021.154838
8. Pasquel FJ, Lansang MC, Dhatariya K, Umpierrez GE. Management of diabetes and hyperglycaemia in the hospital. Lancet Diabetes Endocrinol. 2021;9(3):174-188. doi: https://doi.org/10.1016/S2213-8587(20)30381-8
9. Burgos-Morón E, Abad-Jiménez Z, Marañón AM, et al. Relationship Between Oxidative Stress, ER Stress, and Inflammation in Type 2 Diabetes: The Battle Continues. J Clin Med. 2019;8(9):1385. doi: https://doi.org/10.3390/jcm8091385
10. Al-Gadi IS, Haas RH, Falk MJ, Goldstein A, McCormack SE. Endocrine Disorders in Primary Mitochondrial Disease. J Endocr Soc. 2018;2(4):361-373. doi: https://doi.org/10.1210/js.2017-00434
11. Zajec A, Trebušak Podkrajšek K, Tesovnik T, et al. Pathogenesis of Type 1 Diabetes: Established Facts and New Insights. Genes (Basel). 2022;13(4):706. doi: https://doi.org/10.3390/genes13040706
12. Cook KL, Chappell MC. Gut dysbiosis and hypertension: is it cause or effect?. J Hypertens. 2021;39(9):1768-1770. doi: https://doi.org/10.1097/HJH.0000000000002908
13. Verhaar BJH, Prodan A, Nieuwdorp M, Muller M. Gut Microbiota in Hypertension and Atherosclerosis: A Review. Nutrients. 2020; 12(10):2982. doi: https://doi.org/org/10.3390/nu12102982
14. Chen X, Li P, Liu M, et al. Gut dysbiosis induces the development of pre-eclampsia through bacterial translocation. Gut. 2020;69(3):513-522. doi: https://doi.org/10.1136/gutjnl-2019-319101
15. Wang S, Cui Z, Yang H. Interactions between host and gut microbiota in gestational diabetes mellitus and their impacts on offspring. BMC Microbiol. 2024;24(1):161. doi: https://doi.org/10.1186/s12866-024-03255-y
16. Santisteban MM, Qi Y, Zubcevic J, et al. Hypertension-Linked Pathophysiological Alterations in the Gut. Circ Res. 2017;120(2):312-323. doi: https://doi.org/10.1161/CIRCRESAHA.116.309006
17. Gavin PG, Hamilton-Williams EE. The gut microbiota in type 1 diabetes: friend or foe? Curr Opin Endocrinol Diabetes Obes. 2019;26(4):207-212. doi: https://doi.org/10.1097/MED.0000000000000483
18. Luo M, Sun M, Wang T, et al. Gut microbiota and type 1 diabetes: a two-sample bidirectional Mendelian randomization study. Front Cell Infect Microbiol. 2023;13:1163898. doi: https://doi.org/10.3389/fcimb.2023.1163898
19. Buford TW, Sun Y, Roberts LM, et al. Angiotensin (1-7) delivered orally via probiotic, but not subcutaneously, benefits the gut-brain axis in older rats. Geroscience. 2020;42(5):1307-1321. doi: https://doi.org/10.1007/s11357-020-00196-y
20. de Goffau MC, Luopajärvi K, Knip M, et al. Fecal microbiota composition differs between children with β-cell autoimmunity and those without. Diabetes. 2013;62(4):1238-1244. doi: https://doi.org/10.2337/db12-0526
21. Amiri P, Hosseini SA, Ghaffari S, et al. Role of Butyrate, a Gut Microbiota Derived Metabolite, in Cardiovascular Diseases: A comprehensive narrative review. Front Pharmacol. 2022;12:837509. doi: https://doi.org/10.3389/fphar.2021.837509
22. Brown CT, Davis-Richardson AG, Giongo A, et al. Gut microbiome metagenomics analysis suggests a functional model for the development of autoimmunity for type 1 diabetes. PLoS One. 2011;6(10):e25792. doi: https://doi.org/10.1371/journal.pone.0025792
23. Zhou H, Sun L, Zhang S, Zhao X, Gang X, Wang G. Evaluating the Causal Role of Gut Microbiota in Type 1 Diabetes and Its Possible Pathogenic Mechanisms. Front Endocrinol (Lausanne). 2020;11:125. doi: https://doi.org/10.3389/fendo.2020.00125
24. Massimo F Piepoli, Arno W Hoes, Stefan Agewall, Christian Albus, Carlos Brotons, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts). European Heart Journal, 2016;37(29). doi: https://doi.org/10.1093/eurheartj/ehw106
25. Горбунов В.М. Позиция суточного мониторирования артериального давления в современной практике. // Кардиоваскулярная терапия и профилактика. — 2022. — Т.21. — №12. — С.3456. doi: https://doi.org/10.15829/1728-8800-2022-3456
26. Fucile I, Manzi MV, Mancusi C. Blood Pressure and Lipid Profile in Hypertensive Patients Post the First COVID-19 Lockdown: «Brief Letter for Publication». High Blood Press Cardiovasc Prev. 2021;28(5):493-494. doi: https://doi.org/10.1007/s40292-021-00470-w
27. Williams B, Mancia G, Spiering W, AgabitiRosei E, Azizi M, Burnier M. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial h. J Hypertens. 2018;36(10):1953–2041. doi: https://doi.org/10.1097/HJH.0000000000001940.
28. Кобалава Ж.Д., Ставцева Ю.В., Троицкая Е.А., Сафарова А.Ф., Петросян А.Е. Фенотипы артериального давления у пациентов молодого возраста с сахарным диабетом первого типа. // Российский кардиологический журнал. — 2020. — Т.25. — №3. — С. 3729.
29. Dost A, Klinkert C, Kapellen T, Lemmer A, Naeke A, Grabert M, et al. Arterial hypertension determined by ambulatory blood pressure profiles: contribution to microalbuminuria risk in a multicenter investigation in 2,105 children and adolescents with type 1 diabetes. Diabetes Care 2008;31:720–5. doi: https://doi.org/10.2337/dc07-0824
30. Hermida RC, Ayala DE, Fernandez JR, Mojon A, Smolensky MH. Hypertension: new perspective on its definition and clinical management by bedtime therapy substantially reduces cardiovascular disease risk. Eur J Clin Invest 2018;48: e12909. doi: https://doi.org/10.1111/eci.12909.
31. Najafi MT, Khaloo P, Alemi H, Jaafarinia A, Blaha MJ, Mirbolouk M, et al. Ambulatory blood pressure monitoring and diabetes complications: targeting morning blood pressure surge and nocturnal dipping. Medicine (Baltimore) 2018;97:e12185. doi: https://doi.org/10.1097/MD.0000000000012185.
32. Spallone V, Maiello MR, Morganti R, Mandica S, Frajese G. Usefulness of ambulatory blood pressure monitoring in predicting the presence of autonomic neuropathy in type I diabetic patients. J Hum Hypertens 2007;21:381–6. doi: https://doi.org/10.1038/sj.jhh.1002162.
33. Lurbe E, Redon J, Pascual JM, Tacons J, Alvarez V. The spectrum of circadian blood pressure changes in type I diabetic patients. J Hypertens 2001;19:1421–8. doi: https://doi.org/10.1097/00004872-200108000-00010
34. James S, Perry L. Lowe J, et al. Blood pressure in adolescents and young adults with type 1 diabetes: data from the Australasian Diabetes Data Network registry. Acta Diabetol 2023;60:797–803. doi: https://doi.org/10.1007/s00592-023-02057-4
35. Ogle GD, James S, Dabelea D, et al. Global estimates of incidence of type 1 diabetes in children and adolescents: Results from the International Diabetes Federation Atlas, 10th edition. Diabetes Res Clin Pract. 2022;183:109083. doi: https://doi.org/10.1016/j.diabres.2021.109083
Об авторах
Р. Х. УсеиноваРоссия
Усеинова Реан Хайриевна, аспирант
ResearcherID: JFS-3563-2023
Scopus Author ID: 57223343609
295007, Республика Крым, г. Симферополь, просп. Академика Вернадского, д. 4
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
В. А. Белоглазов
Россия
Белоглазов Владимир Алексеевич, д.м.н., профессор
Scopus Author ID: 7007129056
Симферополь
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
И. Н. Репинская
Россия
Репинская Ирина Николаевна
Симферополь
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
И. А. Яцков
Россия
Яцков Игорь Анатольевич, к.м.н., доцент
Scopus Author ID: 57218873902
Симферополь
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Повышение парацеллюлярной проницаемости кишечника у пациентов с сахарным диабетом 1 типа. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(844KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Основные представители кишечной микробиоты, продуцирующей бутират. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(911KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Усеинова Р.Х., Белоглазов В.А., Репинская И.Н., Яцков И.А. Артериальная гипертензия у молодых пациентов с сахарным диабетом 1 типа. Дисбиоз и повышение парацеллюлярной кишечной проницаемости как потенциальные звенья патогенеза. Ожирение и метаболизм. 2025;22(3):214-221. https://doi.org/10.14341/omet13137
For citation:
Useinova R.Kh., Beloglazov V.A., Repinskaya I.N., Yatskov I.A. Arterial hypertension in young patients with type 1 diabetes mellitus. Dysbiosis and increased paracellular intestinal permeability as potential links of pathogenesis. Obesity and metabolism. 2025;22(3):214-221. (In Russ.) https://doi.org/10.14341/omet13137
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































