Перейти к:
Патофизиологические и клинические аспекты старения жировой ткани
https://doi.org/10.14341/omet13069
Аннотация
Жировая ткань присутствует практически во всех органах и тканях, а также формирует жировые депо, разнообразные по своим структурным и функциональным характеристикам. Жировая ткань крайне пластична; в течение жизни она претерпевает множество изменений и перестроек. С возрастом меняется соотношение различных типов жировой ткани и микроокружение адипоцитов, включая стромальный компонент, иммунные клетки и сосудистое русло. Кроме того, стратегии запасания энергии у молодых и пожилых людей отличаются. С возрастом даже в условиях нормальной массы тела наблюдается перераспределение жировой ткани в висцеральные депо, что усугубляет метаболические расстройства и способствует инсулинорезистентности. Наряду с увеличением провоспалительного потенциала и эндотелиальной дисфункцией старение жировой ткани увеличивает риск неблагоприятных сердечно-сосудистых исходов. Вместе с тем описанные изменения наблюдаются и при ожирении даже у сравнительно молодых пациентов. Предполагается, что особенности накопления липидов за счет гипертрофии адипоцитов влекут за собой развитие дисфункции жировой ткани, что отражается в изменении ее цитокинового и гормонального профиля. Подобные патологические процессы характерны для так называемого «метаболически нездорового» ожирения.
В представленном обзоре приведены современные сведения об изменениях, которым подвергаются различные типы жировой ткани с течением времени, а также о связи патофизиологических процессов с клиническими проявлениями, наблюдающимися при старении и дисфункции жировой ткани.
Ключевые слова
Для цитирования:
Семикова Г.В., Халимов Ю.Ш., Волкова А.Р. Патофизиологические и клинические аспекты старения жировой ткани. Ожирение и метаболизм. 2025;22(1):41-51. https://doi.org/10.14341/omet13069
For citation:
Semikova G.V., Khalimov Yu.Sh., Volkova A.R. Adipose tissue aging: pathophysiological and clinical aspects. Obesity and metabolism. 2025;22(1):41-51. (In Russ.) https://doi.org/10.14341/omet13069
Введение
Жировая ткань (ЖТ) занимает в организме человека до 15–20% у мужчин и до 25–30% у женщин. При морбидном ожирении массовая доля ЖТ может составлять более 70%. Сложно найти ткань, столь разнообразную по своему строению, происхождению, а также локализации — в том или ином виде скопления ЖТ присутствуют практически во всех органах, формируя так называемые жировые депо. Функции жировой ткани многочисленны: она отмечает за накопление энергии, несократительный термогенез, защищает внутренние органы от механического и термического повреждения, служит источником множества гормонов и цитокинов, участвует в гемопоэзе и ремоделировании костной ткани, способствует секреции грудного молока. Что немаловажно, именно жировая ткань является «полем боя» в развитии метаболических нарушений, ассоциированных со старением.
Вместе с тем ЖТ онтогенетически и функционально весьма неоднородна, так как развивается из различных зачатков: в частности, адипоциты подкожной жировой клетчатки образуются из мезенхимальных и гемопоэтических клеток, а адипоциты, локализующиеся в краниофациальной области, происходят из нейроэктодермы. Помимо этого, в качестве предшественников адипоцитов могут выступать фибробласты, клетки эндотелия и перициты. Более того, адипоциты различного происхождения нередко составляют одно жировое депо [1]. Дифференцировка адипоцитов происходит под влиянием сложных эндокринных и паракринных механизмов, существенное влияние оказывает и стромальный компонент ткани, а также иммунный состав отдельно взятого жирового депо. Гормональное влияние на рост и дифференцировку адипоцитов представлено в первую очередь инсулином, кортизолом, соматотропным гормоном, лептином и адипонектином, причем эффекты гормонов могут различаться в зависимости от локализации жирового депо [2]. В настоящее время с учетом выраженной гетерогенности жировых депо каждое из них может быть рассмотрено как отдельный эндокринный орган. Особенности происхождения адипоцитов и строение жировой клетчатки лежат в основе как функциональных особенностей, так и возрастных изменений жировой ткани различных локализаций.
Возникающие в пожилом возрасте перераспределение жировых депо, функциональные нарушения адипоцитов, изменения их соотношения и профиля секретируемых цитокинов играют значительную роль в развитии множества заболеваний [3][4].
Виды, строение и функции жировой ткани
В настоящее время известно несколько видов ЖТ, состоящих из белых, бежевых, бурых, желтых и розовых адипоцитов. Белые, бежевые и бурые адипоциты в жировых депо организма встречаются в разном соотношении. Желтые адипоциты формируют желтый костный мозг, регулируют процессы костного ремоделирования и гемопоэза. Розовые адипоциты, находящиеся в молочных железах, обеспечивают энергией другие ткани молочной железы и синтез компонентов грудного молока. Таким образом, жировая ткань должна рассматриваться не как единый орган, а как множество органов с различным происхождением, клеточным составом и, как следствие, функциональными особенностями.
Белая жировая ткань (БЖТ), содержащая 50–80% зрелых белых адипоцитов, обеспечивает накопление энергии путем запасания ее в форме триглицеридов, а также активно вовлечена в углеводный и липидный виды обмена, обеспечивает механическую и тепловую защиту и широкий спектр эндокринных и метаболических воздействий. БЖТ имеет хорошо выраженное сосудистое русло, что необходимо для активного рекрутирования мезенхимальных стволовых клеток и их дальнейшей дифференцировки по пути преадипоцитов [5].
БЖТ распределена по подкожным (более 80%) и многочисленным висцеральным жировым депо, причем подкожные преадипоциты имеют высокую пролиферативную активность и способны очень быстро накапливать липиды, а для висцеральных адипоцитов характерен высокий темп липолиза и повышенная склонность к апоптозу [6]. Подкожная жировая клетчатка (ПЖК), помимо белых адипоцитов, также содержит бежевые адипоциты, способные как к накоплению липидов в виде капель, так и к термогенезу [7]. В бежевых адипоцитах митохондрий больше, чем в белых, но меньше, чем в бурых, а содержание белка UCP-1 (uncouple protein 1 — разобщающий белок-1, термогенин) в неактивированных бежевых адипоцитах также сравнительно невелико. Количество митохондрий и содержание UCP-1 в бежевых адипоцитах повышается лишь в ответ на адренергическую активацию, приводя к так называемому браунингу (от английского «browning») — резкому увеличению количества митохондрий, что дает им возможность участвовать в поддержании энергетического и температурного гомеостаза. Количество бежевой жировой ткани у животных возрастает под влиянием миокинов, выделяющихся при физической активности; подобный эффект у людей в настоящее время еще не доказан.
Висцеральный жир составляет до 20% ЖТ у мужчин и до 10% у женщин, количество бежевых адипоцитов в нем невелико. Он может быть локализован в средостении (интраторакальный), вокруг сердца (эпикардиальный), желудка (эпигастральный), кровеносных сосудов (периваскулярный), а также способен проникать в паренхиматозные органы и мышечную ткань [8]. Эпикардиальный и перикардиальный жир является объектом пристального внимания исследователей, поскольку содержит более 20% иммунных клеток и активно участвует в процессах воспаления, внося вклад в развитие сердечно-сосудистых заболеваний. Распределение основных жировых депо представлено на рис. 1.
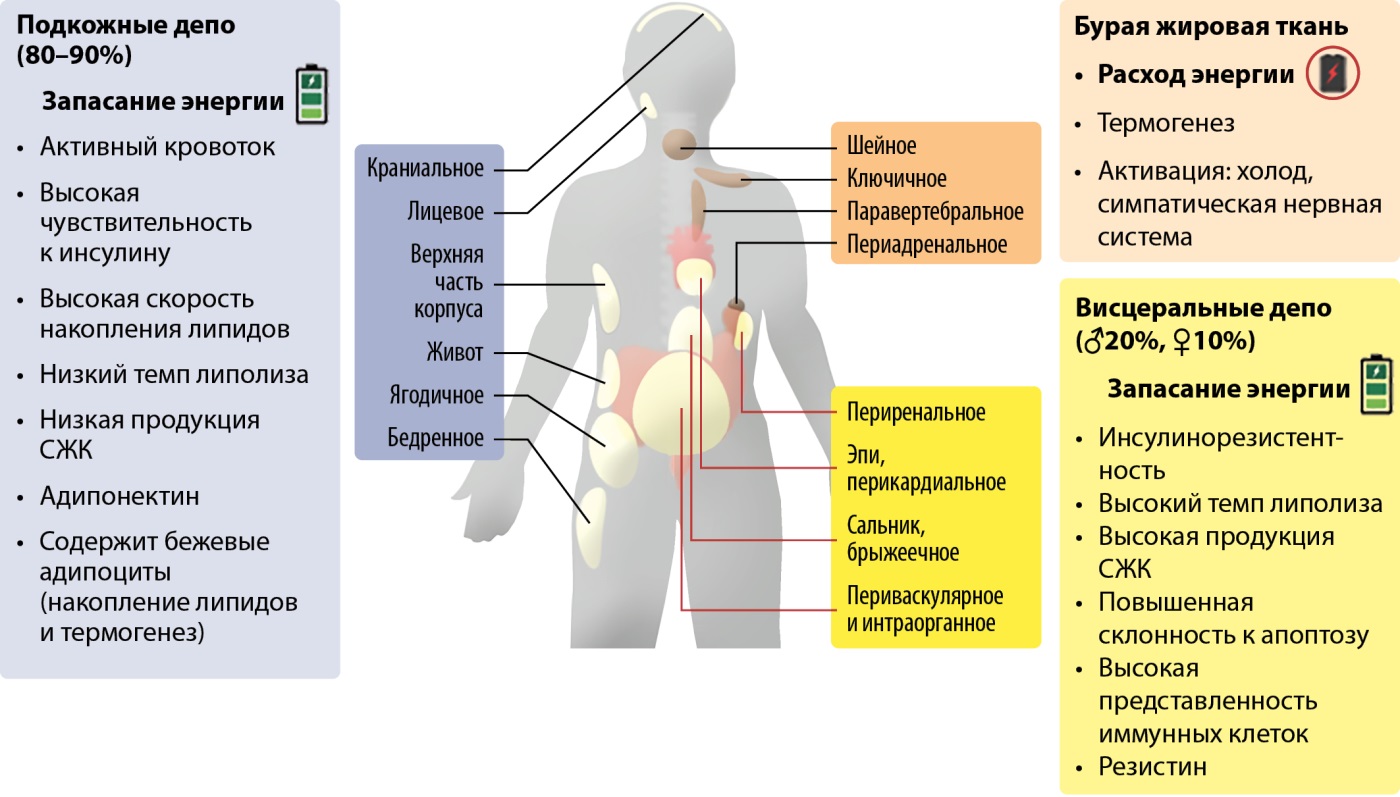
Рисунок 1. Распределение и функции основных жировых депо в организме человека.
СЖК — свободные жирные кислоты.
Figure 1. Distribution and functions of the fat depots in the human body.
Бурая жировая ткань отвечает за «несократительный» термогенез (что объясняет ее второе название — «термогенная жировая ткань»), активно участвует в жировом и углеводном видах обмена, секретирует широкий спектр адипокинов. Данный тип ЖТ состоит преимущественно из бурых адипоцитов, содержащих большое количество митохондрий, цитохромы на поверхности которых и придают характерный цвет, а содержание UCP-1 достигает 30%. Бурая ЖТ также активно васкуляризирована и снабжена окончаниями симпатических нервов, регулирующих ее метаболическую активность [9].
У взрослого человека доля бурой ЖТ сравнительно невелика — до 1,5% от массы тела (у новорожденных — до 5%). Локализуется она преимущественно в надключичной области), небольшое количество содержится также в области мышц и сосудов шеи и грудной клетки, жировых комочках щек, в области подмышек, брюшной полости, средостении и по ходу позвоночника, а также возле ряда внутренних органов: поджелудочной железы, печени, почек, надпочечников, селезенки (рис. 1). В ходе взросления организма число клеток бурой ЖТ в перечисленных зонах постепенно уменьшается (на один бурый адипоцит приходится 100–200 белых) [10]. В то время как у детей в бурой ЖТ преобладают мультилокулярные адипоциты, у взрослого человека содержатся как мультилокулярные, так и унилокулярные клетки с более высоким содержанием липидов. Хроническая норадренергическая стимуляция приводит не только к увеличению экспрессии UCP-1, но и активирует гиперплазию и гипертрофию бурых адипоцитов. Кроме того, в бурой ЖТ выявлена высокая активность дейодиназы 2 типа, что увеличивает чувствительность к адренергическим влияниям через β3-адренорецепторы, опосредующие липолиз и терморегуляцию. К эндокринной стимуляции бурых (и бежевых) адипоцитов приводит действие инсулина, лептина, адипонектина, глюкагоноподобного пептида-1, эстрадиола, натрийуретических пептидов [7]. Бурая ЖТ активно участвует в регуляции углеводного и липидного видов обмена, оказывает влияние на развитие инсулинорезистентности и стеатоза печени. Так, в работе Shankar K. установлено, что трансплантация бурой ЖТ животным, находящимся на высокожировой диете, приводит к снижению массы тела и уменьшению выраженности воспаления в ЖТ; кроме того, у подопытных животных возросла чувствительность к инсулину по сравнению с контрольной группой. С другой стороны, удаление депо бурой ЖТ вызывало увеличение массы тела, рост уровня воспалительных маркеров жировой ткани и инсулинорезистентности [11]. Помимо этого, бурая ЖТ вносит вклад в работу иммунной системы и влияет на развитие костной и мышечной тканей [12][13]. Количество термогенных адипоцитов и их активность снижены как у пожилых людей, так и у больных ожирением и сахарным диабетом (СД), что обусловлено нарушением клеточной пролиферации и дифференциации преадипоцитов, а также активацией апоптоза [14].
Старение жировой ткани
Старение — это неизбежный биологический процесс, характеризующийся постепенным накоплением различных повреждений на всех уровнях: молекулярном, клеточном, тканевом и, как следствие, органном. Хорошо известны патологии, сопровождающие старение сердечно-сосудистой системы; возраст является немодифицируемым фактором риска сердечно-сосудистых осложнений. С возрастом снижается скорость клубочковой фильтрации, уменьшается минеральная плотность костей, половые железы подвергаются постепенной инволюции, возникают ассоциированные со старением нарушения когнитивных и мнестических функций. Однако представления о старении жировой ткани в настоящее время еще остаются разрозненными. Вероятно, это связано именно с неоднородностью, различным морфологическим составом и функциями отдельных жировых депо.
Старение ЖТ необходимо рассматривать как многокомпонентный процесс, параллельно происходящий в разных жировых депо на фоне системной воспалительной реакции. Возрастные изменения ЖТ заключаются в перераспределении белой жировой ткани и ее эктопическом накоплении, а также «отбеливании» бурой ЖТ. Эти процессы у пожилых людей протекают на фоне оксидативного стресса, эндотелиальной дисфункции и различных взаимоотягощающих коморбидных состояний. Старение адипоцитов, вызывающее возрастное увеличение концентрации провоспалительных факторов, приводит к нарушениям метаболизма, сердечно-сосудистым заболеваниям и когнитивным нарушениям.
Системная хроническая воспалительная реакция является одной из наиболее важных характеристик старения, а ЖТ считается одним из основных источников системных воспалительных факторов [15]. В частности, показано, что уровень интерлейкина 6 (IL-6) и фактора некроза опухолей-α (ФНО-α), секретируемых жировой тканью, увеличивается с возрастом. Стоит отметить, что действие IL-6 зависит от места его локального синтеза: так, синтез этого же цитокина в мышечной ткани приводит к усилению окисления жирных кислот, миогенезу, способствует захвату глюкозы миоцитами и росту мышечной ткани. Напротив, повышение уровня IL-6 в БЖТ и печени способствует развитию инсулинорезистентности за счет снижения активности фосфорилирования субстрата инсулинового рецептора-1, вследствие чего тормозится захват глюкозы адипоцитами. Известно, что уровень IL-6 сыворотки крови повышен у пациентов с СД 2 типа (СД2); при этом до 35% всего IL-6 синтезируется именно в ЖТ, что дает основание считать ожирение хроническим воспалительным заболеванием. [16][17]. Изменение секреторной активности ткани в пользу провоспалительных цитокинов в настоящее время описывается как SASP (senescence associated secretory phenotype, ассоциированный со старением секреторный фенотип). Функция SASP заключается в рекрутировании и активации иммунных клеток (в первую очередь макрофагов и NK-клеток) вокруг стареющих клеток с целью их быстрой элиминации. Однако с возрастом количество стареющих адипоцитов значительно увеличивается, в жировой ткани персистирует большое количество активированных иммунных клеток. На фоне системного воспаления снижается чувствительность к инсулину и подавляется дифференцировка клеток во всех типах ЖТ [18]. Привлеченные хемоаттрактантами макрофаги «воспалительной» популяции (М1-макрофаги) окружают мертвые или умирающие адипоциты и образуют типичную коронообразную структуру, которая может быть использована для количественной морфологической оценки выраженности воспаления в жировой ткани [19]. Помимо макрофагов, в стареющей жировой ткани существенно увеличивается содержание CD4+ и CD8+ клеток (данный механизм больше характерен для висцеральной ЖТ) [20].
Окислительный стресс, выраженность которого нарастает как при старении, так и при ожирении, сопровождается выделением активных форм кислорода (АФК). Экспериментально было установлено, что АФК участвуют в дифференцировке адипоцитов, приводя к усилению накопления внутриклеточных липидов и увеличению размера зрелых адипоцитов [21]. АФК усиливают привлечение иммунных клеток в ЖТ, усугубляют инсулинорезистентность и поддерживают процессы воспаления [22]. Таким образом, ЖТ является связующим звеном между возрастным воспалением и метаболической дисфункцией.
Старение белой жировой ткани
Как известно, количество адипоцитов в жировых депо у человека ограничено. Тем не менее в той или иной степени адипогенез продолжается и во взрослом возрасте, при этом если в висцеральных жировых депо индуцирующим фактором адипогенеза является переедание, то для запуска данного процесса в мышцах, костном мозге, дерме требуется более серьезное и опасное воздействие: радиация, ранения, истощение, мышечная дистрофия (рис. 2). В норме активность адипогенеза в указанных локализациях минимальна и находится под полигенным контролем.
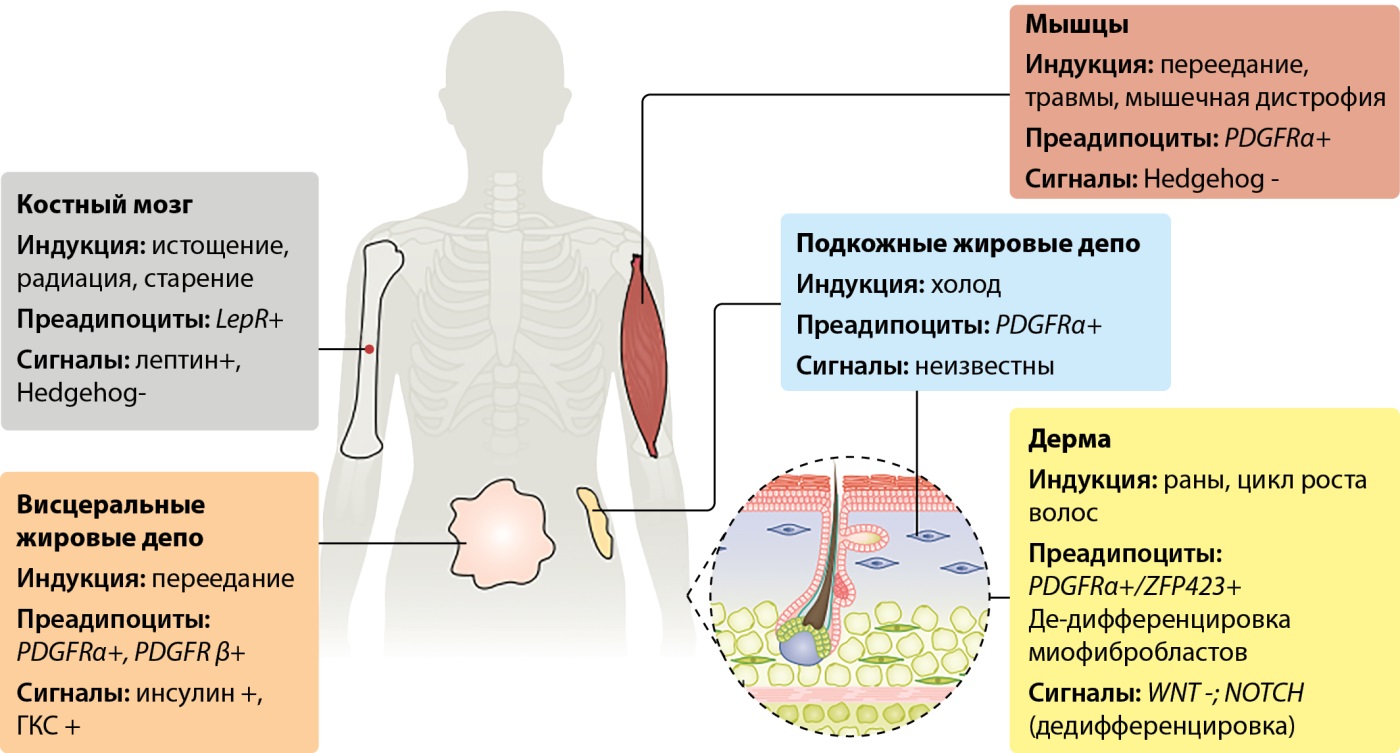
Рисунок 2. Адипогенез у взрослых (адаптировано из Ghaben, 2019) [1].
ГКС — глюкокортикостероиды, PDGFR-α/β — рецептор фактора роста тромбоцитов-α/β, LepR+ — рецепторы к лептину, ген hedgehog (sonic hedgehog) — один из ключевых генов раннего эмбриогенеза, WNT и NOTCH — сигнальные пути дифференцировки клеток, ZFP423 — Zinc Finger Protein 423.
Figure 2. Adipogenesis in adults (adapted from Ghaben, 2019).
Известно, что количество ЖТ имеет тенденцию увеличиваться в среднем возрасте и несколько уменьшаться в пожилом и старческом, что сопровождается перераспределением жира из подкожных жировых депо в висцеральные [23][24][25]. У женщин в постменопаузе и пожилых мужчин наблюдается значительное снижение процента жира на ногах и его увеличение в области живота [26]. Накопление висцеральной ЖТ является фактором риска возрастных заболеваний обмена веществ, а подкожная ЖТ имеет кардиопротективную функцию [27].
Основным механизмом увеличения объема и массы ЖТ при ожирении у взрослых является гипертрофия адипоцитов [28]. Цитокиновый профиль гипертрофированных адипоцитов характеризуется высокой провоспалительной активностью за счет повышения экспрессии ФНО-α, IL-6 и других, в то время как секреция адипонектина в этих условиях снижена. В условиях гипертрофии адипоцитов и усиления локального воспаления нарушаются процессы ангиогенеза, что приводит к гипоксии, ишемическому некрозу и апоптозу адипоцитов. Гибель клеток и гиперпродукция моноцитарного хемоаттрактантного протеина-1 гипертрофированными адипоцитами приводит к инфильтрации жировой ткани активированными макрофагами, что увеличивает экспрессию провоспалительных цитокинов, а также способствует формированию и усилению инсулинорезистентности. В описанных условиях (гибель адипоцитов, гипоксия) прогрессивно нарастает доля фибробластов, а клетки-предшественники адипоцитов могут менять программу дифференцировки от адипогенеза к фиброгенезу [29][30]. Таким образом, создаются условия для избыточного отложения коллагена во внеклеточном матриксе, что меняет механические свойства стромы, снижает пластичность подкожно-жировой клетчатки и усугубляет гипоксию адипоцитов. Схожие изменения (гиперпродукция провоспалительных цитокинов, общая склонность к преобладанию фибротических процессов) наблюдается у человека и с возрастом. Жесткая, переполненная коллагеном строма оказывает давление на адипоциты, вызывая стресс на клеточном уровне, а нарушение кровотока усугубляет гипоксию и препятствует рекрутированию стволовых клеток для дальнейшей дифференцировки в зрелые адипоциты. В описанных условиях механически ограничивается способность адипоцитов к накоплению липидов: по результатам некоторых исследований, диаметр адипоцитов подкожно-жировой клетчатки обратно пропорционален степени фиброза [31]. Процесс старения белой жировой ткани схематично представлен на рис. 3.
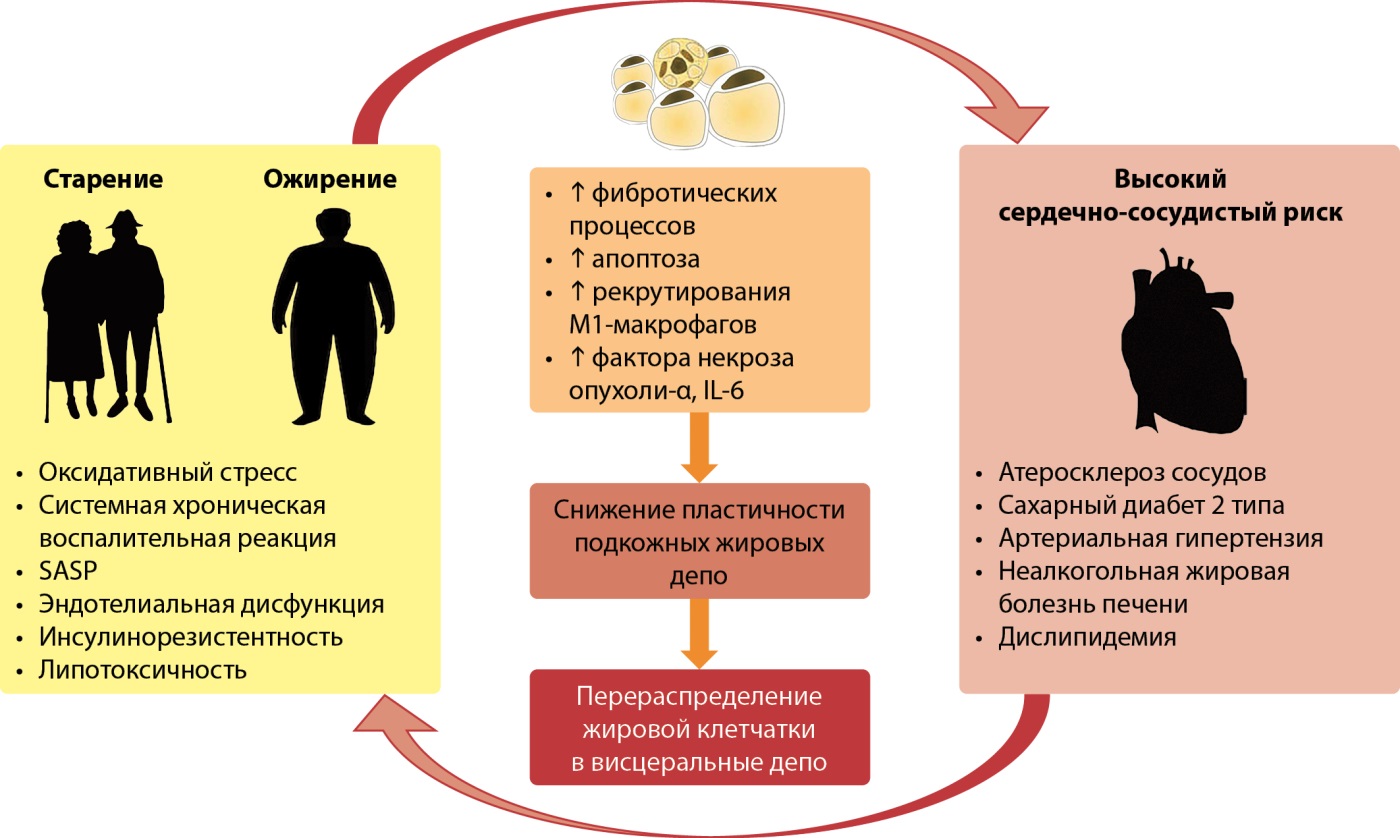
Рисунок 3. Влияние старения и ожирения на белую жировую ткань.
SASP — Senescence associated secretory phenotype (ассоциированный со старением секреторный фенотип); ФНОα — фактор некроза опухоли α, IL-6 — интерлейкин-6.
Figure 3. Effects of aging and obesity on white adipose tissue.
Установлено, что процесс старения и сопутствующее ему нарушение пластичности подкожной ЖТ тесно связаны с инсулинорезистентностью. В экспериментах на мышах лечение ожирения эффективно предотвращало развитие ряда возрастных метаболических нарушений, включая инсулинорезистентность.
Таким образом, усиление процессов апоптоза и снижение количества преадипоцитов наряду с усилением воспаления и фиброза влекут за собой потерю пластичности подкожных жировых депо. Ограничение их вместительной способности приводит к тому, что липиды неизбежно накапливаются в висцеральных жировых депо — пери- и эпикардиально, вокруг печени, поджелудочной железы, крупных сосудов. Как было указано ранее, висцеральные жировые депо имеют несколько иной клеточный состав — в частности, до 20% клеток в них представлены клетками иммунной системы, что приводит к усилению воспалительных процессов. По мнению ряда исследователей, ограничение вместимости адипоцитов ПЖК является основной причиной метаболических осложнений, связанных с возрастом и ожирением [28][31][32]. Накопление висцеральной жировой ткани также ассоциировано со значительным повышением ФНО-α, IL-6, С-реактивного белка, факторов хемотаксиса моноцитов [33].
Адипоциты висцеральных жировых депо, куда в описанных условиях начинает транспортироваться основная масса нутриентов, имеют больший диаметр, но сниженную чувствительность к инсулину по сравнению с адипоцитами подкожных жировых депо [31]. Вследствие снижения физиологического воздействия инсулина в висцеральной ЖТ увеличивается концентрация свободных жирных кислот (СЖК), которые поступают в печень по воротной вене. СЖК усиливают оксидативный стресс и поддерживают воспалительные процессы. Высокая концентрация СЖК опосредует токсическое влияние на печень, что описывается термином «липотоксичность» [34]. Метаболически-ассоциированная жировая болезнь печени, сопровождающаяся процессами воспаления, усугубляет процессы формирования инсулинорезистентности и существенно повышает риск СД2. Висцеральное ожирение ассоциировано с гипертриглицеридемией, увеличением доли липопротеинов низкой и очень низкой плотности, снижением доли липопротеинов высокой плотности [35]. Вследствие этих причин увеличение висцеральных жировых депо в настоящее время считается одним из ведущих факторов риска инсулинорезистентности, СД2, сердечно-сосудистых заболеваний и смерти [36][37][38]. Эти известные клинические данные подтверждаются результатами исследований на животных: накопление именно висцерального, а не подкожного жира у стареющих мышей приводило к повышению активности фибробластов в сердце, процессам ремоделирования с нарушениями сердечных функций [39]. У пожилых людей накопление висцерального жира отрицательно влияет на функцию дыхательной системы [40]. Количество висцеральной жировой ткани оказывает влияние на состояние центральной нервной системы и связано с процессами старения головного мозга. Так, по данным Debette, у пожилых людей объем висцерального жира отрицательно коррелирует с общим объемом головного мозга [41]. По результатам работы Chiba, у пожилых людей перераспределение жировой ткани в пользу висцеральных жировых депо ассоциировано с развитием когнитивных нарушений [42]. В исследовании Nyberg увеличение висцерального жира оказывало негативное влияние на мнестические функции, объем подкоркового серого вещества и гиппокампа [43]. В эксперименте Shin, выполненном на стареющих мышах, выраженность воспалительных процессов в висцеральном жире была связана со структурными изменениями головного мозга, а хирургическое удаление висцерального жира значительно улучшало восстановление после ишемического повреждения головного мозга [44].
Старение бурой жировой ткани
Старение бурой ЖТ включает в себя объемную атрофию, снижение функции митохондрий и пониженную активность UCP-1 — процессы, сочетание которых названо «побелением» бурой ЖТ (в противоположность «браунингу» белой ЖТ [45]. Бурая ЖТ исходно состоит как из бурых, так и из белых адипоцитов, причем с возрастом доля последних увеличивается. Помимо этого, оставшиеся бурые адипоциты вследствие снижения митохондриальной активности избыточно накапливают триглицериды, что фенотипически приближает их к «белым» адипоцитам [46]. Вероятно, описанные изменения, характеризующие «побеление» бурой жировой ткани, могут отражаться и на обменных процессах. Так, крупные исследования выявили связь между бурой жировой тканью и выраженностью метаболических и сердечно-сосудистых расстройств. В работе T. Becher (n=14 923) пациентам проводили позитронно-эмиссионную компьютерную томографию (ПЭТ-КТ) с 18F-фтордезоксиглюкозой (18F-ФДГ) в рамках диагностики онкологических заболеваний. У большей части пациентов визуализировалась и бурая жировая ткань (n=9853). У этих пациентов доля бурой ЖТ отрицательно коррелировала с возрастом (Rs=-0,9850; p<0,0001) и ИМТ пациентов (Rs=-0,9032; p<0,0001). У пациентов с бурой ЖТ по сравнению с лицами без бурой ЖТ (n=5070) значимо реже выявлялись СД2 (4,6% и 9,5%, р<0,0001) и дислипидемия (18,9% и 22,2%, р<0,0001). У описанных пациентов также реже встречались нарушения сердечного ритма по типу фибрилляции/трепетания предсердий (2,8% и 3,6%, р=0,0050), ишемическая болезнь сердца (3,1% и 4,9%, р<0,0001), цереброваскулярные заболевания (2,1% и 2,8%, р=0,0088), застойная сердечная недостаточность (1,0% и 2,0%, р<0,0001) и артериальная гипертензия (26,7% и 30,7%, р<0,0001) [47].
Исследования, проведенные на животных, указывают на нарушение дифференцировки клеток-предшественников бурой ЖК у стареющих мышей [48]. В работе Gonçalves, посвященной морфологическому исследованию бурой ЖТ, у стареющих мышей отмечалось снижение количества липидных капель из-за их слияния, увеличение размера бурых адипоцитов. Изменение бурой ЖТ касается не только морфологических изменений: бурые адипоциты при старении частично утрачивают способность к экспрессии UCP-1 в ответ на холодовую стимуляцию [49]. Подобные изменения выявляются и у пациентов с лишним весом: так, в исследовании van Marken Lichtenbelt активность бурой жировой ткани у тучных лиц была значительно ниже, чем у худых (рис. 4) [50].
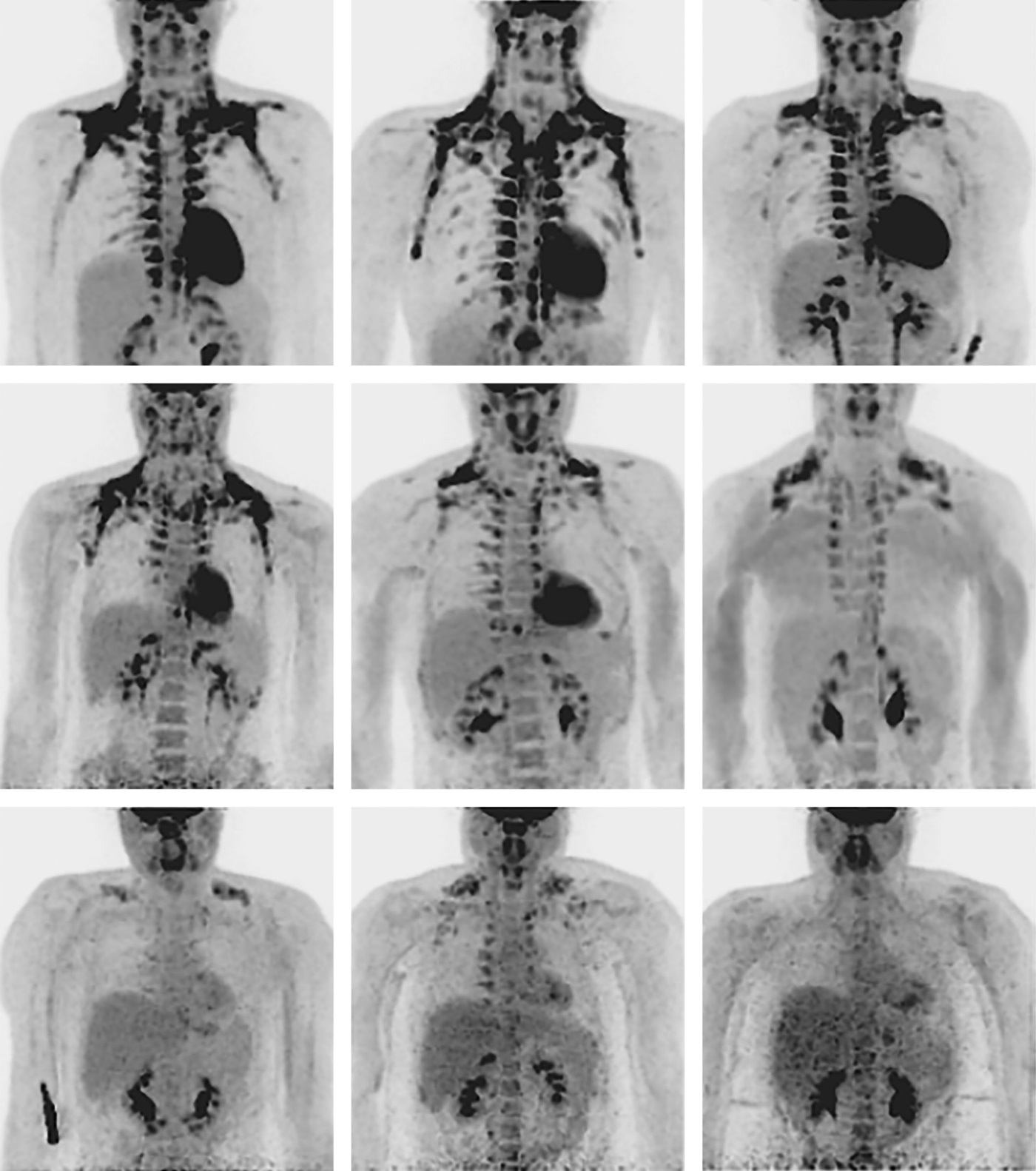
Рисунок 4. Выявление бурой жировой ткани по данным ПЭТ-КТ с 18F-ФДГ у пациентов с различной массой тела в исследовании van Marken Lichtenbelt WD (2009) [50].
Figure 4. Detection of brown adipose tissue according to 18F-FDG PET-CT in patients with different body weights in the van Marken Lichtenbelt WD study (2009) [47].
На серии изображений представлено вариабельное накопление препарата у лиц с разной массой тела. Верхний ряд — худощавые лица с высоким уровнем активности бурой жировой ткани (>500 кБк), в среднем ряду — средний уровень активности, в нижнем ряду — тучные субъекты с самым низким уровнем активности (<100 кБк).
Поскольку UCP-1 очень чувствителен к провоспалительным сигналам, высокая экспрессия воспалительных факторов также ухудшает термогенную активность бурых адипоцитов. Эксперименты Sakamoto указывают на значительно сниженный уровень UCP-1 в бурой ЖТ, инфильтрированной макрофагами М1-популяции и имеющей высокий уровень экспрессии ФНО-α [51]. Влияние окислительного стресса в бурой ЖК приводит к порочному кругу увеличения производства активных форм кислорода, еще больше усиливая окислительное повреждение, что ускоряет митохондриальное старение бурых адипоцитов. Существует теория, что уменьшение количества бурых адипоцитов и снижение экспрессии UCP-1 может быть связано и со снижением симпатической активности [52]. По меньшей мере это может быть отчасти верно для пожилых пациентов, длительно получающих препараты из группы адреноблокаторов.
Особенности воспалительной реакции на уровне бурой ЖТ заключаются в том, что она обладает способностью временно «сопротивляться» воспалению — в частности при ожирении, индуцированном высококалорийным питанием, в исследовании Fitzgibbons уровень микро-РНК иммунных клеток в бурой ЖК был значительно ниже, чем в белой ЖТ [53]. Тем не менее развивающаяся в ходе системной воспалительной реакции на фоне старения высокая концентрация ФНО-α приводит к инсулинорезистентности и в бурых адипоцитах. Таким образом, прогрессирующее воспаление, оксидативный стресс на фоне старения и ожирения приводят к изменению не только морфологии, но и функциональных характеристик бурой ЖТ.
Клинические аспекты старения жировой ткани
Описанные ранее процессы накопления ЖТ за счет гипертрофии адипоцитов приводят к активации воспалительных процессов и перераспределению ЖТ из подкожных в висцеральные жировые депо, в то время как рекрутирование клеток с их дальнейшей дифференцировкой в преадипоциты и адипоциты позволяет дольше сохранить нормальную архитектонику и микроокружение здоровой белой жировой ткани. Таким образом, различные механизмы депонирования липидов лежат в основе метаболически здорового и нездорового ожирения. Именно последнее ассоциировано с развитием ряда метаболических и сердечно-сосудистых расстройств (рис. 5).
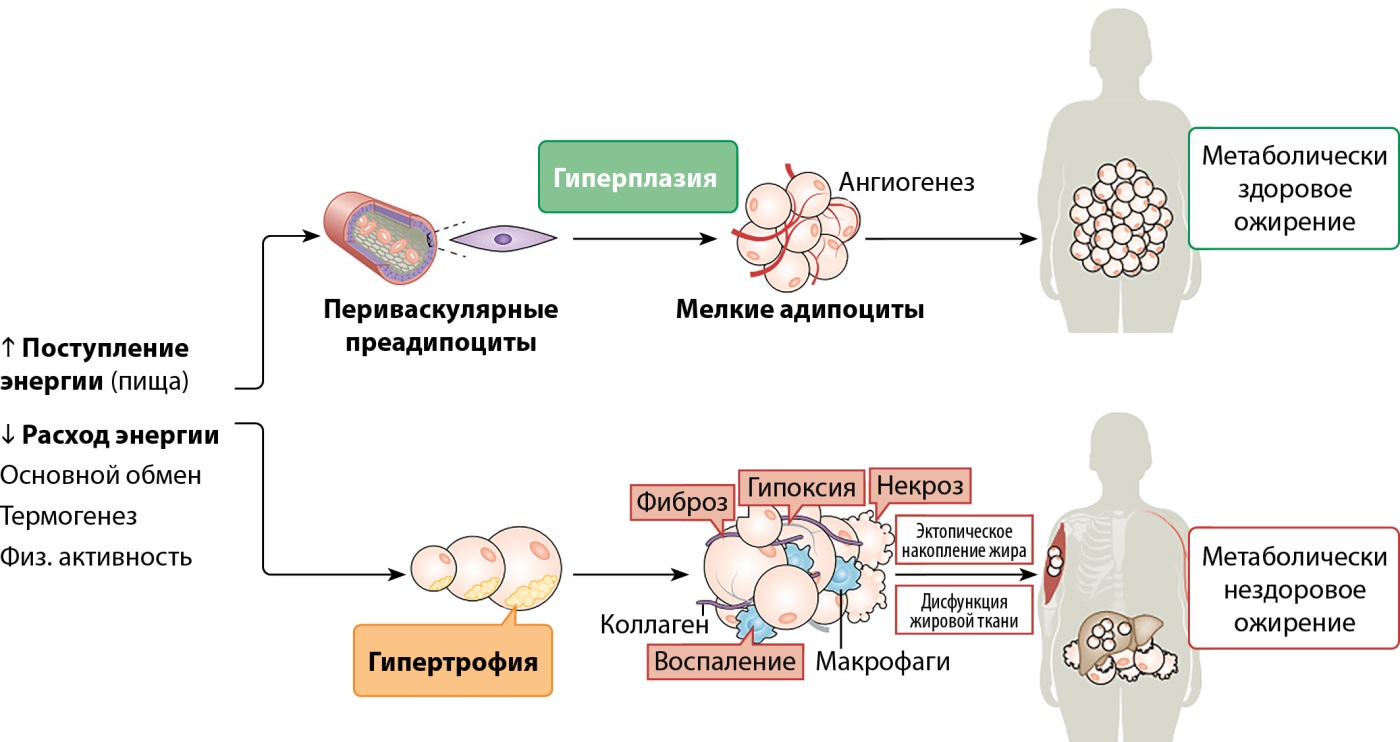
Рисунок 5. Механизмы формирования метаболически здорового и нездорового ожирения. Адаптировано из Ghaben (2019) [1].
Figure 5. Mechanisms of metabolically healthy and unhealthy obesity. Adapted from Ghaben (2019).
Необходимо помнить, что условное метаболическое здоровье, наблюдаемое у ряда пациентов с ожирением, не является бесконечным ресурсом. По мере истощения пула периваскулярных адипоцитов возможность накопления липидов путем гиперплазии неизбежно сменяется гипертрофией уже имеющихся адипоцитов с дальнейшим развитием дисфункции жировой ткани. Помимо этого, даже здоровый метаболический профиль и благоприятное сочетание генов, отвечающих за чувствительность к инсулину и функцию эндотелия, не защищают человека от течения времени. Процессы старения, оксидативный стресс, воспалительная реакция и преобладание процессов фиброза негативно воздействуют как на сердечно-сосудистую систему, так и на жировую ткань; чем больше представленность последней, тем большая нагрузка ложится на основные органы и системы организма. Таким образом, известная U-образная кривая выживаемости пожилых пациентов в зависимости от массы тела остается прежней: чем больше ИМТ, тем хуже выживаемость среди пожилых пациентов. Рекомендации относительно снижения массы тела у пациентов с СД2, артериальной гипертензией, дислипидемией остаются важной составляющей лечения.
Сравнительно новым взглядом являются попытки индуцировать «побурение» БЖТ за счет бежевых адипоцитов, а также повысить активность бурой жировой ткани. Известно, что бурые адипоциты повышают свою активность в ответ на холодовую стимуляцию и симпатическую активацию. Данные относительно ответа бежевых адипоцитов получены преимущественно на животных моделях; так, у мышей бежевые адипоциты активно накапливают митохондрии в ответ не только на указанные стимулы, но и при физической нагрузке. Убедительного подтверждения подобной реакции бежевых адипоцитов у людей в настоящее время не получено, что отчасти связано с отсутствием единого протокола исследования активности бурой и бежевой жировой ткани. На сегодняшний день обсуждается не только ПЭТ с 18F-ФДГ, но и с 11С-ацетатом и рядом жирных кислот (поскольку изучаемые адипоциты активно вовлечены в их метаболизм), а также методы, основанные на изучении митохондриального дыхания и норэпинефринтранспортирующего белка. Активно изучаются методы МР-спектрометрии и визуализации, предлагается детальное изучение кровотока основных депо бурой жировой ткани, а также использование для исследований таргетных веществ, специфических для бурой ЖТ. Указанные методы в настоящее время широкого применения не получили в связи с их малой доступностью и опытом применения преимущественно в эксперименте [54]. Некоторый интерес имеют фармакологические агенты, потенциально способные повлиять на «побурение» бежевых адипоцитов и замедлить «побеление» бурой жировой ткани. Исследования на эту тему продолжаются. Известно, что в первый год жизни алкилглицерины грудного молока препятствуют переходу бежевых адипоцитов ребенка в белые, однако у взрослых людей этот механизм инактивирован [55].
Заключение
Как старение, так и ожирение оказывает негативное влияние на архитектонику и функции белой и бурой жировой ткани. Важным методом борьбы с метаболическими расстройствами, сопровождающими старение, является поддержание адекватной массы тела и чувствительности к инсулину за счет рационального питания, дозированной физической нагрузки и, при необходимости, медикаментозных и хирургических методов лечения.
Дополнительная информация
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Семикова Г.В. — написание статьи, Халимов Ю.Ш. — концепция статьи, редактура, внесение правок; Волкова А.Р. — редактура, внесение правок. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Ghaben AL, Scherer PE. Adipogenesis and metabolic health. Nat Rev Mol Cell Biol. 2019. doi: https://doi.org/10.1038/s41580-018-0093-z
2. Ambele MA, Dhanraj P, Giles R, Pepper MS. Adipogenesis: A Complex Interplay of Multiple Molecular Determinants and Pathways. Int J Mol Sci. 2020;21(12):4283. doi: https://doi.org/10.3390/ijms21124283
3. Liu Z, Wu KKL, Jiang X, Xu A, Cheng KKY. The role of adipose tissue senescence in obesity- and ageing-related metabolic disorders. Clin Sci. 2020;134(2):315-330. doi: https://doi.org/10.1042/CS20190966
4. Tchkonia T, Morbeck DE, Von Zglinicki T, et al. Fat tissue, aging, and cellular senescence. Aging Cell. 2010. doi: https://doi.org/10.1111/j.1474-9726.2010.00608.x
5. Ibrahim MM. Subcutaneous and visceral adipose tissue: structural and functional differences. Obes Rev. 2010;11(1):11-18. doi: https://doi.org/10.1111/j.1467-789X.2009.00623.x
6. Kahn CR, Wang G, Lee KY. Altered adipose tissue and adipocyte function in the pathogenesis of metabolic syndrome. J Clin Invest. 2019;129(10):3990-4000. doi: https://doi.org/10.1172/JCI129187
7. Романцова Т.И. Жировая ткань: цвета, депо и функции // Ожирение и метаболизм. — 2021. — Т. 18. — №3. — C. 282-301. [Romantsova TI. Adipose tissue: colors, depots and functions. Obesity and metabolism. 2021;18(3):282-301. (In Russ.)] doi: https://doi.org/10.14341/omet12748
8. Chait A, den Hartigh LJ. Adipose Tissue Distribution, Inflammation and Its Metabolic Consequences, Including Diabetes and Cardiovascular Disease. Front Cardiovasc Med. 2020;7. doi: https://doi.org/10.3389/fcvm.2020.00022
9. Афанаскина Л.Н., Деревцова С.Н., Синдеева Л.В. и др. Бурая жировая ткань: особенности биологии, участие в энергетическом обмене и ожирении (обзор литературы) // Вестник РАМН. — 2020. — Т. 75. — № 4. — С. 326–330. [Afanaskina L.N., Derevtsova S.N., Sindeeva L.V. et al. Brown adipose tissue: features of biology, participation in energy metabolism and obesity. Annals of the Russian Academy of Medical Sciences. 2020;75(4):326–330. (In Russ.)] doi: http://doi.org/10.15690/vramn1316
10. Мяделец О.Д., Мяделец В.О., Соболевская И.С., и др. Белая и бурая жировые ткани: взаимодействие cо скелетной мышечной тканью // Вестник ВГМУ. — 2014. — Т. 13. — № 5. — С. 35–44 [Myadelets O.D., Myadelets V.O., Sobolevskaya I.S., et al. White and brown adipose tissue: interaction with skeletal muscle tissue // Annals of VGMU . 2014;13(5):35-44 (In Russ.)]]
11. Shankar K, Kumar D, Gupta S, et al. Role of brown adipose tissue in modulating adipose tissue inflammation and insulin resistance in high-fat diet fed mice. Eur J Pharmacol. 2019;854:354-364. doi: https://doi.org/10.1016/j.ejphar.2019.02.044
12. Peirce V, Vidal-Puig A. Regulation of glucose homoeostasis by brown adipose tissue. Lancet Diabetes Endocrinol. 2013;1(4):353-360. doi: https://doi.org/10.1016/S2213-8587(13)70055-X
13. Bredella MA, Gill CM, Rosen CJ, Klibanski A, Torriani M. Positive effects of brown adipose tissue on femoral bone structure. Bone. 2014;58:55-58. doi: https://doi.org/10.1016/j.bone.2013.10.007
14. Maliszewska K, Kretowski A. Brown adipose tissue and its role in insulin and glucose homeostasis. Int J Mol Sci. 2021. doi: https://doi.org/10.3390/ijms22041530
15. López-Otín C, Blasco MA, Partridge L, Serrano M, Kroemer G. The Hallmarks of Aging. Cell. 2013;153(6):1194-1217. doi: https://doi.org/10.1016/j.cell.2013.05.039
16. Piya MK, McTernan PG, Kumar S. Adipokine inflammation and insulin resistance: the role of glucose, lipids and endotoxin. J Endocrinol. 2013;216(1):T1-T15. doi: https://doi.org/10.1530/JOE-12-0498
17. Schaum N, Lehallier B, Hahn O, et al. Ageing hallmarks exhibit organ-specific temporal signatures. Nature. 2020;583(7817):596-602. doi: https://doi.org/10.1038/s41586-020-2499-y
18. Smith U, Li Q, Rydén M, Spalding KL. Cellular senescence and its role in white adipose tissue. Int J Obes. 2021;45(5):934-943. doi: https://doi.org/10.1038/s41366-021-00757-x
19. Murano I, Barbatelli G, Parisani V, et al. Dead adipocytes, detected as crown-like structures, are prevalent in visceral fat depots of genetically obese mice. J Lipid Res. 2008;49(7):1562-1568. doi: https://doi.org/10.1194/jlr.M800019-JLR200
20. Frasca D, Diaz A, Romero M, Landin AM, Blomberg BB. High TNF-α levels in resting B cells negatively correlate with their response. Exp Gerontol. 2014;54:116-122. doi: https://doi.org/10.1016/j.exger.2014.01.004
21. Higuchi M, Dusting GJ, Peshavariya H, et al. Differentiation of human adipose-derived stem cells into fat involves reactive oxygen species and forkhead box o1 mediated upregulation of antioxidant enzymes. Stem Cells Dev. 2013. doi: https://doi.org/10.1089/scd.2012.0306
22. Dludla P V., Nkambule BB, Jack B, et al. Inflammation and oxidative stress in an obese state and the protective effects of gallic acid. Nutrients. 2019. doi: https://doi.org/10.3390/nu11010023
23. Raguso CA, Kyle U, Kossovsky MP, et al. A 3-year longitudinal study on body composition changes in the elderly: Role of physical exercise. Clin Nutr. 2006;25(4):573-580. doi: https://doi.org/10.1016/j.clnu.2005.10.013
24. Zamboni M, Rossi AP, Fantin F, et al. Adipose tissue, diet and aging. Mech Ageing Dev. 2014;136-137:129-137. doi: https://doi.org/10.1016/j.mad.2013.11.008
25. Corrales P, Martín-Taboada M, Medina-Gomez G. The risk of jiggly fat in aging. Aging (Albany NY). 2019;11(15):5298-5299. doi: https://doi.org/10.18632/aging.102147
26. Ambikairajah A, Walsh E, Tabatabaei-Jafari H, Cherbuin N. Fat mass changes during menopause: a metaanalysis. Am J Obstet Gynecol. 2019. doi: https://doi.org/10.1016/j.ajog.2019.04.023
27. Park SE, Park CY, Choi JM, et al. Depot-specific changes in fat metabolism with aging in a type 2 diabetic animal model. PLoS One. 2016. doi: https://doi.org/10.1371/journal.pone.0148141
28. Kim SM, Lun M, Wang M, et al. Loss of White Adipose Hyperplastic Potential Is Associated with Enhanced Susceptibility to Insulin Resistance. Cell Metab. 2014;20(6):1049-1058. doi: https://doi.org/10.1016/j.cmet.2014.10.010
29. Bielczyk-Maczynska E. White adipocyte plasticity in physiology and disease. Cells. 2019. doi: https://doi.org/10.3390/cells8121507
30. Rosen ED, Spiegelman BM. What We Talk About When We Talk About Fat. Cell. 2014;156(1-2):20-44. doi: https://doi.org/10.1016/j.cell.2013.12.012
31. Hammarstedt A, Gogg S, Hedjazifar S, Nerstedt A, Smith U. Impaired Adipogenesis and Dysfunctional Adipose Tissue in Human Hypertrophic Obesity. Physiol Rev. 2018;98(4):1911-1941. doi: https://doi.org/10.1152/physrev.00034.2017
32. Corrales P, Vivas Y, Izquierdo‐Lahuerta A, et al. Long‐term caloric restriction ameliorates deleterious effects of aging on white and brown adipose tissue plasticity. Aging Cell. 2019;18(3). doi: https://doi.org/10.1111/acel.12948
33. Schoettl T, Fischer IP, Ussar S. Heterogeneity of adipose tissue in development and metabolic function. Suarez RK, Hoppeler HH, eds. J Exp Biol. 2018;221(Suppl_1). doi: https://doi.org/10.1242/jeb.162958
34. Tchkonia T, Thomou T, Zhu Y, et al. Mechanisms and Metabolic Implications of Regional Differences among Fat Depots. Cell Metab. 2013;17(5):644-656. doi: https://doi.org/10.1016/j.cmet.2013.03.008
35. Tchernof A, Després J-P. Pathophysiology of Human Visceral Obesity: An Update. Physiol Rev. 2013;93(1):359-404. doi: https://doi.org/10.1152/physrev.00033.2011
36. Frasca D, Blomberg BB. Adipose tissue, immune aging, and cellular senescence. Semin Immunopathol. 2020;42(5):573-587. doi: https://doi.org/10.1007/s00281-020-00812-1
37. Finelli C, Sommella L, Gioia S, La Sala N, Tarantino G. Should visceral fat be reduced to increase longevity? Ageing Res Rev. 2013;12(4):996-1004. doi: https://doi.org/10.1016/j.arr.2013.05.007
38. Koster A, Murphy RA, Eiriksdottir G, et al. Fat distribution and mortality: The AGES‐Reykjavik study. Obesity. 2015;23(4):893-897. doi: https://doi.org/10.1002/oby.21028
39. Sawaki D, Czibik G, Pini M, et al. Visceral Adipose Tissue Drives Cardiac Aging Through Modulation of Fibroblast Senescence by Osteopontin Production. Circulation. 2018;138(8):809-822. doi: https://doi.org/10.1161/CIRCULATIONAHA.117.031358
40. Rossi AP, Watson NL, Newman AB, et al. Effects of Body Composition and Adipose Tissue Distribution on Respiratory Function in Elderly Men and Women: The Health, Aging, and Body Composition Study. Journals Gerontol Ser A Biol Sci Med Sci. 2011;66A(7):801-808. doi: https://doi.org/10.1093/gerona/glr059
41. Debette S, Beiser A, Hoffmann U, et al. Visceral fat is associated with lower brain volume in healthy middle‐aged adults. Ann Neurol. 2010;68(2):136-144. doi: https://doi.org/10.1002/ana.22062
42. Chiba I, Lee S, Bae S, Makino K, Shinkai Y, Shimada H. Visceral Fat Accumulation is Associated with Mild Cognitive Impairment in Community-Dwelling Older Japanese Women. J Nutr Heal aging. 2020;24(3):352-357. doi: https://doi.org/10.1007/s12603-020-1330-7
43. Nyberg CK, Fjell AM, Walhovd KB. Level of body fat relates to memory decline and interacts with age in its association with hippocampal and subcortical atrophy. Neurobiol Aging. 2020;91:112-124. doi: https://doi.org/10.1016/j.neurobiolaging.2019.10.005
44. Shin JA, Jeong SI, Kim M, Yoon JC, Kim H-S, Park E-M. Visceral adipose tissue inflammation is associated with age-related brain changes and ischemic brain damage in aged mice. Brain Behav Immun. 2015;50:221-231. doi: https://doi.org/10.1016/j.bbi.2015.07.008
45. Graja A, Gohlke S, Schulz TJ. Aging of Brown and Beige/Brite Adipose Tissue. In: Handbook of Experimental Pharmacology. ; 2018:55-72. doi: https://doi.org/10.1007/164_2018_151
46. Gao P, Jiang Y, Wu H, et al. Inhibition of mitochondrial calcium overload by SIRT3 prevents obesity-or age related whitening of brown adipose tissue. Diabetes. 2020. doi: https://doi.org/10.2337/db19-0526
47. Becher T, Palanisamy S, Kramer DJ, et al. Brown adipose tissue is associated with cardiometabolic health. Nat Med. 2021;27(1):58-65. doi: https://doi.org/10.1038/s41591-020-1126-7
48. Sellayah D, Sikder D. Orexin restores aging-related brown adipose tissue dysfunction in male mice. Endocrinology. 2014. doi: https://doi.org/10.1210/en.2013-1629
49. Gonçalves LF, Machado TQ, Castro-Pinheiro C, de Souza NG, Oliveira KJ, Fernandes-Santos C. Ageing is associated with brown adipose tissue remodelling and loss of white fat browning in female C57BL/6 mice. Int J Exp Pathol. 2017. doi: https://doi.org/10.1111/iep.12228
50. van Marken Lichtenbelt WD, Vanhommerig JW, Smulders NM, et al. Cold-Activated Brown Adipose Tissue in Healthy Men. N Engl J Med. 2009;360(15):1500-1508. doi: https://doi.org/10.1056/NEJMoa0808718
51. Sakamoto T, Nitta T, Maruno K, et al. Macrophage infiltration into obese adipose tissues suppresses the induction of UCP1 level in mice. Am J Physiol - Endocrinol Metab. 2016. doi: https://doi.org/10.1152/ajpendo.00028.2015
52. Graja A, Schulz TJ. Mechanisms of Aging-Related Impairment of Brown Adipocyte Development and Function. Gerontology. 2015;61(3):211-217. doi: https://doi.org/10.1159/000366557
53. Fitzgibbons TP, Kogan S, Aouadi M, Hendricks GM, Straubhaar J, Czech MP. Similarity of mouse perivascular and brown adipose tissues and their resistance to diet induced inflammation. Am J Physiol - Hear Circ Physiol. 2011. doi: https://doi.org/10.1152/ajpheart.00376.2011
54. Волкова Н.И., Поркшеян М.И., Гюльмагомедова А.Н. Бурая жировая ткань у взрослых: согласительное мнение и рекомендации для проведения будущих эскпериментов // Медицинский вестник Юга России. — 2016. — №3. — С.4-13 [Volkova NI, Porksheyan MI, Gyulmagomedova AN. Brown adipose tissue in adults: consensus points and guidelines for future experiments. Medical Herald of the South of Russia. 2016;(3):4-13. (In Russ.)] doi: https://doi.org/10.21886/2219-8075-2016-3-4-13
55. Yu H, Dilbaz S, Coßmann J, et al. Breast milk alkylglycerols sustain beige adipocytes through adipose tissue macrophages. J Clin Invest. 2019. doi: https://doi.org/10.1172/JCI125646
Об авторах
Г. В. СемиковаРоссия
Семикова Галина Владимировна, к.м.н.
197022, г. Санкт-Петербург, ул. Льва Толстого, д. 6-8
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Ю. Ш. Халимов
Россия
Халимов Юрий Шавкатович, д.м.н., профессор
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. Р. Волкова
Россия
Волкова Анна Ральфовна, д.м.н., профессор
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Распределение и функции основных жировых депо в организме человека. СЖК — свободные жирные кислоты. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(854KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Адипогенез у взрослых (адаптировано из Ghaben, 2019) [1]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(812KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Влияние старения и ожирения на белую жировую ткань. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(818KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Выявление бурой жировой ткани по данным ПЭТ-КТ с 18F-ФДГ у пациентов с различной массой тела в исследовании van Marken Lichtenbelt WD (2009) [50]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(439KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Механизмы формирования метаболически здорового и нездорового ожирения. Адаптировано из Ghaben (2019) [1]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(315KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Семикова Г.В., Халимов Ю.Ш., Волкова А.Р. Патофизиологические и клинические аспекты старения жировой ткани. Ожирение и метаболизм. 2025;22(1):41-51. https://doi.org/10.14341/omet13069
For citation:
Semikova G.V., Khalimov Yu.Sh., Volkova A.R. Adipose tissue aging: pathophysiological and clinical aspects. Obesity and metabolism. 2025;22(1):41-51. (In Russ.) https://doi.org/10.14341/omet13069

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































