Перейти к:
Индекс массы тела как возможный предиктор развития эндокринных иммуноопосредованных нежелательных явлений на фоне терапии ингибиторами контрольных точек иммунного ответа
https://doi.org/10.14341/omet13044
Аннотация
Обоснование. Избыточная масса тела и ожирение оказывают существенное влияние на течение и результаты лечения многих болезней, в том числе онкологических заболеваний. Одним из современных видов противоопухолевой терапии являются ингибиторы контрольных точек иммунного ответа (ИКТИО). С учетом высокой эффективности ИКТИО при различных типах опухолей представляется интересным изучение исходных антропометрических данных пациентов и оценка возможного влияния нутритивного статуса на развитие эндокринных иммуноопосредованных нежелательных явлений (ИОНЯ).
Цель. Сравнить группы пациентов с различным стартовым индексом массы тела (ИМТ) перед первым введением препарата ИКТИО и проанализировать риск развития эндокринных ИОНЯ в дальнейшем.
Материалы и методы. В одноцентровое исследование были включены 172 пациента, которым была рекомендована противоопухолевая терапия ИКТИО в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России и ГБУЗ «МГОБ №62 ДЗМ» в 2020–2022 гг. Измерение роста и массы тела с дальнейшим расчетом ИМТ проводилось перед первым введением препарата из группы ИКТИО.
В зависимости от возникновения в дальнейшем ИОНЯ, проводилось разделение пациентов на группы: с развившимися ИОНЯ (любыми, кожными, тиреоидными) и с отсутствием ИОНЯ (любых, кожных, тиреоидных).
Результаты. По результатам нашего исследования у 38 пациентов (37,3%) из 102, о которых были получены данные о наличии/отсутствии любых ИОНЯ, регистрировались: тиреопатии (n=13, 12,7%), поражения кожи (n=13, 12,7%), гастроинтестинальная токсичность (n=7, 6,9%), гепатотоксичность (n=4, 3,9%), гипофизиты (n=2, 2%), нефриты (n=2, 2%), сахарный диабет (СД) (n=1, 1%), гематологическая токсичность (n=1, 1%), пневмонит (n=1, 1%), синдром Гиена-Барре (n=1, 1%). При этом у большинства пациентов встречалось только одно ИОНЯ (n=31, 81,6%), два ИОНЯ выявлялось значимо реже (n=7, 18,4%).
При проведении сравнительного анализа групп пациентов с развившимися ИОНЯ, в том числе дерматологическими, или их отсутствием была получена статистическая тенденция в различии по ИМТ. С помощью ROC-анализа была определена отрезная точка ИМТ, равная 28,16 кг/м2 для всех ИОНЯ и 25,39 кг/м2 для кожных ИОНЯ, ниже которой, вопреки имеющимся данным, повышался риск развития ИОНЯ, однако диагностическая чувствительность (ДЧ) и диагностическая специфичность (ДС) оказались невысокими.
Заключение. Таким образом, нами была выявлена статистическая тенденция в риске развития ИОНЯ (прежде всего дерматологических) при более низком ИМТ до начала проведения противоопухолевой иммунотерапии ИКТИО. Для поиска более надежной взаимосвязи требуются дополнительные исследования.
Ключевые слова
Для цитирования:
Глибка А.А., Мазурина Н.В., Трошина Е.А., Саранцева К.А., Харкевич Г.Ю., Волконский М.В., Елфимова А.Р. Индекс массы тела как возможный предиктор развития эндокринных иммуноопосредованных нежелательных явлений на фоне терапии ингибиторами контрольных точек иммунного ответа. Ожирение и метаболизм. 2024;21(1):42-57. https://doi.org/10.14341/omet13044
For citation:
Glibka A.A., Mazurina N.V., Troshina E.A., Sarantseva K.A., Kharkevich G.Yu., Volkonskii M.V., Elfimova A.R. Body mass index as a possible predictor of the development of endocrine immune-mediated adverse events during immune checkpoint inhibitors therapy. Obesity and metabolism. 2024;21(1):42-57. (In Russ.) https://doi.org/10.14341/omet13044
ОБОСНОВАНИЕ
Невзирая на усилия, направляемые мировым медицинским сообществом на профилактику неинфекционных заболеваний и борьбу с ними, ожирение продолжает оставаться одним из ведущих заболеваний-пандемий XXI века. Именно ожирение является основным модифицируемым фактором риска развития сердечно-сосудистых заболеваний (главным образом, инфаркта миокарда и инсульта), сахарного диабета, патологий опорно-двигательной системы, психологических проблем и некоторых онкологических заболеваний, таких как рак эндометрия, рак пищевода, рак толстой кишки [1][2].
Ведущими модифицируемыми факторами риска онкологических заболеваний являются: курение, употребление алкоголя, ожирение и ультрафиолетовое излучение [3]. Анализируя известные патофизиологические механизмы, связывающие ожирение и злокачественные опухоли, следует выделить такие, как хроническое воспаление и гипоксия жировой ткани, повышение уровней инсулина и инсулиноподобного фактор роста-1 (ИФР-1), высокая концентрация свободных жирных кислот и циркулирующих эстрогенов, изменение качественного и количественного состава микробиоты. Вышеперечисленные факторы, в свою очередь, через каскад реакций могут послужить причиной снижения апоптоза, увеличения пролиферации клеток, что в итоге предрасполагает к механизмам активации онкогенеза [4].
Кроме того, ожирение может приводить к снижению эффективности лечения рака за счет сложности подбора дозы химиотерапевтических препаратов и позиционирования таких пациентов для проведения лучевой терапии. Пациенты с морбидным ожирением и недостаточной массой тела имеют более высокие показатели смертности после радикального хирургического лечения злокачественных новообразований по сравнению с пациентами, имеющими нормальную или избыточную массу тела [2].
При этом появляется все больше данных о том, что избыточная масса тела или ожирение могут быть прогностически благоприятными факторами, связанными с лучшим ответом на терапию ИКТИО и увеличением общей и безрецидивной выживаемости [5, 6] независимо от типа опухоли [7]. Это примечательное явление известно как «парадокс ожирения» [8]. Данный феномен также описан при других заболеваниях: сердечной недостаточности, остром коронарном синдроме, сахарном диабете 2 типа, терминальной стадии хронической болезни почек, инсульте, хронической обструктивной болезни легких, внебольничной пневмонии и у лиц пожилого возраста [9]. В здоровой же популяции кривая смертности, связанная с индексом массы тела (ИМТ), имеет U-образную форму с наименьшей смертностью при ИМТ в диапазоне 22,5–25,0 кг/м2. Возможно, «парадокс ожирения» связан с наличием метаболического резерва, что благоприятно при кахектических состояниях на фоне непреднамеренной потери массы тела.
Становление иммунотерапии как парадигмы лечения в онкологии открыло новые возможности для дальнейших исследований. Невзирая на достаточно высокую эффективность и безопасность ИКТИО, продолжается поиск наиболее доступных биомаркеров, которые можно было бы использовать в качестве предикторов результата лечения, например, экспрессию PD-L1, микросателлитный статус и мутационную нагрузку опухоли. Однако на практике легче использовать с целью прогнозирования клинические и антропометрические характеристики, и одним из подобных показателей может быть ИМТ.
На сегодняшний день ИМТ, безусловно, является основным суррогатным показателем нутритивного статуса за счет удобства использования в клинической практике. Известно, что ожирение сопровождается хроническим воспалением и повышает риск развития метаболических нарушений [10]. Уровни адипокинов, таких как адипонектин и лептин, провоспалительных цитокинов, таких как С-реактивный белок (СРБ), интрелейкин (ИЛ)-6, ИЛ-10, фактор некроза опухоли-альфа (TNF-α), высвобождаемые адипоцитами, играют важную роль в патогенезе ожирения и связанных с ним коморбидных заболеваний [11].
Иммуноопосредованные нежелательные явления (ИОНЯ) — уникальный класс противоопухолевой токсичности, обычно не наблюдаемый при использовании химиотерапевтических или таргетных препаратов, имеющий иммунологическую основу и требующий более частого мониторинга. Патогенез развития эндокринных ИОНЯ до сих пор остается неясным. Лишь предшествующие аутоиммунные эндокринопатии остаются значимым предиктором возникновения эндокринной токсичности во время лечения ИКТИО, независимо от выбранного лекарственного препарата, типа опухоли и возраста пациента [12][13].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Сравнить группы пациентов с различным стартовым индексом массы тела (ИМТ) перед первым введением препарата ИКТИО и проанализировать риск развития эндокринных ИОНЯ в дальнейшем.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
Работа выполнена как сравнительное исследование с одномоментным и ретроспективным компонентами. Набор пациентов осуществлялся в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России и ГБУЗ «МГОБ №62 ДЗМ» с января 2020-го по февраль 2022 гг.
Критерии включения: пациенты обоих полов и старше 18 лет; верифицированный диагноз онкологического заболевания, выставленный врачом-онкологом (в соответствии с МКБ-10); назначенное лечение ИКТИО профильным врачом-специалистом (в соответствии с действующими клиническими рекомендациями); согласие пациента на проведение терапии ИКТИО; наличие добровольного информированного согласия пациента на участие в исследовании.
Критерии исключения: нахождение в процессе лечения ИКТИО; терапия ИКТИО в рамках предшествующей линии противоопухолевого лечения; сочетанная терапия ИКТИО с различными механизмами действия (ипилимумаб+ниволумаб); прерывание рекомендуемого режима иммунотерапии без медицинских показаний.
Способ формирования выборки: произвольный.
Обследование и лечение пациентов (выбор препарата ИКТИО, его дозы и схема введения) осуществлялись согласно проводимому онкологическому консилиуму в соответствующем специализированном учреждении.
Пациенты были разделены на группы в соответствии со следующими критериями:
1.получавшие только терапию ИКТИО / получавшие совместно с ИКТИО химиотерапию и/или таргетную терапию,
2.с развившимися любыми ИОНЯ на фоне или после терапии ИКТИО / их отсутствием,
3.с тиреоидными ИОНЯ / их отсутствием,
4.с кожными ИОНЯ / их отсутствием,
5.нормальная масса тела / избыточная масса тела / ожирение.
Методы
У включенных в исследование пациентов были определены антропометрические данные:
- измерение роста;
- измерение веса;
- последующий подсчет ИМТ.
С учетом научного интереса на фоне терапии ИКТИО прицельно отслеживались и фиксировалось эндокринные ИОНЯ. Однако дополнительно отмечались и любые другие ИОНЯ: кожные, кишечные, гематологические, неврологические и др. Описываемые ИОНЯ развивались в период от 0 до 34 мес. от момента инициации противоопухолевой иммунотерапии.
Антропометрические данные оценивались в приемных отделениях ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России и ГБУЗ «МГОБ №62 ДЗМ».
ИМТ был рассчитан с использованием формулы отношения массы тела (выраженной в килограммах) к квадрату роста (выраженного в метрах) (ИМТ = масса тела / рост2). Нормальная масса тела (ИМТ = 18,5–24,9 кг/м2), избыточная масса тела (ИМТ = 25,0–29,9 кг/м2) и ожирение (ИМТ≥30,0 кг/м2) определялись на основе рекомендаций Всемирной организации здравоохранения.
Сбор и анализ данных катамнеза включенным в исследование пациентов осуществлялся путем анализа медицинской документации за весь период наблюдения в специализированном онкологическом учреждении, дистанционного общения и личного контакта. Развившиеся ИОНЯ (поражения кожи, желудочно-кишечного тракта, органов эндокринной системы и пр.) фиксировались лечащими онкологами в историях болезней; амбулаторных картах, если иммунотерапия продолжалась в другом лечебном учреждении; а также в рамках дистанционного общения для отслеживания отсроченных нежелательных явлений и статуса пациента. Сбор информации о пациентах по телефону осуществлялся с 15 мая по 02 июня 2023 г., не удалось связаться лишь с 27 пациентами и/или их родственниками (18,5%). Статус пациентов: живы — 78 (53,4%), скончались — 65 (44,5%), о трех пациентах информации не получено.
Этическая экспертиза
Локальный этический комитет при ГНЦ ФГБУ «НМИЦ эндокринологии» Минздрава России постановил одобрить возможность проведения данной научно-исследовательской работы, выписка из протокола №15 от 25.09.2019 г.
Всеми пациентами подписаны информированные согласия на участие в исследовании.
Статистический анализ
Статистический анализ осуществлялся с использованием прикладной программы Statistica 13 (Tibco, США) и языка программирования Python 3.9. Описательная статистика количественных данных представлена медианами, первым и третьим квартилями в формате Me [Q1; Q3], качественных — абсолютными и относительными частотами в формате n (%). Сравнение двух независимых групп по количественным признакам выполнялось с помощью критерия Манна-Уитни (U-тест), трех и более независимых групп — с помощью критерия Краскелла-Уоллиса. Сравнительный анализ качественных признаков выполнялся с помощью точного двустороннего критерия Фишера.
ROC-анализ был выполнен для оценки диагностической способности отдельных параметров. Отрезные точки были выбраны согласно критерию Юдена. Для каждой отрезной точки были рассчитаны: диагностическая чувствительность (ДЧ), диагностическая специфичность (ДС), прогностическая ценность положительного результата (ПЦПР), прогностическая ценность отрицательного результата (ПЦОР) и отношение шансов (ОШ).
Критический уровень статистической значимости при проверке статистических гипотез принят равным 0,05. При множественных сравнениях применялась поправка Бонферрони путем коррекции критического уровня значимости (Р0). Значения уровня значимости между 0,05 и Р0 интерпретировались как статистическая тенденция.
РЕЗУЛЬТАТЫ
Характеристика пациентов
Первый этап анализа
Из 172 пациентов, отобранных онкологами для осуществления текущего исследования, 170 пациентов соответствовали критериям включения, 2 пациента отказались от проведения терапии ИКТИО.
На момент формирования выборки в исследование не были включены 14 пациентов, уже находившихся в процессе ИКТИО; 5 пациентов, которым ранее проводилась терапия ИКТИО; 3 пациента, которые ранее были включены в исследование плацебо/ИКТИО; 1 пациентка, у которой и в анамнезе, и при включении в исследование осуществлялась терапия ИКТИО; 1 пациент, которому планировалось осуществление сочетанной терапии ИКТИО (ипилимумаб+ниволумаб).
Второй этап анализа
После исключения всех перечисленных выше пациентов в анализ были включены 146 испытуемых из 172 изначально отобранных.
Пациенты были госпитализированы накануне проведения первого введения препарата из группы ИКТИО. Медиана возраста пациентов на момент включения в исследование составила 60 лет [24; 87]; соотношение мужчин/женщин — 80 (54,8%)/66 (45,2%).
Распределение пациентов по ИМТ представлено в таблице 1.
Нозологическая структура онкологических заболеваний (в соответствии с МКБ-10) в выборке пациентов (n=146) представлена в таблице 2.
Таким образом, исследуемая выборка была представлена преимущественно пациентами со злокачественной меланомой кожи (51,4%) и злокачественным новообразованием бронхов и легкого (37,7%).
Стадии основного онкологического заболевания в исследуемой выборке отражены в таблице 3.
У пациентов со злокачественными новообразованиями самостоятельных (первичных) множественных локализаций (n=10) стадии выставлялись для каждой отдельной опухоли. Поэтому с учетом различного числа опухолевых заболеваний и их стадий у данных пациентов было принято решение исключать их из сравнительного анализа по линиям противоопухолевой терапии.
Таким образом, стадийность выборки представлена превалированием пациентов с наиболее распространившимся онкологическим процессом: III — 47,9% и IV — 40,4%.
Стадии заболевания и особенности предшествующего противоопухолевого лечения пациентов на момент включения в исследования (0 точка) и представлены в таблице 4.
Таким образом, в исследуемой группе лишь 8,2% пациентов ранее не получали никакого лечения, а у 43,2% было проведено только хирургическое лечение.
После определения последовательности проведения предшествующей противоопухолевой терапии была определена «линия» лечения, которой стала терапия ИКТИО (таблица 5).
Необходимо отметить, что с целью упрощения кодирования для последующего статистического анализа, пациенты, получающие ИКТИО, как неоадъювантную или адъювантную терапию, также были включены в подгруппу испытуемых с первой линией противоопухолевой терапии. В результате чуть больше половины пациентов представлена теми, кто не получал никакого фармакологического лечения на момент 0 точки (53,4%).
Всем пациентам после забора крови (на 0 точке) был введен препарат из группы ИКТИО. Подгруппы пациентов, в зависимости от вводимого препарата, из группы ИКТИО представлены в таблице 6.
Большинство пациентов получали препарат из подгруппы анти-PD-1-моноклональных антител (84,2%). Комбинированную терапию (совместно с ИКТИО проводилась химиотерапия и/или таргетная терапия) получали 24 пациента (16,4%).
На этапе сбора анамнестических и катамнестических данных было принято решение об изучении любых структурных и функциональных поражений желез внутренней секреции. Данная задача достигалась путем детального изучения и анализа всех имеющихся инструментальных (МРТ, КТ, УЗИ) и лабораторных исследований, которые пациентам проводились в рамках обследования по основному онкологическому заболеванию до введения первого препарата ИКТИО (таблица 7).
Среди включенных в исследование испытуемых у 73 пациентов (50,0%) было отмечено наличие хотя бы одного структурного и/или функционального изменения органа эндокринной системы. Из них 21 пациент (28,8% от всех имеющих эндокринопатию) получал соответствующее медикаментозное лечение (прием левотироксина натрия, пероральные сахароснижающие препараты). Только у двух пациентов проводилась терапия гипотиреоза и сахарного диабета (СД) 2 типа.
С учетом возможных различий при проведении иммунотерапии в монорежиме и иммунотерапии в комбинации с другими видами противоопухолевой терапии, мы сравнили две основные группы пациентов, сформированных на основании этого признака. Детальный анализ представлен в таблице 8.
При сравнении были выявлены статистически значимые различия между группами, поэтому с целью исключения смещения выборки пациенты, получающие комбинированную терапию, были исключены из дальнейшего анализа.
Среди пациентов, получающих в дальнейшем только терапию ИКТИО (n=122), в 20 случаях (16,4%) не удалось собрать получить сведения о развитии или отсутствии ИОНЯ.
Третий этап анализа
В итоговый анализ вошли оставшиеся 102 пациента.
Из них у 38 пациентов (37,3%) регистрировались ИОНЯ. При этом у большинства пациентов возникло только одно ИОНЯ (n=31, 81,6%), поражения двух органов или систем органов выявлялось значительно реже (n=7, 18,4%). Фиксировались как эндокринные, так и неэндокринные поражения. Из эндокринных ИОНЯ встречались: тиреопатии (n=13, 12,7%), гипофизит (n=2, 1,9%), СД (n=1, 0,9%). Из неэндокринных побочных эффектов встречались: поражения кожи (n=13, 12,7%), гастроинтестинальная токсичность (n=7, 6,9%), гепатотоксичность (n=4, 3,9%), нефриты (n=2, 1,9%), гематологическая токсичность (n=1, 0,9%), пневмонит (n=1, 0,9%), синдром Гиена-Барре (n=1, 0,9%).
С целью изучения возможных различий между группами пациентов с развившимися ИОНЯ или их отсутствием был проведен сравнительный анализ (таблица 9).
Уровень значимости выявленных различий по ИМТ и характеристике основного онкологического заболевания (нозология, проводимая линия противоопухолевого лечения и предшествующая химиотерапия в анамнезе) может быть охарактеризован как статистическая тенденция.
Далее был проведен ROC-анализ для ИМТ, как параметра, отражающего различиям между группами на уровне статистической тенденции. ROC-анализ представлен на рисунке 1.
Согласно индексу Юдена была выбрана отрезная точка ИМТ, равная 28,16 кг/м2. Характеристики ROC-кривой и операционные характеристики отрезной точки ИМТ представлены в таблице 10.
Среди всех нежелательных явлений с наибольшей частотой были выявлены нарушения функции щитовидной железы, что, по-видимому, частично объясняется прицельным мониторингом уровня ТТГ и тиреоидных гормонов. С учетом этих данных было принято решение сравнить группы с наличием и отсутствием поражений щитовидной железы, как результата иммунологической токсичности (таблица 11). Статистический анализ не показал наличия взаимосвязи между ИМТ и последующим развитием тиреоидных ИОНЯ.
После тиреоидных ИОНЯ чаще всего фиксировались кожные ИОНЯ. Поэтому было принято решение сравнить группы пациентов с наличием и отсутствием проявлений дерматологической токсичности при проведении терапии ИКТИО в монорежиме (таблица 12).
Далее был проведен ROC-анализ для параметра, обладающего статистической тенденцией к различиям между группами (ИМТ). ROC-анализ представлен на рисунке 2.
AUC=0,678 (95% ДИ: 0,538; 0,819). Отрезная точка ИМТ=25,39 кг/м2. Матрица классификации представлена в таблице 13.
С целью проведения сравнительного анализа в зависимости от ИМТ нами были сформированы 3 группы пациентов: с нормальной массой тела, с избыточной массой тела и ожирением. Три пациента с дефицитом массы тела на этом этапе статистической обработки были исключены (таблица 14).
Статистически значимых различий между группами пациентов с различным ИМТ не обнаружено.
Таблица 1. ИМТ в исследуемой выборке 146 пациентов
Table 1. BMI in the study sample of 146 patients
|
ИМТ |
Число пациентов, n |
|
дефицит массы тела [менее 18,5 кг/м2] |
3 |
|
нормальная масса тела [ 18,5–24,9 кг/м2] |
49 |
|
избыточная масса тела [ 25,0–29,9 кг/м2] |
52 |
|
ожирение I степени [ 30,0–34,9 кг/м2] |
33 |
|
ожирение II степени [ 35,0–39,9 кг/м2] |
5 |
|
ожирение III степени [более 40,0 кг/м2] |
4 |
Таблица 2. Нозологическая структура онкологических заболеваний в исследуемой выборке (n=146)
Table 2. Nosological structure of oncological diseases in the study sample (n=146)
|
МКБ-10 |
Класс МКБ-10 |
Число пациентов, n |
|
С22 |
ЗНО печени и внутрипеченочных желчных протоков |
4 |
|
С34 |
ЗНО бронхов и легкого |
55 |
|
С43 |
Злокачественная меланома кожи |
75 |
|
С53 |
ЗНО шейки матки |
1 |
|
С54 |
ЗНО тела матки |
1 |
|
С97 |
ЗНО самостоятельных (первичных) множественных локализаций |
10 |
Таблица 3. Стадии онкологических заболеваний в исследуемой выборке (n=136)
Table 3. Stages of cancer in the study sample (n=136)
|
Стадия опухоли |
Число пациентов, n |
|
I |
2 |
|
II |
5 |
|
III |
70 |
|
IV |
59 |
Таблица 4. Характеристика предшествующей противоопухолевой терапии (точка 0) в исследуемой выборке (n=146)
Table 4. Characteristics of previous antitumor therapy (point 0) in the study sample (n=146)
|
Предшествующая терапия |
Число пациентов, n |
||
|
Без лечения |
12 |
||
|
Монотерапия |
Оперативное лечение |
63 |
|
|
Химиотерапия |
22 |
||
|
Лучевая терапия |
1 |
||
|
Комбинированная терапия |
2 |
Оперативное лечение + химиотерапия |
10 |
|
Оперативное лечение + терапия интерферонами |
10 |
||
|
Лучевая терапия + химиотерапия |
9 |
||
|
Оперативное лечение + таргетная терапия |
3 |
||
|
Оперативное лечение + лучевая терапия |
2 |
||
|
Оперативное лечение + фотодинамическая терапия |
1 |
||
|
3 |
Оперативное лечение + лучевая терапия + химиотерапия |
6 |
|
|
Оперативное лечение + химиотерапия + таргетная терапия |
1 |
||
|
Оперативное лечение + лучевая терапия + терапия интерферонами |
1 |
||
|
4 |
Оперативное лечение + лучевая терапия + химиотерапия + таргетная терапия |
2 |
|
|
Оперативное лечение + лучевая терапия + химиотерапия + гормональная терапия |
2 |
||
|
Оперативное лечение + лучевая терапия + химиотерапия + терапия интерферонами |
1 |
||
Таблица 5. ИКТИО как линия противоопухолевой терапии в исследуемой выборке (n=146)
Table 5. ICI as a line of antitumor therapy in the study sample (n=146)
|
ИКТИО |
Число пациентов, n |
|
Первая линия |
78 |
|
Вторая линия |
48 |
|
Третья линия |
15 |
|
Четвертая линия |
1 |
|
Пятая линия |
3 |
|
Шестая линия |
0 |
|
Седьмая линия |
1 |
Таблица 6. Количество пациентов, получавших терапию различными препаратами из группы ИКТИО, в исследуемой выборке (n=146)
Table 6. Number of patients receiving therapy with various drugs from the ICI group in the study sample (n=146)
|
Подгруппа препарата ИКТИО |
Вводимый препарат |
Число пациентов, n |
|
анти-PD-1-моноклональное антитело |
ниволумаб |
96 |
|
анти-PD-L1-моноклональное антитело |
атезолизумаб |
23 |
|
анти-PD-1-моноклональное антитело |
пембролизумаб |
22 |
|
анти-PD-1-моноклональное антитело |
пролголимаб |
5 |
Таблица 7. Структура имеющихся эндокринных патологий у пациентов на 0 точке в исследуемой выборке (n=146)
Table 7. Structure of existing endocrine pathologies in patients at point 0 in the study sample (n=146)
|
Эндокринный орган |
Изменения / Патологии / Заболевания |
Число пациентов |
|
|
всего |
с терапией |
||
|
Гипофиз (структура) |
без изменений |
47 |
|
|
«пустое» турецкое седло |
1 |
||
|
нет данных |
25 |
||
|
Щитовидная железа (структура) |
без изменений |
17 |
|
|
узловые образования |
21 |
||
|
диффузно-узловой зоб |
2 |
||
|
киста |
1 |
||
|
резекция |
4 |
3 |
|
|
тиреоидэктомия |
3 |
3 |
|
|
тиреоидит в анамнезе |
2 |
||
|
нет данных |
23 |
||
|
Щитовидная железа (функция) |
тиреотоксикоз в анамнезе |
1 |
|
|
гипотиреоз |
4 |
2+2* |
|
|
нет данных / наиболее вероятно эутиреоз |
68 |
||
|
Надпочечники (структура) |
без изменений |
42 |
|
|
гиперплазия в 1 надпочечнике |
2 |
||
|
гиперплазия в 2 надпочечниках |
1 |
||
|
аденома в 1 надпочечнике |
7 |
||
|
аденомы в 2 надпочечниках |
2 |
||
|
метастаз в 1 надпочечник |
12 |
||
|
метастаз в 2 надпочечника |
2 |
||
|
метастаз в 1 надпочечник + проведение ЛТ |
1 |
||
|
нет данных |
4 |
||
|
Поджелудочная железа (структура) |
без изменений |
60 |
|
|
кисты |
1 |
||
|
метастазы |
2 |
||
|
атрофия в исходе ЛТ |
1 |
||
|
нет данных |
9 |
||
|
Поджелудочная железа (эндокринная функция) |
без изменений |
5 |
|
|
нарушение гликемии натощак |
2 |
1 |
|
|
нарушение толерантности к углеводам |
4 |
||
|
сахарный диабет 2 типа |
12 |
9+2* |
|
|
сахарный диабет, индуцированный ЛТ |
1 |
1 |
|
|
нет данных / наиболее вероятно эугликемия |
49 |
||
Примечание: 2* — пациенты, у которых проводилась медикаментозная терапия гипотиреоза и сахарного диабета 2 типа; без изменений — есть хотя бы одно исследование, исключающее структурное или функциональное поражение эндокринного органа; нет данных — нет ни одного исследования исключавшего бы структурное или функциональное поражение органа. Однако можно предположить, что выраженные функциональные изменения работы щитовидной и поджелудочной железы имели бы явное клиническое проявление, а также гликемия достаточно часто оценивается онкологами на амбулаторном и стационарном лечении. Именно поэтому мы предполагаем, что на данном этапе анализа функция желез внутренней секреции была нормальной.
Note: 2* — patients who received drug therapy for hypothyroidism and type 2 diabetes mellitus; no changes — there is at least one study that excludes structural or functional damage to the endocrine organ; no data — there is not a single study that would exclude structural or functional damage to the organ. However, it can be assumed that pronounced functional changes in the functioning of the thyroid and pancreas would have a clear clinical manifestation, and glycemia is often assessed by oncologists during outpatient and inpatient treatment. That is why we assume that at this stage of the analysis the function of the endocrine glands was normal.
Таблица 8. Сравнительный анализ групп пациентов, получавших в дальнейшем только терапию ИКТИО, и тех, кто получал комбинированную противоопухолевую терапию, в исследуемой выборке (n=146)
Table 8. Comparative analysis of groups of patients who subsequently received only ICI therapy and those who received combination antitumor therapy in the study sample (n=146)
|
N |
Монотерапия ИКТИО |
Комбинированная терапия |
р |
|||
|
Me [Q1; Q3] / n (%) |
N |
Me |
||||
|
Антропометрические данные |
||||||
|
Мужской/женский пол |
122 |
63/59 (52% / 48%) |
24 |
17/7 (71% / 29%) |
0,1162 |
|
|
Возраст, лет |
122 |
60 [ 52; 68] |
24 |
56 [ 52; 64] |
0,1541 |
|
|
ИМТ, кг/м2 |
122 |
26,39 [ 23,77; 30,73] |
24 |
26,61 [ 24,00; 29,36] |
0,5761 |
|
|
Кодирование новообразований |
||||||
|
Нозология |
22 |
122 |
1 (0,8%) |
24 |
3 (13%) |
<0,0012 |
|
34 |
39 (32%) |
16 (67%) |
||||
|
43 |
75 (61%) |
0 (0%) |
||||
|
53 |
1 (0,8%) |
0 (0%) |
||||
|
54 |
0 (0%) |
1 (4%) |
||||
|
97 |
6 (5%) |
4 (17%) |
||||
|
Стадии |
I |
116 |
2 (2%) |
20 |
0 (0%) |
0,0092 |
|
II |
4 (3%) |
1 (5%) |
||||
|
III |
66 (57%) |
4 (20%) |
||||
|
IV |
44 (38%) |
15 (75%) |
||||
|
Предшествующая противоопухолевая терапия |
||||||
|
Оперативное лечение |
122 |
92 (75%) |
24 |
10 (42%) |
0,0032 |
|
|
Лучевая терапия |
122 |
15 (12%) |
24 |
9 (38%) |
0,0052 |
|
|
Химиотерапия |
122 |
44 (36%) |
24 |
9 (38%) |
1,0002 |
|
|
Терапия интерфероном |
122 |
12 (10%) |
24 |
0 (0%) |
0,2172 |
|
|
Гормональная терапия |
122 |
0 (0%) |
24 |
2 (8%) |
0,0262 |
|
|
Таргетная терапия |
122 |
3 (2%) |
24 |
3 (13%) |
1,0002 |
|
|
Фотодинам. терапия |
122 |
1 (0,8%) |
24 |
0 (0%) |
0,0562 |
|
|
Линия терапии |
1 |
122 |
65 (53%) |
24 |
13 (54%) |
0,9592 |
|
2 |
40 (33%) |
8 (33%) |
||||
|
3 |
12 (10%) |
3 (13%) |
||||
|
4 |
1 (1%) |
0 (0%) |
||||
|
5 |
3 (2%) |
0 (0%) |
||||
|
7 |
1 (1%) |
0 (0%) |
||||
|
Эндокринологический анамнез |
||||||
|
Наличие любых эндокринных заболеваний |
122 |
59 (48%) |
24 |
14 (58%) |
0,5042 |
|
|
Наличие терапии эндокринных заболеваний |
113 |
17 (15%) |
21 |
5 (24%) |
0,3402 |
|
|
Катамнестические данные |
||||||
|
Длительность терапии ИКТИО |
122 |
288 [ 56; 459] |
24 |
90 [ 32; 325] |
0,0481 |
|
|
Возраст на момент смерти |
50 |
64 [ 58; 70] |
15 |
58 [ 53; 65] |
0,0801 |
|
Поправка Бонферрони Р0=0,05/17=0,003. Выживаемость живых пациентов рассчитана на даты приостановки исследования (15.05–02.06.2023 г.)
Bonferroni correction Р0=0.05/17=0.003. Survival of living patients is calculated on the dates of study suspension (15 May–02 June 2023).
Таблица 9. Сравнительный анализ групп пациентов с развившимися и неразвившимися ИОНЯ в исследуемой выборке (n=102)
Table 9. Comparative analysis of groups of patients with developed and non-developed irAEs in the study sample (n=102)
|
N |
Есть ИОНЯ |
Нет ИОНЯ |
р |
|||
|
Me [Q1; Q3] / n (%) |
N |
Me [Q1; Q3] / n (%) |
||||
|
Антропометрические данные |
||||||
|
Мужской/женский пол |
38 |
16/22 (42% / 58%) |
64 |
34/30 (53% / 47%) |
0,3312 |
|
|
Возраст, лет |
38 |
61 [ 52; 67] |
64 |
59 [ 51; 68] |
0,6131 |
|
|
ИМТ, кг/м2 |
38 |
25,10 [ 21,47; 29,02] |
64 |
28,28 [ 24,15; 31,20] |
0,0401 |
|
|
Кодирование новообразований |
||||||
|
Нозология |
22 |
38 |
0 (0%) |
64 |
1 (2%) |
0,0422 |
|
34 |
7 (18%) |
23 (36%) |
||||
|
43 |
27 (71%) |
38 (59%) |
||||
|
53 |
0 (0%) |
1 (2%) |
||||
|
97 |
4 (11%) |
1 (2%) |
||||
|
Стадии |
I |
34 |
1 (3%) |
63 |
1 (2%) |
0,7652 |
|
II |
0 (0%) |
2 (3%) |
||||
|
III |
21 (62%) |
35 (56%) |
||||
|
IV |
12 (35%) |
25 (40%) |
||||
|
Предшествующая противоопухолевая терапия |
||||||
|
Оперативное лечение |
38 |
31 (82%) |
64 |
44 (69%) |
0,1732 |
|
|
Лучевая терапия |
38 |
2 (5%) |
64 |
9 (14%) |
0,2042 |
|
|
Химиотерапия |
38 |
8 (21%) |
64 |
27 (42%) |
0,0332 |
|
|
Терапия интерфероном |
38 |
3 (8%) |
64 |
7 (11%) |
0,7402 |
|
|
Таргетная терапия |
38 |
0 (0%) |
64 |
2 (3%) |
0,5282 |
|
|
Фотодинам. терапия |
38 |
0 (0%) |
64 |
1 (2%) |
1,0002 |
|
|
Линии терапии |
1 |
38 |
27 (71%) |
64 |
29 (45%) |
0,0281 |
|
2 |
8 (21%) |
25 (39%) |
||||
|
3 |
3 (8%) |
8 (13%) |
||||
|
4 |
0 (0%) |
0 (0%) |
||||
|
5 |
0 (0%) |
2 (3%) |
||||
|
7 |
0 (0%) |
0 (0%) |
||||
|
Эндокринологический анамнез |
||||||
|
Наличие любых эндокринных заболеваний |
38 |
14 (37%) |
64 |
34 (53%) |
0,1512 |
|
|
Наличие терапии эндокринных заболеваний |
36 |
5 (14%) |
64 |
10 (16%) |
1,0002 |
|
|
Катамнестические данные |
||||||
|
Длительность терапии ИКТИО |
38 |
371 [ 113; 661] |
64 |
342 [ 72; 515] |
0,3681 |
|
|
Выживаемость |
37 |
63 [ 54; 70] |
63 |
61 [ 53; 70] |
0,4161 |
|
Поправка Бонферрони Р0=0,05/16=0,003. Выживаемость живых пациентов рассчитана на даты приостановки исследования (15.05–02.06.2023 г.).
Bonferroni correction Р0=0.05/16=0.003. Survival of living patients is calculated on the dates of study suspension (15 May–02 June 2023)
Таблица 10. Характеристики ROC-кривых и операционные характеристики отрезной точки ИМТ, равной 28,16 кг/м2
Table 10. Characteristics of ROC curves and operational characteristics of the BMI cut-off point of 28.16 kg/m²
|
Признак |
AUC, 95% ДИ |
Отрезная точка |
ДЧ, 95% ДИ |
ДС, 95% ДИ |
ПЦПР, 95% ДИ |
ПЦОР, 95% ДИ |
ОШ, 95% ДИ |
|
ИМТ |
0,622 (0,512; 0,732) |
≤ 28,16 кг/м2 |
71% (57%–83%) |
52% (43%–59%) |
47% (38%–54%) |
75% (63%–85%) |
2,61 (1,11–6,15) |
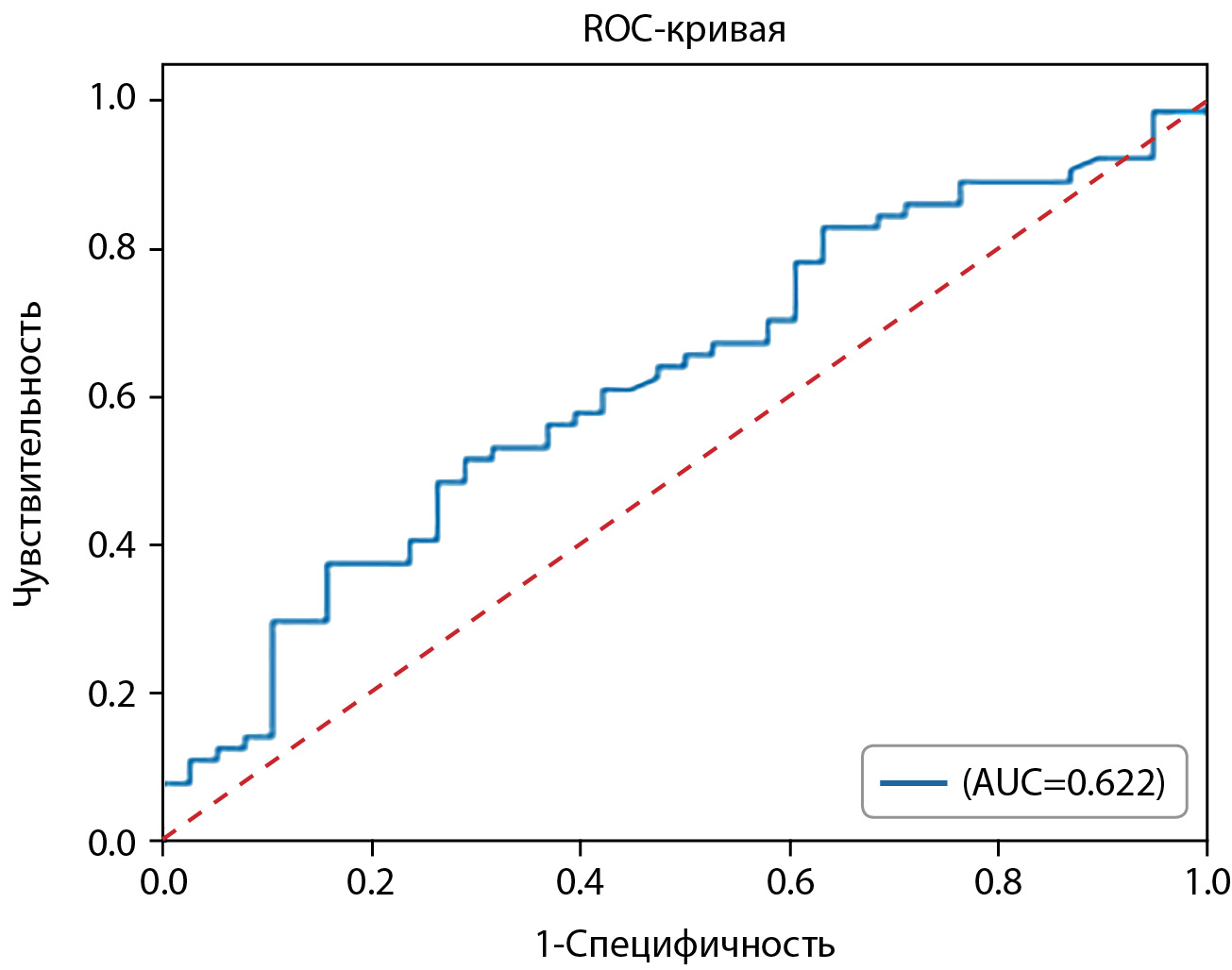
Рисунок 1. ROC-анализ ИМТ.
Figure 1. ROC analysis of BMI.
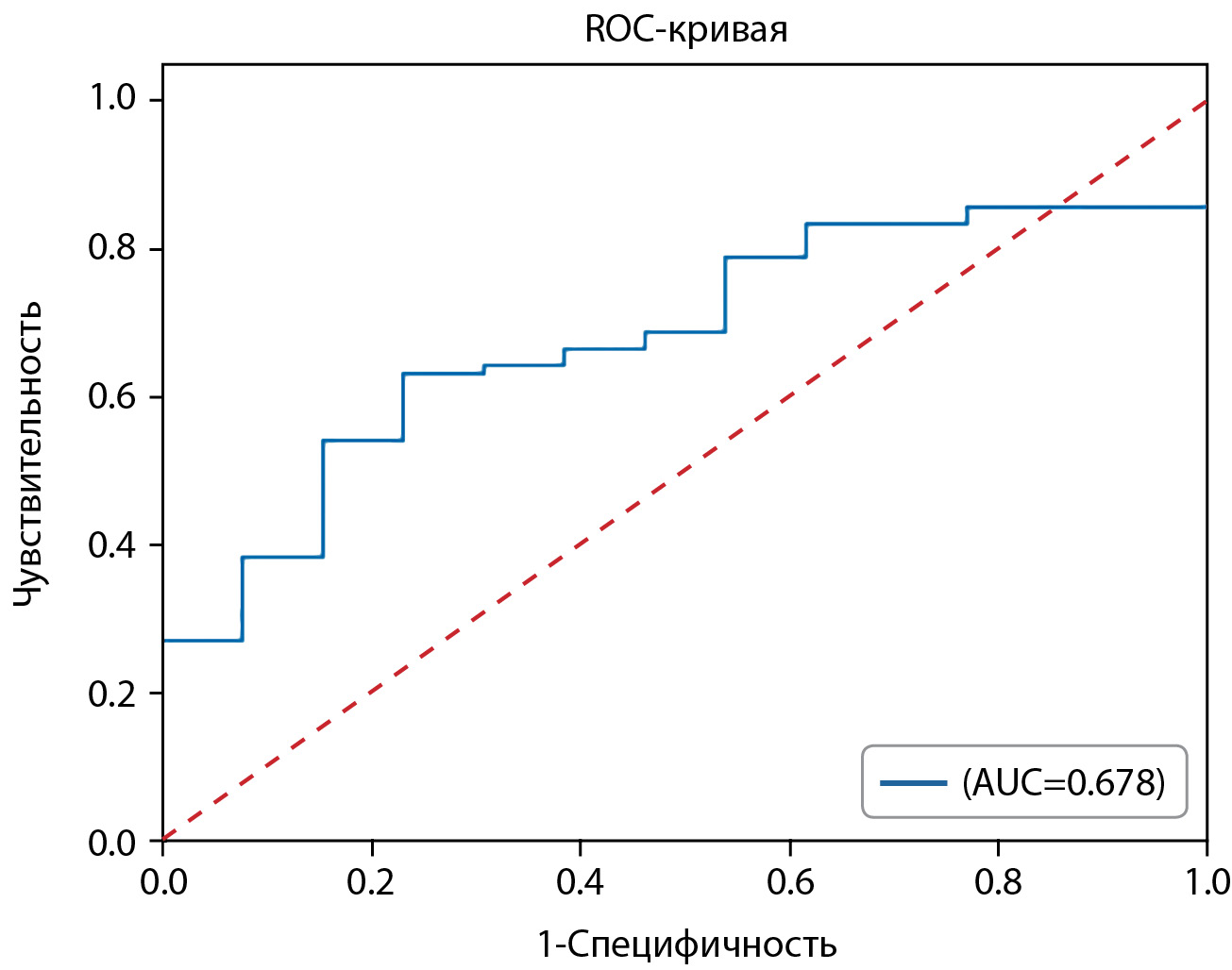
Рисунок 2. ROC-анализ ИМТ.
Figure 2. ROC analysis of BMI.
Таблица 11. Сравнительный анализ групп пациентов с тиреоидными ИОНЯ и без ИОНЯ со стороны щитовидной железы в исследуемой выборке (n=102)
Table 11. Comparative analysis of groups of patients with thyroid irAEs and without thyroid irAEs in the study sample (n=102)
|
N |
Есть тиреоидные ИОНЯ |
Нет тиреоидных ИОНЯ |
р |
|||
|
Me [Q1; Q3] / n (%) |
N |
Me [Q1; Q3] / n (%) |
||||
|
Антропометрические данные |
||||||
|
Мужской/женский пол |
13 |
7/6 (54% / 46%) |
89 |
43/46 (48% / 52%) |
0,7732 |
|
|
Возраст, лет |
13 |
58 [ 48; 65] |
89 |
59 [ 52; 68] |
0,6841 |
|
|
ИМТ, кг/м2 |
13 |
25,65 [ 22,06; 29,40] |
89 |
26,51 [ 23,46; 30,73] |
0,6341 |
|
|
Кодирование новообразований |
||||||
|
Нозология |
22 |
13 |
0 (0%) |
89 |
1 (1%) |
0,7522 |
|
34 |
4 (31%) |
26 (29%) |
||||
|
43 |
8 (62%) |
57 (64%) |
||||
|
53 |
0 (0%) |
1 (1%) |
||||
|
97 |
1 (8%) |
4 (4%) |
||||
|
Стадии |
I |
12 |
0 (0%) |
85 |
2 (2%) |
0,8582 |
|
II |
0 (0%) |
2 (2%) |
||||
|
III |
8 (67%) |
48 (56%) |
||||
|
IV |
4 (33%) |
33 (39%) |
||||
|
Предшествующая противоопухолевая терапия |
||||||
|
Оперативное лечение |
13 |
9 (69%) |
89 |
66 (74%) |
0,7412 |
|
|
Лучевая терапия |
13 |
0 (0%) |
89 |
11 (12%) |
0,3512 |
|
|
Химиотерапия |
13 |
4 (31%) |
89 |
31 (35%) |
1,0002 |
|
|
Терапия интерфероном |
13 |
1 (8%) |
89 |
9 (10%) |
1,0002 |
|
|
Таргетная терапия |
13 |
0 (0%) |
89 |
2 (2%) |
1,0002 |
|
|
Фотодинам. терапия |
13 |
0 (0%) |
89 |
1 (1%) |
1,0002 |
|
|
Линии терапии |
1 |
13 |
8 (62%) |
89 |
48 (54%) |
1,0002 |
|
2 |
4 (31%) |
29 (33%) |
||||
|
3 |
1 (8%) |
10 (11%) |
||||
|
4 |
0 (0%) |
0 (0%) |
||||
|
5 |
0 (0%) |
2 (2%) |
||||
|
7 |
0 (0%) |
0 (0%) |
||||
|
Эндокринологический анамнез |
||||||
|
Наличие эндокринных заболеваний |
13 |
5 (38%) |
89 |
43 (48%) |
0,5642 |
|
|
Наличие терапии эндокринных заболеваний |
13 |
0 (0%) |
87 |
15 (17%) |
0,2072 |
|
|
Катамнестические данные |
||||||
|
Длительность терапии ИКТИО |
13 |
425 [ 221; 927] |
89 |
345 [ 77; 519] |
0,0771 |
|
|
Выживаемость |
13 |
60 [ 48; 67] |
87 |
62 [ 54; 70] |
0,6781 |
|
Поправка Бонферрони Р0=0,05/16=0,003. Выживаемость живых пациентов рассчитана на даты приостановки исследования (15.05–02.06.2023 г.).
Bonferroni correction Р0=0.05/16=0.003. Survival of living patients is calculated on the dates of study suspension (15 May–02 June 2023).
Таблица 12. Сравнительный анализ групп пациентов с развившимися кожными ИОНЯ и их отсутствием в исследуемой выборке (n=102)
Table 12. Comparative analysis of groups of patients with developed cutaneous irAEs and their absence in the study sample (n=102)
|
N Me [Q1; Q3] / n (%) |
Есть кожные ИОНЯ |
Нет кожных ИОНЯ |
р |
|||
|
N |
Me [Q1; Q3] / n (%) |
|||||
|
Антропометрические данные |
||||||
|
Мужской/женский пол |
13 |
2/11 (15% / 85%) |
89 |
48/41 (54% / 46%) |
0,0152 |
|
|
Возраст, лет |
13 |
61 [ 59; 67] |
89 |
59 [ 51; 68] |
0,3351 |
|
|
ИМТ, кг/м2 |
13 |
24,56 [ 21,47; 25,16] |
89 |
27,78 [ 23,72; 30,90] |
0,0391 |
|
|
Кодирование новообразований |
||||||
|
Нозология 34 43 53 97 |
22 |
13 3 (23%) 8 (62%) 0 (0%) 2 (15%) |
0 (0%) |
89 27 (30%) 57 (64%) 1 (1%) 3 (3%) |
1 (1%) |
0,4022 |
|
Стадии II III IV |
I |
11 0 (0%) 6 (55%) 4 (36%) |
1 (9%) |
86 2 (2%) 50 (58%) 33 (38%) |
1 (1%) |
0,4532 |
|
Предшествующая противоопухолевая терапия |
||||||
|
Оперативное лечение |
13 |
11 (85%) |
89 |
64 (72%) |
0,5052 |
|
|
Лучевая терапия |
13 |
1 (8%) |
89 |
10 (11%) |
1,0002 |
|
|
Химиотерапия |
13 |
3 (23%) |
89 |
32 (36%) |
0,5342 |
|
|
Терапия интерфероном |
13 |
0 (0%) |
89 |
10 (11%) |
0,3542 |
|
|
Таргетная терапия |
13 |
0 (0%) |
89 |
2 (2%) |
1,0002 |
|
|
Фотодинам. терапия |
13 |
0 (0%) |
89 |
1 (1%) |
1,0002 |
|
|
Линии терапии |
1 |
13 |
10 (77%) |
89 |
46 (52%) |
0,3942 |
|
2 |
3 (23%) |
30 (34%) |
||||
|
3 |
0 (0%) |
11 (12%) |
||||
|
4 |
0 (0%) |
0 (0%) |
||||
|
5 |
0 (0%) |
2 (2%) |
||||
|
7 |
0 (0%) |
0 (0%) |
||||
|
Эндокринологический анамнез |
||||||
|
Наличие эндокринных заболеваний |
13 |
5 (38%) |
89 |
43 (48%) |
0,5642 |
|
|
Наличие терапии эндокринных заболеваний |
12 |
2 (17%) |
88 |
13 (15%) |
1,0002 |
|
|
Катамнестические данные |
||||||
|
Длительность терапии ИКТИО |
13 |
422 [ 360; 872] |
89 |
338 [ 77; 510] |
0,0631 |
|
|
Выживаемость |
13 |
64 [ 61; 70] |
87 |
61 [ 53; 70] |
0,2151 |
|
1. U-тест (U test).
2. Точный критерий Фишера (Fisher’s exact test).
Поправка Бонферрони Р0=0,05/16=0,003. Выживаемость живых пациентов рассчитана на даты приостановки исследования (15.05–02.06.2023 г.).
Bonferroni correction Р0=0.05/16=0.003. Survival of living patients is calculated on the dates of study suspension (15 May–02 June 2023).
Таблица 13. Матрица классификации ИМТ≤25,39 кг/м2
Table 13. Classification matrix for BMI≤25.39 kg/m²
|
ИОНЯ кожные есть |
ИОНЯ кожных нет |
|
|
ИМТ≤25,39 кг/м2 |
10 |
34 |
|
ИМТ>25,39 кг/м2 |
3 |
55 |
ДЧ=77% (95% ДИ: 48%–94%)
ДС=62% (95% ДИ: 58%–64%)
ПЦПР=23% (95% ДИ:14%–28%)
ПЦОР=95% (95% ДИ: 88%–99%)
ОШ=5,39 (95% ДИ: 1,39–20,99)
Таблица 14. Сравнительный анализ групп пациентов с различным уровнем ИМТ в выборке 99 пациентов
Table 14. Comparative analysis of groups of patients with different BMI levels in a sample of 99 patients
|
N |
ИМТ = 18,5–24,9 |
ИМТ = 25–29,9 |
ИМТ≥30 |
р |
p, post-hoc |
||||
|
Me |
N |
Me |
N |
Me |
|||||
|
Антропометрические данные |
|||||||||
|
Мужской/женский пол |
37 |
15/22 |
31 |
20/11 |
31 |
13/18 |
0,115 |
– |
|
|
Возраст, года |
37 |
57 [ 46; 68] |
31 |
61 [ 54; 66] |
31 |
59 [ 56; 68] |
0,567 |
– |
|
|
Кодирование новообразований |
|||||||||
|
Нозология |
22 |
37 |
0 (0%) |
31 |
0 (0%) |
31 |
1 (3%) |
0,667 |
– |
|
34 |
13 (35%) |
10 (32%) |
6 (19%) |
||||||
|
43 |
22 (59%) |
20 (65%) |
22 (71%) |
||||||
|
53 |
0 (0%) |
0 (0%) |
1 (3%) |
||||||
|
97 |
2 (5%) |
1 (3%) |
1 (3%) |
||||||
|
Стадии |
I |
35 |
0 (0%) |
39 |
2 (7%) |
30 |
0 (0%) |
0,532 |
– |
|
II |
1 (3%) |
0 (0%) |
1 (3%) |
||||||
|
III |
21 (60%) |
15 (50%) |
19 (63%) |
||||||
|
IV |
13 (37%) |
13 (43%) |
10 (33%) |
||||||
|
Предшествующая противоопухолевая терапия |
|||||||||
|
Оперативное лечение |
37 |
27 (73%) |
31 |
23 (74%) |
31 |
24 (77%) |
0,957 |
– |
|
|
Лучевая терапия |
37 |
5 (14%) |
31 |
3 (10%) |
31 |
2 (6%) |
0,649 |
– |
|
|
Химиотерапия |
37 |
13 (35%) |
31 |
12 (39%) |
31 |
8 (26%) |
0,555 |
– |
|
|
Терапия интерфероном |
37 |
6 (16%) |
31 |
2 (6%) |
31 |
2 (6%) |
0,346 |
– |
|
|
Таргетная терапия |
37 |
0 (0%) |
31 |
1 (3%) |
31 |
1 (3%) |
0,527 |
– |
|
|
Фотодинамическая терапия |
37 |
0 (0%) |
31 |
1 (3%) |
31 |
0 (0%) |
0,626 |
– |
|
|
Линии терапии |
1 |
37 |
18 (49%) |
31 |
17 (55%) |
31 |
20 (65%) |
0,665 |
– |
|
2 |
15 (41%) |
9 (29%) |
8 (26%) |
||||||
|
3 |
4 (11%) |
4 (13%) |
2 (6%) |
||||||
|
4 |
0 (0%) |
0 (0%) |
0 (0%) |
||||||
|
5 |
0 (0%) |
1 (3%) |
1 (3%) |
||||||
|
7 |
0 (0%) |
0 (0%) |
0 (0%) |
||||||
|
Эндокринологический анамнез |
|||||||||
|
Наличие эндокринных заболеваний |
37 |
16 (43%) |
31 |
12 (39%) |
31 |
18 (58%) |
0,285 |
– |
|
|
Наличие терапии эндокринных заболеваний |
36 |
4 (11%) |
30 |
3 (10%) |
31 |
7 (23%) |
0,388 |
– |
|
|
Катамнестические данные |
|||||||||
|
Длительность терапии ИКТИО |
37 |
356 [ 51; 765] |
31 |
323 [ 128; 459] |
31 |
365 [ 128; 656] |
0,874 |
– |
|
|
Выживаемость |
37 |
60 [ 49; 72] |
29 |
63 [ 57; 66] |
31 |
62 [ 58; 71] |
0,580 |
– |
|
|
Характеристика развившихся ИОНЯ |
|||||||||
|
Развившиеся ИОНЯ |
37 |
16 (43%) |
31 |
13 (42%) |
31 |
7 (23%) |
0,172 |
– |
|
|
Тиреоидные ИОНЯ |
37 |
4 (11%) |
31 |
5 (16%) |
31 |
3 (10%) |
0,800 |
– |
|
|
Кожные ИОНЯ |
37 |
8 (22%) |
31 |
4 (13%) |
31 |
1 (3%) |
0,086 |
– |
|
Поправка Бонферрони Р0=0,05/18=0,003.
Bonferroni correction Р0=0.05/18=0.003.
Сопоставление с другими публикациями
Насколько нам известно, наша работа не является единственным исследованием, целью которого была оценка влияния ожирения и избыточной массы тела на риск развития ИОНЯ при проведении противоопухолевой терапии ИКТИО.
Согласно нашим собственным данным, частота возникновения кожных ИОНЯ оказалась выше у пациентов с более низким ИМТ. При включении в анализ всех ИОНЯ нам не удалось выявить четкой статистической взаимосвязи с ИМТ, однако была выявлена статистическая тенденция, что требует дополнительных исследований. Интересно, что наши данные не совпадают с результатами проведенных ранее исследований, показавших, что избыточная масса тела и ожирение повышают риск развития любых ИОНЯ.
По данным ретроспективного многоцентрового исследования Cortellini et al., 2019 г. [14], была обнаружена значительно более высокая частота выявляемых ИОНЯ любой степени среди пациентов с ИМТ≥25,0 кг/м2, однако при этом показатели выживаемости, напротив, были лучше при избыточной массе тела и ожирении. Сходные результаты были получены Guzman-Prado et al., в 2021 г. при проведении метаанализа [15]. Gülave et al. в 2021 г. [16] было продемонстрировано, что повышенный риск развития ИОНЯ характерен для пациентов с ИМТ≥30 кг/ м2 и пациентов с уже имеющимися до проведения иммунотерапии аутоиммунными заболеваниями. При этом у пациентов с аутоиммунными заболеваниями риск возникновения ИОНЯ тяжелой степени по CTCAE увеличивался при использовании салицилатов.
По данным еще одного ретроспективного обсервационного исследования Leiter et al, 2021 г. [17], повышенному риску развития ИОНЯ были подвержены пациенты с избыточной массой тела и с двумя и более сопутствующими метаболическими нарушениями (такими как сахарный диабет, дислипидемия и артериальная гипертензия).
Таким образом, становится очевидно, что ИМТ следует учитывать при оценке риска развития ИОНЯ и прогнозировании ответа на терапию ИКТИО у онкологических пациентов. Возможно, избыток жировой ткани повышает риск развития всех ИОНЯ, обладая определенным протективным действием именно в отношении дерматологической токсичности.
Клиническая значимость результатов
Полученные результаты могут быть использованы для дальнейшего поиска предикторов развития ИОНЯ на фоне терапии злокачественных новообразований ИКТИО. Нутритивный статус пациента, оцененный на основании ИМТ, может быть одним из прогностических критериев, оцениваемых в сочетании с другими клиническими или лабораторными показателями. Выявленная статистическая тенденция позволяет рассматривать избыточную массу тела как благоприятный фактор для онкологических пациентов, получающих лечение ИКТИО.
Ограничения исследования
В рамках данного исследования проводилась лишь одномоментная оценка ИМТ. Безусловно, ИМТ, невзирая на простоту его определения, не является идеальной оценкой ожирения и избыточной массы тела, поскольку не отражает структурный состав тела и распределение жировой ткани. Констатация факта возникновения ИОНЯ осуществлялось частично на основании данных, зафиксированных в историях болезней, что могло привести к смещению структуры выявляемых нежелательных явлений.
Наше исследование включало в себя неоднородную популяцию пациентов с несколькими типами злокачественных новообразований, различными курсами лечения и продолжительностью ИКТИО, что также могло отразиться на результатах оценки корреляции между исследуемыми параметрами. Формирование более обширной группы пациентов с возможностью ранжирования на различные подгруппы в зависимости от комбинаций проводимой терапии было бы желательным для детального изучения таких пациентов и спектра ИОНЯ.
Направления дальнейших исследований
Планируется более детальная проспективная оценка функции щитовидной железы, гипоталамо-гипофизарно-надпочечниковой системы у представленной выборки пациентов на фоне проведения терапии ИКТИО.
ЗАКЛЮЧЕНИЕ
Ввиду высокой частоты разнообразных ИОНЯ на фоне иммунотерапии ИКТИО [18], активно ведутся фундаментальные, наблюдательные и клинические исследования для поиска маркеров последующего развития ИОНЯ. Прогнозирование возможных токсических проявлений необходимо для оптимального мониторинга состояния пациентов. Это особенно актуально в контексте своевременной диагностики жизнеугрожающих нежелательных явлений, таких как надпочечниковая недостаточность, пневмонит, нефрит, гепатит и прочие, из-за схожести клинических симптомов ИОНЯ и симптомов основного заболевания у онкологических пациентов. Поиск неинвазивных предикторов является необходимым для данной категории пациентов для сохранения качества их жизни. Также это позволит избежать необоснованной отмены терапии ИКТИО.
По нашим данным, согласующимися с имеющимися зарубежными исследованиями, начало ИОНЯ может быть как немедленным, так и отсроченным (на срок до 2 лет). Так, у 38 пациентов (37,3%) регистрировались разнообразные ИОНЯ, спектр которых был представлен тиреопатиями (n=13, 12,7%), поражениями кожи (n=13, 12,7%), гастроинтестинальная токсичность (n=7, 6,9%), гепатотоксичностью (n=4, 3,9%), гипофизитами (n=2, 2%), нефритами (n=2, 2%), СД (n=1, 1%), гематологической токсичностью (n=1, 1%), пневмонитом (n=1, 1%), синдромом Гиена-Барре (n=1, 1%).
С учетом уже проведенных исследований, ИМТ был выбран в качестве доступного в реальной клинической практике маркера прогнозирования риска ИОНЯ у пациентов на фоне последующей иммунотерапии ИКТИО. Мы провели оценку ИМТ одномоментно — перед началом терапии ИКТИО. Вопреки имеющимся в научной литературе данным, в нашей когорте пациентов ИМТ>28,16 кг/м2 характеризовался меньшим риском развития ИОНЯ, прежде всего дерматологических.
Таким образом, вопрос о взаимосвязи между ИМТ и развитием ИОНЯ остается открытым. Представляется важным осуществление дальнейших исследований с возможной оценкой ИМТ у пациентов с другими (даже более редкими) ИОНЯ, безусловно, с большей выборкой испытуемых.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено при поддержке гранта Министерства науки и высшего образования Российской Федерации (соглашение №075-15-2020-899).
Конфликт интересов. Трошина Е.А. — член редакционной коллегии журнала «Ожирение и метаболизм».
Участие авторов. Глибка А.А. — анализ клинического материала, написание статьи; Мазурина Н.В., Трошина Е.А. — концепция и дизайн работы, редактирование текста рукописи; Саранцева К.А., Харкевич Г.Ю., Волконский М.В. — сбор клинического материала, редактирование текста рукописи; Елфимова А.Р. — статистический анализ.
Все авторы внесли существенный вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией.
Благодарности. Всем медицинским специалистам (врачам, медицинским сестрам, сотрудникам лабораторий), помогавшим осуществить данное исследование. Также авторы выражают искреннюю благодарность пациентам, принявшим участие в проведении исследования.
Список литературы
1. ВОЗ. Информационные бюллетени. Ожирение и избыточный вес. 9 июня 2021 г. Режим доступа: https://www.who.int/ru/newsroom/fact-sheets/detail/obesity-and-overweight. Ссылка активна на 02.10.2023
2. Woodall MJ, Neumann S, Campbell K, Pattison ST, Young SL. The Effects of Obesity on Anti-Cancer Immunity and Cancer Immunotherapy. Cancers (Basel). 2020;12(5):1230. doi: https://doi.org/10.3390/cancers12051230
3. Tran KB, Lang JJ, Compton K, et al. The global burden of cancer attributable to risk factors, 2010—19: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2022;400(10352):563-591. doi: https://doi.org/10.1016/S0140-6736(22)01438-6
4. Gallo M, Adinolfi V, Barucca V, et al. Expected and paradoxical effects of obesity on cancer treatment response. Rev Endocr Metab Disord. 2021;22(4):681-702. doi: https://doi.org/10.1007/s11154-020-09597-y
5. Xu H, Cao D, He A, Ge W. The prognostic role of obesity is independent of sex in cancer patients treated with immune checkpoint inhibitors: A pooled analysis of 4090 cancer patients. Int Immunopharmacol. 2019;74:105745. doi: https://doi.org/10.1016/j.intimp.2019.105745
6. An Y, Wu Z, Wang N, et al. Association between body mass index and survival outcomes for cancer patients treated with immune checkpoint inhibitors: a systematic review and meta-analysis. J Transl Med. 2020;18(1):235. doi: https://doi.org/10.1186/s12967-020-02404-x
7. Nie R-C, Chen G-M, Wang Y, et al. Association Between Body Mass Index and Survival Outcomes In Patients Treated With Immune Checkpoint Inhibitors: Meta-analyses of Individual Patient Data. J Immunother. 2021;44(9):371-375. doi: https://doi.org/10.1097/CJI.0000000000000389
8. Yoo S-K, Chowell D, Valero C, Morris LGT, Chan TA. Outcomes Among Patients With or Without Obesity and With Cancer Following Treatment With Immune Checkpoint Blockade. JAMA Netw Open. 2022;5(2):e220448. doi: https://doi.org/10.1001/jamanetworkopen.2022.0448
9. Braun N, Gomes F, Schutz P "The obesity paradox” in disease — is the protective effect of obesity true? Swiss Med Wkly. December 2015. doi: https://doi.org/10.4414/smw.2015.14265
10. Rodrigues MR da S, Santo MA, Favero GM, et al. Metabolic surgery and intestinal gene expression: Digestive tract and diabetes evolution considerations. World J Gastroenterol. 2015;21(22):6990-6998. doi: https://doi.org/10.3748/wjg.v21.i22.6990
11. Rabe K, Lehrke M, Parhofer KG, Broedl UC. Adipokines and Insulin Resistance. Mol Med. 2008;14(11-12):741-751. doi: https://doi.org/10.2119/2008-00058.Rabe
12. Rubino R, Marini A, Roviello G, et al. Endocrine-related adverse events in a large series of cancer patients treated with anti-PD1 therapy. Endocrine. 2021;74(1):172-179. doi: https://doi.org/10.1007/s12020-021-02750-w
13. Presotto EM, Rastrelli G, Desideri I, et al. Endocrine toxicity in cancer patients treated with nivolumab or pembrolizumab: results of a large multicentre study. J Endocrinol Invest. 2020;43(3):337-345. doi: https://doi.org/10.1007/s40618-019-01112-8
14. Cortellini A, Bersanelli M, Buti S, et al. A multicenter study of body mass index in cancer patients treated with anti-PD-1/PD-L1 immune checkpoint inhibitors: when overweight becomes favorable. J Immunother Cancer. 2019;7(1):57. doi: https://doi.org/10.1186/s40425-019-0527-y
15. Guzman-Prado Y, Ben Shimol J, Samson O. Body mass index and immune-related adverse events in patients on immune checkpoint inhibitor therapies: a systematic review and metaanalysis. Cancer Immunol Immunother. 2021;70(1):89-100. doi: https://doi.org/10.1007/s00262-020-02663-z
16. Gulave B, Hew MN, de Groot JS, et al. High body mass index and preexisting autoimmune disease are associated with an increased risk of immune-related adverse events in cancer patients treated with PD-(L)1 inhibitors across different solid tumors. ESMO Open. 2021; 6(3):100107. doi: https://doi.org/10.1016/j.esmoop.2021.100107
17. Leiter A, Carroll E, De Alwis S, et al. Metabolic disease and adverse events from immune checkpoint inhibitors. Eur J Endocrinol. 2021;184(6):857-865. doi: https://doi.org/10.1530/EJE-20-1362
18. Fujii T, Colen RR, Bilen MA, et al. Incidence of immunerelated adverse events and its association with treatment outcomes: the MD Anderson Cancer Center experience. Invest New Drugs. 2018;36(4):638-646. doi: https://doi.org/10.1007/s10637-017-0534-0
Об авторах
А. А. ГлибкаРоссия
Глибка Анастасия Андреевна.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Нет
Н. В. Мазурина
Россия
Мазурина Наталия Валентиновна - д.м.н.
Москва
Конфликт интересов:
Нет
Е. А. Трошина
Россия
Трошина Екатерина Анатольевна - д.м.н., профессор.
Москва
Конфликт интересов:
Трошина Е.А. — член редакционной коллегии журнала «Ожирение и метаболизм».
К. А. Саранцева
Россия
Саранцева Ксения Андреевна - к.м.н.
Москва
Конфликт интересов:
Нет
Г. Ю. Харкевич
Россия
Харкевич Галина Юрьевна - к.м.н.
Москва
Конфликт интересов:
Нет
М. В. Волконский
Россия
Волконский Михаил Викторович.
Москва
Конфликт интересов:
Нет
А. Р. Елфимова
Россия
Елфимова Алина Ринатовна.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. ROC-анализ ИМТ. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(114KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. ROC-анализ ИМТ. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(111KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Глибка А.А., Мазурина Н.В., Трошина Е.А., Саранцева К.А., Харкевич Г.Ю., Волконский М.В., Елфимова А.Р. Индекс массы тела как возможный предиктор развития эндокринных иммуноопосредованных нежелательных явлений на фоне терапии ингибиторами контрольных точек иммунного ответа. Ожирение и метаболизм. 2024;21(1):42-57. https://doi.org/10.14341/omet13044
For citation:
Glibka A.A., Mazurina N.V., Troshina E.A., Sarantseva K.A., Kharkevich G.Yu., Volkonskii M.V., Elfimova A.R. Body mass index as a possible predictor of the development of endocrine immune-mediated adverse events during immune checkpoint inhibitors therapy. Obesity and metabolism. 2024;21(1):42-57. (In Russ.) https://doi.org/10.14341/omet13044

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































