Перейти к:
Ожирение и нервная система
https://doi.org/10.14341/omet13019
Аннотация
В статье обсуждаются чрезвычайно актуальные в связи с пандемическим распространением ожирения аспекты взаимосвязи неврологических заболеваний и метаболических нарушений. Подробно рассмотрен патогенез поражения нервной системы (НС). Показано влияние основных обменных факторов на развитие цереброваскулярных заболеваний (ЦВЗ), в т.ч. нейровоспаления, изменение гемостаза и др. Освещена проблема развития когнитивной дисфункции на фоне ожирения за счет формирования атрофических процессов в структурах мозга. Описаны современные возможности оценки и модулирования пищевого поведения за счет стимуляции головного мозга с применением функциональной магнитно-резонансной томографии (фМРТ) и навигационной ритмической транскраниальной магнитной стимуляции (рТМС).
Представлена проблема цереброметаболического здоровья как единство метаболических и церебральных изменений. Механизмы взаимодействия двух важнейших систем организма позволяют рассматривать возникающие в них изменения в качестве целостной нейроэндокринной альтерации.
Ключевые слова
Для цитирования:
Антонова К.В., Танашян М.М., Раскуражев А.А., Спрышков Н.Е., Панина А.А., Лагода О.В., Аметов А.С., Трошина Е.А. Ожирение и нервная система. Ожирение и метаболизм. 2024;21(1):68-78. https://doi.org/10.14341/omet13019
For citation:
Antonova K.V., Tanashyan M.M., Raskurazhev A.A., Spryshkov N.E., Panina A.A., Lagoda O.V., Ametov A.S., Troshina E.A. Obesity and the nervous system. Obesity and metabolism. 2024;21(1):68-78. (In Russ.) https://doi.org/10.14341/omet13019
Нервная система (НС) и метаболизм неразрывно связаны. Регуляция гомеостаза осуществляется структурами головного мозга. В свою очередь жировая ткань и сигнальные пути, связанные с поступлением и аккумуляцией энергетических субстратов, оказывают воздействие на НС, а механизмы метаболических нарушений и неврологических расстройств тесно переплетены.
Пандемическое распространение ожирения неуклонно и стремительно увеличивается [1], бросая вызов нашему представлению о нормальном функционировании человеческого организма и создавая серьезную проблему для общественного здравоохранения. Распространенность ожирения утроилась с 1975 г. В настоящее время 30% населения мира имеют ожирение или избыточную массу тела [1]. Из числа лиц трудоспособного населения нашей страны около 40 млн человек больны ожирением [2]. Распространенность ожирения в России отражает общемировые тенденции. Так, среди мужчин этот показатель возрос с 10,8 в 1993 г. до 27,9% в 2017 г., среди женщин — с 26,4 до 31,8% соответственно [3]. Поданным скрининга популяции трудоспособного возраста 40–59 лет, ожирение отмечено у трети обследованных лиц, а в сумме с избыточным весом составляет 67% наблюдений [4].
Из-за множества прямых и косвенных последствий ожирения, вызывающих дисфункцию многих тканей и органов, результирующие изменения весьма разнообразны [2]. Большую медико-социальную значимость имеет развитие и прогрессирование широкого спектра неврологических расстройств, возникающих в исходе патологических процессов, связанных с ожирением [1][3][4]. В совокупности эти нарушения требуют оценки сложной взаимосвязи между ожирением и нарушениями со стороны НС, включая головной мозг.
В этой связи целью настоящего обзора стало обобщение представлений о взаимосвязи НС и метаболических нарушений, прямых и опосредованных механизмах влияния ожирения на развитие и прогрессирование цереброваскулярных заболеваний (ЦВЗ) и ряда других неврологических расстройств.
РАЗДЕЛ 1
Ожирение представляет собой каскад процессов, запускаемых нарушением ряда сигналов в условиях избыточной энергетической ценности поступающей пищи. Нарушение функции кортиколимбической системы награды, обеспечивающей получение удовольствия от пищи, богатой жирами и углеводами, играет важнейшую роль в эпидемии ожирения. Известно, что гипоталамус интегрирует сигналы, отражающие долгосрочные запасы и краткосрочные поступления энергетических субстратов, что приводит к изменению контроля питания, физической активности и основного расхода энергии. Однако все больше данных указывают на многофакторные социальные, нейро-поведенческие и метаболические детерминанты потребления пищи, влияющие на риск ожирения. Вознаграждающая пища через подкрепляющий эффект стимулирует не только метаболические, но и стрессовые гормоны, которые, в свою очередь, захватывают эмоциональные (лимбические) и мотивационные (стриатальные) пути мозга, способствуя чрезмерному потреблению пищи. Кроме того, обсуждается влияние высоких уровней стресса, а также изменения чувствительности к инсулину на процессы самоконтроля в префронтальной коре головного мозга, которые регулируют эмоциональные, мотивационные и висцеральные гомеостатические механизмы потребления пищи и риск ожирения [5].
Ключевую роль в поддержании энергетического гомеостаза играет гипоталамус, который регулирует потребление пищи и расход энергии, воспринимая циркулирующие питательные вещества и гормоны через срединное возвышение. Этот эффект более значим в нейронах, вырабатывающих проопиомеланокортин (ПОМК) [6]. В частности, ПОМК является общим предшественником многих нейропептидов, включая α-меланоцитстимулирующий гормон (α-МСГ), β-эндорфин и адренокортикотропный гормон (АКТГ). Нейропептид α-MСГ, полученный из ПОМК, связывается с рецептором меланокортина-4 в головном мозге, что приводит к уменьшению потребления пищи и увеличению расхода энергии (через симпатическую НС) после интеграции центральных нейронных и периферических сигналов. Возбудимость нейронов ПОМК регулируется в ответ на изменения уровней метаболических маркеров, в частности, глюкозы [7]. Нейроны ПОМК получают как центральные сигналы, такие как α-МСГ, β-эндорфин и АКТГ, так и периферические сигналы: лептин, инсулин, адипонектин, глюкагоноподобный пептид-1 и глюкагоноподобный пептид-2, влияющие на метаболизм глюкозы через соответствующие рецепторы и родственные сигнальные пути. Нарушения в этих процессах могут привести к ожирению [8].
Инсулин выполняет две важные функции в гипоталамусе: подавление приема пищи и улучшение метаболизма глюкозы. Киназы IκB и JNK (англ. c-Jun N-terminal kinase) являются основными участниками пути воспаления, который активируется насыщенными жирными кислотами, индуцирующими резистентность гипоталамуса к инсулину. Тирозинфосфатазы, активирующиеся при хроническом переедании, дефосфорилируют рецептор инсулина и его белки-субстраты, вызывая гипоталамическую инсулинорезистентность. Длительная гиперинсулинемия при избыточном питании активирует киназный путь mTOR/S6 (Мишень рапамицина млекопитающих/киназа S6), тем самым усиливая фосфорилирование серина субстрата инсулинового рецептора-1, способствуя резистентности гипоталамуса к инсулину [9].
Продуцируемый белой жировой тканью лептин передает информацию о запасе энергии от жировой ткани к мозгу, в частности, к гипоталамусу. При ожирении повышение уровня лептина сопровождается нарушением его сигналинга (т.е. лептино-резистентность) и транспорта через гематоэнцефалический барьер (ГЭБ) [10-12]. Ранние модели предполагали, что лептин регулирует энергетический баланс путем прямого воздействия на нейроны ПОМК. Однако эта точка зрения резко изменилась с появлением доказательств того, что нейроны ПОМК очень гетерогенны. Современные исследования показали, что нейроны ПОМК являются прямыми мишенями лептина для контроля метаболизма глюкозы, но не потребления пищи. С эволюционной точки зрения ожирение не является остро опасным состоянием, в отличие от голодания, поэтому нехватка лептина является более критической, чем избыток [13][14]. Однако это не умаляет важности ПОМК, который играет ключевую роль в контроле энергетического баланса. В свою очередь, анорексигенные эффекты лептина опосредованы другими чувствительными к лептину, не-ПОМК популяциями нейронов, связанными с рецепторами гамма-аминомасляной кислоты; также анорексигенные эффекты лептина могут опосредоваться ПОМК-нейронами косвенно [15]. Таким образом, результаты исследований предполагают участие различных популяций нейронов, опосредующих специфические эффекты лептина [14][16].
Ожирение в значительной степени связано с дисбалансом симпатического и парасимпатического отделов НС. В аркуатном ядре гипоталамуса орексигенные нейроны, содержащие агути-родственный пептид и нейропептид Y (НПY), воспринимают через полупроницаемый гематоэнцефалический барьер периферические сигналы нехватки энергии, такие как снижение уровня глюкозы или повышение уровня грелина [17]. НПY является важным модулятором питания и расхода энергии; регулируется серией периферических нервных и гуморальных сигналов, реагирующих на восприятие питательных веществ; его роль в энергетическом балансе тесно связана с энергетическим статусом – функцией митохондрий. Воздействуя на симпатическую нервную систему, НПY модулирует термогенез и липолиз. Нарушение регуляции системы НПY, происходящее при ожирении, способствует митохондриальной дисфункции и оксидантному стрессу [18].
Ожирение в целом ассоциировано с воспалением. Последнее при ожирении может обнаруживаться в гипоталамусе раньше, чем в жировой ткани или периферической крови. Срединное возвышение не защищено гематоэнцефалическим барьером, что способствует его уязвимости к свободным жирным кислотам и воспалительным адипокинам (например, лептин, резистин, хемерин). Ранние маркеры системного воспаления, связанного с ожирением (в частности, фактор некроза опухолей — α [ФНО-α]), и признаки активации микроглии обнаруживаются в аркуатном ядре гипоталамуса. Микроглия экспрессирует толл-подобные рецепторы (TLR), которые распознают длинноцепочечные жирные кислоты. Активация этих рецепторов способствует продукции провоспалительных цитокинов, что приводит к распространению воспаления и стимулированию процесса глиоза в гипоталамусе [11]. Гипоталамическое нейровоспаление, промотирующее глиоз и нейрональную смерть [19], может быть основано в т.ч. на эффектах лептина и инсулина, а также факторов, которые могут действовать через систему ПОМК: SMAD7 (Suppressor of Mothers Against Decapentaplegic 7), факторы, индуцируемые гипоксией (Hypoxia-Inducible Factors, HIF), сиртуин 6 и коактиватор стероидных рецепторов-2 [8].
Глиоз развивается в качестве физиологической адаптивной и защитной реакции на повреждения, вызванные нейровоспалением. Глиоз — это неспецифическое реактивное изменение глиальных клеток в ответ на любое повреждение ЦНС, и этот ответ включает пролиферацию нескольких различных типов глиальных клеток. Он возникает при ожирении и в основном происходит в гипоталамусе, вызывая потерю нейронов в медиобазальном гипоталамусе, который широко связан с инфундибулярным ядром или аркуатным ядром гипоталамуса, ответственным за функции, связанные с весом и энергетическим гомеостазом. В этих структурах мозга расположены нейроны, отвечающие за энергетический баланс, продуцирующие ПОМК, агути белок и НПY [20].
Исследования — как гистопатологические (посмертные), так и проведенные in vivo нейровизуализационные — с измерением маркеров микроструктуры ткани, подтверждают присутствие воспаления и глиоза гипоталамуса у лиц с ожирением (рис. 1) [21].
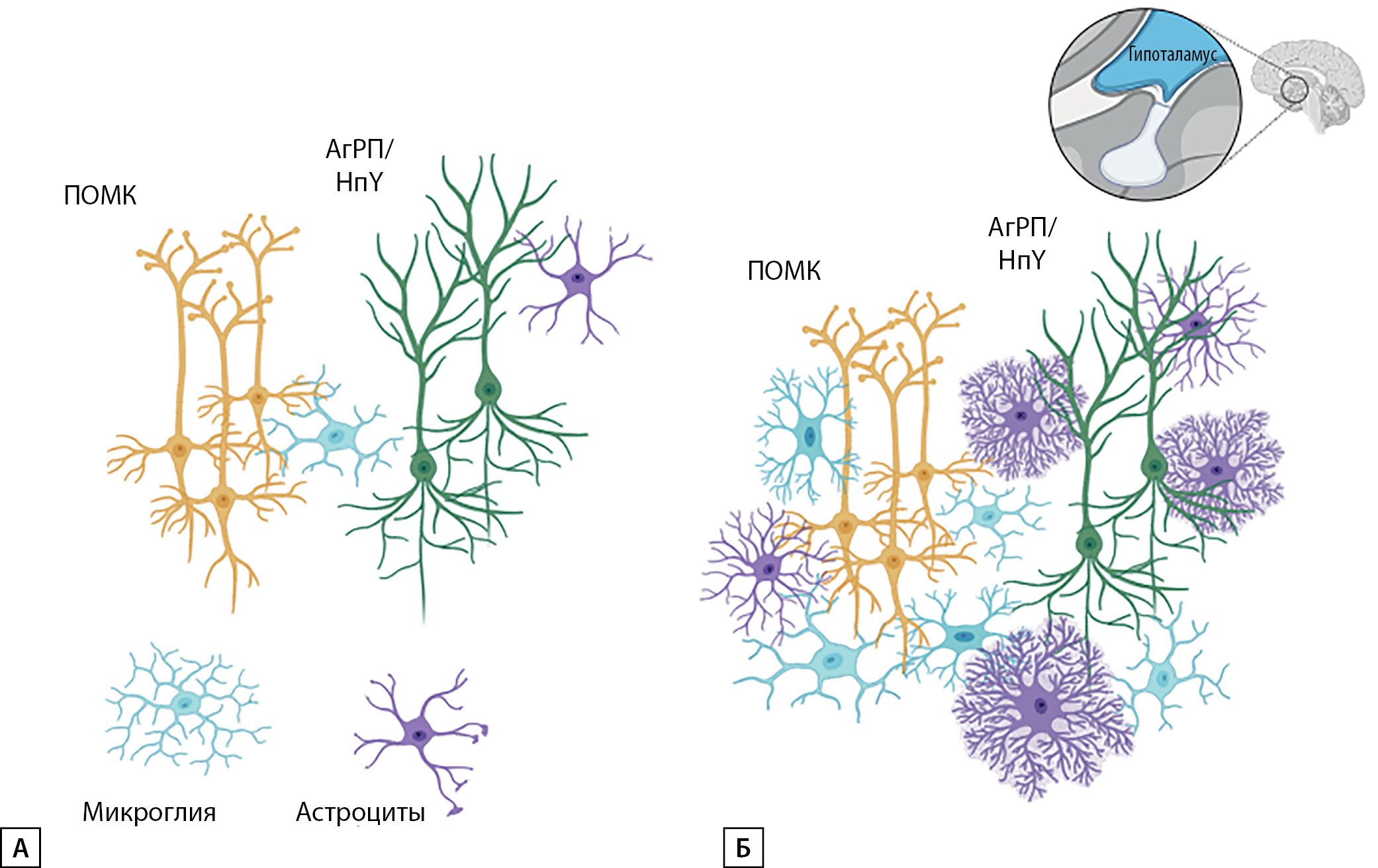
Рисунок 1. Модель гипоталамического глиоза у человека (создано на основанаии статьи Sewaybricker LE, Huang A, Chandrasekaran S, Melhorn SJ, Schur EA. The Significance of Hypothalamic Inflammation and Gliosis for the Pathogenesis of Obesity in Humans [21]).
А — нейроны гипоталамуса в норме взаимодействуют с популяцией микроглии и астроцитов; Б — пролиферация популяции гипоталамической микроглии и астроцитов в условиях ожирения.
Figure 1. Model of hypothalamic gliosis in humans (based on the article Sewaybricker LE, Huang A, Chandrasekaran S, Melhorn SJ, Schur EA. The Significance of Hypothalamic Inflammation and Gliosis for the Pathogenesis of Obesity in Humans [21]).
A — hypothalamic neurons normally interact with the population of microglia and astrocytes; B — proliferation of the population of hypothalamic microglia and astrocytes in case of obesity.
Интегративность ядер мозга, регулирующих аппетит и чувство насыщения, изменяется не только под воздействием нейровоспаления, но и в ассоциации с такими актами высшей нервной деятельности, как память и познание [22]. В свою очередь гипоталамическое нейровоспаление модулирует контроль над чувством сытости, тем самым еще больше увеличивая риск развития ожирения [5].
Итак, развитие инсулино- и лептинорезистентности наряду с глиальной активацией и последующим высвобождением провоспалительных медиаторов изменяет активность орексигенных (агути-родственный пептид и НПY) и анорексигенных (ПОМК) нейронов, нейронов гипоталамуса. Изменения гипоталамической регуляции гомеостаза, включающие в том числе и усиление продукции НПY, являющегося не только мощным стимулятором аппетита, но и активатором симпатической НС, приводит к дальнейшему увеличению потребления пищи при снижении возможности утилизации источников энергии. Эти процессы результируют прогрессивным течением ожирения и способствуют развитию хронического системного воспаления и изменениям НС.
РАЗДЕЛ 2. ПАТОГЕНЕЗ ПОРАЖЕНИЯ НЕРВНОЙ СИСТЕМЫ
При ожирении отмечаются изменения как центральной (ЦНС), так и периферической НС. В первую очередь это ЦВЗ и нейродегенеративные процессы и связанные с ними когнитивные нарушения (КН). В основе процессов повреждения НС лежат несколько механизмов. К прямым механизмам можно отнести липотоксичность, индуцированную повышенным уровнем свободных жирных кислот, которая приводит к неврологической дисфункции и нейродегенерации. Кроме прямых механизмов, на неврологический дефицит могут влиять и другие компоненты. Так, существует тесная связь между инсулинорезистентностью и снижением когнитивных функций [11]. Важнейшим фактором поражения ЦНС может стать сосудистое повреждение при ожирении.
Влияние нейровоспаления на центральную и периферическую нервную систему
Нейровоспаление, ассоциированное с ожирением, представляет собой хроническое асептическое воспаление ЦНС, которое характеризуется системными характеристиками, связанными с повышением уровня провоспалительных цитокинов, таких как интерлейкин-1бета (ИЛ-1β) и интерлейкин-18 (ИЛ-18), а также наличием активации микроглии и реактивного астроглиоза, а также изменением регуляции образования инфламмасомы NLRP3 [19].
При длительно текущем нейровоспалении нарушаются существующие защитные барьеры, что приводит к развитию нейродегенеративных расстройств. Так, в норме ГЭБ препятствует попаданию в головной мозг воспалительных клеток крови, но при длительно текущем воспалении проницаемость ГЭБ повышается, нейтрофилы и моноциты достигают тканей мозга, способствуя усилению инфламматорных процессов.
Избыточный адипогенез часто сопровождается вялотекущим воспалением и иммунным ответом, секрецией адипокинов и высвобождением жирных кислот, которые могут поддерживать активацию иммунных клеток [23]. Повышенный уровень свободных жирных кислот (СЖК) при ожирении приводит к снижению нейротрофической поддержки и усилению нейродегенерации периферических нервов. Длинноцепочечные жирные кислоты и медиаторы воспаления напрямую повреждают нейроны корешковых ганглиев, окончания кожных нервных волокон и гематоневрального барьера. По мере его повреждения аксоны и шванновские клетки становятся более уязвимы, что промотирует воспаление. В совокупности все эти изменения приводят к трансформации функции и структуры нерва, способствуя развитию полинейропатии [11]. С другой стороны, продемонстрирована связь дисрегуляции адипогенеза с патогенезом периферической нейропатии, которая может быть опосредована иммунной инфильтрацией [24][25]. Снижение веса с помощью бариатрической хирургии приводит к уменьшению проявлений нейропатии и регенерации тонких нервных волокон, по данным конфокальной микроскопии роговицы у людей с ожирением как в сочетании с сахарным диабетом (СД) 2 типа, так и без него [25].
Ожирение ассоциировано с дислипидемией, которая в свою очередь пагубно воздействует на нервные волокна, что ведет к соматической и вегетативной нейропатии за счет митохондриальной дисфункции [26]. Поскольку нейроны зависят от снабжения энергией и особенно восприимчивы к митохондриальным нарушениям, условия, препятствующие нормальной динамике и функции митохондрий, могут привести к дисфункции аксонов, повреждению и гибели сенсорных нейронов. Повышенный уровень насыщенных жирных кислот (НЖК), связанный с дислипидемией, в чувствительных нейронах нарушает функцию митохондрий, вызывая их деполяризацию, нарушая биоэнергетику и ухудшая аксональный транспорт. Это приводит к снижению содержания АТФ-нейронов и апоптозу [26].
Итак, при ожирении развитие и прогрессирование поражений центральной и периферической НС связано с нейровоспалением и нейродегенерацией, которые ассоциированы с избыточным адипогенезом, дислипидемией и нарушением проницаемости гематоэнцефалического и гематоневрального барьеров.
Ожирение как фактор риска цереброваскулярных заболеваний
Сосудистые заболевания головного мозга представляют важнейшую медико-социальную проблему вследствие высокой распространенности и тяжелых последствий для состояния здоровья населения. Заболеваемость составляет 864,9 на 100 тысяч человек [27]. Ожирение тесно ассоциировано с цереброваскулярными заболеваниями (ЦВЗ). Распространенность ожирения у пациентов с ЦВЗ составляет от 18 до 50% [27][28].
Абсолютное число случаев инсульта в мире увеличилось на 70,0% (67,0–73,0) с 1990 по 2019 гг., смертность от инсульта увеличилась на 43,0% (31,0–55,0), а годы жизни с поправкой на инвалидность (disability-adjusted life-years (DALY) вследствие инсульта увеличились на 32,0%. С 1990 по 2019 гг. уровень показателя DALY, связанный с инсультом из-за факторов риска, увеличился с 91,5 млн (85,8–98,3) до 125 млн (115–134). Самым быстрорастущим фактором риска инсульта в период с 1990 по 2019 гг. был высокий индекс массы тела, вклад которого возрос с 15,4 (8,2–24,2) до 24,3% (15,7–33,2) (увеличение составило 57,8%) [29]. На метаболические факторы (высокое систолическое АД, индекс массы тела (ИМТ), гликемия, холестерин и низкая СКФ) приходится 72% DALY инсульта [30].
При увеличении ИМТ на 1 кг/м2 увеличивается риск ишемического инсульта в среднем на 5%. Во всех возрастных категориях повышение ИМТ ассоциировано с увеличением риска инсульта, но в наибольшей степени — у молодых пациентов. Однако традиционный подход к ожирению, как фактору риска инсульта пересматривается. Результаты исследования менделевской рандомизации продемонстрировали причинное влияние ожирения на все кардиоваскулярные показатели, кроме инсульта [31], что ставит вопрос дифференцированного подхода к фенотипам ожирения при рассмотрении риска сосудистого повреждения головного мозга. Показатели центрального ожирения (окружность талии, соотношение талии и бедер, соотношение талии и роста) являются лучшими предикторами ЦВЗ. Пагубные последствия абдоминального ожирения связаны с дисфункцией висцеральной жировой ткани, которая, в свою очередь, коррелирует с традиционными факторами риска сосудистых заболеваний - инсулинорезистентность, системное воспаление, дислипидемия, артериальная гипертензия (АГ) [28]. Так, абдоминальное ожирение повышает риск ЦВЗ частично независимо от АД и полностью независимо от гликемии. Ключевую роль метаболических факторов в генезе ЦВЗ подтвердили результаты опубликованного в 2021 г. большого норвежского исследования (включавшего более 35 тыс. человек), по результатам которого ожирение само по себе не являлось независимым фактором риска инсульта, что также изменяет наши представления о сосудистых факторах риска. Показано, что риск в большей степени определяется не фактом повышения массы тела, а ассоциирован с метаболическим «нездоровьем». Последнее определяется по наличию увеличения окружности талии и двух из следующих факторов: АГ, дислипидемия, снижение ЛПВП, повышение ТГ и ЛПНП, СД (де факто — абдоминальным ожирением, проатерогенным сдвигом липидограммы, гипергликемией и наличием инсулинорезистентности) [32].
Все больший интерес в ангионеврологии привлекает так называемый «парадокс ожирения». Отмечено, что у пациентов с ожирением, которые пережили первый инсульт, наблюдаются более благоприятное течение ЦВЗ и меньшие показатели долгосрочной смертности после инсульта. При рассмотрении факторов, повлиявших на такой, на первый взгляд противоречивый результат, оказалось, что хороший исход у больных инсультом и ожирением был ассоциирован с более молодым возрастом (менее 55 лет). У этих больных отмечался лучший профиль факторов риска (курение, дислипидемия, гипергликемия) по сравнению с пациентами с нормальным ИМТ [28][33]. Таким образом, проблема «парадокса ожирения» при ЦВЗ требует дальнейшего изучения.
Одновременный эпидемический рост заболеваемости СД и ожирением неизбежно негативно влияет на результат усилий мирового сообщества по предотвращению бремени инсульта и СД. Инсулинорезистентность, глюкозо- и липотоксичность создают условия не только для развития атеротромбоза, повышают риск инсульта, но и ухудшают прогноз ЦВЗ, в том числе за счет инициации и нарастания КН [34].
Помимо этого, важными факторами риска ЦВЗ, напрямую связанными с ожирением, являются АГ, фибрилляция предсердий и обструктивное апноэ сна, которые распространены у лиц с избыточной массой тела [28]. Повышение систолического артериального давления на каждые 10 мм рт.ст. увеличивает риск ишемического инсульта на 30%.
Кардиометаболическим нарушениям способствует связанное с ожирением воспаление. Адипокины могут оказывать прямое или опосредованное влияние на НС [10][11].
Дисфункция жировой ткани приводит к развитию хронического слабовыраженного воспаления, которое является важнейшим пусковым фактором других метаболических и воспалительных нарушений. У людей с ожирением отмечаются иммунные реакции в жировой ткани, включая увеличение популяций иммунных клеток и качественные изменения в функции этих клеток [35]. Воспаление жировой ткани характеризуется повышенной экспрессией субстанций, обладающих провоспалительными свойствами (С-реактивный белок, интерлейкин-1 (ИЛ-1), ИЛ-6, ИЛ-1b, ФНО-а, лептин). Кроме того, в условиях инсулинорезистентности нарушается клиренс циркулирующих свободных жирных кислот (СЖК). Избыток системных СЖК и пищевых липидов попадает внутрь клеток нежировых органов и откладывается в виде эктопического жира, вызывая липотоксичность [36]. Глюкозо- и липотоксичность играют немаловажную роль в развитии ЦВЗ [37].
Важную роль играет адипонектин, который в норме оказывает инсулиносенсибилизирующее и противовоспалительное действие. В отличие от большинства адипокинов, уровень адипонектина в плазме крови обратно пропорционален ожирению и резистентности к инсулину. Еще одним адипокином является резистин, который преимущественно секретируется макрофагами. Повышение его уровня связано с развитием инсулинорезистности и СД, а также с дисфункцией эндотелия, пролиферацией гладкомышечных клеток сосудов, образованием пенистых клеток и воспалением артерий, что в свою очередь способствует генезу атеросклероза. Так, ангиотензиноген, продуцируемый жировой тканью, является предшественником ангиотензина и способствует развитию АГ, важнейшего фактора рисканарушений мозгового кровообращения.
Накопление висцерального жира сопровождается гормональными, воспалительными и эндотелиальными альтерациями (в том числе повышение уровня СЖК, ангиотензина 2, фактора некроза опухолей альфа, ингибитора активатора плазминогена, фактора роста эндотелия сосудов). Активация этих механизмов увеличивает инсулинорезистентность, стимулирует симпатическую нервную систему и ренин-ангиотензиновую систему. Также эти механизмы вызывают нарушения баро- и хеморефлекса кардиоваскулярного контроля, эндотелиальную дисфункцию и задержку натрия, что в совокупности детерминирует повышение АД и увеличивает риск сосудистых событий: ишемического и геморрагического инсульта. Отражением этого механизма является тот факт, что распространенность АГ почти в 3 раза выше при ожирении, чем у людей с нормальной массой тела [38][39].
Кроме того, ожирение является независимым фактором риска фибрилляции предсердий: увеличение ИМТ на 5 кг/м2 повышает риск выявления ФП на 20–30% [38]. Такие факторы, как дизавтономия, механизмы развития которой при ожирении рассмотрены выше, изменение метаболического профиля с развитием инсулинорезистентности, воспаления и традиционные факторы кардиоваскулярного риска способствую развитию целого спектра кардиальной патологии, ассоциированной с ЦВЗ. Необходимо учитывать неблагоприятные механические эффекты увеличения массы жировой ткани и ее эктопии (апноэ сна). Синдром нарушения дыхания во сне является фактором риска ССЗ, в частности острых нарушений мозгового кровообращения, а также ассоциирован с повышением смертности, обусловленной инсультом [38].
Ожирение и гемостаз при цереброваскулярных заболеваниях
Большое число факторов риска ЦВЗ реализуются неблагоприятным профилем риска ишемического инсульта посредством изменений системы гемостаза – одного из важнейших факторов, играющих роль при всех патогенетических подтипах сосудистой патологии мозга. Активация тромбоцитов и коагуляции являются ключевым процессом, наряду с эндотелиальной дисфункций, которые ведут к развитию тромботического церебрального события [40].
Метаболическая патология (в первую очередь нарушения углеводного обмена), согласно проведенным нами исследованиям, значимо ассоциирована с изменением гемостазиологических и гемореологических свойств при ЦВЗ. Так, при острых нарушениях мозгового кровообращения отмечена статистически значимая зависимость уровня фибриногена (r=0,29), индекса фибринолиза (r=-0,30) и D-димера от значений HbA1c (r=0,36) [34]. При хронических формах ЦВЗ такой маркер, как конечные продукты гликирования, также был негативно ассоциирован с показателями гемореологии и гемостаза.
Большой пул исследований, посвященный проблеме сосудистой патологии мозга на фоне такой коморбидной ассоциации, как метаболический синдром, продемонстрировал однонаправленные изменения гемореологических и гемостазиологических показателей в сторону гиперкоагуляции и прогрессирования протромбогенного потенциала, причем степень этих изменений усугубляется по мере увеличения компонентов метаболического синдрома [41]. Так, было показано, что у пациентов как с острыми, так и с хроническими ЦВЗ, на фоне метаболического синдрома повышается агрегация тромбоцитов под влиянием АДФ.
Многочисленные исследования подтверждают, что ожирение повышает риск развития тромботических осложнений, включая острый инфаркт миокарда, инсульт, тромбоз вен [42]. В норме периваскулярная жировая ткань накапливается вокруг сосудов и обеспечивает структурную поддержку сосудов, а также влияет на гемостаз, высвобождая многочисленные адипокины. Непропорциональное увеличение массы периваскулярной жировой ткани при ожирении увеличивает высвобождение воспалительных адипокинов при одновременном снижении адипонектина, вызывая воспаление и дисфункции сосудов [39]. При ожирении жировая ткань индуцирует поляризацию макрофагов М2 в сторону провоспалительного фенотипа М1 и переключает клетки Т-хелперы Th2 на типы Th1 и Th17, тем самым вызывая системный воспалительный ответ, нарушение эндотелиальной функции. Макрофаги жировой ткани M1 также секретируют тканевой фактор, который в сочетании с усиленным синтезом факторов VII и VIII увеличивает риск коагуляции. С другой стороны, тучная жировая ткань высвобождает более низкие уровни адипонектина, способствуя повышению восприимчивости тромбоцитов к агрегации, а также сверхсекретирует PAI-1, ограничивая фибринолиз. Все вместе эти состояния способствуют протромботическому состоянию при ожирении. У пациентов с ЦВЗ состояние гемореологии и изменения системы гемостаза находятся во взаимосвязи с увеличением площади висцерального жира [43].
Ожирение и когнитивные функции
Появляется все больше данных, свидетельствующих о том, что ожирение предрасполагает к развитию КН, которые характеризуются дефицитом одной или нескольких из шести когнитивных областей: речи, памяти, внимания, социального/эмоционального, исполнительного и зрительно-пространственного функционирования. Несколько факторов, включая старение, генетику, сердечно-сосудистые и метаболические заболевания, оказывают влияние на риск развития деменции. По причине старения населения и того факта, что деменция в первую очередь поражает людей >60 лет, в мире ожидается увеличение случаев деменции с 57 миллионов в 2019 г. до >150 миллионов в 2050-м [44]. Одним из наиболее быстро растущих факторов риска развития деменции считается ожирение.
Ожирение способствует КН за счет метаболических, гормональных и сосудистых механизмов. У пациентов с ожирением в белом и сером веществе головного мозга отмечается ряд изменений: уменьшение серого вещества в гиппокампе, префронтальной коре и других подкорковых областях. Эти различия были приписаны исключительно ожирению, поскольку было показано, что они все еще присутствуют даже после контроля состояний, связанных с ожирением, включая СД [45-47]. Атрофия гиппокампа в данном случае имеет особое значение, поскольку связана с болезнью Альцгеймера.
Ожирение связано с ухудшением когнитивных функций и у пациентов среднего возраста — повышается риск легких когнитивных нарушений; ухудшается кратковременная память и исполнительные функции. Также отмечается связь ожирения, особенно висцерального, с депрессией, тревогой и нарушениями сна [48].
Ожирение неоднородно влияет на риск развития деменции на разных этапах жизни (например, в среднем и позднем зрелом возрасте) [49]. По данным некоторых исследований, ожирение в возрасте 50 лет является фактором риска развития деменции, но в возрасте 60 и 70 лет такой связи не отмечалось. Такие результаты могут объясняться тем, что вес начинает снижаться за несколько лет до начала клинических проявлений деменции. Отношения рисков при увеличении ИМТ на 5 кг/м2 для деменции составили 0,71 (95% доверительный интервал = 0,66–0,77), 0,94 (0,89–0,99) и 1,16 (1,05–1,27), когда ИМТ оценивался за 10 лет, 10–20 лет. лет и >20 лет до постановки диагноза деменция, соответственно [50].
Воспаление и окислительный стресс, ассоциированные с ожирением, могут нарушить локальную доставку кислорода и питательных веществ из сосудистого русла к активным нейронам, что может привести к нейрональной дисфункции. Изменения нейроваскулярной единицы относят к механизмам развития КН [51].
На прогрессирование деменции могут влиять не только внутренние факторы головного мозга, но и ось кишечник-мозг, которая описывает взаимодействие между кишечной микробиотой, кишечной нервной системой и ЦНС. Кишечник и мозг имеют динамическую взаимосвязь в развитии КН через нервные, эндокринные, метаболические и иммунные пути при дисбиозе. Бактериальные эндотоксины и провоспалительные факторы могут посылать сенсорную информацию через вагальные афферентные волокна в ЦНС, что влияет на поведение и ухудшает когнитивные функции [51]. Окисидантный стресс, вызванный нарушением структуры кишечной микробиоты, является одним из ключевых механизмов, способствующих нейровоспалению [52]. Определение точного вклада кишечного микробиома в КН является сложной задачей и требует дальнейшего изучения, поскольку дисбиоз также влияет на метаболические, сердечно-сосудистые, желудочно-кишечные и нейроиммунные заболевания [53].
Согласно проведенным нами ранее исследованиям, у больных с ЦВЗ чаще отмечались умеренные и выраженные когнитивные нарушения. Была отмечена обратная взаимосвязь между ИМТ, окружностью талии и результатами нейропсихологического тестирования. Описан паттерн ЦВЗ при ожирении в сочетании СД, который проявляется нейрокогнитивной дисфункцией по результатам нейропсихологического тестирования, нейрофизиологического и нейровизуализационного исследований [34].
Вышесказанное позволяет выделить в качестве отдельной формы междисциплинарной коморбидности термин «цереброметаболическое нездоровье», который, на наш взгляд, может стать следующей ступенью к созданию более целостной картины многообразия метаболических процессов, ассоциированных с цереброваскулярными (и не только) заболеваниями. К очевидным достоинствам подобного подхода следует отнести: повышение интереса неврологов и эндокринологов к проблеме (или мультидисциплинарность); персонализацию диагностики и терапии данной когорты больных; повышение научной (как фундаментальной, так и клинической) составляющей.
Обобщение механизмов неврологических нарушений во взаимосвязи с метаболическими расстройствами («цереброметаболическое нездоровье») представлено на рисунке 2.
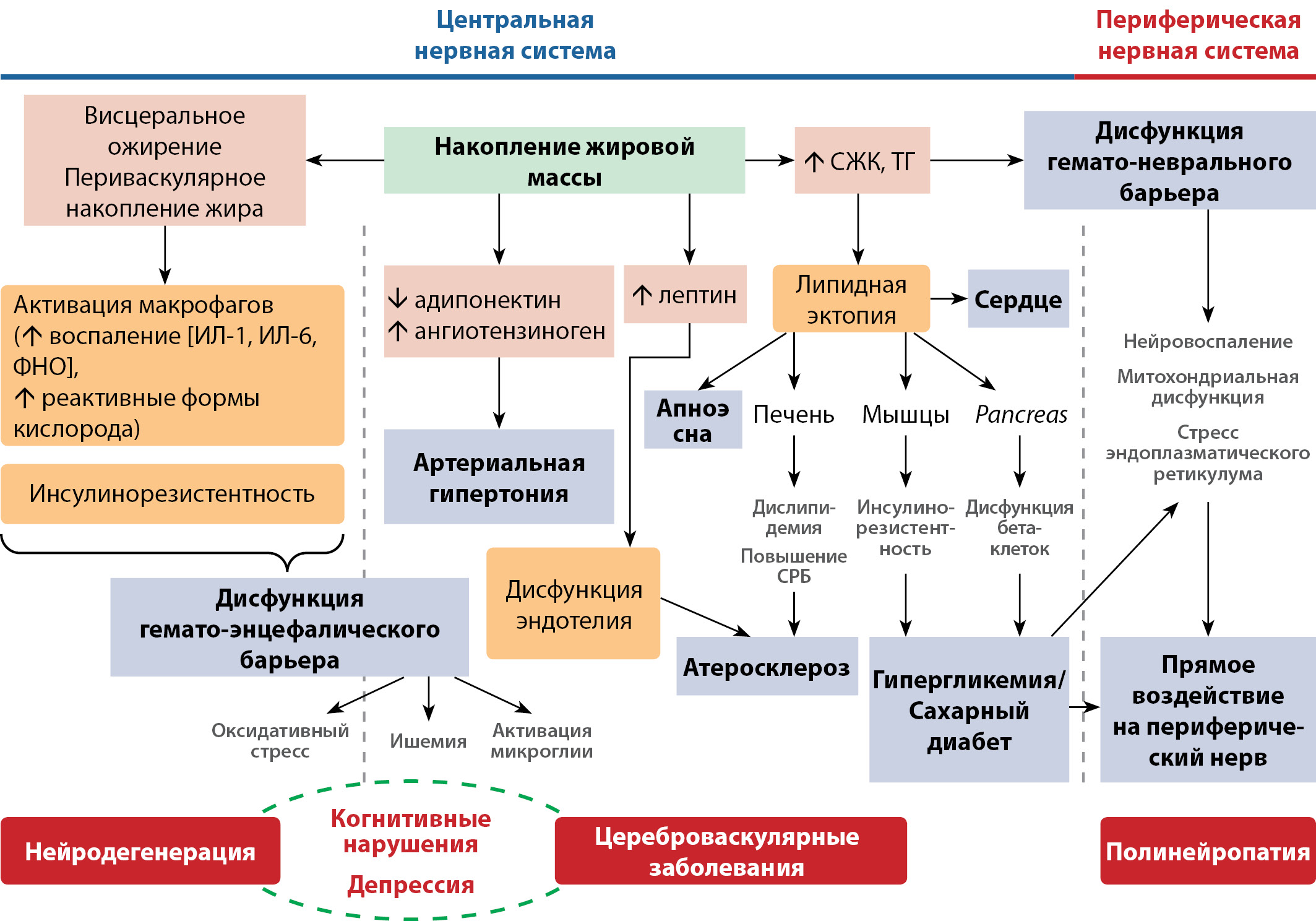
Рисунок 2. Патогенез неврологических заболеваний при ожирении.
Figure 2. Pathogenesis of neurological diseases in obesity.
Хроническое слабовыраженное воспаление в долгосрочной перспективе может привести к нейродегенеративным заболеваниям. Нейровоспаление или глиоз у пациентов с ожирением связаны с действием адипокинов, высоким уровнем липидов и глюкозы, которые увеличивают выработку свободных радикалов. Церебральный глиоз — фактор риска развития нейродегенеративных заболеваний [20]. Микроглиоз, вызванный диетой, был подтвержден в клинических и лабораторных исследованиях нейродегенеративных заболеваний, таких как болезнь Альцгеймера и Паркинсона, и обеспечивает возможную связь между ожирением/СД 2 типа и ускоренным снижением когнитивных способностей [54]. Люди с ожирением подвержены большему риску развития возрастного когнитивного снижения, сосудистой деменции, легкого КН, болезни Альцгеймера, а также болезни Паркинсона и Гентингтона [55].
Эпилепсия — распространенное заболевание, также связано с ожирением во всех возрастных группах. Риск лекарственно-резистентной эпилепсии также выше среди больных с ожирением [56], что требует дополнительного изучения.
Рассеянный склероз (РС) — хроническое воспалительное заболевание ЦНС, поражающее молодое трудоспособное население, связанное с факторами окружающей среды и образа жизни. Избыточный вес и ожирение играют важную роль в развитии РС. Популяционные исследования свидетельствуют о том, что распространенность РС увеличивается во всем мире аналогично тенденциям для ожирения. Повышенный ИМТ в возрасте 15 лет и ожирение в возрасте 20 лет увеличивают риск развития РС (OР=2,16, P=0,01 и OР=3,9, P=0,01) [57]. У больных РС ожирение в подростковом возрасте было связано с более высоким уровнем инвалидности, что сопровождалось повышенными нейровоспалением и атрофией серого вещества [57].
Новые методы диагностики
Понимание нейрональных механизмов регуляции питания является первостепенной задачей в оценке пищевого поведения в норме и при ожирении. Помочь понять нейробиологические основы различий в пищевом поведении могут современные методы нейровизуализации, один из которых — функциональная магнитно-резонансная томография (фМРТ). Была разработана простая в использовании и воспроизводимая зрительная фМРТ-парадигма для оценки системы контроля пищевого поведения у здоровых добровольцев. С ее помощью у данной группы исследуемых выявлены компоненты всех трех звеньев пищевой регуляторной системы и выделена зона интереса — дорсолатеральная префронтальная кора (ДЛПФК).
Центральная регуляция пищевого поведения осуществляется при активном участии префронтальной коры. Воздействие на эту область (с помощью неинвазивной стимуляции головного мозга) может стать одним из перспективных способов моделирования пищевого поведения. Такое воздействие может быть оказано с помощью навигационной ритмической транскраниальной магнитной стимуляции (рТМС).
Динамическое исследование активности головного мозга с помощью фМРТ показало, что на фоне медикаментозной коррекции избыточной массы тела, которая сопровождается снижением активации в проекции затылочных долей и левой островковой доли мозга, повышением активации в области левой ДМПФК. Эти данные могут свидетельствовать о снижении эмоционального восприятия высококалорийной пищи, уменьшении мотивации к ее приему, повышении когнитивного контроля. В целом отмеченная динамика функциональной активности головного мозга у больных ожирением на фоне терапии может быть расценена как изменение ранее сформировавшихся паттернов пищевого поведения [58][59].
ЗАКЛЮЧЕНИЕ
Таким образом, представлена концепция систематизации сложной сети тесных нейрогуморальных путей, связывающих ожирение и нервную систему. Нарушения обменной регуляции, аккумуляция жира и гипергликемия, ассоциированные с функциональными и структурными церебральными нарушениями, составляют ядро цереброметаболического нездоровья.
Нейрофизиологические и поведенческие факторы, которые регулируют энергетический баланс, являются предметом активного изучения, что подтверждает бурный рост научных работ за последние два десятилетия и открытие многих эффекторов и регуляторных путей центральной и периферической НС. Все больше проводится исследований как в области ангионеврологии, так и интеграции возможностей нейровизуализации, в том числе фармакологической, а также нейромодуляции в изучении ожирения и его терапии. На данный момент остается множество вопросов, ответы на которые еще предстоит найти. Успехи научных изысканий в этой области дают основания для оптимизма в понимании перспектив коррекции нейроэндокринных альтераций.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Работа выполнена в соавторстве с членом редакционной коллегии журнала «Ожирение и метаболизм» Трошиной Е.А.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Health Effects of Overweight and Obesity in 195 Countries over 25 Years. N Engl J Med. 2017;377(1):13-27. doi: https://doi.org/10.1056/NEJMoa1614362
2. Мокрышева Н.Г. Борьба с ожирением как фокус развития здравоохранения // Ожирение и метаболизм. — 2022. — Т.19. — №1. — С. 4-6. doi: https://doi.org/10.14341/omet12865
3. Алферова В.И., Мустафина С.В. Распространенность ожирения во взрослой популяции Российской Федерации (обзор литературы) // Ожирение и метаболизм. — 2022. — Т.19. — №1. — С. 96-105. doi: https://doi.org/10.14341/omet12809
4. Гнедовская Е.В., Кравченко М.А., Прокопович М.Е., и др. Распространенность факторов риска цереброваскулярных заболеваний у жителей мегаполиса в возрасте 40-59 лет (клиникоэпидемиологическое исследование). Анналы клинической и экспериментальной неврологии. — 2016. — Т. 10. — №4. — С. 11-19. doi: https://doi.org/10.17816/psaic13
5. Sinha R. Role of addiction and stress neurobiology on food intake and obesity. Biol Psychol. 2018;131:5-13. doi: https://doi.org/10.1016/j.biopsycho.2017.05.001
6. Candler T, Kuhnen P, Prentice AM, Silver M. Epigenetic regulation of POMC; implications for nutritional programming, obesity and metabolic disease. Front Neuroendocrinol. 2019;54:100773. doi: https://doi.org/10.1016/j.yfrne.2019.100773
7. Goit RK, Taylor AW, Lo ACY. The central melanocortin system as a treatment target for obesity and diabetes: A brief overview. Eur J Pharmacol. 2022;924:174956. doi: https://doi.org/10.1016/j.ejphar.2022.174956
8. Yang D, Hou X, Yang G, et al. Effects of the POMC System on Glucose Homeostasis and Potential Therapeutic Targets for Obesity and Diabetes. Diabetes, Metab Syndr Obes Targets Ther. 2022;Volume 15:2939-2950. doi: https://doi.org/10.2147/DMSO.S380577
9. Ono H. Molecular Mechanisms of Hypothalamic Insulin Resistance. Int J Mol Sci. 2019;20(6):1317. doi: https://doi.org/10.3390/ijms20061317
10. Uranga RM, Keller JN. The Complex Interactions Between Obesity, Metabolism and the Brain. Front Neurosci. 2019;13. doi: https://doi.org/10.3389/fnins.2019.00513
11. O'Brien PD, Hinder LM, Callaghan BC, Feldman EL. Neurological consequences of obesity. Lancet Neurol. 2017;16(6):465-477. doi: https://doi.org/10.1016/S1474-4422(17)30084-4
12. Чумакова Г.А., Отт А.В., Веселовская Н.Г. и др. Патогенетические механизмы лептинорезистентности // Российский Кардиологический Журнал. — 2015. — Т.4. — №120. — С. 107-110. doi: https://doi.org/10.15829/1560-4071-2015-4-107-110
13. Banks WA. Leptin and the Blood-Brain Barrier: Curiosities and Controversies. In: Comprehensive Physiology. Wiley; 2021:2351-2369. doi: https://doi.org/10.1002/cphy.c200017
14. Lavoie O, Michael NJ, Caron A. A critical update on the leptin-melanocortin system. J Neurochem. 2023;165(4):467-486. doi: https://doi.org/10.1111/jnc.15765
15. Zeltser LM, Seeley RJ, Tschop MH. Synaptic plasticity in neuronal circuits regulating energy balance. Nat Neurosci. 2012. doi: https://doi.org/10.1038/nn.3219
16. Quaresma PGF, Wasinski F, Mansano NS, et al. Leptin Receptor Expression in GABAergic Cells is Not Sufficient to Normalize Metabolism and Reproduction in Mice. Endocrinology. 2021;162(11). doi: https://doi.org/10.1210/endocr/bqab168
17. Comeras LB, Herzog H, Tasan RO. Neuropeptides at the crossroad of fear and hunger: a special focus on neuropeptide Y. Ann N Y Acad Sci. 2019;1455(1):59-80. doi: https://doi.org/10.1111/nyas.14179
18. Sousa D, Lopes E, Rosendo-Silva D, Matafome P. The Bidirectional Relationship of NPY and Mitochondria in Energy Balance Regulation. Biomedicines. 2023;11(2):446. doi: https://doi.org/10.3390/biomedicines11020446
19. Marcos JL, Olivares-Barraza R, Ceballo K, et al. Obesogenic Diet-Induced Neuroinflammation: A Pathological Link between Hedonic and Homeostatic Control of Food Intake. Int J Mol Sci. 2023;24(2):1468. doi: https://doi.org/10.3390/ijms24021468
20. Bandala C, Cardenas-Rodnguez N, Reyes-Long S, et al. Trends in Gliosis in Obesity, and the Role of Antioxidants as a Therapeutic Alternative. Antioxidants. 2022;11(10):1972. doi: https://doi.org/10.3390/antiox11101972
21. Sewaybricker LE, Huang A, Chandrasekaran S, Melhorn SJ, Schur EA. The Significance of Hypothalamic Inflammation and Gliosis for the Pathogenesis of Obesity in Humans. Endocr Rev. 2023. doi: https://doi.org/10.1210/endrev/bnac023
22. Zhang Q, Jin K, Chen B, et al. Overnutrition Induced Cognitive Impairment: Insulin Resistance, Gut-Brain Axis, and Neuroinflammation. Front Neurosci. 2022;16. doi: https://doi.org/10.3389/fnins.2022.884579
23. Maurizi G, Della Guardia L, Maurizi A, Poloni A. Adipocytes properties and crosstalk with immune system in obesity-related inflammation. J Cell Physiol. 2018;233(1):88-97. doi: https://doi.org/10.1002/jcp.25855
24. Lin Y, Qu L, Wu J, Pu M, Huang Y, Cao Y. Identification of Adipogenesis Subgroups and Immune Infiltration Characteristics in Diabetic Peripheral Neuropathy. Xu Z, ed. J Immunol Res. 2023;2023:1-15. doi: https://doi.org/10.1155/2023/3673094
25. Iqbal Z, Bashir B, Ferdousi M, et al. Lipids and peripheral neuropathy. Curr Opin Lipidol. 2021;32(4):249-257. doi: https://doi.org/10.1097/MOL.0000000000000770
26. Rumora AE, Savelieff MG, Sakowski SA, Feldman EL. Disorders of mitochondrial dynamics in peripheral neuropathy: Clues from hereditary neuropathy and diabetes. In: International Review of Neurobiology. 2019:127-176. doi: https://doi.org/10.1016/bs.irn.2019.05.002
27. Marini S, Merino J, Montgomery BE, et al. Mendelian Randomization Study of Obesity and Cerebrovascular Disease. Ann Neurol. 2020;87(4):516-524. doi: https://doi.org/10.1002/ana.25686
28. Letra L, Sena C. Cerebrovascular Disease: Consequences of Obesity-Induced Endothelial Dysfunction. In: Advances in Neurobiology. ; 2017:163-189. doi: https://doi.org/10.1007/978-3-319-63260-5_7
29. Feigin VL, Stark BA, Johnson CO, et al. Global, regional, and national burden of stroke and its risk factors, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Neurol. 2021;20(10):795-820. doi: https://doi.org/10.1016/S1474-4422(21)00252-0
30. Gorelick PB. The global burden of stroke: persistent and disabling. Lancet Neurol. 2019;18(5):417-418. doi: https://doi.org/10.1016/S1474-4422(19)30030-4
31. Kim MS, Kim WJ, Khera A V., et al. Association between adiposity and cardiovascular outcomes: An umbrella review and meta-analysis of observational and Mendelian randomization studies. Eur Heart J. 2021. doi: https://doi.org/10.1093/eurheartj/ehab454
32. Horn JW, Feng T, M0rkedal B, et al. Obesity and Risk for First Ischemic Stroke Depends on Metabolic Syndrome: The HUNT Study. Stroke. 2021;52(11):3555-3561. doi: https://doi.org/10.1161/STROKEAHA.120.033016
33. Kim P-J, Kim C, Lee S-H, et al. Another Look at Obesity Paradox in Acute Ischemic Stroke: Association Rule Mining. J Pers Med. 2021;12(1):16. doi: https://doi.org/10.3390/jpm12010016
34. Танашян М.М., Антонова К.В., Лагода О.В., Шабалина А.А. Решенные и нерешенные вопросы цереброваскулярной патологии при сахарном диабете // Анналы клинической и экспериментальной неврологии. — 2021. — Т. 15. — №3. — C. 5-14 doi: https://doi.org/10.54101/ACEN.2021.3.1
35. Chavakis T, Alexaki VI, Ferrante AW. Macrophage function in adipose tissue homeostasis and metabolic inflammation. Nat Immunol. 2023;24(5):757-766. doi: https://doi.org/10.1038/s41590-023-01479-0
36. Ahmed B, Sultana R, Greene MW. Adipose tissue and insulin resistance in obese. Biomed Pharmacother. 2021;137:111315. doi: https://doi.org/10.1016/j.biopha.2021.111315
37. Танашян М.М., Антонова К.В., Раскуражев А.А., и др. Цереброваскулярные заболевания и глюколипотоксичность // Анналы клинической и экспериментальной неврологии. — 2020. — Т. 14. — №1. — С. 17-24. doi: https://doi.org/10.25692/ACEN.2020.1.2
38. Ortega FB, Lavie CJ, Blair SN. Obesity and Cardiovascular Disease. Circ Res. 2016;118(11):1752-1770. doi: https://doi.org/10.1161/CIRCRESAHA.115.306883
39. Чумакова Г.А., Кузнецова Т.Ю., Дружилов М.А., Веселовская Н.Г. Индуцированная ожирением артериальная гипертензия. Основные патофизиологические механизмы развития // Артериальная Гипертензия. — 2021. — Т.3. — С. 260-268. doi: https://doi.org/10.18705/1607-419X-2021-27-3-260-268
40. Антонова К.В., Танашян М.М., Шабалина А.А., и др. Гемостаз у лиц с сахарным диабетом 2-го типа и ожирением при острой и хронической цереброваскулярной патологии // Тромбоз, гемостаз и реология. — 2020. — Т. 82. — №2. — С. 60-67. doi: https://doi.org/10.25555/THR.2020.2.0919
41. Танашян М.М., Лагода О.В., Антонова К.В. Цереброваскулярная патология и метаболический синдром. — М.: «АСТ 345», 2019. doi: https://doi.org/10.33901/978-5-6041430-2-5-2019-1-370
42. Prospective Studies Collaboration. Body-mass index and causespecific mortality in 900 000 adults: collaborative analyses of 57 prospective studies. Lancet. 2009;373(9669):1083-1096. doi: https://doi.org/10.1016/S0140-6736(09)60318-4
43. Танашян М.М., Антонова К.В., Лагода О.В. и др. Ожирение и протромбогенное состояние крови у пациентов с цереброваскулярными заболеваниями // Тромбоз, гемостаз и реология. — 2023. doi: https://doi.org/10.25555/THR.2023.3.1069
44. Nichols E, Steinmetz JD, Vollset SE, et al. Estimation of the global prevalence of dementia in 2019 and forecasted prevalence in 2050: an analysis for the Global Burden of Disease Study 2019. Lancet Public Heal. 2022;7(2):e105-e125. doi: https://doi.org/10.1016/S2468-2667(21)00249-8
45. Stillman CM, Weinstein AM, Marsland AL, Gianaros PJ, Erickson KI. Body-Brain Connections: The Effects of Obesity and Behavioral Interventions on Neurocognitive Aging. Front Aging Neurosci. 2017;9. doi: https://doi.org/10.3389/fnagi.2017.00115
46. Raji CA, Ho AJ, Parikshak NN, et al. Brain structure and obesity. Hum Brain Mapp. 2010;31(3):353-364. doi: https://doi.org/10.1002/hbm.20870
47. Medic N, Ziauddeen H, Ersche KD, et al. Increased body mass index is associated with specific regional alterations in brain structure. Int J Obes. 2016;40(7):1177-1182. doi: https://doi.org/10.1038/ijo.2016.42
48. Abdalla MMI, Azzani M, Atroosh W, Anbazhagan D, Kumarasamy V. The association between mental health and obesity in postmenopausal women: A systematic review. Endocr Regul. 2022;56(4):295-310. doi: https://doi.org/10.2478/enr-2022-0032
49. Singh-Manoux A, Dugravot A, Shipley M, et al. Obesity trajectories and risk of dementia: 28 years of follow-up in the Whitehall II Study. Alzheimer's Dement. 2018;14(2):178-186. doi: https://doi.org/10.1016/j.jalz.2017.06.2637
50. Kivimaki M, Luukkonen R, Batty GD, et al. Body mass index and risk of dementia: Analysis of individual-level data from 1.3 million individuals. Alzheimer's Dement. 2018;14(5):601-609. doi: https://doi.org/10.1016/j.jalz.2017.09.016
51. Wong Zhang DE, Tran V, Vinh A, et al. Pathophysiological Links Between Obesity and Dementia. NeuroMolecular Med. 2023;25(4):451-456. doi: https://doi.org/10.1007/s12017-023-08746-1
52. Loffredo L, Ettorre E, Zicari AM, et al. Oxidative Stress and Gut-Derived Lipopolysaccharides in Neurodegenerative Disease: Role of NOX2. Oxid Med Cell Longev. 2020;2020:1-7. doi: https://doi.org/10.1155/2020/8630275
53. Vamanu E, Rai SN. The Link between Obesity, Microbiota Dysbiosis, and Neurodegenerative Pathogenesis. Diseases. 2021;9(3):45. doi: https://doi.org/10.3390/diseases9030045
54. Chowen JA, Garcia-Segura LM. Microglia, neurodegeneration and loss of neuroendocrine control. Prog Neurobiol. 2020;184:101720. doi: https://doi.org/10.1016/j.pneurobio.2019.101720
55. Flores-Cordero JA, Perez-Perez A, Jimenez-Cortegana C, Alba G, Flores-Barragan A, Sanchez-Margalet V. Obesity as a Risk Factor for Dementia and Alzheimer's Disease: The Role of Leptin. Int J Mol Sci. 2022;23(9):5202. doi: https://doi.org/10.3390/ijms23095202
56. Nazish S. Obesity and metabolic syndrome in patients with epilepsy, their relation with epilepsy control. Ann Afr Med. 2023;22(2):136. doi: https://doi.org/10.4103/aam.aam_139_22
57. Stampanoni Bassi M, Iezzi E, Buttari F, et al. Obesity worsens central inflammation and disability in multiple sclerosis. Mult Scler J. 2020;26(10):1237-1246. doi: https://doi.org/10.1177/1352458519853473
58. Кузнецова П.И., Романцова Т.И., Логвинова О.В., и др. Функциональная МР-томография головного мозга на фоне медикаментозной коррекции ожирения // Ожирение и метаболизм. — 2022.— Т.19. — №1. — С. 74-82. doi: https://doi.org/10.14341/omet12810
59. Кузнецова П.И., Логвинова О.В., Пойдашева А.Г. и др. Применение навигационной ритмической транскраниальной магнитной стимуляции с целью коррекции пищевого поведения при ожирении (клинические наблюдения) // Ожирение и метаболизм. — 2020. — Т.17. — №1. — С. 100-109. doi: https://doi.org/10.14341/omet10148
Об авторах
К. В. АнтоноваРоссия
Антонова Ксения Валентиновна - доктор медицинских наук, ведущий научный сотрудник 1 неврологического отделения, врач-эндокринолог.
125367, Москва, Волоколамское шоссе, д. 80
Researcher ID: J-9971-2016; Scopus Author ID: 7004672742
Конфликт интересов:
Работа выполнена в соавторстве с членом редакционной коллегии журнала «Ожирение и метаболизм» Трошиной Е.А.
М. М. Танашян
Россия
Танашян Маринэ Мовсесовна - д.м.н., профессор.
Москва
Researcher ID: F-8483-2014; Scopus Author ID: 6506228066
Конфликт интересов:
Работа выполнена в соавторстве с членом редакционной коллегии журнала «Ожирение и метаболизм» Трошиной Е.А.
А. А. Раскуражев
Россия
Раскуражев Антон Алексеевич - к.м.н.
Москва
Researcher ID: K-7636-2012; Scopus Author ID: 57191092653
Конфликт интересов:
Работа выполнена в соавторстве с членом редакционной коллегии журнала «Ожирение и метаболизм» Трошиной Е.А.
Н. Е. Спрышков
Россия
Спрышков Никита Евгеньевич.
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членом редакционной коллегии журнала «Ожирение и метаболизм» Трошиной Е.А.
А. А. Панина
Россия
Панина Анастасия Андреевна.
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членом редакционной коллегии журнала «Ожирение и метаболизм» Трошиной Е.А.
О. В. Лагода
Россия
Лагода Ольга Викторовна - к.м.н.
Москва
Researcher ID: C-5395-2012; Scopus Author ID: 6507370001
Конфликт интересов:
Работа выполнена в соавторстве с членом редакционной коллегии журнала «Ожирение и метаболизм» Трошиной Е.А.
А. С. Аметов
Россия
Аметов Александр Сергеевич - д.м.н., профессор.
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членом редакционной коллегии журнала «Ожирение и метаболизм» Трошиной Е.А.
Е. А. Трошина
Россия
Трошина Екатерина Анатольевна - д.м.н., профессор.
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членом редакционной коллегии журнала «Ожирение и метаболизм» Трошиной Е.А.
Дополнительные файлы
|
|
1. Рисунок 1. Модель гипоталамического глиоза у человека (создано на основанаии статьи Sewaybricker LE, Huang A, Chandrasekaran S, Melhorn SJ, Schur EA. The Significance of Hypothalamic Inflammation and Gliosis for the Pathogenesis of Obesity in Humans [21]). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(357KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Патогенез неврологических заболеваний при ожирении. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(519KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Антонова К.В., Танашян М.М., Раскуражев А.А., Спрышков Н.Е., Панина А.А., Лагода О.В., Аметов А.С., Трошина Е.А. Ожирение и нервная система. Ожирение и метаболизм. 2024;21(1):68-78. https://doi.org/10.14341/omet13019
For citation:
Antonova K.V., Tanashyan M.M., Raskurazhev A.A., Spryshkov N.E., Panina A.A., Lagoda O.V., Ametov A.S., Troshina E.A. Obesity and the nervous system. Obesity and metabolism. 2024;21(1):68-78. (In Russ.) https://doi.org/10.14341/omet13019

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































