Перейти к:
Неочевидность причин вторичного остеопороза на примере реального клинического случая
https://doi.org/10.14341/omet13003
Аннотация
В данной статье представлен нестандартный клинический случай неочевидности причин вторичного остеопороза в рутинной практике врача-эндокринолога амбулаторного и стационарного профилей. В этой работе демонстрируется достаточно редкая ситуация, включающая в себя выявление у пациента нетипичных клинических проявлений остеопороза, а именно наличие у молодого мужчины жалоб на общую слабость, выраженный болевой синдром в позвоночнике, вынуждающий к ежедневному приему нестероидных противовоспалительных средств, снижение двигательной активности, и лабораторных показателей, таких как гиперкальциемия, гиперкальциурия на фоне референсных значений паратгормона, гиперпротеинемии и повышения СОЭ. С учетом описанной выше клинической картины неотъемлемой частью дальнейшего верного диагностического поиска является исключение эндокринных заболеваний, которые обусловливают снижение минеральной плотности костной ткани. Параллельно инициированное назначение патогенетически обоснованного лечения вторичного остеопороза является важным составляющим компонентом в рамках данного заболевания. Применение подобного многопрофильного подхода привело к своевременной верификации основного онкогематологического заболевания и маршрутизации пациента в специализированный стационар, позволило предотвратить необратимые изменения, ассоциированные с критическим снижением минеральной плотности костной ткани, и улучшить качество жизни пациента.
Для цитирования:
Шутова А.С., Федина Е.А., Кузьмин А.Г., Пигарова Е.А., Пржиялковская Е.Г., Литвинова Е.Е., Шутова Н.А., Дзеранова Л.К. Неочевидность причин вторичного остеопороза на примере реального клинического случая. Ожирение и метаболизм. 2023;20(3):269-273. https://doi.org/10.14341/omet13003
For citation:
Shutova A.S., Fedina E.A., Kuzmin A.G., Pigarova E.A., Przhiyalkovskaya E.G., Litvinova E.E., Shutova N.A., Dzeranova L.K. The implicit reason of secondary osteoporosis: real clinical case. Obesity and metabolism. 2023;20(3):269-273. (In Russ.) https://doi.org/10.14341/omet13003
АКТУАЛЬНОСТЬ
Остеопороз — метаболическое заболевание скелета с неуклонно прогрессирующим течением, характеризующееся снижением костной массы, нарушением микроархитектоники костей, переломами при минимальной травматическом воздействии или вовсе в его отсутствие [1].
Выделяют первичный и вторичный остеопороз. Данные диагностические категории включают все многообразие причин рассматриваемой костной метаболической патологии: первичный остеопороз включает постменопаузальный, ювенильный, идиопатический; вторичный может быть обусловлен алиментарным статусом, генетической предрасположенностью, приемом лекарственных препаратов, различными заболеваниями. Ключевым фактором успешного лечения остеопороза является определение его истинной причины, которая не всегда очевидна.
Социальная значимость остеопороза определяется его последствиями — переломами тел позвонков и костей периферического скелета, приводящими к большим материальным затратам в области здравоохранения и обусловливающими высокий уровень нетрудоспособности, включая инвалидность и смертность. Остеопороз до развития патологического перелома не имеет клинических проявлений. Патологический перелом, напротив, в остром периоде часто имеет яркую клиническую картину. Перелом сопряжен с болью, нарушением функции и характерной рентгенологической картиной. Отдельного внимания заслуживают клинические проявления патологических переломов тел позвонков, которые длительно, до 75% случаев, могут оставаться недиагностированными ввиду неяркой, неспецифической симптоматики, а также низкой настороженности пациентов и врачей. Компрессионные переломы тел позвонков сопровождаются болью или чувством усталости в спине, снижением роста, а также, в случае развития множественных компрессионных деформаций, целым рядом клинических проявлений: дизурическими явлениями, обусловленными уменьшением объема грудной и брюшной полостей, дыхательными нарушениями и болью в области сердца, изжогой из-за спастического сокращения мышц, диффузным болевым синдромом вследствие перерастяжения мышц шеи и патологического натяжения связок, остеоартритом бедренных суставов [1][2].
Таким образом, инвалидизирующий характер остеопороза, значительная стоимость лечения как самого заболевания, так и его прямых осложнений — переломов, развитие болевого синдрома, деформации скелета, потери трудоспособности и возможности самообслуживания определяют важность данной медико-социальной проблемы.
Первичный остеопороз развивается как самостоятельное заболевание, занимает 95% в структуре остеопороза у женщин в постменопаузе (постменопаузальный остеопороз) и 80% в структуре остеопороза у мужчин [1–4]. Встречаемость вторичного остеопороза значимо отличается и составляет 5% у женщин и лишь 20% у мужчин [1–4]. Скрининг на вторичные причины остеопороза обязателен для всех пациентов с остеопорозом и закреплен в клинических рекомендациях. Но необходимо отметить, что, несмотря на это, в поисках причины вторичного остеопороза пациенты нередко безрезультатно проходят через множество врачебных кабинетов, не получая искомого облегчения.
Приводимое нами клиническое наблюдение демонстрирует, что, несмотря на несопоставимо меньшее процентное соотношение вторичного остеопороза по сравнению с первичным, положительный прогноз увеличения продолжительности и улучшения качества жизни возможен только при своевременном установлении правильного диагноза и назначении патогенетически обоснованного лечения.
ОПИСАНИЕ СЛУЧАЯ
Пациент Я., 44 года, при обращении предъявлял жалобы на общую слабость, выраженный болевой синдром в костях, преимущественно в грудном, пояснично-крестцовом отделах позвоночника и ребрах, требующий ежедневного приема анальгетических препаратов, снижения двигательной активности.
При физикальном обследовании специфических изменений не выявлено, масса тела 86 кг, рост 178 см, индекс массы тела 27,1 кг/м², артериальное давление 130/80 мм рт.ст.
В июне 2022 г., при обследовании в ФГБУ «НМИЦ эндокринологии» Минздрава России выявлены увеличение скорости оседания эритроцитов (СОЭ) до 73 мм/ч (2–15 мм/ч), анемия легкой степени — гемоглобин 124 г/л (132–172 г/л), повышение уровня общего белка в сыворотке крови до 108 г/л (64–83 г/л), общего кальция до 2,66 ммоль/л (2,15–2,55 ммоль/л) и суточной кальциурии до 11,56 ммоль/сут (2,5–8 ммоль/сут). Уровни щелочной фосфатазы, паратгормона, тестостерона, 25(OH)D, тиреоидных гормонов, кортизола в суточной моче и в слюне вечером — в пределах референсных значений. Согласно предоставленным данным эзофагогастродуоденоскопии клинически значимых патологических изменений не выявлено.
В связи с выявлением гиперкальциемии, гиперкальциурии на фоне референсных значений паратгормона, а также гиперпротеинемии и повышения СОЭ заподозрено наличие парапротеинемического гемобластоза. Проведена рентгенография черепа, по данным которой выявлены остеопороз костей свода черепа и множественные разнокалиберные очаги деструкции литического характера, местами с нечеткими контурами без периостальных наложений, диффузные во всех отделах, размерами от 2,9 до 13,5 мм (рис. 1). Данная рентгенологическая картина расценена как патогномоничная для множественной миеломы. Сходные изменения выявлены в телах и дужках шейных, грудных и поясничных позвонков (рис. 2).
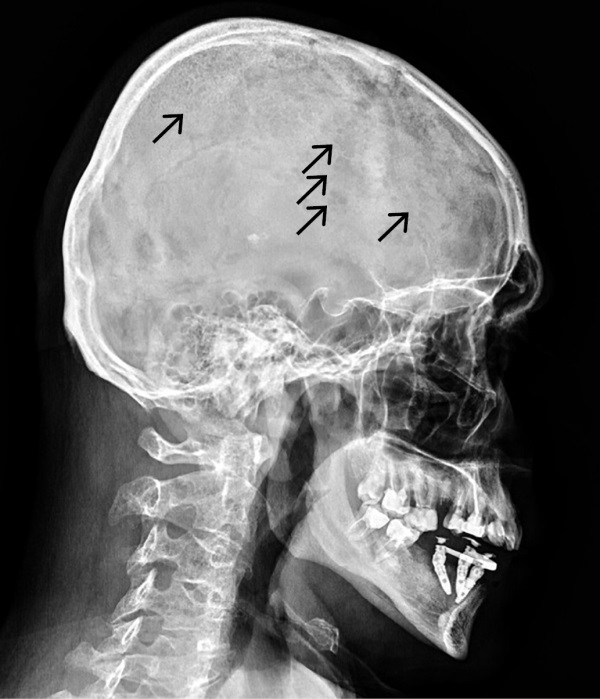
Рисунок 1. Рентгенограмма черепа в боковой проекции пациента Я.
Стрелками обозначены очаги остеолизиса — симптом «дырявого черепа».
Figure 1. X-ray of the skull in the lateral projection of the patient I.
Arrows indicate foci of osteolysis — a symptom of a «leaky skull».

Рисунок 2. Рентгенограмма грудного (А) и поясничного (Б)
отделов позвоночника в боковой проекции пациента Я.
Стрелками указаны очаги литической деструкции в телах позвонков,
в ребрах, особенно в их задних отрезках,
в остистых отростках позвонков по типу «пчелиных сот».
Figure 2. X-ray of the thoracic (A) and lumbar (B) spine
in the lateral projection of the patient I.
Arrows indicate foci of lytic destruction in the vertebral bodies,
in the ribs, especially in their posterior segments, in the spinous processes
of the vertebrae of the type of «honeycomb».
На рентгенограмме боковой проекции грудного отдела позвоночника выявлены компрессия по краниальной и каудальной площадкам с потерей плотной массы Th6 (до 13%), Th7 (до 8%), Th8 (до 4%), выраженный остеопороз и остеохондроз, множественные протрузии межпозвоночных дисков межлопаточной области, на рентгенограмме поясничного отдела позвоночника в боковой проекции выявлены умеренный остеохондроз, ретролистез L3 до 2,2 мм и межпозвоночные протрузии L4–S1. При рентгеноденситометрии получены данные о выраженном снижении минеральной плотности костной ткани с максимальным снижением до -3,8 SD в L1–L4 по Z-критерию.
Учитывая полученные инструментальные и лабораторные данные, патогномоничные для множественной миеломы, проведено углубленное обследование в объеме иммунохимического исследования белков сыворотки крови и мочи, выявившее моноклональную секрецию парапротеина Gλ до 26,8 г/л (рис. 3) и вторичную гипогаммаглобулинемию. Уровень β-2-микроглобулина в крови — в пределах референсных значений, белок Бенс-Джонса не выявлен.
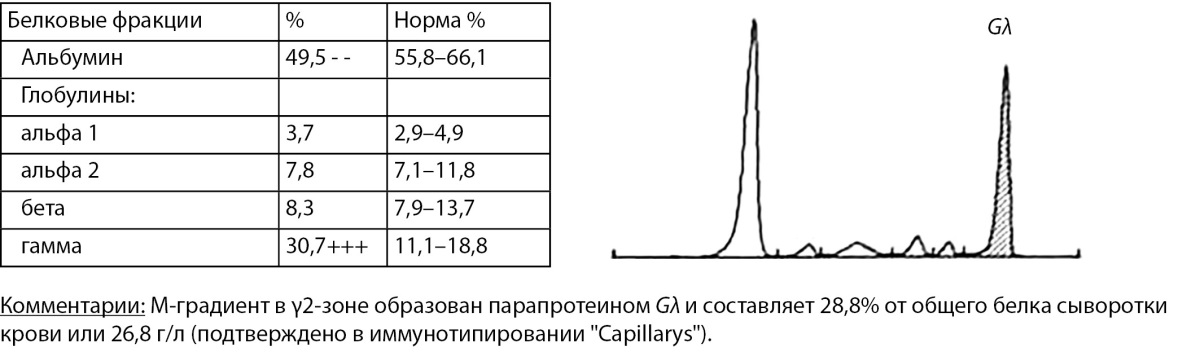
Рисунок 3. Электрофоретическое исследование белков сыворотки крови.
Figure 3. Electrophoretic study of serum proteins.
Пациенту выполнена компьютерная томография органов грудной клетки: в режиме костной визуализации отмечены признаки выраженного диффузного остеопороза с наличием множественных очагов резорбции костной ткани преимущественно небольших размеров — до 5 мм, единичный очаг в теле Th11 позвонка достигает 13×11 мм, заполнен содержимым пониженной плотности (15 HU). По данным ПЭТ-КТ с 18F-фтордезоксиглюкозой определялось диффузное поглощение радиофармпрепарата в костном мозге и в местах консолидированных переломов ребер (без признаков онкологического поражения).
В рамках наблюдения в ФГБУ «НМИЦ эндокринологии» Минздрава России пациенту была инициирована терапия бисфосфонатами (золедроновая кислота 5 мг в/в).
Для определения дальнейшей тактики лечения множественной миеломы, включающей морфологическую верификацию диагноза, пациент был госпитализирован в специализированный гематологический стационар. В миелограмме обнаружено 6,3% плазматических клеток, в трепанобиоптате визуализировались мелко- и крупноочаговые разрастания плазматических клеток, представленных как зрелыми плазмоцитами, так и проплазмоцитами и плазмобластами. Таким образом, был верифицирован диагноз множественной миеломы, протекающей с парапротеинемией Gλ, распространенным остеодеструктивным процессом, IIIA стадия по –Salmon. Была инициирована индукционная терапия по схеме PAD (бортезомиб, доксорубицин, дексаметазон) с последующим проведением высокодозной химиотерапии с трансплантацией аутологичных стволовых клеток. Планируется дальнейшее консолидирующее химиотерапевтическое лечение.
ОБСУЖДЕНИЕ
Для предотвращения развития необратимых патологических изменений, снижения качества жизни и инвалидизации пациентов с вторичным остеопорозом наибольшее значение имеет своевременное установление правильного диагноза основного заболевания. В нашем случае ключевыми факторами верного направления диагностического поиска выступили нехарактерная клиническая картина: мужской пол, молодой возраст пациента, исключение эндокринных причин, обусловливающих снижение минеральной плотности костной ткани, — гиперпаратиреоза, тиреотоксикоза, гиперкортицизма. Лабораторными параметрами, обратившими на себя внимание, явились повышение уровня общего белка в сыворотке крови в совокупности с увеличением СОЭ. Остеопороз при множественной миеломе — неотъемлемый спутник, однако множественная миелома в структуре причин остеопороза занимает незначительную долю — лишь 4% [5]. В 90% случаев у пациентов с множественной миеломой возникают минерально-костные нарушения, развивается остеопороз, ярче всего проявляющий себя выраженным болевым синдромом в области позвоночника [6]. В основе патогенеза остеопороза при множественной миеломе лежит дисрегуляция костного обмена: клетки множественной миеломы препятствуют физиологическому ремоделированию кости, активируют остеокластогенез и ингибируют синтез остеобластов, усиливают апоптоз остеоцитов. Злокачественная пролиферация плазматических клеток скелета приводит к боли в костях и патологическим переломам [7]. Неоднократные переломы, выраженный болевой синдром, не купирующийся симптоматической терапией, могут стать определяющими факторами для инициации интенсифицированного лечения. Так, в литературе описаны случаи назначения терипаратида в качестве препарата первой линии пациентам с остеопорозом и недиагностированной множественной миеломой [8–10]. Использование рекомбинантного паратиреоидного гормона противопоказано пациентам со злокачественным поражением костной системы. При множественной миеломе наблюдается постоянный дисбаланс между активностью остеокластов и остеобластов с повышенной экспрессией RANKL в остеобластах, что приводит к резорбции костной ткани. Лечение терипаратидом оказывает пульсаторное влияние на RANKL, способствующее активации остеобластов и усилению патологического костеобразования. В демонстрируемом нами случае лечение остеопороза проводилось бисфосфонатами, являющимися препаратами выбора как для лечения остеопороза вне наличия парапротеинемической гаммапатии, так и в случае снижения минеральной плотности костной ткани при множественной миеломе [8–10]. На фоне терапии у пациента Я. наблюдался незамедлительный положительный эффект в виде нивелирования болевого синдрома и снижения степени гиперкальциемии.
При выявлении нехарактерных для предполагаемого диагноза симптомов, отсутствия ожидаемого эффекта антиостеопоротической терапии, в том числе сохраняющегося болевого синдрома, необходимо сохранять готовность к пересмотру первоначального диагноза с повторным скринингом на вторичные причины остеопороза. В нетипичных случаях, подозрительных в отношении метаболического заболевания костей, может быть рекомендована трепанобиопсия. В отношении рассматриваемого клинического случая имеющиеся множественные переломы с наибольшей вероятностью были следствием существующей множественной миеломы, своевременное выявление и лечение которой позволило бы предотвратить необратимые изменения костной ткани и улучшить качество жизни пациента на протяжении многих лет. Данный случай подтверждает тезис лезвия Оккама, в соответствии с которым разнородные клинические проявления с наибольшей вероятностью имеют объединяющую причину, обусловливающую необходимость ее поиска [11].
ЗАКЛЮЧЕНИЕ
Остеопороз при моноклональной гаммапатии — тяжелое, относительно частое осложнение, выраженность которого напрямую зависит от прогрессирования основного заболевания. Неочевидность причины вторичного остеопороза при поверхностном рассмотрении клинико-лабораторной картины обусловливает особую настороженность в отношении наличия у пациента других неэндокринных заболеваний. В установлении положительного тренда социальной и трудовой адаптации, улучшении качества и увеличении продолжительности жизни пациентов с вторичным остеопорозом крайне важными являются своевременная оценка комплекса лабораторных и инструментальных параметров, характерных для моноклональной гаммапатии, их правильная интерпретация с целью назначения патогенетической терапии и предотвращения развития необратимых патологических изменений.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Публикация подготовлена в рамках гранта Министерства образования и науки Российской Федерации, соглашение 075-15-2022-310 от 20.04.2022.
Конфликт интересов. Работа выполнена в соавторстве с заведующей редакцией журнала «Ожирение и метаболизм» Дзерановой Л.К., членом редакционной коллегии журнала «Ожирение и метаболизм» Пигаровой Е.А.
Согласие пациента. Авторы настоящей статьи получили письменное разрешение от упоминаемых в статье пациентов на публикацию их медицинских данных в журнале.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Белая Ж.Е., Белова К.Ю., Бирюкова Е.В., и др. Федеральные клинические рекомендации по диагностике, лечению и профилактике остеопороза // Остеопороз и остеопатии. — 2021. — Т. 24. — №2. — С. 4-47. doi: https://doi.org/10.14341/osteo12930
2. Сamacho PM, Petak SM, Binkley N, et al. American association of clinical endocrinologists and American college of endocrinology clinical practice guidelines for the diagnosis and treatment of postmenopausal osteoporosis – 2016. Endocr Pract. 2016;22(S4):1-42. doi: https://doi.org/10.4158/EP161435.GL
3. Kanis JA, Cooper C, Rizzoli R, Reginster J-Y. Scientific advisory board of the european society for clinical and Economic Aspects of Osteoporosis (ESCEO) and the committees of scientific advisors and National societies of the International Osteoporosis Foundation (IOF). European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int. 2019;30(1):3-44. doi: https://doi.org/10.1007/s00198-018-4704-5.
4. Сosman F, de Beur SJ, LeBoff MS, et al. National Osteoporosis Foundation. Clinician’s guide to prevention and treatment of osteoporosis. Osteoporos Int. 2014;25(10):2359-2381. doi: https://doi.org/10.1007/s00198-014-2794-2
5. Gaudio A, Xourafa A, Rapisarda R, et al. Hematological diseases and osteoporosis. Int J Mol Sci. 2020;21(10):3538. doi: https://doi.org/10.3390/ijms21103538
6. Roodman GD. Pathogenesis of myeloma bone disease. J Cell Biochem. 2010;(109):283-291. doi: https://doi.org/10.1002/jcb.22403
7. Bouvard B, Royer M, Chappard D, et al. Monoclonal gammopathy of undetermined significance, multiple myeloma, and osteoporosis. Jt Bone Spine. 2010;77(2):120-124. doi: https://doi.org/10.1016/j.jbspin.2009.12.002
8. Koski A-M, Sikio A, Forslund T. Teriparatide treatment complicated by malignant myeloma. Case Reports. 2010;2010:bcr0120102681. doi: https://doi.org/10.1136/bcr.01.2010.2681
9. Forslund T, Koski A-M, Koistinen A, Sikiö A. Malignant myeloma in a patient after treatment for osteoporosis with teriparatide; a rare coincidence. Clin Med Case Reports. 2008;(1):119-122. doi: https://doi.org/10.4137/CCRep.S1026
10. Miller PD. Safety of parathyroid hormone for the treatment of osteoporosis. Curr Osteoporos Rep. 2008;6(1):12-16. doi: https://doi.org/10.1007/s11914-008-0003-y
11. Barry CM. Who sharpened Occam’s Razor? Irish Philosophy; 2014.
Об авторах
А. С. ШутоваРоссия
Шутова Александра Сергеевна
Researcher ID: AAP-8599-2020
eLibrary SPIN: 4774-0114
117036, Москва, улица Дм. Ульянова, д.11
Е. А. Федина
Россия
Федина Елизавета Алексеевна
Москва
А. Г. Кузьмин
Россия
Кузьмин Анатолий Геннадьевич, к.м.н.
eLibrary SPIN: 7804-2128
Москва
Е. А. Пигарова
Россия
Пигарова Екатерина Александровна, д.м.н.
eLibrary SPIN: 6912-6331
Scopus Author ID: 55655098500
Researcher ID: T-9424-2018
Москва
Е. Г. Пржиялковская
Россия
Пржиялковская Елена Георгиевна, к.м.н.
eLibrary SPIN: 9309-3256
Москва
Е. Е. Литвинова
Россия
Литвинова Елена Евгеньевна
Москва
Н. А. Шутова
Шутова Наталия Александровна
ResearcherID: AAP-8599-2020
AuthorID: 717009
Москва
Л. К. Дзеранова
Россия
Дзеранова Лариса Константиновна, д.м.н.
eLibrary SPIN: 2958-5555
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Рентгенограмма черепа в боковой проекции пациента Я. Стрелками обозначены очаги остеолизиса — симптом «дырявого черепа». | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(203KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Рентгенограмма грудного (А) и поясничного (Б) отделов позвоночника в боковой проекции пациента Я. Стрелками указаны очаги литической деструкции в телах позвонков, в ребрах, особенно в их задних отрезках, в остистых отростках позвонков по типу «пчелиных сот». | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(524KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Электрофоретическое исследование белков сыворотки крови. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(177KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Шутова А.С., Федина Е.А., Кузьмин А.Г., Пигарова Е.А., Пржиялковская Е.Г., Литвинова Е.Е., Шутова Н.А., Дзеранова Л.К. Неочевидность причин вторичного остеопороза на примере реального клинического случая. Ожирение и метаболизм. 2023;20(3):269-273. https://doi.org/10.14341/omet13003
For citation:
Shutova A.S., Fedina E.A., Kuzmin A.G., Pigarova E.A., Przhiyalkovskaya E.G., Litvinova E.E., Shutova N.A., Dzeranova L.K. The implicit reason of secondary osteoporosis: real clinical case. Obesity and metabolism. 2023;20(3):269-273. (In Russ.) https://doi.org/10.14341/omet13003

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































