Перейти к:
Течение подагры у пациентки с болезнью Иценко-Кушинга после успешного хирургического лечения
https://doi.org/10.14341/omet12945
Аннотация
Эндогенный гиперкортицизм — тяжелое эндокринное заболевание, характеризующееся длительным воздействием на организм избыточного количества глюкокортикоидных гормонов, сопровождающееся широким спектром симптомов и осложнений, в том числе иммуносупрессией. Своевременно проведенное оперативное лечение в большинстве случаев позволяет сохранить жизнь пациента, существенно улучшить ее качество. Однако нередко восстановление нормальной концентрации глюкокортикоидных гормонов может стать триггерным фактором в развитии или обострении аутоиммунных и аутовоспалительных заболеваний. В статье представлен клинический случай атипичного течения подагры у пациентки с гиперкортицизмом и проградиентным нарастанием симптомов заболевания после успешного хирургического лечения по поводу болезни Иценко–Кушинга и достижения стойкой ремиссии. Освещены вопросы диагностики и лечения данной группы аутовоспалительных заболеваний, рассмотрены ведущие клинические и рентгенологические симптомы, представлена дифференциальная диагностика микрокристаллических (метаболических) артритов. Несмотря на широкое распространение, диагностика и лечение данной группы заболеваний до сих пор вызывают затруднения специалистов. Грамотный выбор медикаментозной терапии позволяет полностью контролировать рассматриваемые в статье заболевания, в том числе при их сочетании, и тем самым улучшить качество жизни пациента.
Ключевые слова
Для цитирования:
Дзеранова Л.К., Елисеев М.С., Голоунина О.О., Черёмушкина Е.В., Пигарова Е.А., Мельниченко Г.А. Течение подагры у пациентки с болезнью Иценко-Кушинга после успешного хирургического лечения. Ожирение и метаболизм. 2022;19(4):404-409. https://doi.org/10.14341/omet12945
For citation:
Dzeranova L.K., Eliseev M.S., Golounina O.O., Cheremushkina E.V., Pigarova E.A., Melnichenko G.A. The course of gout in a patient with Cushing’s disease after successful surgical treatment. Obesity and metabolism. 2022;19(4):404-409. (In Russ.) https://doi.org/10.14341/omet12945
АКТУАЛЬНОСТЬ
Эндогенный гиперкортицизм — тяжелое эндокринное заболевание, характеризующееся длительным воздействием на организм избыточного количества глюкокортикоидных гормонов, сопровождающееся широким спектром симптомов и осложнений. Среди спектра нозологий, приводящих к гиперкортицизму, до 80% случаев составляют аденомы гипофиза, секретирующие адренокортикотропный гормон (АКТГ), в частности, болезнь Иценко–Кушинга (БИК). Значительно более редким вариантом эндогенного гиперкортицизма является АКТГ-эктопированный синдром, обусловленный избыточной продукцией АКТГ, реже кортикотропин-рилизинг-гормона, нейроэндокринной опухолью с формированием клинической картины гиперкортицизма [1].
В норме основные физиологические эффекты глюкокортикоидов (ГК) проявляются во всех видах обмена. ГК оказывают противовоспалительное, противоаллергическое действия, тормозят иммунные реакции в организме, тем самым предрасполагая к развитию инфекционных осложнений, однако эта же особенность действия ГК с успехом используется в лечении аутоиммунных заболеваний. Эндогенный гиперкортицизм биохимически характеризуется нефизиологическим гиперкортицизмом, который, подобно использованию экзогенных ГК, вызывает обратимое состояние иммуносупрессии [2]. Значимость подобного эффекта частично отражается в улучшении течения аутоиммунных заболеваний в активной стадии эндогенного гиперкортицизма. Напротив, при достижении ремиссии гиперкортицизма и нормализации уровня кортизола существует риск развития или обострения ревматических заболеваний, в том числе у пациентов с подагрой. Так, ранее описан клинический случай формирования тяжелого хронического артрита, связанного с надпочечниковой недостаточностью, развившейся в результате резкой отмены ГК [3]. И напротив, длительный прием ГК может «стирать» симптомы подагры, снижая вероятность приступов артрита и их интенсивность [4], что, как следствие, может затруднять диагностику заболевания.
В литературе имеются сообщения о возникновении либо обострении аутоиммунных заболеваний, таких как ревматоидный артрит [5][6], саркоидоз [7–9], системная красная волчанка [10], ревматическая полимиалгия [11], заболевания щитовидной железы [12], после радикального лечения эндогенного гиперкортицизма различной этиологии и восстановления физиологической продукции ГК.
Представляем клинический случай атипичного течения подагры у пациентки с гиперкортицизмом и проградиентным нарастанием симптомов заболевания после успешного хирургического лечения по поводу БИК и достижения стойкой ремиссии.
ОПИСАНИЕ СЛУЧАЯ
Пациентка С. впервые обратилась в ФГБУ «НМИЦ эндокринологии» Минздрава России в возрасте 54 лет. Из анамнеза известно, что в течение последних 7 лет отмечала эпизоды повышения артериального давления (АД) до 180/110 мм рт.ст., сопровождающиеся сильной головной болью. Длительное время принимала антигипертензивную терапию, неоднократно проводилась коррекция лечения, однако сохранялось кризовое течение артериальной гипертензии. В 49-летнем возрасте перенесла несколько приступов артрита суставов стоп (боль по визуальной аналоговой шкале (ВАШ) до 70 мм), включая 1-е плюсне-фаланговые суставы, купировавшихся спонтанно в течение нескольких дней либо приемом нестероидных противовоспалительных препаратов (НПВП). По данным лабораторных исследований отмечалось повышение мочевой кислоты сыворотки крови до 800 мкмоль/л. Был предположен диагноз подагры, назначен аллопуринол, от приема которого пациентка отказалась в пользу низкопуриновой диеты. С 50-летнего возраста на протяжении 4 лет приступов артрита не отмечала, симптомы заболевания ограничивались эпизодами артралгий.
В возрасте 51 года перенесла острое нарушение мозгового кровообращения. Тогда же впервые выявлено повышение уровня АКТГ утром до 52 пг/мл, уровня кортизола в образце слюны, собранной в 23:00, до 9,6 нмоль/л (<9,4 нмоль/л), свободного кортизола в суточной моче до 502,7 нмоль/сут (<485,6 нмоль/сут), отрицательная малая дексаметазоновая проба (МДП) (кортизол в сыворотке крови в 8:00 после приема 1 мг дексаметазона накануне в 23:00 — 596,96 нмоль/л (<50)), установлен диагноз эндогенного гиперкортицизма.
Отсутствие подавления кортизола в ходе МДП и повышенный уровень АКТГ свидетельствовали в пользу АКТГ-зависимого эндогенного гиперкортицизма, наиболее частой причиной которого является кортикотропинома [13]. Однако при проведении МРТ головного мозга с контрастным усилением данных за аденому гипофиза получено не было. В ходе комплексного обследования по данным мультиспиральной компьютерной томографии забрюшинного пространства с контрастным усилением впервые выявлено объемное образование левого надпочечника овальной формы с ровными четкими контурами, исходящее от латеральной ножки, размерами 10×15 мм, плотностью 17 HU, равномерно накапливающее контраст до 67 HU. С целью дифференциальной диагностики АКТГ-зависимых форм эндогенного гиперкортицизма рекомендовано проведение селективного забора крови из нижних каменистых синусов, однако пациентка отказалась.
В возрасте 52 лет в связи с ухудшением состояния, сохранением кризового течения артериальной гипертензии, несмотря на четырехкомпонентную гипотензивную терапию, пациентка госпитализирована в эндокринологическое отделение областной больницы по месту жительства, где выполнена лапароскопическая левосторонняя адреналэктомия. В раннем послеоперационном периоде клинических проявлений надпочечниковой недостаточности — основного предиктора радикально проведенной операции — не наблюдалось.
При обследовании по месту жительства через год после хирургического лечения сохранялись лабораторные признаки эндогенного гиперкортицизма в виде повышения уровня АКТГ утром до 132,0 нг/мл (0,0–46,0 нг/мл). По данным МРТ головного мозга с контрастным усилением — МР-признаки микроаденомы гипофиза размерами 5,5×5,3×5,4 мм.
При госпитализации в ФГБУ «НМИЦ эндокринологии» Минздрава России (в возрасте 54 лет) подтверждено нарушение циркадного ритма АКТГ и кортизола, повышение уровня кортизола в слюне в 23:00 до 30,0 нмоль/л, свободного кортизола в суточной моче — до 750,2 нмоль/сут. По данным двухэнергетической рентгеновской абсорбциометрии (dual-energy X-ray absorptiometry, DXA) выявлено снижение минеральной плотности кости в поясничном отделе позвоночника до -3,3SD по Т-критерию, в связи с чем выполнена внутривенная инфузия золедроновой кислоты 5 мг/100 мл. По результатам МРТ головного мозга в правых отделах аденогипофиза определялось образование размерами 12×8×11 мм. По совокупности данных пациентке установлен диагноз БИК, проведена трансназальная аденомэктомия.
В раннем послеоперационном периоде развилась вторичная надпочечниковая недостаточность, в связи с чем назначена заместительная терапия гидрокортизоном в дозе 25 мг/сут. Через 4 нед после оперативного вмешательства — эпизод острой надпочечниковой недостаточности, купированный 100 мг гидрокортизона внутривенно.
Через 4 мес после проведенного оперативного лечения БИК пациентка планово госпитализирована в отделение нейроэндокринологии и остеопатий ФГБУ «НМИЦ эндокринологии» Минздрава России, где в ходе лабораторного обследования подтверждена ремиссия БИК (кортизол в крови утром — 20 нмоль/л, АКТГ — 11 пг/мл). При поступлении пациентка получала гидрокортизон в дозе 30 мг/сут, сохранялась тенденция к гипотонии (АД 80/60 мм рт.ст.).
При осмотре: рост 163 см (снижение в росте на 2,5 см за жизнь), масса тела 70 кг, ИМТ 26,3 кг/м2. Основными предъявляемыми жалобами пациентки были болезненность при движении в области лучезапястных суставов, ограничения объема движения в них, онемение пальцев рук. Вышеперечисленные жалобы стали беспокоить через 2 мес после хирургического лечения по поводу БИК, в связи с чем самостоятельно принимала НПВП, однако клинически значимого улучшения состояния не отмечала.
При обследовании в стационаре выявлено повышение уровня мочевой кислоты сыворотки крови до 447 мкмоль/л на фоне нормального уровня СОЭ (5 мм/ч). Учитывая выраженный болевой синдром (65 мм по ВАШ) и неэффективность предшествующей терапии НПВП, выполнена однократная внутримышечная инъекция триамцинолона, на фоне которой субъективно отметила улучшение в виде уменьшения интенсивности боли в суставах. Проведено исследование, по результатам которого ревматоидный фактор составил 7,6 МЕ/мл (<14 МЕ/мл), антитела к циклическому цитруллин-содержащему пептиду (АЦЦП) <7 Ед/мл (<17 Ед/мл), С-реактивный белок в крови — 0,4 мг/л (0,1–5 мг/л). По данным рентгенографии кистей, стоп и коленных суставов выявлены признаки остеоартрита 1–2-й ст. по Kellgren–Lawrence.
После выписки из стационара пациентка консультирована в ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой». Заподозрен синдром дисплазии соединительной ткани, выявлено выраженное комбинированное продольно-поперечное плоскостопие, вальгусная деформация 1-х пальцев, молоткообразная деформация 2–5-х пальцев стоп, по поводу чего в ноябре 2021 г. и в марте 2022 г. выполнены реконструктивные операции на заднем и среднем отделах соответственно левой и правой стоп. С 2022 г. приступов артрита отмечено не было, однако сохранялись артралгии в кистях и стопах (до 50 мм по ВАШ).
Пациентка повторно обратилась в ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой». При осмотре выявлялась болезненность в таранно-пяточных, 1-х плюсне-фаланговых, 2–4-х пястно-фаланговых и лучезапястных суставах. По данным анализов крови отмечено персистирование гиперурикемии (мочевая кислота сыворотки крови 429 мкмоль/л), маркеры острой фазы воспаления оставались в пределах нормальных значений. Проведена диагностическая пункция 1-го плюсне-фалангового сустава справа, однако кристаллы в синовиальной жидкости обнаружены не были. УЗИ также не выявило признаков депонирования кристаллов. В качестве дополнительного метода визуализации использована двухэнергетическая компьютерная томография (ДЭКТ), посредством которой выявлены депозиты кристаллов моноурата натрия в таранно-пяточном суставе левой стопы (рис. 1).
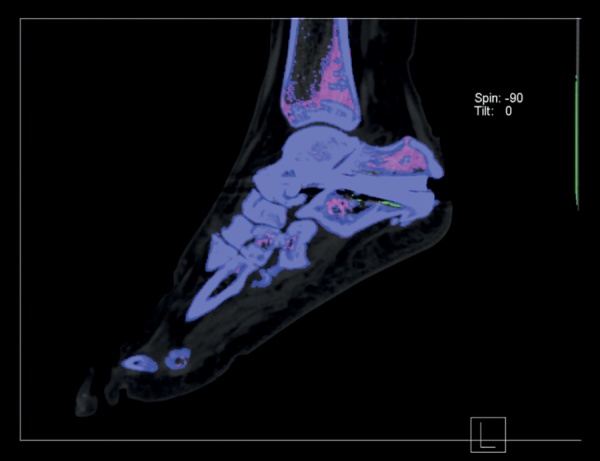
Рисунок 1. Двухэнергетическая компьютерная томография стоп пациентки С.
Примечание. Полученные при двухэнергетической компьютерной томографии данные отображаются в виде трехмерной модели c цветовым кодом. Отложение кристаллов моноурата натрия показано зеленым цветом, визуализируется в таранно-пяточном суставе левой стопы. Синим цветом обозначена кортикальная кость, фиолетовым — трабекулярная.
Figure 1. Dual-energy computed tomography of the feet of patient S.
Comments. Data obtained from dual-energy computed tomography is displayed as a three-dimensional model with a color code. The deposition of monosodium urate crystals is shown in green, visualized in the talocalcaneal joint of the left foot. Blue indicates cortical bone, purple indicates trabecular bone.
В соответствии с критериями ACR/EULAR 2015 г. верифицирован диагноз подагры. Инициирована уратснижающая терапия аллопуринолом 300 мг/сут и профилактическая противовоспалительная терапия колхицином 0,5 мг/сут в режиме длительного приема.
ОБСУЖДЕНИЕ
Своевременно проведенное оперативное лечение эндогенного гиперкортицизма в большинстве случаев позволяет сохранить жизнь пациента, существенно улучшить ее качество. В то же время восстановление концентрации ГК и одновременное восстановление числа иммунокомпетентных клеток может стать триггерным фактором в развитии или обострении аутоиммунных заболеваний [11]. Интересно, что одним из первых препаратов, которые доказали свою эффективность при симптоматическом лечении подагры, был АКТГ, причем еще до внедрения в рутинную клиническую практику ГК [14]. Более того, опубликованы данные, что однократная инъекция АКТГ для купирования острого приступа подагрического артрита не уступает в эффективности таковой для ГК [15]. Но если до последнего десятилетия применение ГК при подагре ограничивалось, как правило, их рутинным использованием для купирования острых приступов артрита, то в последние годы они, наряду с колхицином и НПВП, назначаются длительно в низких дозах с целью профилактики приступов [16], что снижает не только их частоту, но и интенсивность, тем самым «стирая» характерные для подагры симптомы артрита (сильнейшая боль, ограничение функции, гиперемия и гипертермия и т.д.) [4][17].
В представленном клиническом случае у пациентки проявления заболевания лишь частично соответствовали классификационным критериям подагры: вовлечение 1-х плюснефаланговых суставов, самокупирование приступа в течение нескольких дней, незначительное повышение сывороточного уровня мочевой кислоты [18]. Кроме того, многолетнее отсутствие приступов артрита при сохраняющейся гиперурикемии и отсутствии адекватной уратснижающей терапии предопределяло необходимость подтверждения диагноза подагры с помощью инструментальных методов. Важно, что явления артрита, а затем его спонтанная ремиссия предшествовали появлению явных симптомов эндогенного гиперкортицизма. По всей видимости, длительное повышение уровня ГК, имеющих выраженный противовоспалительный эффект, маскировало признаки подагрического артрита. При купировании явлений эндогенного гиперкортицизма и снижении уровня ГК в периферическом кровотоке у пациентки вновь развилось обострение артрита, идентифицировать который, основываясь исключительно на клинической картине, было затруднительно. Так, учитывая преимущественное поражение мелких суставов кистей, жалобы на скованность и тугоподвижность, а также наличие в анамнезе гиперурикемии, которая имеет место и в настоящее время, требовалось проведение дифференциальной диагностики между ревматоидным артритом и заболеваниями группы микрокристаллических артритов. Отсутствие активного синовита мелких суставов кистей, нормальная концентрация острофазовых показателей, отрицательные уровни ревматоидного фактора и АЦЦП, отсутствие деструктивных изменений суставов по данным рентгенологического исследования минимизировали вероятность ревматоидного артрита [19]. Однако и диагноз микрокристаллического артрита, учитывая отсутствие рентгенографических и сонографических признаков депонирования кристаллов, а также отсутствие кристаллов в синовиальной жидкости (исследовалась 2-кратно), оставался сомнительным, но в то же время не исключенным.
Важно, что УЗИ стоп, с одной стороны, не показав характерных для подагры и болезни депонирования кристаллов пирофосфата кальция признаков, выявило наличие синовитов левого голеностопного и таранно-ладьевидного суставов, «минимальные» асимметричные синовиты лучезапястных и мелких суставов кистей. Последний факт также не позволил приблизиться к верному диагнозу: поражение мелких суставов кистей и лучезапястных суставов хоть и характерно, но не патогномонично для ревматоидного артрита, а отсутствие симметрии поражения суставов, чаще встречающееся у пациенток с болезнью депонирования кристаллов пирофосфата кальция и подагрой, также не может быть критерием установления диагноза микрокристаллического артрита [20, 21].
Кроме того, и подагра, и болезнь депонирования кристаллов пирофосфата кальция могут сочетаться как между собой, так и с другими ревматическими заболеваниями, что еще больше затрудняет своевременную верификацию диагноза [22][23]. В научной литературе описаны схожие с этим клинические случаи, когда хронический артрит как при подагре, так и при болезни депонирования кристаллов пирофосфата кальция симулирует симптомы ревматоидного артрита [24][25].
Болезнь депонирования кристаллов пирофосфата кальция является результатом их накопления в суставном хряще и развивающегося в результате воспаления иммунного характера. Согласно рекомендациям Европейской антиревматической лиги (European League Against Rheumatism, EULAR) [26], для подтверждения диагноза болезни депонирования кристаллов пирофосфата кальция необходимы определение кристаллов пирофосфата кальция методом поляризационной микроскопии, а также выявление хондрокальциноза инструментальными методами. Однако признаков хондрокальциноза по результатам лучевой диагностики получено не было, что в совокупности с отсутствием кристаллов в синовиальной жидкости делало этот диагноз также сомнительным, но, как и в случае с подагрой, не исключало его полностью [27]. При этом вполне вероятно, что, как и в случае подагры, клиническая симптоматика болезни депонирования кристаллов пирофосфата кальция в условиях гиперкортицизма может быть менее явной.
Таким образом, единственным диагностическим методом, входящим в классификационные критерии подагры и рассматриваемым как потенциально важный для диагностики болезни депонирования кристаллов пирофосфата кальция, оставалась ДЭКТ [18][28]. Для выявления отложений кристаллов пирофосфата ДЭКТ более чувствительна, но менее специфична в сравнении с рентгенографией [29]. Однако в отношении кристаллов моноурата натрия ДЭКТ обладает более высокой чувствительностью (90,4%) и специфичностью (74,5%). Визуализация кристаллов моноурата натрия по данным ДЭКТ в совокупности с другими признаками подагры увеличивает чувствительность действующих критериев диагноза подагры ACR/EULAR 2015 г. до 100% [30]. В случае пациентки С. результаты ДЭКТ стоп выявили отложения кристаллов моноурата натрия в таранно-пяточном суставе (рис. 1), то есть именно там, где определялись признаки артрита по данным сонографии.
ЗАКЛЮЧЕНИЕ
Представленный клинический случай иллюстрирует необходимость более настороженного отношения врачей к возможности развития или обострения аутовоспалительных заболеваний после достижения ремиссии эндогенного гиперкортицизма. Несмотря на высокую распространенность, диагностика и лечение микрокристаллических артритов до сих пор вызывают затруднения специалистов. Применение современных методов диагностики с целью верификации сходных по клинической картине заболеваний позволит с высокой вероятностью установить верный клинический диагноз. Выбор оптимальной терапии должен осуществляться индивидуально у каждого пациента с учетом противопоказаний и сопутствующих заболеваний.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Пациентка обследована на базе ФГБУ «НМИЦ эндокринологии» Минздрава России, ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой».
Согласие пациента. Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Ожирение и метаболизм».
Конфликт интересов. Дзеранова Л.К. — заведующая редакцией журнала «Ожирение и метаболизм»; Пигарова Е.А. — член редколлегии журнала «Ожирение и метаболизм»; Мельниченко Г.А. — заместитель главного редактора журнала «Ожирение и метаболизм».
Участие авторов. Дзеранова Л.К. — разработка концепции и дизайна, ведение пациентки, редактирование текста рукописи, одобрение финальной версии рукописи; Елисеев М.С. — ведение пациентки, написание и редактирование текста рукописи; Голоунина О.О. — сбор и анализ данных, написание текста; Черёмушкина Е.В. — ведение пациентки, редактирование текста рукописи; Пигарова Е.А., Мельниченко Г.А. — редактирование текста, одобрение финальной версии рукописи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных сточностью или добросовестностью любой части работы.
Список литературы
1. Голоунина О.О., Белая Ж.Е., Рожинская Л.Я., и др. Клиниколабораторная характеристика и результаты лечения пациентов с АКТГ-продуцирующими нейроэндокринными опухолями различной локализации // Терапевтический архив. — 2021. — Т. 93. — №10. — С. 1171-1178. doi: https://doi.org/10.26442/00403660.2021.10.201102
2. Belaya Z, Golounina O, Melnichenko G, et al. Clinical course and outcome of patients with ACTH-dependent Cushing's syndrome infected with novel coronavirus disease-19 (COVID-19): case presentations. Endocrine. 2021;72(1):12-19. doi: https://doi.org/10.1007/s12020-021-02674-5
3. Барскова В.Г., Елисеев М.С., Денисов И.С. Опыт лечения больного подагрой с хронической надпочечниковой недостаточностью // Современная ревматология. — 2012. — Т. 6. — №4. — С. 61-65. doi: https://doi.org/10.14412/1996-7012-2012-765
4. Чикина М.Н., Елисеев М.С., Желябина О.В. Сравнение эффективности и безопасности различных противовоспалительных препаратов при инициации уратснижающей терапии у пациентов с подагрой (предварительные данные) // Современная ревматология. — 2021. — Т. 15. — №2. — С. 50-56. doi: https://doi.org/10.14412/1996-7012-2021-2-50-56.
5. Yakushiji F, Kita M, Hiroi N, et al. Exacerbation of rheumatoid arthritis after removal of adrenal adenoma in Cushing's syndrome. Endocr J. 1995;42(2):219-223. doi: https://doi.org/10.1507/endocrj.42.219
6. Uthman I, Senecal JL. Onset of rheumatoid arthritis after surgical treatment of Cushing's disease. J Rheumatol. 1995;22(10):1964-1966.
7. Bongetta D, Zoia C, Lombardi F, et al. Systemic sarcoidosis unmasked by Cushing's disease surgical treatment. Case Rep Med. 2016;2016:1-3. doi: https://doi.org/10.1155/2016/6405840
8. Diernaes JEF, Bygum A, Poulsen PL. Unmasking sarcoidosis following surgery for Cushing disease. Dermatoendocrinol. 2016;8(1):e983688. doi: https://doi.org/10.4161/derm.29855
9. Norena-Rengifo BD, Gomez-Corrales JD, Roman-Gonzalez A. Unmasking of sarcoidosis after successful management of Cushing's syndrome. Cureus. 2019;11(1):e3896. doi: https://doi.org/10.7759/cureus.3896
10. Noguchi Y, Tamai H, Fujisawa K, et al. Systemic lupus erythematosus after pituitary adenomectomy in a patient with Cushing's disease. Clin Endocrinol. 1998;48(5):670-672. doi: https://doi.org/10.1046/j.1365-2265.1998.00489.x
11. Muzulu SI., Howlett TA. Polymyalgia rheumatica presenting after successful treatment of Cushing's disease. Rheumatology. 1998;37(7):804-805. doi: https://doi.org/10.1093/rheumatology/37.7.804
12. Colao A, Pivonello R, Faggiano A, et al. Increased prevalence of thyroid autoimmunity in patients successfully treated for Cushing's disease. Clin Endocrinol (Oxf). 2000;53(1):13-19. doi: https://doi.org/10.1046/j.1365-2265.2000.01018.x
13. Мельниченко Г.А., Дедов И.И, Белая Ж.Е., и др. Болезнь Иценко-Кушинга: клиника, диагностика, дифференциальная диагностика, методы лечения // Проблемы эндокринологии. — 2015. — Т. 61. — №2. — С. 55-77. doi: https://doi.org/10.14341/probl201561255-77
14. Hench PS. Effects of cortisone acetate and pituitary ACTH on rheumatoid arthritis, rheumatic fever and certain other conditions: A Study in Clinical Physiology. Arch Intern Med (Chic). 1950;85(4):545-666. doi: https://doi.org/10.1001/archinte.1950.00230100002001
15. Daoussis D, Kordas P, Varelas G, et al. ACTH vs steroids for the treatment of acute gout in hospitalized patients: a randomized, open label, comparative study. Rheumatol Int. 2022;42(6):949-958. doi: https://doi.org/10.1007/s00296-022-05128-x
16. Елисеев МС. Рекомендации Американской коллегии ревматологов (2020 г.) по ведению больных подагрой: что нового и что спорно // Научно-практическая ревматология. — 2021. — Т. 59. — №2. — С. 129-133. doi: https://doi.org/10.47360/1995-4484-2021-129-133
17. Yu J, Qiu Q, Liang L, et al. Prophylaxis of acute flares when initiating febuxostat for chronic gouty arthritis in a real-world clinical setting. Modern Rheumatology. 2018;28(2):339-344. doi: https://doi.org/10.1080/14397595.2017.1318467
18. Елисеев МС. Классификационные критерии подагры (рекомендации ACR/EULAR) // Научно-практическая ревматология. — 2015. — Т. 53. — №6. — 581-585. doi: https://doi.org/10.14412/1995-4484-2015-581-585
19. Елисеев М.С., Владимиров С.А. Распространенность и клинические особенности подагры и БДПК у пациентов с острым артритом // Научно-практическая ревматология. — 2015. — Т. 53. — №4. — С. 375-378. doi: https://doi.org/10.14412/1995-4484-2015-375-378
20. Кудаева Ф.М., Владимиров С.А., Елисеев М.С., и др. Особенности клинических проявлений болезни депонирования кристаллов пирофосфата кальция // Научно-практическая ревматология. — 2014. — Т. 52. — №4. — С. 405-409. doi: https://doi.org/10.14412/1995-4484-2014-405-409
21. Елисеев М.С., Чикаленкова Н.А., Барскова В.Г. Клинические особенности подагры у женщин: результаты сравнительного исследования // Научно-практическая ревматология. — 2014. — Т. 52. — №2. — С. 178-182. doi: https://doi.org/10.14412/1995-4484-2014-178-182
22. Reuss-Borst M, Tausche A-K. Gicht und Calciumpyrophosphat-Dihydrat-Arthropathie («Pseudogicht») — ein Update. Dtsch med Wochenschr. 2018;143(16):1157-1166. doi: https://doi.org/10.1055/a-0504-5684
23. Георгинова О.А., Горбунов Р.М., Кадрев А.В., Плисюк А.Г. Трудности верификации диагноза у пациента с подагрой и пирофосфатной артропатией // Терапия. — 2019. — Т. 3. — №29. — С. 136-139. doi: https://doi.org/10.18565/therapy.2019.3.136-139
24. Aletaha D, Neogi T, Silman AJ, et al. 2010 Rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis. 2010;69(9):1580-1588. doi: https://doi.org/10.1136/ard.2010.138461
25. Владимиров С.А., Елисеев М.С., Раденска-Лоповок С.Г., Барскова В.Г. Дифференциальная диагностика ревматоидного артрита и подагры // Современная ревматология. — 2008. — Т. 2. — №4. — С. 39-41. doi: https://doi.org/10.14412/1996-7012-2008-505
26. Zhang W, Doherty M, Pascual E, et al. EULAR recommendations for calcium pyrophosphate deposition. Part II: Management. Ann Rheum Dis. 2011;70(4):571-575. doi: https://doi.org/10.1136/ard.2010.139360
27. Елисеев М.С., Желябина О.В., Чикина М.Н. Возрастные особенности болезни депонирования кристаллов пирофосфата кальция // Научно-практическая ревматология. — 2019. — Т. 57. — №6. — С. 651-656. doi: https://doi.org/10.14412/1995-4484-2019-651-656
28. Filippou G, Filippucci E, Mandl P, Abhishek A. A critical review of the available evidence on the diagnosis and clinical features of CPPD: do we really need imaging? Clin Rheumatol. 2021;40(7):2581-2592. doi: https://doi.org/10.1007/s10067-020-05516-3
29. Tanikawa H, Ogawa R, Okuma K, et al. Detection of calcium pyrophosphate dihydrate crystals in knee meniscus by dualenergy computed tomography. J Orthop Surg Res. 2018;13(1):73. doi: https://doi.org/10.1186/s13018-018-0787-0
30. Sotniczuk M, Nowakowska-Ptaza A, Wronski J, et al. The clinical utility of dual-energy computed tomography in the diagnosis of gout — A cross-sectional study. J Clin Med. 2022;11(17):5249. doi: https://doi.org/10.3390/jcm11175249
Об авторах
Л. К. ДзерановаРоссия
Дзеранова Лариса Константиновна - доктор медицинских наук.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Нет
М. С. Елисеев
Россия
Елисеев Максим Сергеевич – кандидат медицинских наук.
Москва
Конфликт интересов:
Нет
О. О. Голоунина
Россия
Голоунина Ольга Олеговна.
Москва
Конфликт интересов:
Нет
Е. В. Черёмушкина
Россия
Черёмушкина Елена Владимировна.
Москва
Конфликт интересов:
Нет
Е. А. Пигарова
Россия
Пигарова Екатерина Александровна – доктор медицинских наук.
Москва
Конфликт интересов:
Нет
Г. А. Мельниченко
Россия
Мельниченко Галина Афанасьевна – доктор медицинских наук, профессор
Москва
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Двухэнергетическая компьютерная томография стоп пациентки С. | |
| Тема | ||
| Тип | рисунок | |
Посмотреть
(82KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Дзеранова Л.К., Елисеев М.С., Голоунина О.О., Черёмушкина Е.В., Пигарова Е.А., Мельниченко Г.А. Течение подагры у пациентки с болезнью Иценко-Кушинга после успешного хирургического лечения. Ожирение и метаболизм. 2022;19(4):404-409. https://doi.org/10.14341/omet12945
For citation:
Dzeranova L.K., Eliseev M.S., Golounina O.O., Cheremushkina E.V., Pigarova E.A., Melnichenko G.A. The course of gout in a patient with Cushing’s disease after successful surgical treatment. Obesity and metabolism. 2022;19(4):404-409. (In Russ.) https://doi.org/10.14341/omet12945

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































