Перейти к:
Дигидротахистерол: неоправданный выбор в терапии хронического гипопаратиреоза
https://doi.org/10.14341/omet12882
Аннотация
Гипопаратиреоз — эндокринное заболевание, обусловленное поражением околощитовидных желез, при котором снижена или отсутствует секреция паратиреоидного гормона. Это неизбежно приводит к нарушению фосфорно-кальциевого обмена с развитием гипокальциемии и связанных с этим состоянием осложнений. При хроническом течении гипопаратиреоза требуется пожизненная медикаментозная терапия, включающая препараты витамина D и кальция.
Целью лечения является достижение целевых показателей фосфорно-кальциевого обмена, однако в то же время имеется риск ятрогенной гиперкальциемии, вплоть до развития гиперкальциемического криза, часто осложняющегося развитием острой почечной недостаточности. В свою очередь, длительно сохраняющаяся, даже относительная гиперкальциемия — неблагоприятный фактор риска нефролитиаза, нефрокальциноза, хронической почечной недостаточности вплоть до пред- и диализных стадий.
Дигидротахистерол — синтетический аналог витамина D, ранее активно применявшийся в комплексной терапии гипопаратиреоза. В соответствии с современными представлениями, отечественными и зарубежными рекомендациями данный препарат не должен использоваться в лечении хронического гипопаратиреоза. Особенности метаболизма дигидротахистерола (длительный период выведения, отсутствие регуляции синтеза активных метаболитов дигидротахистерола по типу обратной связи, высокая биологическая активность) и, как следствие, узкий терапевтический диапазон обуславливают частое развитие гиперкальциемии и ассоциированных с ней нарушений.
В данной статье приводится собственное клиническое наблюдение серии случаев пациентов с хроническим гипопаратиреозом, получавших терапию дигидротахистеролом, осложнившуюся тяжелой гиперкальциемией и острой почечной недостаточностью.
Ключевые слова
Для цитирования:
Авсиевич Е.С., Ковалева Е.В., Горбачева А.М., Еремкина А.К., Мокрышева Н.Г. Дигидротахистерол: неоправданный выбор в терапии хронического гипопаратиреоза. Ожирение и метаболизм. 2022;19(2):198-205. https://doi.org/10.14341/omet12882
For citation:
Avsievich E.S., Kovaleva E.V., Gorbacheva A.M., Eremkina A.K., Mokrysheva N.G. Dihydrotachysterol: a bad choice in the treatment of chronic hypoparathyroidism. Obesity and metabolism. 2022;19(2):198-205. (In Russ.) https://doi.org/10.14341/omet12882
АКТУАЛЬНОСТЬ
Гипопаратиреоз — заболевание, характеризующееся недостатком паратиреоидного гормона (ПТГ), приводящим к гипокальциемии, гиперфосфатемии и повышению фракционной экскреции кальция с мочой [1]. Распространенность гипопаратиреоза варьирует в пределах от 23 до 37 случаев на 100 тыс. человек. Наиболее частой причиной является проведение оперативного вмешательства на органах шеи (примерно в 78–80% случаев) [2]. В целом частота гипопаратиреоза после операции на области шеи составляет около 8% случаев, среди них у 75% пациентов наблюдаются транзиторные нарушения, разрешающиеся в течение первых 6 мес после вмешательства [3]. Хронический послеоперационный гипопаратиреоз, как правило, диагностируется не более чем в 2% случаев [4]. К другим причинам развития гипопаратиреоза относятся различные генетические заболевания [5], включающие аутоиммунный гипопаратиреоз в рамках аутоиммунного полигландулярного синдрома 1 типа, аутосомно-доминантную гипокальциемию, синдром ДиДжорджи и др. В редких случаях поражение околощитовидных желез (ОЩЖ) может быть следствием их инфильтрации при гемохроматозе, болезни Вильсона, а также вследствие метастатического процесса. Описаны казуистические случаи пострадиационного поражения ОЩЖ. Диагноз идиопатического гипопаратиреоза устанавливается после исключения основных причин развития заболевания, в том числе с помощью медико-генетического консультирования [4].
Некомпенсированный гипопаратиреоз характеризуется повышенной нервно-мышечной проводимостью и может проявляться разнообразными симптомами гипокальциемии, начиная от легкой парестезии, мышечных спазмов и удлинения скорректированного интервала QT (QTc) до тяжелых, угрожающих жизни проявлений, таких как аритмия, ларингоспазм и тетания. Однако у некоторых пациентов, особенно с определенными генетическими формами гипопаратиреоза, гипокальциемия может протекать бессимптомно [2]. К основным терапевтическим целям относится поддержание низко-нормальных показателей кальция в сыворотке крови. Согласно действующим рекомендациям, на фоне терапии допускаются также значения кальциемии несколько ниже референса при условии отсутствия проявлений заболевания. Концентрации фосфора, магния и показатели суточной кальциурии должны находиться в пределах референсных диапазонов (РД), а концентрация 25(ОН) витамина D — более 30 нг/мл (75 нмоль/л), как и в общей популяции [6]. Помимо достижения целевых лабораторных показателей, лечение хронического гипопаратиреоза направлено на предотвращение симптомов гипокальциемии и минимизацию развития осложнений заболевания [7]. Однако стандартная терапия препаратами кальция и активными формами витамина D может увеличивать риски развития осложнений вследствие неадекватно подобранных доз. Таким образом, некоторые осложнения гипопаратиреоза могут быть связаны не только с самим заболеванием, но и нерационально подобранными схемами лечения [8].
Для лечения гипокальциемии при гипопаратиреозе в разное время использовались различные лекарственные препараты. Впервые в 1909 г. W. MacCallum и C. Voegtlin заметили, что паратиреоидэктомия сопровождается гипокальциемией, апарентеральное введение экстракта ОЩЖ и кальция эффективно для ее купирования [9]. В 1928 г. был открыт эргостерол, превращающийся под действием ультрафиолетовых лучей в эргокальциферол и колекальциферол. Терапия гипопаратиреозана тот момент включала в себя прием высоких доз колекальциферола (60–920 тыс. МЕ в сутки) [10]. В 1933 г. был разработан препарат дигидротахистерола (ДГТ), являющийся фотохимическим производным эргокальциферола, в 1938 г. он был впервый раз применен у пациентов с гипопаратиреозом [11]. В 1971 г. был выделен активный метаболит витамина D — 1,25(OH)2D3 (кальцитриол), искусственно синтезировать его получилось в 1972 г., а в 1986 г. он был уже представлен в виде лекарственного средства. В 1973 г. экспериментально был получен 1α-гидроксивитамин D3 [12], и в 1981 г. японской фармацевтической компанией Chugai совместно с Институтом биомедицинских исследований Teijin разработан альфакальцидол (1α-гидроксивитамин D3) [13]. На сегодняшний день препараты кальцитриол и альфакальцидол являются основными для лечения пациентов с гипопаратиреозом.
В данном клиническом наблюдении представлена серия случаев пациентов (табл. 1), получавших ДГТ для лечения гипопаратиреоза с развитием выраженной гиперкальциемии и острой почечной недостаточности вследствие передозировки препаратом. Случаи наглядно иллюстрируют последствия приема ДГТ без регулярного контроля кальция крови, а также опасность самостоятельного изменения получаемой дозы.
Таблица 1. Динамика изменений лабораторных данных и проводимого лечения пациентов
Пациент | Доза ДГТ | Время приема | Промежуточный контроль показателей | Лабораторные данные на фоне гиперкальциемии в стационаре | Проводимое лечение | Время восстановления нормокальциемии | Лабораторные данные после лечения | Дальнейшая терапия |
1 | 6 кап./сут, увеличение до 30 кап./сутки | по 30 кап./сут около | кальций общ. 3,61 ммоль/л | кальций общ. 3,71 ммоль/л | отмена ДГТ, инфузионная терапия | 10 дней | кальций общ. 2,16 ммоль/л | Альфакальцидол Карбонат кальция 1000 мг/сут, Колекальциферол 1000 МЕ/сут |
кальций ион. 1,65 ммоль/л | кальций ион. 1,79 ммоль/л | кальций ион. 1,08 ммоль/л | ||||||
фосфор | - | фосфор 0,94 ммоль/л | ||||||
рСКФ по EPI | рСКФ по EPI | рСКФ по EPI | ||||||
мочевина 20,1 | мочевина 18,5 | мочевина 10,2 | ||||||
2 | 42 кап./сут | 12 дней | кальций общ 3,28 ммоль/л | кальций общ., фосфор неизвестны | отмена ДГТ, инфузионная терапия | 5 дней | кальций общ. 2,91 ммоль/л с последующим снижением до РД | Карбонат кальция 1000 мг/сут, Колекальциферол 1000-1500 МЕ/сут |
рСКФ по EPI | ||||||||
мочевина 9,6 | ||||||||
3 | 30 кап./сут | 10 дней | - | кальций общ. 6,0 ммоль/л | отмена ДГТ, инфузионная терапия | 7 дней | кальций скорр. 2,1 ммоль/л | Кальцитриол Карбонат кальция 2000 мг/сут |
фосфор | фосфор 1,27 ммоль/л | |||||||
рСКФ по EPI 18 мл/мин/1,73 м2 | рСКФ по EPI 58 мл/мин/1,73 м2 | |||||||
4 | 8 кап./сут | 17 лет | - | кальций общ. 3,3 ммоль/л | отмена ДГТ | 2 месяца | кальций скорр. 1,8 ммоль/л | Альфакальцидол 0,5 мкг/сут, Карбонат кальция 1500 мг/сут |
рСКФ по EPI | фосфор 1,87 ммоль/л | |||||||
рСКФ по EPI 21 мл/мин/1,73 м2 |
ОПИСАНИЕ КЛИНИЧЕСКИХ СЛУЧАЕВ
Клинический случай 1
Пациентка А., 63 лет, из анамнеза известно, что в 2003 г., после проведенной тотальной тиреоидэктомии по поводу папиллярного рака щитовидной железы, развился хронический гипопаратиреоз. Длительно получала терапию кальция карбонатом в дозе 1000 мг/сут, однако симптоматика гипокальциемии сохранялась. В связи с частыми эпизодами судорог неоднократно самостоятельно вводила 10–20 мл кальция хлорида внутривенно с краткосрочным положительным эффектом. С 2006 г. по рекомендации эндокринолога к терапии добавлен ДГТ по 6 капель/сут. На этом фоне состояние пациентки улучшилось, и она в течение длительного времени не обращалась за медицинской помощью. Регулярного контроля показателей фосфорно-кальциевого обмена не проводилось.
В 2017 г. в связи с возобновлением судорог пациентка самостоятельно увеличила дозу ДГТ с 6 до 30 капель/сут (рис. 1), которую получала на протяжении 5 дней с последующим присоединением тошноты и рвоты. С указанными жалобами обратилась за амбулаторной помощью в ФГБУ «НМИЦ эндокринологии» Минздрава России, где была зафиксирована выраженная гиперкальциемия (кальций общий 3,61 ммоль/л, РД 2,15–2,55; кальций ионизированный 1,65 ммоль/л, РД 1,03–1,29), атакже снижение фильтрационной функции почек (расчетная скорость клубочковой фильтрации (рСКФ) по EPI 13 мл/мин/1,73 м2) с повышением мочевины до 20,1 ммоль/л (РД 2,5–6,7). С диагнозом гиперкальциемического криза, осложнившегося острым интерстициальным нефритом и острой почечной недостаточностью, пациентка была экстренно госпитализирована в нефрологическое отделение. В стационаре проводилась инфузионная терапия физиологическим раствором в течение 10 дней с положительным эффектом, на момент выписки достигнута нормокальциемия (кальций общий 2,16 ммоль/л, кальций ионизированный 1,08 ммоль/л) и нормофосфатемия (0,94 ммоль/л, РД 0,74-1,52), повышение рСКФ по EPI до 36 мл/мин/1,73 м2. При УЗИ в обеих почках впервые выявлены гиперэхогенные включения размерами 3,5 и 2 см. По данным эхокардиографии определялись кальцинаты кольца и створок аортального клапана. После стабилизации основных показателей фосфорно-кальциевого обмена пациента была переведена на терапию альфакальцидолом в дозе 1 мкг/сут и препаратами кальция (1500–3000 мг/сут).
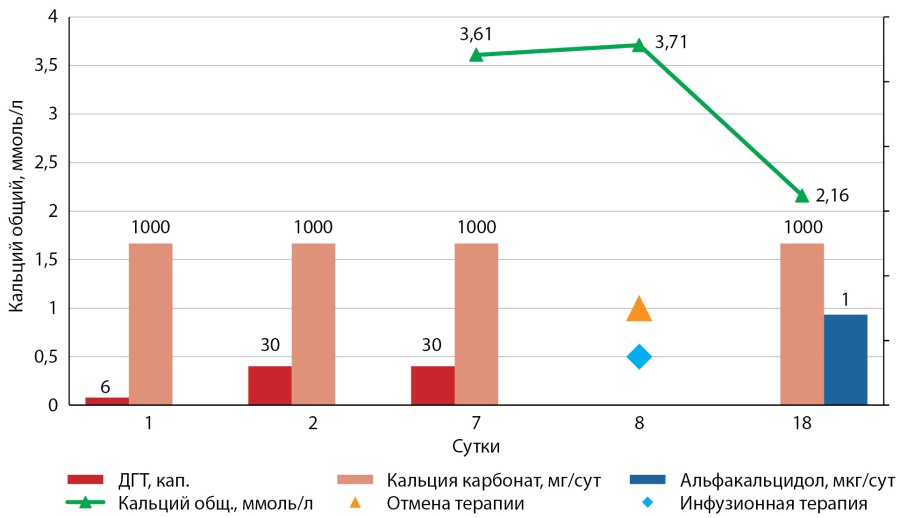
Рис. 1. Динамика изменения кальциемии у пациентки А. в зависимости от получаемой терапии.
В дальнейшем пациентка продолжила наблюдаться в ФГБУ «НМИЦ эндокринологии» Минздрава России. Последняя госпитализация в 2022 г., где по данным лабораторного обследования отмечена субкомпенсация фосфорно-кальциевого обмена — нормокальциемия (альбумин-скорректированный кальций 2,25 ммоль/л); нормофосфатемия (1,5 ммоль/л) и гиперкальциурия (9,1 ммоль/сут) на фоне терапии альфакальцидолом в дозе 2,5 мкг/сут, карбонатом кальция 3000 мг/сут. Гипомагниемия исключена (0,763 ммоль/л). В стационаре проведена коррекция терапии — доза карбоната кальция уменьшена до 2000 мг/сут, доза альфакальцидола оставлена без изменений. Фильтрационная функция почек оставалась удовлетворительной (рСКФпо EPI 79 мл/мин/1,73 м2). При УЗИ почек отмечены диффузные изменения паренхимы обеих почек, уплотнение чашечно-лоханочной системы с гиперэхогенными включениями до 0,1-0,3 см без четкой акустической тени (расценены как микролиты), конкремент правой почки до 0,6 см с акустической тенью. Также были отмечены признаки начальной катаракты обоих глаз. По данным нативной МСКТ головного мозга кальцификаций не выявлено.
Клинический случай 2
Пациент Б., 41 год. Диагноз гипопаратиреоза установлен в 2020 г. после проведенной тотальной тиреоидэктомии по поводу папиллярного рака щитовидной железы. Назначено лечение ДГТ 14 капель 3 р/сут, карбонатом кальция 3000 мг/сут. Спустя 12 дней от начала приема ДГТ отметил ухудшение состояния, повышение артериального давления до 160/100 мм рт. ст., давящие боли за грудиной с иррадиацией в голову, в связи с чем госпитализирован в стационар с подозрением на острый коронарный синдром. В ходе госпитализации выявлена тяжелая гиперкальциемия (кальций общий 3,28 ммоль/л), а также значимое снижение фильтрационной функции почек (рСКФ по EPI 44 мл/мин/1,73 м2, мочевина 9,6 ммоль/л). В стационаре был отменен прием препаратов кальция и ДГТ, проводилась инфузионная терапия физиологическим раствором. При контрольных анализах крови спустя 2 дня стационарного лечения общий кальций крови составил 2,91 ммоль/л с последующим снижением до РД. При выписке пациенту рекомендован прием колекальциферола 1000-1500 МЕ/сут и препаратов кальция 1000 мг/сут.
При дальнейшем контроле лабораторных показателей отмечалась умеренная гипокальциемия (в пределах 2,0–2,06 ммоль/л), нормофосфатемия (0,9–3,1 ммоль/л) и восстановление почечной функции (рСКФ по EPI до 111 мл/мин/1,73 м2).
Госпитализация в ФГБУ «НМИЦ эндокринологии» Минздрава России в 2021 г., при поступлении отмечена декомпенсация фосфорно-кальциевого обмена — выраженная гипокальциемия (альбумин-скорректированный кальций 1,87 ммоль/л, ионизированный кальций 0,94 ммоль/л), нормофосфатемия (1,19 ммоль/л), гипокальциурия (2,2 ммоль/сут). Проведена коррекция терапии — инициирован прием альфакальцидола по 0,5 мкг утром и 0,25 мкг вечером (0,75 мкг/сут), увеличена доза карбоната кальция до 1500 мг/сут с достижением и лабораторного и клинического улучшения самочувствия (альбумин-скорректированный кальций 2,02 ммоль/л, фосфор 1,23 ммоль/л). Также проведено обследование на предмет осложнений хронического гипопаратиреоза: фильтрационная функция почек удовлетворительная (рСКФ по EPI 88 мл/мин/1,73 м2), по данным УЗИ почек четких данных за наличие конкрементов не получено. При офтальмологическом осмотре помутнения хрусталика не отмечено.
Клинический случай 3
Пациентка В., 30 лет, из анамнеза известно, что в сентябре 2021 г. была выполнена тиреоидэктомия с центральной лимфодиссекцией по поводу папиллярной аденокарциномы. В послеоперационном периоде развились симптомы гипокальциемии. Внутривенно вводился глюконат кальция, однако уровень кальция не исследовался. Пациентка была выписана с рекомендацией приёма ДГТ 10 капель/сут и карбоната кальция по 2000 мг/сут.
При лабораторном контроле через несколько недель после выписки фиксировалась нормокальциемия (общий кальций 2,23 ммоль/л (РД 2,08–2,65), кальций ионизированный 0,95 ммоль/л (РД 1,05–1,3)), гиперфосфатемия (1,84 ммоль/л (РД 0,81-1,45)). Врачом по месту жительства доза ДГТ была увеличена до 30 кап/сут.
Спустя 10 дней после повышения дозы ДГТ пациентку стала беспокоить выраженная слабость, впоследствии присоединились тошнота и рвота, головокружение, явления наподобие зрительных галлюцинаций. По данным лабораторных анализов от16.10.2021 — общий кальций более 6,0 ммоль/л, фосфор 3,34 ммоль/л, ПТГ 0,477 пмоль/л (РД 1,69—6,9). Пациентка была экстренно госпитализирована в стационар по месту жительства: на момент поступления рСКФ по EPI составила 18 мл/мин/1,73 м2. Проводился форсированный диурез (фуросемидом и физиологическим раствором). На 5–7-й день госпитализации отмечалось значимое снижение уровня кальциемии: общий кальций 2,64 ммоль/л, ионизированный кальций 1,14 ммоль/л; а также улучшение фильтрационной функции почек (рСКФ по EPI 58 мл/мин/1,73 м2). После выписки в анализах крови фиксировались целевые показатели фосфорно-кальциевого обмена: общий кальций 2,06 ммоль/л, альбумин-скорректированный кальций 2,1 ммоль/л, фосфор 1,27 ммоль/л (РД 0,74–1,52), магний 0,67 ммоль/л (РД 0,66–1,07), 25(OH)D 49 нг/мл, суточная кальциурия до 2,97 ммоль/сут (РД 2,5–7,5). Пациентка была выписана без рекомендаций по терапии гипопаратиреоза, в связи с чем обратилась за телемедицинской консультацией в одну из коммерческих клиник г. Москвы, где была назначена терапия карбонатом кальция 2000 мг/сут, кальцитриолом 0,25 мкг/сут. На этом фоне по данным лабораторных анализов крови от января 2022 г.: ПТГ 0,2 пмоль/л (РД 1,17–7,63), нормокальциемия (альбумин-скорректированный кальций 2,304 ммоль/л, ионизированный кальций 1,05 ммоль/л), нормофосфатемия (1,59 ммоль/л (РД 0,78-1,65)), нормомагниемия (0,68 ммоль/л), медикаментозная терапия продолжена в прежнем объеме.
Госпитализация в ФГБУ «НМИЦ эндокринологии» Минздрава России в марте 2022 г. На момент госпитализации получала терапию кальцитриолом 0,25 мкг/сут, кальция карбонатом 1500 мг/сут, колекальциферолом 2000 МЕ/сут. На этом фоне отмечалось сохранение целевых показателей фосфорно-кальциевого обмена с нормокальциемией (альбумин-скорректированный кальций 2,312 ммоль/л), нормофосфатемией (1,23 ммоль/л), нормомагниемией (0,7 ммоль/л) и нормокальциурией (7,02 ммоль/сут). Уровень ПТГ 7,35 пг/мл (РД 15–65), что позволило установить хроническую форму заболевания. Фильтрационная функция почек остается сохранной (рСКФ по EPI 96 мл/мин/1,73 м2). По данным УЗИ почек визуализировались эхографические признаки диффузных изменений паренхимы почек.
Клинический случай 4
Пациентка В., 78 лет, из анамнеза известно, что с 2004 г. после тиреоидэктомии, осложнившейся развитием хронического послеоперационного гипопаратиреоза, рекомендован прием ДГТ по 8 капель/сут, а также препаратов кальция (доза неизвестна).
В 2021 г. отметила появление потливости, потери аппетита, гипотонии. По данным лабораторных анализов крови впервые зафиксирована выраженная гиперкальциемия (кальций общий 3,3 ммоль/л), снижение фильтрационной функции почек (рСКФпо EPI 19 мл/мин/1,73 м2). Эндокринологом по месту жительства рекомендована отмена ДГТ, при этом госпитализация в нефрологический стационар не обсуждалась. Спустя месяц при контрольном анализе крови сохранялась гиперкальциемия до 2,7 ммоль/л по общему кальцию (до 1,34 ммоль/л по кальцию ионизированному), рСКФ по EPI 23 мл/мин/1,73 м2. Пациентка амбулаторно консультирована специалистом ФГБУ «НМИЦ эндокринологии» Минздрава России, рекомендовано питание сограничением молочных продуктов, питьевой режим, контрольный анализ показателей фосфорно-кальциевого обмена через 2 нед или при возникновении судорожного синдрома для назначения терапии альфакальцидолом.
При следующем визите к эндокринологу спустя месяц было отмечено наличие гипокальциемии до 1,816 ммоль/л по альбумин-скорректированному кальцию крови, гиперфосфатемии до 1,87 ммоль/л, рСКФ по EPI 21 мл/мин/1,73 м2. По данным УЗИ почек — микронефролитиаз, парапельвикальная киста левой почки, признаки хронического пиелонефрита. Рекомендована терапия альфакальцидолом в дозе 0,5 мкг/сут и карбонатом кальция 1500 мг/сут. При последующем контроле были достигнуты целевые показатели кальция и фосфора сыворотки крови, уровень рСКФ по EPI без значимой динамики.
ОБСУЖДЕНИЕ
До 2015 г. хронический гипопаратиреоз оставался последним серьезным эндокринным дефицитом без доступной заместительной терапии. Однако, несмотря на создание препаратов рекомбинантного ПТГ, они до сих пор лимитированы в своем использовании для этой когорты пациентов не только на территории РФ, но и в других странах. Традиционная терапия препаратами кальция и активными формами витамина D остается основой лечения хронического гипопаратиреоза. По этой причине оптимизация целевых параметров минерального обмена при минимизации ассоциированных с заболеванием симптомов для профилактики многочисленных острых и отдаленных осложнений хронического гипопаратиреоза остается достаточно сложной задачей [1]. На фоне стандартной терапии сохраняются риски развития гиперкальциемии и гиперкальциурии, которые, в свою очередь, приводят к отложению кальция в почечной паренхиме, прогрессирующему нефролитиазу и почечной недостаточности [14]. В когорте пациентов с хроническим гипопаратиреозом частота нефрокальциноза и нефролитиаза, по данным различных исследований, варьирует от 12 до 57%, при этом риски их развития в 5 раз выше общепопуляционных показателей. Сходные результаты отмечены в отношении функции почек. Почечная недостаточность со снижением СКФ менее 60 мл/мин/1,73 м2 регистрируется в 12–41% наблюдений; риски развития и прогрессирования ХБП возрастают в 2–17 раз среди пациентов со стажем гипопаратиреоза 7 лет и более. В 2020 г. проведено одномоментное обсервационное сплошное исследование с использованием базы данных пациентов с хроническим гипопаратиреозом ФГБУ «НМИЦ эндокринологии» Минздрава России, среди осложнений заболевания в обследуемой группе (n=169) преобладали нарушения со стороны почек. В данном исследовании было установлено, что 13% пациентов имеют ХБП 3–5 ст., а 38% — поражение структуры почек (нефрокальциноз или нефролитиаз) [15]. По данным анализа всероссийского регистра пациентов с гипопаратиреозом (n=544) отмечено, что нарушение функции почек со снижением СКФ менее 60 мл/мин/1,73 м2 происходитв 15,8% случаев, нефролитиаз выявляется у 32,5% пациентов, нефрокальциноз — у 12,3%. Установлено, что уровень кальциемии имеет отрицательную корреляцию с рСКФ, а риски структурных нарушений почек повышаются с увеличением длительности заболевания более 4,5 года [16].
ДГТ — синтетический аналог витамина D, ранее активно применявшийся в комплексной терапии гипопаратиреоза. Максимальная концентрация ДГТ достигается через 6 ч после приема, период полувыведения составляет 10,5–13 ч, при этом полное прекращение действия происходит через 7–21 день. Средние терапевтические дозы ДГТ, как правило, не превышают 1,0 мг/сут [17]. ДГТ преобразуется печенью в 25-гидроксидигидротахистерин. Образование активных метаболитов ДГТ не регулируется по типу обратной связи, поэтому концентрация 25-гидроксидигидротахистерола в крови растет линейно при увеличении принимаемой дозы препарата, что обусловливает необходимость тщательного подбора и контроля дозы, обеспечивающей нормальный уровень кальция в крови и отсутствие гиперкальциемии [18]. ДГТ депонируется в печени, жировой ткани, коже, мышцах и костях, в связи с чем его действие может продолжаться еще в течение 1–2 мес после прекращения приема. Это обуславливает пролонгированную токсичность препарата. Передозировка ДГТ приводит к гиперкальциемии; а при длительном ее сохранении — к нарушению функции почек, кардиосклерозу, пневмосклерозу, нефросклерозу. Гиперкальциемия, обусловленная интоксикацией ДГТ, требует больше времени для купирования, выбора более активной тактики лечения [19].
Повышение уровня сывороточного кальция напрямую связано с развитием почечного повреждения. Обратимое снижение скорости клубочковой фильтрации при тяжелой гиперкальциемии во многом опосредовано прямым сужением почечных сосудов. Кроме того, нарушение концентрационной способности почек, приводящее к полиурии и в дальнейшем к уменьшению объема мочи, также способствует дальнейшему ухудшению функции почек [20]. Предполагается, что это связано с подавлением водных каналов аквапорина 2 в собирательных трубочках [21] и тубулоинтерстициальным повреждением, вызванным отложением кальция в мозговом веществе почек. Кроме того, активация кальцийчувствительных рецепторов, присутствующих на базолатеральной мембране толстой восходящей части петли Генле, снижает реабсорбцию кальция и хлорида натрия. Острое почечное повреждение, вызванное гиперкальциемией, обычно обратимо при увеличении объема циркулирующей жидкости, достигаемом при помощи инфузий физиологического раствора, а также снижении концентрации кальция в сыворотке крови [20].
В соответствии с отечественными и зарубежными рекомендациями ДГТ ввиду своих фармакодинамических особенностей не должен использоваться в лечении хронического гипопаратиреоза, предпочтение следует отдавать более специфическим аналогам/метаболитам витамина D с меньшей частотой побочных эффектов — кальцитриолу и альфакальцидолу. Наряду с нашими наблюдениями, в литературе представлено множество случаев с описанием токсических эффектов ДГТ. Так, еще в1975 г. в публикации Ziegler R. et al. сообщается о клинических случаях передозировки ДГТ с летальными исходами. Три пациентки поступили в стационар в состоянии тяжелой гиперкальциемии (до 4,5–4,8 ммоль/л), две из них скончались отразвившейся сердечно-сосудистой недостаточности, несмотря на успешное снижение уровня кальция крови, летальный исход третьей пациентки связан с тромбоэмболией легочной артерии на фоне сохраняющейся гиперкальциемии спустя несколько месяцев после прекращения приема ДГТ [22]. Quack I. et al. в 2005 г. опубликовали данные по 5 пациентам, длительно получающим ДГТ (от 4 до 50 лет), что привело к развитию гиперкальциемии в диапазоне от 3,02 до 4,97 ммоль/л, осложнившейся развитием почечной недостаточности. У одного из пациентов, получавшего ДГТ в течение 50 лет, после нормализации кальция крови сохранялось стойкое снижение фильтрационной функции почек, при этом по результатам биопсии почки были обнаружены множественные тубулоинтерстициальные микрокальцинаты [23]. Также в литературе описан случай 74-летнего пациента, который ошибочно принимал 75 капель в день ДГТ (около 3 мг) в течение 6–8 нед, что было ассоциировано сразвитием тяжелой гиперкальциемии >3,7 ммоль/л и почечной недостаточностью. Лечение включало в себя инфузионную терапию, преднизолон и 60 мг внутривенного памидроната натрия. На 4-й день кальций сыворотки снизился до РД, лечение гипопаратиреоза возобновлено через 10 дней после прекращения приема ДГТ [19]. Также сообщается о похожем клиническом случае у пациентки, получающей ДГТ, которая была госпитализирована в стационар с гиперкальциемией до 4,14 ммоль/л, признаками почечной недостаточности, развитием аритмии, которая позже осложнилась приступом ишемической болезни сердца [24].
ЗАКЛЮЧЕНИЕ
Большинство симптомов гиперкальциемии неспецифичны, что затрудняет диагностику данного состояния у пациента. При терапии хронического гипопаратиреоза необходим пожизненный прием препаратов витамина D и кальция, что требует постоянного контроля лабораторных показателей, регулярного обследования на предмет наличия осложнений, обусловленных как непосредственно гипопаратиреозом, так и получаемой терапией, особая настороженность требуется в отношении пожилых пациентов.
Для ДГТ характерна высокая биологическая активность, линейное увеличение концентрации препарата в крови при увеличении дозы, депонирование в организме и длительное сохранение гиперкальциемического эффекта даже после прекращения приема. Трудности при подборе адекватной дозы, узкий терапевтический диапазон, а также высокий риск передозировки препаратом с развитием гиперкальциемии, вплоть до гиперкальциемического криза с явлениями острой почечной недостаточности, лимитируют его использование в лечении пациентов с хроническим гипопаратиреозом. Рекомендуется замена ДГТ на производные витамина D более короткого действия, такие как альфакальцидол или кальцитриол.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Данное исследование выполнено в рамках государственного задания «Всероссийский реестр пациентов с хроническим гипопаратиреозом как основа оптимизации и внедрения персонализированного подхода для улучшения качества оказания медицинской помощи населению Российской Федерации», регистрационный номер НИОКТРАААА-А20-120011790168-2.
Конфликт интересов. Мокрышева Н.Г. — член редакционной коллегии журнала «Ожирение и метаболизм».
Участие авторов. Авсиевич Е.С. — получение, анализ данных и интерпретация результатов, написание статьи; Ковалева Е.В. — получение, анализ данных и интерпретация результатов, внесение в рукопись существенной правки с целью повышения научной ценности статьи; Горбачева А.М. — получение, анализ данных и интерпретация результатов, внесение в рукопись существенной правки с целью повышения научной ценности статьи; Еремкина А.К. — получение, анализ данных и интерпретация результатов, внесение в рукопись существенной правки с целью повышения научной ценности статьи; Мокрышева Н.Г. — существенный вклад в концепцию и дизайн исследования, внесение в рукопись существенной правки с целью повышения научной ценности статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациента. Пациенты добровольно подписали информированное согласие на публикацию персональной медицинской информации в обезличенной форме.
Список литературы
1. Мокрышева Н.Г., Eремкина А.К., Ковалева Е.В. Хронический гипопаратиреоз у взрослых: клиническая картина, диагностика, лечение, динамический контроль // Ожирение и метаболизм. — 2018. — Т. 15. — №4. — С. 74-82. https://doi.org/10.14341/omet9699
2. Gafni RI, Collins MT. Hypoparathyroidism. N Engl J Med. 2019; 380(18):1738-1747. https://doi.org/10.1056/NEJMcp1800213
3. Mannstadt M, Bilezikian JP, Thakker RV, et al. Hypoparathyroidism [published correction appears in Nat Rev Dis Primers. 2017 Oct 05;3:17080]. Nat Rev Dis Primers. 2017;3:17055. Published 2017 Aug 31. https://doi.org/10.1038/nrdp.2017.55
4. Bilezikian JP. Hypoparathyroidism. J Clin Endocrinol Metab. 2020;105(6):1722-1736. https://doi.org/10.1210/clinem/dgaa113
5. Gordon RJ, Levine MA. Genetic Disorders of Parathyroid Development and Function. Endocrinol Metab Clin North Am. 2018;47(4):809-823. https://doi.org/10.1016/j.ecl.2018.07.007
6. Bollerslev J, Rejnmark L, Marcocci C, et al. European Society of Endocrinology Clinical Guideline: Treatment of chronic hypoparathyroidism in adults. Eur J Endocrinol. 2015;173(2):G1-G20. https://doi.org/10.1530/EJE-15-0628
7. Babey M, Brandi ML, Shoback D. Conventional Treatment of Hypoparathyroidism. Endocrinol Metab Clin North Am. 2018;47(4):889-900. https://doi.org/10.1016/j.ecl.2018.07.012
8. Saha S, Kandasamy D, Sharma R, et al. Nephrocalcinosis, Renal Dysfunction, and Calculi in Patients With Primary Hypoparathyroidism on Long-Term Conventional Therapy. J Clin Endocrinol Metab. 2020;105(4):dgz319. https://doi.org/10.1210/clinem/dgz319
9. Maccallum WG, Voegtlin C. On the relation of tetany to the parathyroid glands and to calcium metabolism. J Exp Med. 1909;11(1):118-151. https://doi.org/:10.1084/jem.11.1.118.
10. Mclean FC. Activated sterols in the treatment of parathyroid insufficiency: a review. JAMA. 1941;117(8):609–619. https://doi.org/10.1001/jama.1941.72820340003009
11. Dodds BF. Studies of the relationship of dihydrotachysterol and calciferol to parathyroid function. Master’s Thesis, Rice University, 1955.
12. DeLuca HF, Plum LA. Analogs of 1α,25-Dihydroxyvitamin D₃ in Clinical Use. Vitam Horm. 2016;100:151-164. https://doi.org/10.1016/bs.vh.2015.11.002
13. Kubodera N. A new look at the most successful prodrugs for active vitamin D (D hormone): alfacalcidol and doxercalciferol. Molecules. 2009;14(10):3869-3880. Published 2009 Sep 29. https://doi.org/10.3390/molecules14103869
14. Boyce AM, Shawker TH, Hill SC, et al. Ultrasound is superior to computed tomography for assessment of medullary nephrocalcinosis in hypoparathyroidism. J Clin Endocrinol Metab. 2013;98(3):989-994. https://doi.org/10.1210/jc.2012-2747
15. Ковалева Е.В., Еремкина А.К., Айнетдинова А.Р., Мокрышева Н.Г. Результаты анализа базы данных пациентов с гипопаратиреозом ФГБУ «НМИЦ эндокринологии» Минздрава России // Проблемы эндокринологии. — 2020. — Т. 66. — №5. — С. 7–14. doi: https://doi.org/10.14341/probl12675
16. Kovaleva EV, Eremkina AK, Elfimova AR, et al. The Russian Registry of Chronic Hypoparathyroidism. Front Endocrinol (Lausanne). 2022;13:800119. Published 2022 Feb 16. https://doi.org/10.3389/fendo.2022.800119
17. Bilezikian JP, Brandi ML, Cusano NE, et al. Management of Hypoparathyroidism: Present and Future. J Clin Endocrinol Metab. 2016;101(6):2313-2324. https://doi.org/10.1210/jc.2015-3910
18. Available from: https://grls.pharm-portal.ru
19. Jensterle M, Pfeifer M, Sever M, et al. Dihydrotachysterol intoxication treated with pamidronate: a case report. Cases J. 2010;3:78. https://doi.org/10.1186/1757-1626-3-78
20. Bhat NA, Mustafa F, Sheikh RY, et al. Incidence, etiology, and course of hypercalcemia-induced AKI in a tertiary care center from northern India. Egypt J Intern Med 33, 36 (2021). https://doi.org/10.1186/s43162-021-00067-8
21. Arroyo M, Fenves AZ, Emmett M. The calcium-alkali syndrome. Proc (Bayl Univ Med Cent). 2013;26(2):179-181. https://doi.org/10.1080/08998280.2013.11928954
22. Ziegler R, Minne H, Raue F, et al. Beobachtungen zur Vitamin-Dund Dihydrotachysterin-Vergiftung [Observations in vitamin D and dihydrotachysterol poisoning]. Dtsch Med Wochenschr. 1975;100(9):415-423. https://doi.org/10.1055/s-0028-1106230
23. Quack I, Zwernemann C, Weiner SM, et al. Dihydrotachysterol therapy for hypoparathyroidism: consequences of inadequate monitoring. Five cases and a review. Exp Clin Endocrinol Diabetes. 2005;113(7):376-380. https://doi.org/10.1055/s-2005-865724
24. Jalbert M, Mignot A, Gauchez AS, et al. Hypercalcémie sévère de cause inhabituelle, à la recherche du coupable : cas clinique et revue de la littérature [Severe hypercalcemia of unusual cause, looking for the culprit: Case report and review of the literature]. Nephrol Ther. 2018;14(4):231-236. https://doi.org/10.1016/j.nephro.2018.03.003
Об авторах
Е. С. АвсиевичРоссия
Авсиевич Екатерина Сергеевна, ординатор
Москва
Е. В. Ковалева
Россия
Ковалева Елена Владимировна
eLibrary SPIN: 7387-6791
Москва, ул. Дм. Ульянова, д. 11
А. М. Горбачева
Россия
Горбачева Анна Максимовна
eLibrary SPIN-код: 9815-7509
Москва
А. К. Еремкина
Россия
Еремкина Анна Константиновна, к.м.н.
Researcher ID: R-8848-2019
Scopus аuthor ID: 57197775339
eLibrary SPIN: 884a8-2660
Москва
Н. Г. Мокрышева
Россия
Мокрышева Наталья Георгиевна, д.м.н., профессор
eLibrary SPIN: 5624-3875
Москва
Конфликт интересов:
Мокрышева Н.Г. — член редакционной коллегии журнала «Ожирение и метаболизм».
Дополнительные файлы
|
|
1. Рис. 1. Динамика изменения кальциемии у пациентки А. в зависимости от получаемой терапии. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(194KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Авсиевич Е.С., Ковалева Е.В., Горбачева А.М., Еремкина А.К., Мокрышева Н.Г. Дигидротахистерол: неоправданный выбор в терапии хронического гипопаратиреоза. Ожирение и метаболизм. 2022;19(2):198-205. https://doi.org/10.14341/omet12882
For citation:
Avsievich E.S., Kovaleva E.V., Gorbacheva A.M., Eremkina A.K., Mokrysheva N.G. Dihydrotachysterol: a bad choice in the treatment of chronic hypoparathyroidism. Obesity and metabolism. 2022;19(2):198-205. (In Russ.) https://doi.org/10.14341/omet12882

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































