Перейти к:
Роль цитокинов в развитии системного воспаления при хронической обструктивной болезни легких и ожирении
https://doi.org/10.14341/omet12847
Аннотация
Для больных хронической обструктивной болезнью легких (ХОБЛ) характерны разнообразные коморбидные состояния, включающие как соматические (артериальная гипертония, атеросклероз, ишемическая болезнь сердца, бронхиальная астма, злокачественные новообразования, сахарный диабет, ожирение и т.д.), так и психические (депрессивные расстройства, попытки суицида). На фоне различных хронических заболеваний дыхательной и эндокринной систем, метаболических нарушений повышаются риски обострений ХОБЛ.
Ведущим, объединяющим механизмом этих состояний является системное субклиническое воспаление. Его избыточная активность ведет к утрате физиологических функций воспаления, что сопровождается дисбалансом эндокринной системы и выбросом высоких концентраций гормонов и нейромедиаторов. Результатом такого ответа является разобщение цитокиновых механизмов, что приводит к дисбалансу системы про- и противовоспалительных цитокинов. В статье описывается роль провоспалительного хемокина IL-8 (интерлейкина-8), ответственного за миграцию нейтрофилов в очаг воспаления. Так формируется нейтрофильный тип воспаления. Рассматриваются IL-4 и IL-10, занимающие ведущую позицию в формировании CD4+ типа иммунореактивности, которая наблюдается при бронхиальной астме. Акцентируется внимание на значимости IL-6, т.к. он является неотъемлемым компонентом местного и системного воспаления. Увеличение его концентрации и, как следствие, потенциального риска повреждения респираторного эпителия приводит к ремоделированию бронхиального дерева, в результате чего снижается эластичность эпителия дыхательных путей. Этот механизм обуславливает формирование эмфиземы легких и дальнейшее потенцирование патофизиологических процессов у пациентов с ХОБЛ.
Поскольку IL-6 является цитокином, обладающим, помимо про-, еще и противовоспалительными свойствами, его молекулярная активность достигается путем взаимодействия со специальным рецепторным комплексом, состоящим из двух субъединиц: IL-6R и gp130. Первая обуславливает связывание IL-6, а вторая запускает пути сигнального каскада JAK/STAT или MAPK. Результат реакции IL-6 с эффекторной клеткой напрямую зависит от типа сигналинга.
В работе описываются три механизма передачи сигнала в клетку-мишень: классический, кластерный и транссигналинг. Таким образом, изучая роль цитокинов в системном воспалительном ответе, мы показали перекрестные механизмы между жировой тканью и легкими при ожирении, выделив основные медиаторы воспаления, что может обозначить новые терапевтические мишени для предотвращения легочной дисфункции.
Ключевые слова
Для цитирования:
Благов А.Ю., Ефремова О.А., Ходош Э.М., Алейникова К.С., Дуброва В.А. Роль цитокинов в развитии системного воспаления при хронической обструктивной болезни легких и ожирении. Ожирение и метаболизм. 2022;19(4):442-448. https://doi.org/10.14341/omet12847
For citation:
Blagov A.Yu., Efremova O.A., Khodosh E.M., Aleinikova K.S., Dubrova V.A. The role of cytokines in the development of systemic inflammation in chronic obstructive pulmonary disease and obesity. Obesity and metabolism. 2022;19(4):442-448. (In Russ.) https://doi.org/10.14341/omet12847
ВВЕДЕНИЕ
Проблема коморбидности хронической обструктивной болезни легких (ХОБЛ) и ожирения изучается долгие годы, однако по настоящее время данная тема сохраняет за собой высокую актуальность, и, вероятнее всего, в обозримом будущем внимание к проблеме будет только расти.
В нашей стране проживают около 11 млн людей с ХОБЛ. В течение последних 20 лет отмечается рост заболеваемости на 68,9%, а всего в мире на сегодняшний день 384 млн больных ХОБЛ. Общая распространенность этого заболевания составляет 11,7%. При этом в России официальный диагноз поставлен лишь 2,4 млн пациентов [1]. Причиной данного заболевания являются профессиональные вредности, загрязнение воздуха в промышленно развитых городах, наследственные и врожденные заболевания респираторного тракта, и, наконец, лидирующее место занимает табакокурение. Курение особенно способствует развитию болезней дыхательных путей. Так, даже заядлые курильщики, снизившие интенсивность курения вполовину, по-прежнему имеют значительный риск развития ХОБЛ [2][3].
Усугубить течение ХОБЛ могут лишний вес, который наблюдается у более чем миллиарда человек на нашей планете, частые аденовирусные инфекции, плохое социально-экономическое положение населения и его неосведомленность об этиологии заболевания, несоблюдение пациентами регулярности лечения и обследований и многие другие факторы [2–4]. Согласно статистическим данным, в Российской Федерации процент больных ожирением от общего количества больных с заболеваниями эндокринной системы достигает 42,3% [1]. Все это объясняет высокую частоту заболеваемости и низкую частоту выявлений заболевания, что приводит к преждевременной смертности, инвалидизации и нанесению экономического ущерба стране. Больные ХОБЛ зачастую имеют коморбидные патологии, такие как остеопороз, сахарный диабет, анемия, ожирение, метаболический синдром, которые тесно связаны единым патогенезом с ХОБЛ [5–7]. Ожирение значимо повышает риск многих заболеваний внутренних органов, сердечно-сосудистых заболеваний [8][9]. Коморбидные заболевания негативным образом влияют на общее состояние больных ХОБЛ и исход заболевания [10][11]. Тем не менее механизмы, лежащие в основе сочетанной патологии ХОБЛ и ожирения, раскрыты не полностью.
В данном обзоре представлена информация о роли цитокинов в развитии системного воспаления при ХОБЛ и ожирении. Был проведен поиск научных публикаций по ключевым словам: цитокины, воспаление, хроническая обструктивная болезнь легких, интерлейкин-6, ожирение, коморбидность (на русском и английском языках), с использованием полнотекстовых и реферативно-библиографических баз данных: PubMed, Google Scholar, научные электронные библиотеки eLIBRARY.RU и cyberleninka.ru. Сайты издательств Springer и Elsevier использовались для доступа к полному тексту статей. Временной диапазон поиска с 2012 по 2022 гг. Было найдено более 23 000 статей. Далее, используя сортировки по датам и точным совпадениям, сузили результат поиска до 102 статей, которые были нами проанализированы, из них отобрали 36 с учетом цели статьи.
ПРОБЛЕМА КОМОРБИДНОСТИ ХОБЛ И ОЖИРЕНИЯ
ХОБЛ является мультифакторным респираторным заболеванием, характеризующимся воспалением дыхательных путей, ремоделированием и ограниченным движением воздуха в легких. К патологическим нарушениям в легочной ткани присоединяются значительные внелегочные изменения: дисфункция скелетных мышц, потеря массы тела, остеопороз, депрессия, приводящие к снижению качества жизни и увеличению риска смерти этих пациентов [5][7]. ХОБЛ часто прогрессирует на фоне сердечно-сосудистых заболеваний, метаболического синдрома и аутоиммунных нарушений. На фоне различных хронических заболеваний дыхательной и эндокринной систем, метаболических нарушений повышаются риски обострений ХОБЛ [10–13].
Многие публикации свидетельствуют о том, что у больных в коморбидном статусе основное заболевание протекает более тяжело, увеличиваются количество и тяжесть обострений, используемая терапия обладает меньшей эффективностью. Как результат такие больные подлежат более частой и длительной госпитализации [12][14–16].
Основываясь на данных многочисленных исследований, можно сделать вывод, что ХОБЛ является полиэтиологическим заболеванием, в ходе выяснения истинных причин которого необходимо учитывать те факты, что большая часть пациентов с ХОБЛ подвергались в течение жизни воздействию различных патогенных факторов, которые действовали на организм с разной интенсивностью и продолжительностью [2–4][17][18].
Однако, имея столь множественные и сильные патогенные факторы, которые ежедневно оказывают на каждого из нас негативное влияние, мы сталкиваемся с проблемой коморбидности одних из наиболее распространенных состояний — ожирения и ХОБЛ. Ведущим объединяющим механизмом этих состояний является системное субклиническое воспаление [7][12][15][16], которое сопровождается дисбалансом эндокринной системы и выбросом высоких концентраций гормонов и нейромедиаторов. Результатом такого ответа является разобщение цитокиновых механизмов, что приводит к дисбалансу системы про- и противовоспалительных цитокинов [7][12][19].
РОЛЬ ВОСПАЛЕНИЯ В ГЕНЕЗЕ ХОБЛ И ОЖИРЕНИЯ
В дополнение к механическим вентиляционным ограничениям избыток жировой ткани при ожирении может привести к эктопическому отложению жира в висцеральных депо, способствуя метаболическим нарушениям и изменяя профиль секреции адипокинов. В частности, адипокины лептин и адипонектин, по-видимому, играют роль в возникновении легочных заболеваний, вызванных ожирением, воздействуя на системное воспаление, активность иммунных Treg и ответы Th17 и Th2. Было показано, что эти адипокины могут также модулировать активность инфламмасомы NLRP3, мультимерного комплекса, играющего ключевую роль в воспалительных процессах, который активируется как в жировой ткани, так и в легких у людей с ожирением (рис. 1). Более того, цитокины, производные NLRP3 (например, IL-1β, IL-18), по-видимому, являются основными индукторами цитокинового каскада (с участием IL-23, -17, -26, -6, -13) [14][20][21]. Стоит остановиться более подробно на влиянии провоспалительных цитокинов на организм всецело и легочную ткань, их концентрациях при этих состояниях.
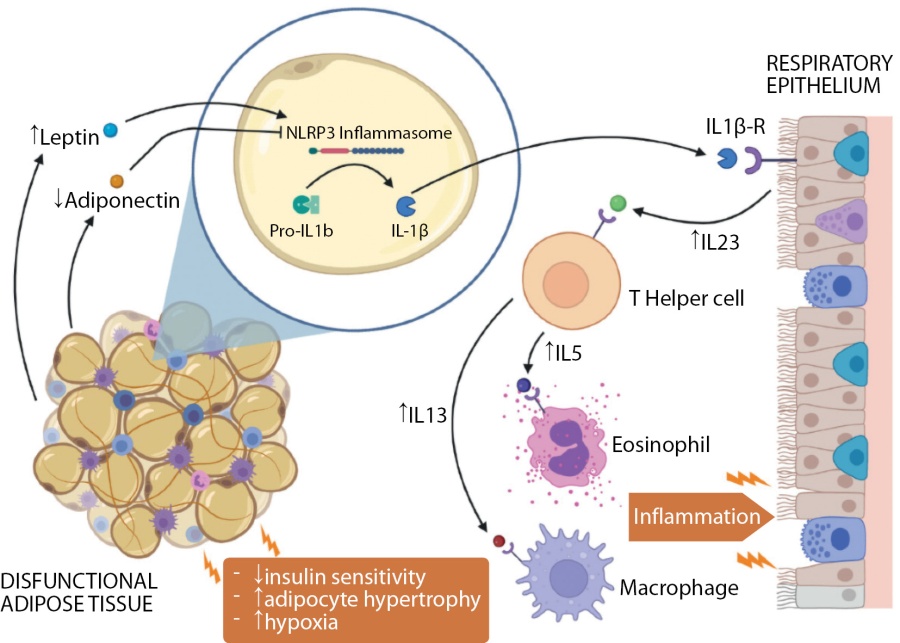
Рисунок 1. Перекрестные взаимодействия между дисфункциональной жировой тканью и респираторным эпителием в легких. Инсулинорезистентность, гипертрофия адипоцитов и гипоксия изменяют секрецию адипокинов дисфункциональной жировой ткани, способствуя активации воспалительных процессов [22].
Figure 1. Crosstalk between dysfunctional adipose tissue and respiratory epithelium in the lungs. Insulin resistance, adipocyte hypertrophy, and hypoxia alter the secretion of adipokines from dysfunctional adipose tissue, contributing to the activation of inflammatory processes [22].
В исследовании по изучению системного воспаления у больных ХОБЛ и ожирением показаны особенности про- и противовоспалительного цитокинового профиля, уровни биомаркеров легочного повреждения, а также количество адипокинов у больных [23]. Выборка из 88 больных ХОБЛ (GOLD 2–4, группа D), вошедших в исследование, составляла 2 группы испытуемых. Первая группа включала 44 больных ХОБЛ без ожирения, а во 2-й группе было 44 больных ХОБЛ с ожирением. Полученные результаты указали на однозначно более активное системное воспаление в группе больных с ХОБЛ и сопутствующим ему ожирением. Данный факт основывался на имеющихся различиях в концентрациях С-реактивного белка, интерферона-γ, факторов некроза опухоли (ФНО-α, ФНО-R1, ФНО-R2). В то же время уровни IL-4, -6, -8, -10 значимых различий не имели, и причину в данном исследовании установить не удалось [23].
В другом исследовании 2019 г. была создана группа из 80 больных, разделенная на две подгруппы. В 1-й подгруппе оказались 40 человек с ХОБЛ и нормальной массой тела, а во второй — с ХОБЛ и ожирением, из них 31 мужчина и 9 женщин. Результаты исследования свидетельствовали о выраженности системного воспаления в подгруппе больных ХОБЛ и ожирением. У них были значимо повышены в крови концентрации С-реактивного белка, ФНО-α, интерферона. Однако и в этом исследовании уровни IL-6, -4, -8 и -10 каких-либо различий между двумя подгруппами не продемонстрировали [24].
При анализе литературы по изучению отдельных цитокинов, причин их повышения и роли в поддержании системного воспаления удалось установить следующее:
- IL-6 является неотъемлемым компонентом местного и системного воспаления. Увеличение его концентрации и, как следствие, потенциального риска повреждения респираторного эпителия является причиной ремоделирования бронхиального дерева. В результате чего снижается эластичность эпителия дыхательных путей. Этот механизм приводит к формированию эмфиземы легких и дальнейшему потенцированию патофизиологических процессов у больных с ХОБЛ [13][25]. Под ремоделированием следует понимать любые изменения в дыхательной системе, не свойственные для нормальной ткани [26–28]. Однако при ХОБЛ присутствует свой спектр изменений, который коррелирует с тяжестью заболевания: увеличиваются плотность кровеносных сосудов, количество подслизистых и слизистых желез, с последующей гиперсекрецией слизи, происходит метаплазия эпителиальных клеток, разрушаются терминальные и респираторные бронхиолы, стенки альвеол, а также повышается нейтрофильное воспаление и инфильтрация CD8+ Т-лимфоцитами [26][29];
- провоспалительный хемокин IL-8 ответственен за миграцию нейтрофилов в очаг воспаления. Так формируется нейтрофильный тип воспаления. Интерес к IL-8 обусловлен активацией нейтрофилов в ответ на токсические и инфекционные агенты. Токсическим фактором выступает также табачный дым как значимый фактор развития ХОБЛ [25];
- IL-4 и IL-10 занимают ведущую позицию в формировании CD4+ типа иммунореактивности, которая наблюдается при бронхиальной астме. Результатом этого является воспаление по эозинофильному типу. IL-4 также ведет к ремоделированию бронхиального дерева путем синтеза факторов роста [25].
В исследовании Трушиной Е.Ю. и соавт. на основании анализа 50 больных установлено, что IL-4 и IL-10 не являются ведущими в развитии воспаления при ХОБЛ. CD4+ тип иммунного ответа также не столь значим. По мнению автора, именно IL-8, и в особенности IL-6, являются значимыми компонентами ремоделирования бронхов [25][27]. Данное положение разделяют Т.И. Виткина и К.А. Сидлецкая [30].
РОЛЬ IL-6 В РАЗВИТИИ ВОСПАЛЕНИЯ ПРИ ХОБЛ И ОЖИРЕНИИ
Повышенная концентрация IL-6 у больных ХОБЛ имеет тенденцию к неуклонному росту по мере прогрессирования ХОБЛ. Именно поэтому IL-6 является маркером системного воспаления [30][31]. Поскольку IL-6 является цитокином, обладающим, помимо про-, еще и противовоспалительными свойствами, его молекулярная активность достигается путем взаимодействия со специальным рецепторным комплексом, состоящим из двух субъединиц: IL-6R и gp130. Первая обуславливает связывание IL-6, а вторая запускает пути сигнального каскада JAK/STAT или MAPK. Результат реакции IL-6 с эффекторной клеткой напрямую зависит от типа сигналинга. В настоящее время известно три механизма передачи сигнала в клетку мишень: классический, кластерный и транссигналинг [29–33].
Классический способ свойственен клеткам, несущим на своей поверхности обе субъединицы. Данный тип сигналинга опосредует противовоспалительные и регенераторные свойства IL-6. Отдельно стоит указать тот факт, что gp130 продуцируется многими клетками, а IL-6R — нейтрофилами, гепатоцитами, макрофагами, моноцитами, Т- и В-лимфоцитами [34]. Таким образом, реализация классического механизма сигналинга IL-6 возможна только в указанных клетках, и эти же клетки являются источником sIL-6R (растворимая форма IL-6R). Обязательным условием для реализации подобного механизма является наличие растворимой формы IL-6R [29][30][33].
Во время транссигналинга IL-6 образует комплекс с растворимой формой IL-6R (sIL-6R) посредством ограниченного протеолиза или альтернативного сплайсинга. Затем расположенная на мембране клетки эффектора субъединица p130 взаимодействует с образовавшимся комплексом, запуская активацию воспалительных сигналов. Таким образом, в результате транссигналинга плейотропный цитокин IL-6 оказывает воздействие на все клетки, на поверхности которых располагается рецептор gp130. Именно поэтому вовлечение в процесс новых клеток имеет резко прогрессивный характер [30][34].
В 2017 г. S. Heink и соавт. описали механизм кластерного сигналинга. Он заключается в образовании комплекса IL-6 с sIL-6R во внутриклеточных компартментах дендритной клетки и последующим выходом комплекса на мембрану, где происходит контакт с субъединицей gp130. Молекула gp130 располагается на поверхности Т-лимфоцита в момент антигенпрезентации. Есть предположения, что представленный вид сигналинга является необходимым компонентом в дифференцировке наивных Т-хелперов [32].
Необходимо отметить, что передача сигнала посредством IL-6 подлежит строгому контролю на различных этапах сигналинга. Это осуществляется для поддержания баланса между реакциями иммунной системы и избегания гиперреактивности. Навнеклеточном уровне это достигается путем инактивации комплекса IL-6 и его растворимой формы посредством связывания с растворимой формой gp130 (sgp130). Подобный механизм контроля достигается благодаря наличию белков из семейства SOCS (suppressor of cytokine signalling) и PIAS (protein inhibitor of activated STAT), способных инактивировать цитокиновый сигналинг. А также при помощи протеасомной деградации белков рецепторного комплекса [29][32].
В самом начале системного воспаления роль цитокина IL-6 заключается в передаче сигнала о повреждении ткани. У больных ХОБЛ это легочная ткань и дыхательные пути, начиная с 8-й генерации и диаметром менее 2 мм [20][33].
Табачный дым, попадая на слизистую оболочку дыхательных путей, реагирует с Toll-like рецепторами (TLR). Наиболее значимыми из них являются TLR2 и TLR4, активация которых приводит к развитию воспаления [35]. Такой ответ обусловлен увеличением транскрипции мРНК IL-6. Стоит отметить, что IL-6 данный процесс не ограничивается и вовлекаются IL-4, -8, -10 и т.д. Однако в контексте наиболее значимых цитокинов особое значение имеют IL-6 и IL-8. Результатом локального синтеза IL-6 в ответ на повреждение является его выход в кровоток с последующим системным эффектом [30]. IL-6 в результате транссигналинга и последующего синтеза эндотелиальными клетками хемокинов привлекает лейкоциты в очаг воспаления. Источником растворимой формы IL-6R могут выступать CD4+ клетки, макрофаги, нейтрофилы и Т-хелперы. Т-хелперы способны синтезировать sIL-6R посредством ограниченного протеолиза после активации Т-клеточного рецептора. Апоптоз выступает в роли стимула для выделения макрофагами и нейтрофилами растворимой формы IL-6R. Затем в очаг воспаления мигрируют нейтрофилы. Фагоцитируя патогены, они подвергаются апоптозу, при этом после их гибели освобождается растворимая форма IL-6R, что приводит к облегченному и ускоренному формированию комплекса IL-6 с растворимой формой IL-6R–IL-6/IL-6R. И как результат транссигналинга комплекса в эндотелиальных клетках секретируются хемокины и усиливается миграция мононуклеарных фагоцитов и Т-клеток в очаг. Более того, IL-6 способен удерживать Т-клетки в очаге воспаления, таким образом потенцируя ими синтез антиапоптотических регуляторов (Bcl-2, Bcl-XL), модулирующих экспрессию Fas-рецептора [20].
Недавно группе ученых удалось доказать причастность IL-6 к развитию эмфиземы. Это подтверждается связью уровня IL-6 в крови больных ХОБЛ с развитием эмфиземы и тем фактом, что генетическая блокада gp130 ведет к облегчению проявлений болезни [30][36]. Также усиление синтеза IL-6 легочной тканью ведет к апоптозу альвеолярных клеток и, как следствие, к развитию эмфиземы. Установлено, что IL-6 принимает участие в формировании легочного фиброза у больных ХОБЛ. Объясняется это развитием хронического субклинического воспаления как следствия персистирования активированных Т-клеток и нейтрофилов. Ингибирование IL-6 ведет к замедлению развития фиброза [36].
Измененный профиль секреции адипокинов из дисфункциональной жировой ткани при морбидном ожирении способствует системному слабовыраженному воспалению, ослабляя легочный иммунный ответ и способствуя гиперреактивности дыхательных путей [22]. Потенциальной мишенью этих адипокинов могут быть цитокины, особенно IL-6, вредное провоспалительное действие которого влияет как на жировую, так и на легочную ткань при ожирении.
В этом обзоре мы показали перекрестные механизмы между жировой тканью и легкими при ожирении, выделив основные медиаторы воспаления, что может обозначить новые терапевтические мишени для предотвращения легочной дисфункции.
ЗАКЛЮЧЕНИЕ
Таким образом, изучая роль цитокинов в системном воспалительном ответе, следует учитывать, что ожирение и дисфункция легких тесно связаны. Поиск оптимального терапевтического решения должен включать множественные воспалительные пути, фокусируясь на общих для дисфункциональной жировой и легочной ткани, чтобы предотвратить как метаболические нарушения, так и легочные заболевания. Поскольку дисфункция жировой ткани негативно влияет на здоровье легких, ожирение может быть важной и подходящей мишенью для профилактики респираторных заболеваний. Следовательно, методы лечения ожирения, способные уменьшить жировую ткань и вызвать потерю массы тела, такие как изменение образа жизни, фармакотерапия и бариатрическая хирургия, могут представлять собой еще один подход к лечению легочных заболеваний.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Благов А.Ю. — разработка концепции, составление плана рукописи, сбор и систематизация данных, написание рукописи; Ефремова О.А. — существенный вклад в концепцию исследования и анализ данных, внесение существенных правок, редактирование рукописи; Ходош Э.М. — редактирование рукописи, внесение важных правок; Алейникова К.С. — анализ публикаций, сбор и систематизация данных; Дуброва В.А. — редактирование рукописи, внесение важных правок. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Федеральная служба государственной статистики. Здравоохранение в России. 2019: Стат. сб. — М.: Росстат; 2019. — 170 с.
2. Global Initiative for Chronic Obstructive Lung Disease [Internet]. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Revised 2017. [cited 23.03.2023] Available from: http://www.goldcopd.com
3. Клинические рекомендации. Хроническая обструктивная болезнь легких (ХОБЛ). 2021-2022-2023 (23.06.2021). Утверждены Минздравом РФ. Доступно по: http://disuria.ru/_ld/10/1081_kr21J44MZ.pdf. Ссылка активна на 23.03.2023.
4. Ефименко Е.В., Ефремова О.А., Ходош Э.М. Диагностические признаки для вероятностной оценки риска обострений хронической обструктивной болезни легких // Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация. — 2016. — Т. 5. — № 226. — С. 15-20.
5. Barnes PJ. Senescence in COPD and Its Comorbidities. Annu Rev Physiol. 2017;79(1):517-539. doi: https://doi.org/10.1146/annurev-physiol-022516-034314
6. Global Initiative for Chronic Obstructive Lung Disease [Internet]. Global Strategy for Prevention, Diagnosis and Management of COPD, 2020 GOLD Report. [cited 23.03.2023] Available from: https://goldcopd.org/gold-reports
7. Chetty U, McLean G, Morrison D, et al. Chronic obstructive pulmonary disease and comorbidities: a large cross-sectional study in primary care. Br J Gen Pract. 2017;67(658):e321-e328. doi: https://doi.org/10.3399/bjgp17X690605
8. Булгакова С.В., Овчинникова Е.А., Захарова Н.О., Тренева Е.В. Состояние микроциркуляторного русла при сочетанном течении ишемической болезни сердца и хронической обструктивной болезни легких у пациентов старческого возраста // Современные проблемы здравоохранения и медицинской статистики. — 2020. — №1. — С. 1-16. doi: https://doi.org/10.24411/2312-2935-2020-00001
9. Ершов Н.Г., Котляров С.Н., Александрова Л.Н., Пимахина Е.В. Оценка функции внешнего дыхания в зависимости от степени морбидного ожирения у пациентов в бариатрической хирургии // Медико-фармацевтический журнал «Пульс». — 2019. — Т. 21. — №8. — С. 47-52. doi: https://doi.org/10.26787/nydha-2686-6838-2019-21-8-47-52
10. Воронкова О.В., Саприна Т.В., Букреева Е.Б., Зима А.П. Этиопатогенетические параллели и нерешенные вопросы патогенеза коморбидности хронической обструктивной болезни легких и метаболического синдрома (обзор литературы) // Ожирение и метаболизм. — 2020. — Т. 17. — №3. — С. 292-298. doi: https://doi.org/10.14341/omet12378
11. Coats V, Despres J-P, Almeras N, et al. Ectopic adiposity and cardiometabolic health in COPD. Int J Chron Obstruct Pulmon Dis. 2018;13(8):3331-3340. doi: https://doi.org/10.2147/COPD.S168963
12. Кожевникова С.А., Будневский А.В., Овсянников Е.С., Белов В.Н. Особенности клинического течения и качества жизни пациентов с хронической обструктивной болезнью легких на фоне метаболического синдрома // Медицинский вестник Северного Кавказа. — 2017. — Т. 12. — №1. — С. 20-23. doi: https://doi.org/10.14300/mnnc.2017.12006
13. Hotamisligil GS. Foundations of immunometabolism and implications for metabolic health and disease. Immunity. 2017;47(3):406-420. doi: https://doi.org/10.1016/j.immuni.2017.08.009
14. Ковалёва Ю.А., Ефремова О.А., Шелест Б.А., и др. Дисфункция эндотелия в динамике лечения больных с ишемической болезнью сердца и ожирением // Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация. — 2014. — Т. 11. — №182. — С. 52-57.
15. Choi HS, Rhee CK, Park YB, et al. Metabolic Syndrome in Early Chroni Obstructive Pulmonary Disease: Gender Differences and Impac on Exacerbation and Medical Costs. Int J Chron Obstruct Pulmon Dis. 2019;14(1):2873-2883. doi: https://doi.org/10.2147/COPD.S228497
16. Будневский А.В., Овсянников Е.С., Мальцева Ю.С., и др. Особенности течения хронической обструктивной болезни легких на фоне метаболического синдрома // Наука молодых (Eruditio Juvenium). — 2020. — Т. 8. — №2. — С. 164-171. doi: https://doi.org/10.23888/HMJ202082164-171
17. Профессиональная хроническая обструктивная болезнь легких / Под ред. Горблянский Ю.Ю., Яковлева Н.В., Пиктушанская Т.Е., и др. — Ростов-на-Дону: ООО «Фонд науки и образования»; 2018. — 312 с.
18. Ефремова О.А., Камышникова Л.А., Шелякина Е.В., и др. Роль хронической обструктивной болезни лёгких в развитии полиморбидной патологии. Научный результат // Медицина и фармация. — 2016. — Т. 2. — №4. — С. 13-18.
19. Stockley RA, Halpin DMG, Celli BR, Singh D. Chronic obstructive pulmonary disease biomarkers and their interpretation. Am J Respir Crit Care Med. 2019;199(10):1195-1204. doi: https://doi.org/10.1164/rccm.201810-1860SO
20. Barnes PJ. Cellular and molecular mechanisms of asthma and COPD. Clin Sci. 2017;131(13):1541-1558. doi: https://doi.org/10.1042/CS20160487
21. Saltiel AR, Olefsky JM. Inflammatory mechanisms linking obesity and metabolic disease. J Clin Invest. 2017;127(1):1-4. doi: https://doi.org/10.1172/JCI92035
22. Palma G, Sorice GP, Genchi VA, et al. Adipose tissue inflammation and pulmonary dysfunction in obesity. Int J Mol Sci. 2022;23(13):7349. doi: https://doi.org/10.3390/ijms23137349
23. Овсянников Е.С., Авдеев С.Н., Будневский А.В. Системное воспаление у больных хронической обструктивной болезнью легких и ожирением // Терапевтический архив. — 2020. — Т. 92. — №3. — C. 13-18. doi: https://doi.org/10.26442/00403660.2020.03.000265
24. Овсянников Е.С., Антакова Л.Н., Перцев А.В. Параметры воспаления у больных хронической обструктивной болезнью легких с нормальной массой и ожирением / В кн.: Проблема реализации мультидисциплинарного подхода к пациенту в современном здравоохранении: сборник материалов международной научно-практической конференции, Курск, 12 марта 2019 года. — Курск: Курский государственный медицинский университет, ООО «МедТестИнфо»; 2019. — С. 176-181.
25. Трушина Е.Ю., Костина Е.М., Молотилов Б.А., и др. Роль цитокинов IL-4, IL-6, IL-8, IL-10 в иммунопатогенезе хронической обструктивной болезни легких // Медицинская иммунология. — 2019. — Т. 21. — №1. — С. 89-98. doi: https://doi.org/10.15789/1563-0625-2019-1-89-98
26. Афанасьева Е.Ю., Наумов Д.Е. Механический стресс как фактор ремоделирования дыхательных путей при хронических респираторных заболеваниях, сопровождающихся синдромом бронхиальной обструкции (обзор литературы) // Бюллетень физиологии и патологии дыхания. — 2020. — №75. — С. 104-114. doi: https://doi.org/10.36604/1998-5029-2020-75-104-114
27. Fehrenbach H, Wagner C, Wegmann M. Airway remodeling in asthma: what really matters. Cell Tissue Res. 2017;367(3):551-569. doi: https://doi.org/10.1007/s00441-016-2566-8
28. Boulet L-P. Airway remodeling in asthma. Curr Opin Pulm Med. 2018;24(1):56-62. doi: https://doi.org/10.1097/MCP.0000000000000441
29. Lee YS, Wollam J, Olefsky JM. An integrated view of immunometabolism. Cell. 2018;172(1-2):22-40. doi: https://doi.org/10.1016/j.cell.2017.12.025
30. Виткина Т.И., Сидлецкая К.А. Роль интерлейкин-6 сигналинга в развитии системного воспаления при хронической обструктивной болезни легких // Бюллетень физиологии и патологии дыхания. — 2018. — №69. — С. 97-106. doi: https://doi.org/10.12737/article_5b9858ead1b5e3.93619630
31. Атякшин Д.А., Цветикова Л.Н., Лобеева Н.В., и др. Показатели иммунного статуса при хронической обструктивной болезни легких // Успехи современного естествознания. — 2015. — Т. 9. — №2. — С. 195-197. Доступно по: http://www.natural-sciences.ru/ru/article/view?id=35558 Ссылка активна на 20.05.2021.
32. Heink S, Yogev N, Garbers C, et al. Trans-presentation of IL-6 by dendritic cells is required for the priming of pathogenic TH17 cells. Nat Immunol. 2017;18(1):74-85. doi: https://doi.org/10.1038/ni.3632
33. Quintana FJ. Old dog, new tricks: IL-6 cluster signaling promotes pathogenic TH17 cell differentiation. Nat Immunol. 2017;18(1):8-10. doi: https://doi.org/10.1038/ni.3637
34. Durham AL, Caramori G, Chung KF, Adcock IM. Targeted anti-inflammatory therapeutics in asthma and chronic obstructive lung disease. Transl Res. 2016;167(1):192-203. doi: https://doi.org/10.1016/j.trsl.2015.08.004
35. Hansbro PM, Haw TJ, Starkey MR, Miyake K. Toll-like receptors in COPD. Eur Respir J. 2017;49(5):1700739. doi: https://doi.org/10.1183/13993003.00739-2017
36. Bradford E, Jacobson S, Varasteh J, et al. The value of blood cytokines and chemokines in assessing COPD. Respir Res. 2017;18(1):180. doi: https://doi.org/10.1186/s12931-017-0662-2
Об авторах
А. Ю. БлаговРоссия
Благов Алексей Юрьевич.
Белгород
Конфликт интересов:
Нет
О. А. Ефремова
Россия
Ефремова Ольга Алексеевна – доктор медицинских наук, заведующая кафедрой факультетской терапии.
308015, Белгород, ул. Победы, д. 85
Researcher ID: ABB-1749-2021; Scopus Author ID: 56362811400
Конфликт интересов:
Нет
Э. М. Ходош
Украина
Ходош Эдуард Михайлович – кандидат медицинских наук.
Харьков
Конфликт интересов:
Нет
К. С. Алейникова
Россия
Алейникова Ксения Сергеевна.
Белгород
Конфликт интересов:
Нет
В. А. Дуброва
Россия
Дуброва Владислав Александрович.
Белгород
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Перекрестные взаимодействия между дисфункциональной жировой тканью и респираторным эпителием в легких. Инсулинорезистентность, гипертрофия адипоцитов и гипоксия изменяют секрецию адипокинов дисфункциональной жировой ткани, способствуя активации воспалительных процессов [22]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(294KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Благов А.Ю., Ефремова О.А., Ходош Э.М., Алейникова К.С., Дуброва В.А. Роль цитокинов в развитии системного воспаления при хронической обструктивной болезни легких и ожирении. Ожирение и метаболизм. 2022;19(4):442-448. https://doi.org/10.14341/omet12847
For citation:
Blagov A.Yu., Efremova O.A., Khodosh E.M., Aleinikova K.S., Dubrova V.A. The role of cytokines in the development of systemic inflammation in chronic obstructive pulmonary disease and obesity. Obesity and metabolism. 2022;19(4):442-448. (In Russ.) https://doi.org/10.14341/omet12847

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































