Перейти к:
Обоснование подходов к коррекции нарушений липидного обмена и неалкогольной жировой болезни печени у детей с экзогенно-конституциональным ожирением
https://doi.org/10.14341/omet12802
Аннотация
Обоснование. Учитывая участие окислительного стресса в патогенезе ожирения, представляет интерес исследование плазменного уровня коэнзима Q10 в корреляционной взаимосвязи с изменениями биохимических показателей, характеризующих нарушения липидного обмена и функционального состояния печени.
Цель. Исследовать содержание коэнзима Q10 и его взаимосвязь с показателями липидограммы и печеночных ферментов у детей с экзогенно-конституциональным ожирением.
Материалы и методы. В одноцентровое одномоментное исследование были включены дети (средний возраст 12 лет) 2 групп: основной (n=40; SD индекса массы тела (ИМТ) >+2,0) и контрольной (n=32; -1,0≤SD ИМТ≤+1,0). У всех детей оценивали SD ИМТ, УЗИ печени, липидограмму, ферменты печени (аланинаминотрансферазу (АЛТ), аспартатаминотрансферазу (АСТ)), плазменный уровень коэнзима Q10.
Результаты. Уровни коэнзима Q10 в сравниваемых группах были сопоставимы (p>0,05) и не отличались у пациентов с различной степенью ожирения. У пациентов основной группы уровень липопротеидов высокой плотности был ниже, а уровень липопротеидов низкой плотности — выше показателей группы контроля. Самые высокие показатели липопротеидов высокой плотности были у пациентов с 1-й степенью ожирения, а триглицеридов — у пациентов с 4-й степенью ожирения. Повышенный уровень холестерина чаще отмечался у детей основной группы (8 (20%); р=0,037). 15 (37,5%) пациентов основной группы имели дислипидемию (р<0,001). В контрольной группе установлена прямая взаимосвязь уровня коэнзима Q10 и общего холестерина (r=0,474; р=0,009), в основной группе подобная взаимосвязь отмечалась только у пациентов с 1-й степенью ожирения (r=0,548; р=0,035). Показатели АСТ в обследуемых группах не различались, однако уровни АЛТ и соотношения АЛТ/АСТ были выше у пациентов основной группы (p<0,001). При этом самые высокие показатели АЛТ и соотношения АЛТ/АСТ отмечались у пациентов с 4-й степенью ожирения. У 18 (45%) детей основной группы отношение АЛТ/АСТ было ≥1 (p<0,001), при этом у 14 (80%) из них по данным УЗИ печени отмечалось увеличение обеих долей и изменение ее структуры. В контрольной группе установлена прямая взаимосвязь уровня коэнзима Q10 и отношения АЛТ/АСТ (r=0,412; р=0,023), в основной группе — индекса атерогенности и АЛТ/АСТ (r=0,436; р=0,006), а у пациентов с 1-й степенью ожирения также коэнзима Q10 и АЛТ (r=0,875; р<0,001).
Заключение. Нарушение адекватного обеспечения холестерина коэнзимом Q10 у детей с экзогенно-конституциональным ожирением отражает патогенетическую роль окислительного стресса в развитии дислипидемий и неалкогольной жировой болезни печени и может служить показанием для назначения препаратов коэнзима Q10 с целью коррекции данных осложнений.
Для цитирования:
Поварова О.В., Городецкая Е.А., Куляк О.Ю., Демяненко А.Н., Алимова И.Л., Каленикова Е.И., Медведев О.С. Обоснование подходов к коррекции нарушений липидного обмена и неалкогольной жировой болезни печени у детей с экзогенно-конституциональным ожирением. Ожирение и метаболизм. 2022;19(1):19-26. https://doi.org/10.14341/omet12802
For citation:
Povarova O.V., Gorodetskaya E.A., Kulyak O.Y., Demyanenko A.N., Alimova I.L., Kalenikova E.I., Medvedev O.S. Substantiation of approaches to the correction of lipid metabolism disorders and non-alcoholic fatty liver disease in children with exogenous obesity. Obesity and metabolism. 2022;19(1):19-26. https://doi.org/10.14341/omet12802
ОБОСНОВАНИЕ
В 2000-е гг. стала ярче проявляться тенденция «омоложения» ряда соматических заболеваний. Усугубляется негативное воздействие таких факторов, как малоподвижный образ жизни, нерациональное питание, повторяющиеся стрессовые ситуации, что приводит к дисфункции сердечно-сосудистой, эндокринной, дыхательной, пищеварительной систем, изменениям психологического состояния. Одним из проявлений данной тенденции является рост частоты встречаемости ожирения у молодого населения [1]. По данным ВОЗ, в 2016 г. избыточную массу тела и ожирение имели около 340 млн детей и подростков от 5 до 19 лет, в 2019 г. — около 1 млн детей в возрасте до 5 лет [2][3].
Детям и подросткам, у которых наблюдается ожирение, следует уделять особое внимание в связи с высоким риском развития метаболического синдрома и хронических заболеваний в зрелом возрасте [4].
Ранняя диагностика таких осложнений ожирения у детей, как дислипидемия, неалкогольная жировая болезнь печени, нуждается в дополнительных критериях для обоснования своевременных мер по их коррекции [5][6]. Учитывая участие окислительного стресса в патогенезе ожирения, представляет интерес исследование плазменного уровня коэнзима Q10 в корреляционной взаимосвязи с изменениями биохимических показателей, характеризующих нарушения липидного обмена и функционального состояния печени [7].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Исследовать содержание коэнзима Q10 и его взаимосвязь с показателями липидограммы и печеночных ферментов у детей с экзогенно-конституциональным ожирением.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. В исследование включались пациенты, находившиеся на стационарном обследовании в ОГБУЗ «Смоленская областная детская клиническая больница», педиатрическое отделение №1.
Время исследования. Декабрь 2018– июнь 2019 г.
Изучаемые популяции (одна или несколько)
Две популяции: пациенты с экзогенно-конституциональным ожирением и пациенты с нормальной массой тела.
Популяция 1 «пациенты с экзогенно-конституциональным ожирением».
Критерии включения: возраст от 7 до 15 лет, экзогенно-конституциональное ожирение 1–4 степени (SDS ИМТ >+2,0).
Популяция 2 «пациенты с нормальной массой тела».
Критерии включения: возраст от 7 до 15 лет, нормальная масса тела (-1,0≤SDИМТ≤+1,0).
Критерии исключения для обеих популяций: установленный диагноз сахарного диабета 2 типа, наличие воспалительных и аутоиммунных заболеваний печени, прием лекарственных препаратов.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Сплошной.
Дизайн исследования
Одноцентровое одномоментное интервенционное двухвыборочноое сравнительное исследование.
Описание медицинского вмешательства (для интервенционных исследований)
Всем пациентам проводились антропометрическое исследование (измерение роста и массы тела); расчет SD ИМТ по программе WHOAntroPlus; биохимический анализ крови с определением уровней общего холестерина, триглицеридов (ТАГ), липопротеидов низкой плотности (ЛПНП), липопротеидов высокой плотности (ЛПВП), уровня печеночных ферментов: аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ); определение плазменного уровня эндогенного антиоксиданта — СоQ10; УЗИ печени; расчет индекса атерогенности (общий холестерин, ммоль/л - ЛПВП, ммоль/л) / ЛПВП, ммоль/л).
Рост измеряли с помощью стандартного вертикального ростомера с точностью до 0,5 см, массу тела — с помощью напольных весов с точностью до 0,1 кг.
Для исследования биохимических показателей липидного обмена и ферментов печени забор крови проводили строго натощак в утренние часы.
Для определения уровня убихинона забор крови осуществляли строго натощак в утренние часы в объеме 1,5 мл в пробирки с добавлением гепарина. Плазму крови отделяли центрифугированием с последующим замораживанием и хранением при температуре -20°С до проведения анализа.
Методы
Общеклинические данные включали анализ антропометрических показателей: SDS ИМТ (число стандартных отклонений от среднего ИМТ для конкретного возраста и пола). Диагностическим критерием ожирения был принят SDS ИМТ >+2,0 [8].
Определение уровня убихинона (коэнзима Q10, СоQ10) выполняли по валидированной методике с использованием высокоэффективной жидкостной хроматографии (с электрохимическим детектированием на оборудовании фирмы EnvironmentalSciencesAssociate, Inc., США. Регистрацию и обработку хроматографических данных проводили с помощью компьютерной программы фирмы EnvironmentalSciencesAssociate, Inc., (США. Нижний предел количественного определения СoQ10 — 0,25 мкг/мл [9]. Референсные значения коэнзима Q10 0,4–1,0 нмоль/л.
Биохимический анализ крови выполнялся на автоматическом анализаторе IndikoThermoScientific и включал определение общего холестерина, ТАГ, ЛПНП, ЛПВП, уровня печеночных ферментов (АЛТ и АСТ). Проводился расчет индекса атерогенности ((общий холестерин, ммоль/л-ЛПВП, ммоль/л)/ ЛПВП, ммоль/л) и отношения АЛТ/АСТ.
Диагноз дислипидемии устанавливался при наличии 2 и более «высоких» и/или «низких» показателей [8].
Ультразвуковое исследование (УЗИ) печени проводили на аппарате Philips EPIQ 7. Диагноз неалкогольной жировой болезни печени устанавливался при наличии гепатомегалии, неоднородности паренхимы печени и обеднения сосудистого рисунка в режиме цветного допплеровского картирования [8].
Для оценки влияния степени ожирения на показатели коэнзима Q10, липидограммы и печеночных ферментов пациенты основной группы были дополнительно разделены на 4 группы: с 1, 2, 3 и 4-й степенями ожирения.
Для изучения взаимосвязи уровня коэнзима Q10 и показателей липидограммы пациенты основной группы были дополнительно разделены на 2 группы: с дислипидемией и не имеющие дислипидемии.
Для изучения взаимосвязи уровня коэнзима Q10 и показателей печеночных ферментов пациенты основной группы были дополнительно разделены на 2 группы: с отношением АЛТ/АСТ ≥1 и <1.
Статистический анализ
Статистическую обработку результатов осуществляли с помощью пакета программ Statistica 7.0 (StatSoft, США). Анализ данных проводили с помощью набора непараметрических процедур, так как большинство распределений исследуемых признаков отличалось от нормального. Количественные данные представлены в виде медианы и интерквартильного размаха Me (25–75 перцентиль); качественные данные представлены в виде абсолютных значений (n) и/или частот (%). Различие между количественными признаками оценивалось с помощью критерия Краскела–Уоллиса (при сравнении 3 и более выборок) и Манна–Уитни (при сравнении двух выборок). В случае множественных сравнений использовалась поправка Бонферрони. Различие между качественными признаками оценивалось с помощью точного критерия Фишера. Значение р<0,05 считалось статистически значимым. Взаимосвязь между двумя показателями оценивалась с использованием коэффициента ранговой корреляции Спирмена.
Этическая экспертиза
Проведение исследования одобрено Этическим комитетом при ФГБОУ ВО СГМУ Минздрава России (протокол № 17 от 25.11.2017). Все участники исследования и их законные представители подписывали информированное согласие на участие в исследовании и на обработку персональных данных.
РЕЗУЛЬТАТЫ
Обследованы 72 пациента, которые были распределены на две группы: основная (n=40) — пациенты с экзогенно-конституциональным ожирением и контрольная — пациенты с нормальной массой тела (n=32).
Пациенты обеих групп были сопоставимы (р>0,05) по возрасту (12,0 года (8,0–15,0) и 12,0 года (7,0–15,0)) и полу (м/д: 25/15 и 20/12).
Результаты исследуемых биохимических параметров представлены в таблице 1. В каждой группе оцениваемые показатели между мальчиками и девочками не различались, что позволило проводить сравнение без учета пола.
Уровень коэнзима Q10 в сравниваемых группах был сопоставим (p>0,05) и не отличался у пациентов с различной степенью ожирения (табл. 2). При индивидуальном анализе повышенный уровень коэнзим Q10 выявлен у 6 (15%) пациентов основной группы (у 4 (12,5%) в контрольной группе), а сниженный — у 5 (12,5%) (у 5 (15,6%) в контрольной группе).
Таблица 1. Лабораторные показатели у обследованных пациентов
|
Показатель |
Основная группа (n=40) |
Контрольная группа (n=32) |
Р между группами |
|
Коэнзим Q10, мкг/мл |
0,8 (0,2–1,8) |
0,7 (0,2–1,5) |
>0,05 |
|
Общий холестерин, ммоль/л |
4,35 (2,90–7,60) |
4,30 (3,50–5,60) |
>0,05 |
|
ЛПВП, ммоль/л |
1,3 (0,7–2,9) |
1,7 (0,9–2,5) |
0,008 |
|
ЛПНП, ммоль/л |
2,9 (1,5–6,1) |
2,6 (1,8–3,9) |
0,048 |
|
Триглицериды, ммоль/л |
1,06 (0,43–3,91) |
0,97 (0,46–1,78) |
>0,05 |
|
Индекс атерогенности |
2,5 (0,6–8,2) |
1,7 (0,7–3,8) |
<0,001 |
|
АЛТ, Ед/л |
26,0 (11,0–82,0) |
16,0 (7,0–25,0) |
<0,001 |
|
АСТ, Ед/л |
25,0 (15,0–49,0) |
26,0 (14,0–52,0) |
>0,05 |
|
АЛТ/АСТ |
1,0 (0,5–1,6) |
0,6 (0,3–1,1) |
<0,001 |
Примечание. Результаты представлены в виде медианы и интерквартильного размаха Me (25–75 перцентиль); ЛПВП — липопротеиды высокой плотности; ЛПНП — липопротеиды низкой плотности; АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза; АЛТ/АСТ — отношение уровня аланинаминотрансферазы к уровню аспартатаминотрансферазы.
Таблица 2. Лабораторные показатели пациентов основной группы с различной степенью ожирения
|
Показатель |
1-я степень (n=8) |
2-я степень (n=16) |
3-я степень (n=12) |
4-я степень (n=4) |
р |
|
Коэнзим Q10, мкг/мл |
0,48 (0,42–0,82) |
0,6 (0,71–0,87) |
0,66 (0,46–0,77) |
0,89 (0,55–1,23) |
>0,05 |
|
Общий холестерин, ммоль/л |
4,80 (4,00–5,45) |
4,20 (4,10–4,76) |
4,65 (3,80–4,98) |
4,05 (4,02–5,20) |
>0,05 |
|
ЛПВП, ммоль/л |
1,78 (1,54–1,84) |
1,16 (0,96–1,37) |
1,29 (1,06–1,59) |
0,88 (0,83–1,11) |
0,001 |
|
ЛПНП, ммоль/л |
2,84 (2,06–3,46) |
2,95 (2,65–3,31) |
2,94 (2,28–3,32) |
2,64 (2,50–3,70) |
>0,05 |
|
Триглицериды, ммоль/л |
1,01 (0,67–1,29) |
1,00 (0,71–1,22) |
1,05 (0,89–1,16) |
1,70 (1,46–2,34) |
0,023 |
|
Индекс атерогенности |
1,92 (1,27–2,71) |
2,68 (2,05–3,67) |
2,43 (1,85–2,67) |
3,44 (2,68–4,84) |
0,087 |
|
АЛТ, Ед |
26,0 (15,0–27,3) |
30,0 (17,5–37,5) |
23,5 (14,8–27,8) |
37,0 (31,8–44,0) |
0,001 |
|
АСТ, Ед |
26,5 (21,3–33,0) |
25,0 (18,5–46,5) |
24,0 (21,8–27,0) |
29,0 (23,0–30,5) |
>0,05 |
|
АЛТ/АСТ |
0,84 (0,80–0,93) |
0,97 (0,8–1,35) |
0,94 (0,7–1,10) |
1,52 (1,42–1,56) |
0,016 |
Примечание. Результаты представлены в виде медианы и интерквартильного размаха Me (25–75 перцентиль); ЛПВП — липопротеиды высокой плотности; ЛПНП — липопротеиды низкой плотности; АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза; АЛТ/АСТ — отношение уровня аланинаминотрансферазы к уровню аспартатаминотрансферазы.
По результатам исследования липидограммы (см. табл. 1) у пациентов основной группы уровень ЛПВП был ниже, а уровень ЛПНП выше показателей группы контроля, что и обуславливает более высокий индекс атерогенности у пациентов основной группы. У пациентов с различной степенью ожирения были получены различия по уровню ЛПВП (самые высокие показатели у пациентов с 1-й степенью ожирения) и триглицеридов (самый высокий уровень у пациентов с 4-й степенью ожирения) (табл. 2).
В отсутствие статистически значимых различий по содержанию холестерина в исследуемых группах, при индивидуальном анализе повышенный уровень холестерина чаще отмечался у детей основной группы в сравнении с контрольной (8 (20 %) и 1 (3%); р=0,037). 15 (37,5%) пациентов основной группы имели дислипидемию (в контрольной группе — 1 (3%, р<0,001), однако уровень коэнзима Q10 у них (0,81 (0,52–0,86)) статистически значимо не различался по сравнению с пациентами без диагностированной дислипидемии (0,72 (0,46–0,91)).
При проведении корреляционного анализа в контрольной группе установлена прямая взаимосвязь уровня коэнзима Q10 и общего холестерина (r=0,474, р=0,009), в основной группе подобная взаимосвязь отмечалась только у пациентов с 1-й степенью ожирения (r=0,548, р=0,035) (рис. 1).
При анализе уровня печеночных ферментов разницы по АСТ в обследуемых группах получено не было, однако уровень АЛТ и соотношения АЛТ/АСТ были достоверно выше у пациентов основной группы (p<0,001) (см. табл. 1). При этом самые высокие показатели АЛТ и соотношения АЛТ/АСТ отмечались у пациентов с 4-й степенью ожирения (табл. 2).
У 18 (45%) детей основной группы отношение АЛТ/АСТ было ≥1 (в группе контроля — у 1 (3%) (p<0,001), при этом у 14 (80%) из них по данным УЗИ печени отмечалось увеличение обеих долей и изменение ее структуры.
При проведении корреляционного анализа в контрольной группе установлена прямая взаимосвязь уровня коэнзима Q10 и отношения АЛТ/АСТ (r=0,412; р=0,023) (рис. 2), в основной группе — индекса атерогенности и АЛТ/АСТ (r=0,436; р=0,006) (рис. 3), а у пациентов с 1-й степенью ожирения также коэнзима Q10 и АЛТ (r=0,875; р<0,001).
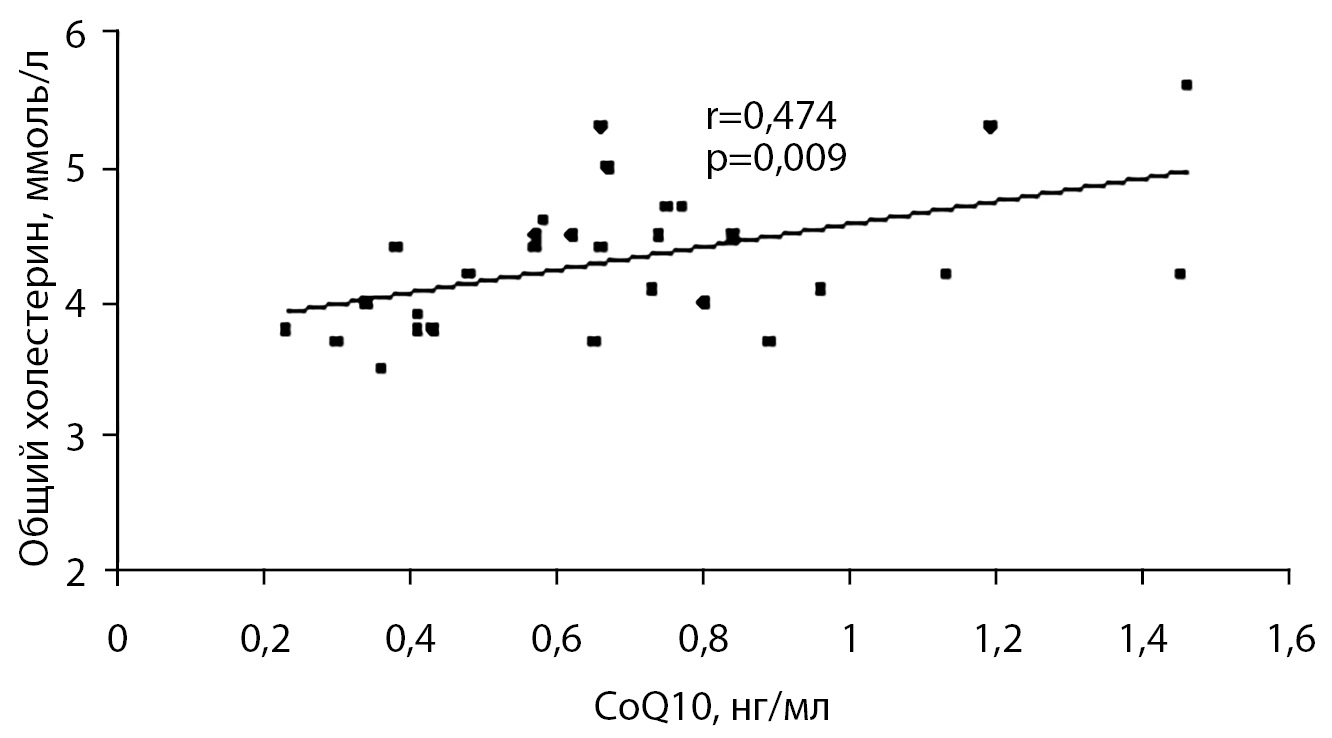
Рисунок 1. Корреляционные взаимосвязи между коэнзимом Q10 и общим холестерином в контрольной группе.
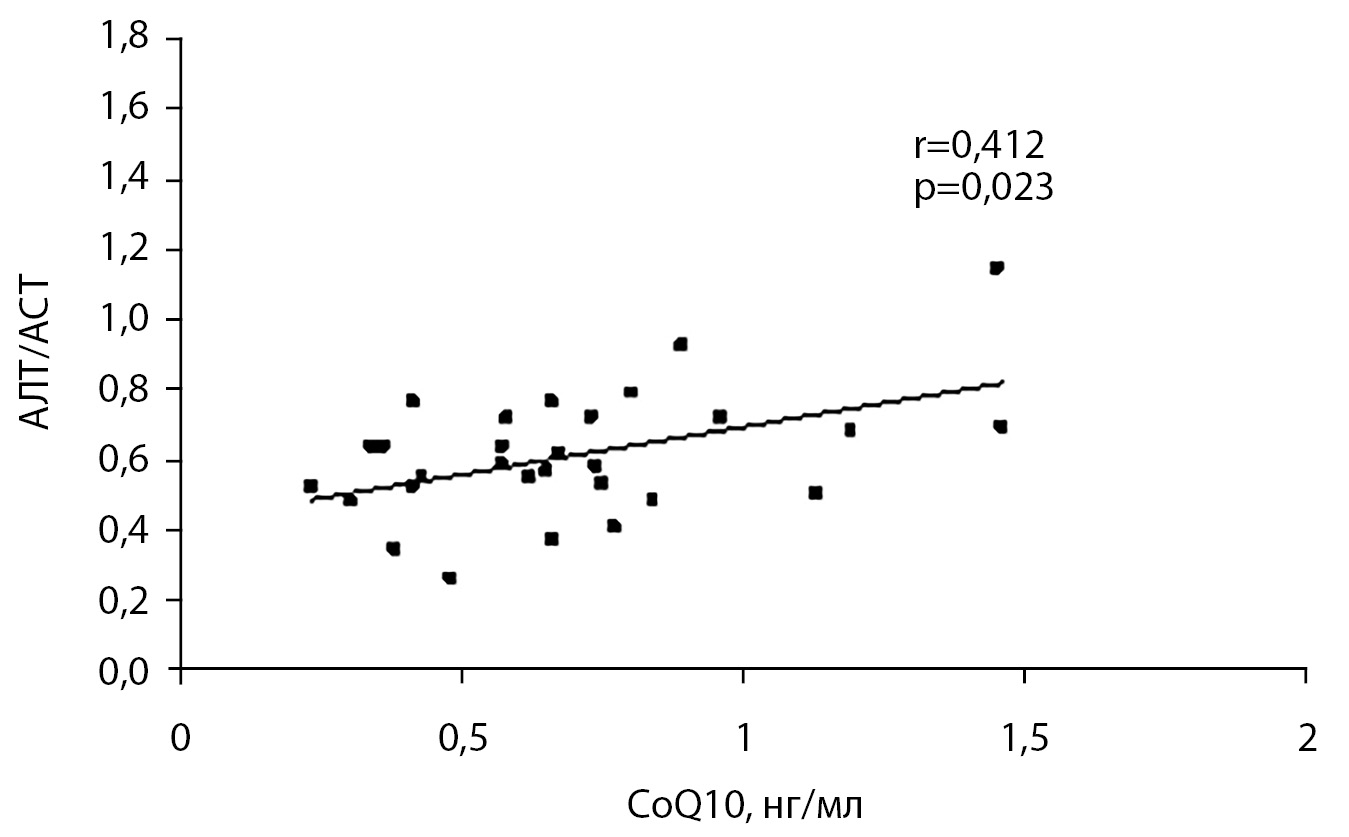
Рисунок 2. Корреляционные взаимосвязи между коэнзимом Q10 и отношением АЛТ/АСТ в контрольной группе.
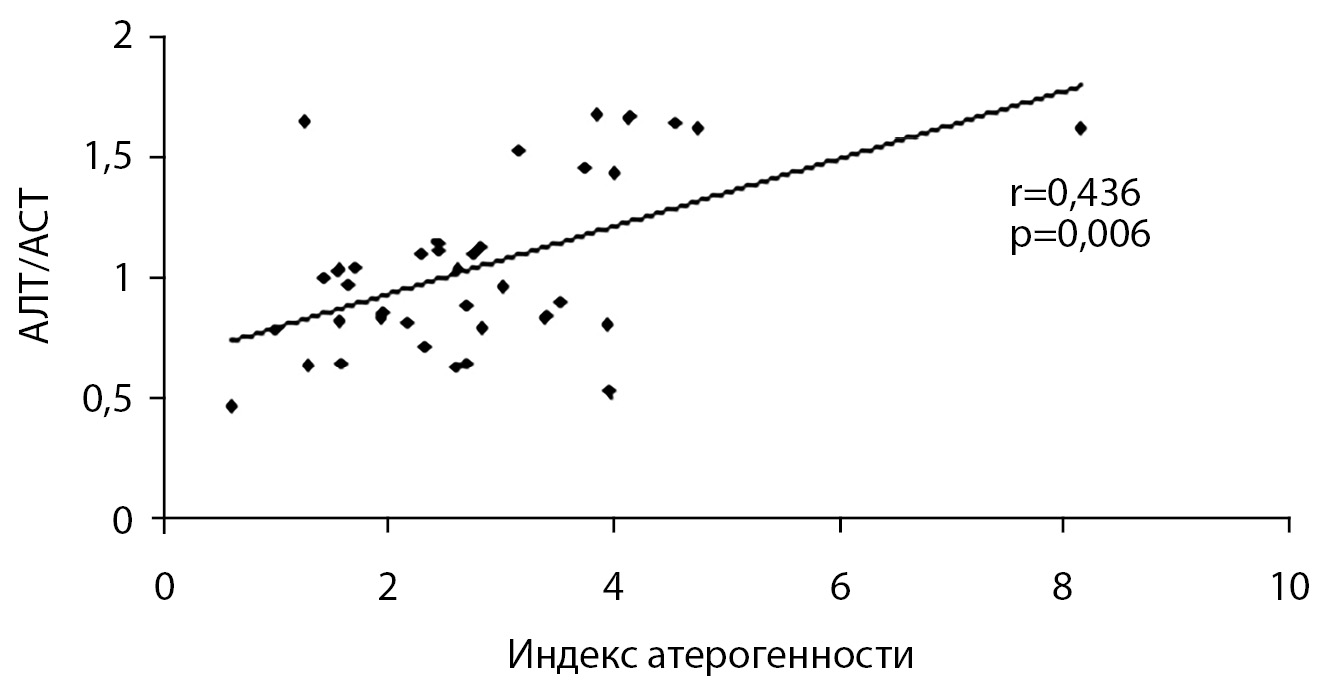
Рисунок 3. Корреляционные взаимосвязи между индексом атерогенности и отношением АЛТ/АСТ в основной группе.
ОБСУЖДЕНИЕ
Репрезентативность выборок
Обследованы 72 пациента в условиях ОГБУЗ «Смоленская областная детская клиническая больница» с подбором участников по принципу «случай-контроль». Размер выборки предварительно не рассчитывался.
Сопоставление с другими публикациями
Одним из патогенетических звеньев ожирения, сопровождающегося хроническим воспалением, является окислительный стресс [7]. В результате многочисленных клинических исследований у пациентов с ожирением были выявлены снижение активности антиоксидантных ферментов (супероксиддисмутазы, глутатионпероксидазы), снижение общего антиоксидантного статуса плазмы крови, а также положительная взаимосвязь между уровнем перечисленных маркеров окислительного стресса и ИМТ [10–12]. Учитывая важнейшую роль коэнзима Q10 в работе дыхательной цепи митохондрий, а также его антиоксидантную функцию понятен интерес исследователей к этому соединению [13, 14].
В нашем исследовании, включающем преимущественно детей с 2-й и 3-й степенью ожирения, не было достоверных изменений плазменных уровней коэнзима Q10 относительно детей контрольной группы. В литературе содержатся противоречивые данные о взаимосвязи ожирения с уровнем коэнзима Q10. Так, в исследовании A. Gvozdjakova и соавт. у детей в возрасте от 10 до 18 лет с преимущественно средней степенью ожирения и повышенным уровнем общего холестерина установлено снижение общего содержания коэнзима Q10 в плазме крови на 51 и 59% у мальчиков и девочек соответственно [14]. В исследовании S. Muhtaroglu у детей с ожирением той же возрастной группы при повышенных уровнях общего холестерина, ЛПНП содержание коэнзима Q10 в плазме было снижено [15]. Однако в исследовании T. Menke и соавт. у детей в возрасте 10–13 лет с умеренной степенью ожирения при повышенном содержании холестерина в плазме не выявлено изменений уровня коэнзима Q10, нормированного на холестерин [16].
Известно, что в плазме крови холестерин является основным носителем коэнзима Q10, а коэнзим Q10, в свою очередь, — важнейшим компонентом его антиоксидантной защиты [13]. В нашем исследовании у пациентов основной группы присутствовала прямая корреляционная связь между уровнями коэнзима Q10 и общего холестерина только при 1-й степени ожирения, существующая и в контрольной группе. При ≥2-й степени ожирения подобная взаимосвязь отсутствовала. Обнаруженное у детей с ожирением нарушение адекватного обеспечения холестерина коэнзимом Q10 может являться следствием снижения содержания коэнзима Q10 в печени на фоне воспаления и одной из причин наблюдаемой у этих пациентов дислипидемии. По данным A. Gvozdjakova и соавт., при прогрессировании ожирения у детей наблюдается дальнейшее повышение уровня холестерина и снижение содержания коэнзима Q10 в плазме [14].
Согласно современным патогенетическим представлениям, ожирение является следствием хронического воспалительного процесса в жировой ткани, имеющего тенденцию к распространению в том числе и на гепатоциты, с последующим развитием осложнений в виде неалкогольной жировой болезни печени (НАЖБП), одним из биохимических критериев которой предлагается рассматривать соотношение АЛТ/АСТ ≥1 [17–19].
В обследованной нами группе детей с ожирением относительно контрольной группы отмечалось двукратное статистически значимое повышение уровня АЛТ (в пределах референтных значений) и соотношения АЛТ/АСТ. Увеличение соотношения АЛТ/АСТ в этой группе коррелировало с проявлением дислипидемии, что отражает взаимосвязь воспалительных изменений в гепатоцитах с повышенной интенсивностью окислительных процессов. Основываясь на гистологических изменениях в печени на субклеточном уровне (накоплении жирных кислот в гепатоцитах, окислении фосфолипидов мембран клеток, в т.ч. мембран митохондрий), некоторые авторы рассматривают НАЖБП как «митохондриальное заболевание» [20]. В обзорной статье K. Botham и соавт. анализируются многочисленные клинические и экспериментальные исследования при НАЖБП и приводятся противоречивые данные об уровнях коэнзима Q10 как в виде повышения плазматического уровня в одних исследованиях, так и понижения уровня в плазме и ткани печени, что, возможно, является отражением различных стадий патологического процесса в печени и постепенным сокращением «запасов» коэнзима Q10 [21]. Также в нашем исследовании были выявлены корреляционная связь между соотношением АЛТ/АСТ и уровнем коэнзима Q10 в плазме крови детей контрольной группы и отсутствие этой связи у пациентов основной группы при наличии у детей с 1-й степенью ожирения прямой корреляционной связи между коэнзимом Q10 и АЛТ. Дисбаланс между значениями АЛТ/АСТ и уровнем коэнзима Q10 при ожирении может являться следствием разнонаправленных изменений плазменных уровней АЛТ и эндогенного антиоксиданта коэнзима Q10 в результате патологического процесса в печени, ведущего к повышению содержания в плазме печеночных ферментов и истощению запасов (снижению синтеза) коэнзима Q10.
Ограничения исследования
Ограничением данной работы является небольшая выборка пациентов с ожирением, в том числе с 1-й и 4-й степенями.
Направления дальнейших исследований
Запланировано продолжение исследования с оценкой эффективности применения коэнзима Q10 для коррекции дислипидемий у детей с ожирением.
ЗАКЛЮЧЕНИЕ
В ходе исследования у детей с экзогенно-конституциональным ожирением были выявлены нарушения липидного обмена, изменения активности печеночных ферментов, степень выраженности которых прогрессировала по мере увеличения степени ожирения.
В группе детей без ожирения были установлены прямые корреляционные взаимосвязи коэнзима Q10 с общим холестерином и отношением АЛТ/АСТ, которые присутствовали у пациентов с 1-й степенью ожирения и исчезали по мере прогрессирования заболевания.
Таким образом, нарушение адекватного обеспечения холестерина коэнзимом Q10 у детей с экзогенно-конституциональным ожирением отражает патогенетическую роль окислительного стресса в развитии дислипидемий и неалкогольной жировой болезни печени и может служить показанием для назначения препаратов коэнзима Q10 с целью коррекции данных осложнений.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Поварова О.В. — разработка протокола исследования, сбор материала, обработка и интерпретация результатов, подготовка рукописи; Городецкая Е.А. — разработка протокола исследования, интерпретация результатов, контроль и координация проведения исследования, внесение правок в рукопись; Куляк О.Ю. — хроматографический анализ содержания коэнзима Q10, сбор материала, обработка и интерпретация результатов; Демяненко А.Н. — сбор материала, обработка и интерпретация результатов, внесение правок в рукопись; Алимова И.Л. — разработка протокола исследования, сбор материала, анализ результатов, подготовка рукописи; Каленикова Е.И. — хроматографический анализ содержания коэнзима Q10, анализ и интерпретация полученных результатов, подготовка рукописи; Медведев О.С. — анализ и интерпретация полученных результатов, внесение правок в рукопись. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Wang LX, Gurka MJ, DeBoer MD. Metabolic syndrome severity and lifestyle factors among adolescents. Minerva Pediatr. 2018;70:467-475. doi: https://doi.org/10.23736/S0026-4946.18.05290-8
2. Garwood P, Chaib F, Brogan C. Tenfold increase in childhood and adolescent obesity in four decades: new study by Imperial College London and WHO.[cited 2017 October 11]. Available from: https://www.who.int/news/item/11-10-2017-tenfold-increase-in-childhoodand-adolescent-obesity-in-four-decades-new-study-by-imperialcollege-london-and-who
3. WHO: obesity and overweight. [cited 2020 April 4]. Available from: https://www.who.int/news-room/fact-sheets/detail/obesity-andoverweight
4. Бокова Т.А. Неалкогольная жировая болезнь печени и основные компоненты метаболического синдрома у детей // Экспериментальная и клиническая гастроэнтерология. — 2020. — Т. 173. — №1. — С. 15-20. doi: https://doi.org/10.31146/1682-8658-ecg-173-1-15-20
5. Weihe P, Weihrauch-Blüher S. Metabolic syndrome in children and adolescents: diagnostic criteria, therapeutic options and perspectives. Curr Obes Rep. 2019;8:472-479. doi: https://doi.org/10.1007/s13679-019-00357-x.
6. DeBoer MD. Assessing and managing the metabolic syndrome in children and adolescents. Nutrients. 2019;11:1788-1790. doi: https://doi.org/10.3390/nu11081788
7. Manna P, Jain SK. Obesity, oxidative stress, adipose tissue dysfunction, and the associated health risks: causes and therapeutic strategies. Metab Syndr Relat Disord. 2015;10:423-444. doi: https://doi.org/10.1089/met.2015.0095
8. Клинические рекомендации «Ожирение у детей» 2021 г. Доступно по: http://cr.minzdrav.gov.ru/recomend/229_2. Ссылка активна на 12.10.2021.
9. Kalenikova EI, Gorodetskaya EA, Medvedev OS. Pharmacokinetics of coenzyme Q10. Bull Exp Biol Med. 2008;146 (3):313-316. doi: https://doi.org/10.1007/s10517-008-0270-8
10. Коденцова В.М., Вржесинская О.А., Кошелева О.В., и др. Оценка обеспеченности витаминами-антиоксидантами пациентов с ожирением с позиций риска развития сопутствующих заболеваний // Ожирение и метаболизм. — 2020. — Т. 17. — №1. — С. 22-32. doi: https://doi.org/10.14341/omet10144
11. Поварова О.В., Городецкая Е.А., Каленикова Е.И., Медведев О.С. Метаболические маркеры и окислительный стресс в патогенезе ожирения у детей // Рос. вестн. перинатол. и педиатр. — 2020. — Т. 65. — №1. — С. 22-29. doi: https://doi.org/10.21508/1027-4065-2020-65-1-22-29
12. Vona R, Gambardella L, Cittadini C, et al. Biomarkers of Oxidative Stress in Metabolic Syndrome and Associated Diseases. Oxid Med Cell Longev. 2019;2019:1-19. doi: https://doi.org/10.1155/2019/8267234
13. Casagrande D, Waib PH, Jordão Júnior AA. Mechanisms of action and effects of the administration of Coenzyme Q10 on metabolic syndrome. J Nutr Intermed Metab. 2018;13:26-32. doi: https://doi.org/10.1016/j.jnim.2018.08.002
14. Gvozdjakova A, Kucharska J, Tkacov M, et al. Ratio of lipid parameters to coenzyme Q10 could be used as biomarker of the development of early complications of obesity in children. Bratisl. Lek. Listy. 2012;113:21-25. doi: https://doi.org/10.4149/BLL_2012_005
15. Muhtagorlu S, Koca SO, Cetin I, et al. Investigation of ischemia modified albumin and coenzyme Q10 levels in obese children with metabolic syndrome. TJB. 2016;41:443-449. doi: https://doi.org/10.1515/tjb-2016-0147
16. Menke T, Niklowitz P, de Sousa G, et al. Comparison of coenzyme Q10 plasma levels in obese and normal weight children. Clin. Chim. Acta. 2004;349:121-127. doi: https://doi.org/10.1016/j.cccn.2004.06.015
17. Павловская Е.В., Строкова Т.В., Пырьева Е.А., Шилина Н.М. Неалкогольная жировая болезнь печени у детей с ожирением: современные аспекты диагностики и лечения // Вопросы детской диетологии. — 2021. — Т. 19. — №2. — С. 53–61. doi: https://doi.org/10.20953/1727-5784-2021-2-53-61
18. Kawamoto R, Kohara K, Kusunoki T, et al. Alanine aminotransferase/ aspartate aminotransferase ratio is the best surrogate marker for insulin resistance in non-obese Japanese adults. Cardiovasc Diabetol. 2012;11:1-8. doi: https://doi.org/10.1186/1475-2840-11-117
19. Homsanit M, Sanguankeo A, Upala S, Udol K. Abnormal liver enzymes in Thai patients with metabolic syndromes. J Med Assoc Thai. 2012;95:444.
20. Ajith TA. Role of mitochondria and mitochondria-targeted agents in non-alcoholic fatty liver disease. Clin Exp Pharmacol Physiol. 2018;45:413-421. doi: https://doi.org/10.1111/1440-1681.12886
21. Botham KM, Napolitano M, Bravo E. The emerging role of disturbed CoQ metabolism in nonalcoholic fatty liver disease development and progression. Nutrients. 2015;7:9834-9846. doi: https://doi.org/10.3390/nu7125501
Об авторах
О. В. ПовароваРоссия
Поварова Оксана Викторовна, кандидат медицинских наук
119991, г. Москва, Ломоносовский проспект, д. 27, корп. 1
Researcher ID: R-3090-2016;
Scopus Author ID: 6603347164;
eLibrary SPIN: 6244-2772
Е. А. Городецкая
Городецкая Евгения Ароновна, кандидат биологических наук, доцент
Москва
Scopus Author ID: 6603700637;
eLibrary ID: 82831
О. Ю. Куляк
Куляк Олеся Юрьевна, кандидат фармацевтических наук
Москва
Researcher ID: AAO-6219-2021;
Scopus Author ID:
57039988900; eLibrary SPIN: 9697-1220
А. Н. Демяненко
Демяненко Александра Николаевна, кандидат медицинских наук
Смоленск
eLibrary SPIN: 6889-8349
И. Л. Алимова
Алимова Ирина Леонидовна, доктор медицинских наук, профессор
Смоленск
eLibrary SPIN: 4583-9822
Е. И. Каленикова
Каленикова Елена Игоревна, доктор фармацевтических наук, профессор
Москва
Scopus Author ID: 6603796631;
eLibrary SPIN: 5868-6998
О. С. Медведев
Медведев Олег Стефанович, доктор медицинских наук, профессор
Москва
Researcher ID: A-5674-2016;
Scopus Author ID: 7103337682;
eLibrary SPIN: 7696-3683
Дополнительные файлы
|
|
1. Рисунок 1. Корреляционные взаимосвязи между коэнзимом Q10 и общим холестерином в контрольной группе. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(73KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Корреляционные взаимосвязи между коэнзимом Q10 и отношением АЛТ/АСТ в контрольной группе. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(73KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Корреляционные взаимосвязи между индексом атерогенности и отношением АЛТ/АСТ в основной группе. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(67KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Поварова О.В., Городецкая Е.А., Куляк О.Ю., Демяненко А.Н., Алимова И.Л., Каленикова Е.И., Медведев О.С. Обоснование подходов к коррекции нарушений липидного обмена и неалкогольной жировой болезни печени у детей с экзогенно-конституциональным ожирением. Ожирение и метаболизм. 2022;19(1):19-26. https://doi.org/10.14341/omet12802
For citation:
Povarova O.V., Gorodetskaya E.A., Kulyak O.Y., Demyanenko A.N., Alimova I.L., Kalenikova E.I., Medvedev O.S. Substantiation of approaches to the correction of lipid metabolism disorders and non-alcoholic fatty liver disease in children with exogenous obesity. Obesity and metabolism. 2022;19(1):19-26. https://doi.org/10.14341/omet12802

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































