Перейти к:
Трудности дифференциальной диагностики остеомаляции и остеопороза, ассоциированного с беременностью и лактацией: клинический случай
https://doi.org/10.14341/omet13254
Аннотация
Беременность и лактация сопровождаются физиологической перестройкой минерально-костного обмена, направленной на обеспечение потребностей развивающегося плода и новорожденного при сохранении здоровья матери. В связи с указанными изменениями особое значение приобретают потребление кальцийсодержащих продуктов, достаточное поступление витамина D совместно с умеренной физической активностью и адекватной инсоляцией. Костные патологии, наблюдаемые на поздних сроках гестации, нередко манифестируют схожей клинической симптоматикой при существенных патогенетических различиях, повышая риск диагностических и терапевтических ошибок. В статье представлен клинический случай остеомаляции, развившейся у пациентки, предположительно, задолго до наступления беременности, однако диагностированной лишь после продолжительного курса антиостеропоротической и анаболической терапии. В работе рассматриваются трудности дифференциальной диагностики остеомаляции и остеопороза, ассоциированного с беременностью и лактацией, подчеркивается важность междисциплинарного подхода и необходимость повышения осведомленности специалистов, в частности врачей-рентгенологов, с целью своевременного выявления заболевания и назначения патогенетически обоснованного лечения.
Для цитирования:
Эбаноидзе Л.Г., Кацобашвили И.А., Берлович М.С., Пигарова Е.А., Дзеранова Л.К., Воротникова С.Ю., Хайриева А.В., Тарбаева Н.В. Трудности дифференциальной диагностики остеомаляции и остеопороза, ассоциированного с беременностью и лактацией: клинический случай. Ожирение и метаболизм. 2025;22(2):138-144. https://doi.org/10.14341/omet13254
For citation:
Ebanoidze L.G., Katsobashvili I.A., Berlovich M.S., Pigarova E.A., Dzeranova L.K., Vorotnikova S.Y., Khairieva A.V., Tarbaeva N.V. Differential Diagnosis Challenges in Osteomalacia and Pregnancy and Lactation Associated Osteoporosis: A Case Report. Obesity and metabolism. 2025;22(2):138-144. (In Russ.) https://doi.org/10.14341/omet13254
АКТУАЛЬНОСТЬ
Одно из первых описаний этиологии и лечения остеомаляции датируется 1896 годом [1]. В XX веке в научной литературе использовался термин «остеопоромаляция» в связи с частым сочетанным развитием этих заболеваний [2]. Распространенность остеомаляции остается недостаточно изученной, что обусловлено трудностями верификации диагноза при отсутствии выраженных клинических проявлений [3]. Подтверждение возможно лишь при гистологическом исследовании биоптатов костной ткани с применением специальных морфологических методик [4].
Впервые гипотеза о рассмотрении послеродового остеопороза как самостоятельного синдрома была выдвинута британскими учеными Б. Нордином и А. Ропером в 1955 г. [5]. Согласно эпидемиологическим данным, распространенность остеопороза, ассоциированного с беременностью и лактацией (ОБЛ), составляет 4–8 случаев на 1 000 000 женщин, однако фактическое число может быть выше, поскольку у значительной части пациенток заболевание остается не диагностированным [6].
При остеопорозе в процессе ремоделирования резорбция костной ткани сопровождается формированием меньшего объема нормальной пластинчатой кости, тогда как при остеомаляции замещение происходит неминерализованным матриксом (или остеоидом) [7]. Понимание этих фундаментальных патогенетических различий в сочетании с комплексной оценкой клинической картины, результатов инструментальных и лабораторных исследований является ключевым фактором в дифференциальной диагностике. Ошибочная интерпретация остеомаляции как остеопороза может привести к назначению нецелесообразной антиостеопоротической терапии, не устраняющей причину возникновения патологии.
ОПИСАНИЕ СЛУЧАЯ
Пациентка Б. обратилась в ГНЦ ФГБУ «НМИЦ эндокринологии» Минздрава России в 2019 г. в возрасте 32 лет с жалобами на боли в пояснично-крестцовом и грудном отделах позвоночника, возникшие в 2014 г. после первых срочных физиологических родов.
Из анамнеза заболевания известно, что с 2016 г. после вторых родов у пациентки отмечалось ухудшение состояния, проявляющееся в усилении болевого синдрома и прогрессирующем снижении подвижности. По данным двухэнергетической рентгеновской абсорбциометрии (DXA), диагностирован тяжелый остеопороз с максимальным снижением минеральной плотности кости (МПК) в поясничном отделе позвоночника L1-4 до -3,7 SD по Z-критерию (табл. 1). По результатам МРТ, визуализированы компрессионные переломы тел Th5, Th8, Th10 позвонков с явлениями отека. Лактация прекращена пациенткой самостоятельно после 5 месяцев вскармливания ребенка.
По данным клинико-лабораторного исследования от 2017 г., выявлен выраженный дефицит витамина D (8,0 нг/мл), в связи с чем инициирована терапия колекальциферолом 6000 МЕ ежедневно в комбинации с цитратом кальция в суточной дозе 500 мг с последующим достижением целевых показателей фосфорно-кальциевого обмена. Ввиду снижения МПК поясничного отдела позвоночника и наличия переломов тел грудных позвонков, с 2017 г. назначена ибандроновая кислота 150 мг перорально 1 раз в месяц. При динамическом обследовании отмечен прирост МПК на DXA (табл. 1).
В декабре 2019 г. на фоне приема антирезорбтивной терапии при проведении МРТ рентгенологами описаны новые компрессионные переломы тел позвонков (рис. 1 и рис. 2). Однако по результатам DXA зарегистрировано увеличение МПК (табл. 1). В этот период пациенткой самостоятельно отменен прием нативной формы витамина D.
В апреле 2020 г. состояние пациентки было отягощено выраженным болевым синдромом в грудном и поясничном отделах позвоночника, в тазобедренных суставах и в верхних конечностях с онемением пальцев кисти. Кроме того, сохранялись периодические головные боли, купируемые на протяжении длительного времени нестероидными противовоспалительными средствами. Учитывая отсутствие клинически значимого ответа на предшествующее антиостеопоротическое лечение, было принято решение о назначении терипаратида.
С целью исключения онкологических процессов перед инициацией костно-анаболической терапии рекомендовано проведение остеосцинтиграфии с технефором Тс-99m. В ходе исследования обнаружено очаговое накопление остеотропного радиофармацевтического препарата в костномозговом канале диафиза правой бедренной кости. По результатам МРТ, данное образование имело гиперваскулярную структуру неправильной формы с нечеткими, неровными контурами размером до 14х9 мм.
При повторной медицинской интерпретации МРТ-диска в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» изменение в правой бедренной кости интерпретировано как участок фиброзной дисплазии малых размеров с наименьшей вероятностью злокачественного процесса. Также с целью исключения миеломной болезни в ФГБУ «НМИЦ гематологии» МЗ РФ проведен анализ на иммунохимическое исследование белков сыворотки крови. По результатам иммуноэлектрофореза патологической секреции иммуноглобулинов установлено не было.
На основании врачебного консилиума с мая 2020 г. пациентке инициирован терипаратид 20 мкг подкожно ежедневно. После 18 месяцев анаболической терапии зафиксирована положительная динамика МПК (табл. 1) с последующим закреплением эффекта золедроновой кислотой 5 мг внутривенно капельно.
В 2023 г., по данным клинико-лабораторного исследования, у пациентки впервые диагностирован вторичный гиперпаратиреоз (ВГПТ), возникший из-за недостаточного потребления кальция и применения бисфосфонатов (табл. 2). Назначена терапия карбонатом и лактоглюконатом кальция 1000 мг в сутки. На фоне постоянного приема колекальциферола в поддерживающей дозе достигнут целевой уровень 25(ОН) витамина D.
При обследовании в апреле 2025 г. на фоне проведенного лечения пациенткой отмечено улучшение общего самочувствия, уменьшение интенсивности болей в грудном и поясничном отделах позвоночника. По результатам биохимического исследования крови, данных за нарушения минерального обмена не получено (табл. 2). При проведении DXA МПК во всех отделах скелета соответствует возрастной норме, в связи с чем принято решение о перерыве в лечении бисфосфонатами (табл. 1).
Таблица 1. Динамика показателей МПК по данным рентгеновской остеоденситометрии
|
Дата |
L1-4, SD |
Femur Neck, SD |
Total Hip, SD |
Radius 33%, SD |
Radius Total, SD |
|
2016 г. |
-3,7 |
-2,5 |
-1,8 |
|
|
|
2017 г. |
-3,3 |
-1,8 |
-1,8 |
|
|
|
2018 г. |
-2,5 |
-2,0 |
-1,5 |
|
|
|
2019 г. |
-2,4 |
-0,7 |
-1,6 |
|
|
|
2021 г. |
-2,1 |
-0,9 |
-1,4 |
-1,3 |
-1,2 |
|
2022 г. |
-1,6 |
-0,7 |
-1,0 |
-1,2 |
-1,3 |
|
2023 г. |
-1,2 |
-0,6 |
-1,3 |
-1,2 |
-1,5 |
Таблица 2. Динамика лабораторных показателей
|
Дата |
Са скорр., ммоль/л (2,15–2,55) |
ПТГ, пг/мл (15–65) |
25(OH) витамин D, нг/мл (30–60) |
|
С сентября 2017 г. — Ибандроновая кислота 150 мг перорально 1 р/мес |
|||
|
Декабрь 2019 г. |
2,44 |
40,93 |
- |
|
Март 2020 г. |
- |
27,11 |
15,2 |
|
С мая 2020 г. — Терипаратид 20 мкг п/к ежедневно |
|||
|
Апрель 2021 г. |
2,19 |
40,96 |
13,7 |
|
Апрель 2022 г. |
2,23 |
25,86 |
34,8 |
|
В июне 2022 г. — Золедроновая кислота 5 мг 100 мл в/в |
|||
|
Ноябрь 2023 г. |
2,1 |
76,86 |
30,9 |
|
Февраль 2025 г. |
2,23 |
48,0 |
35,4 |
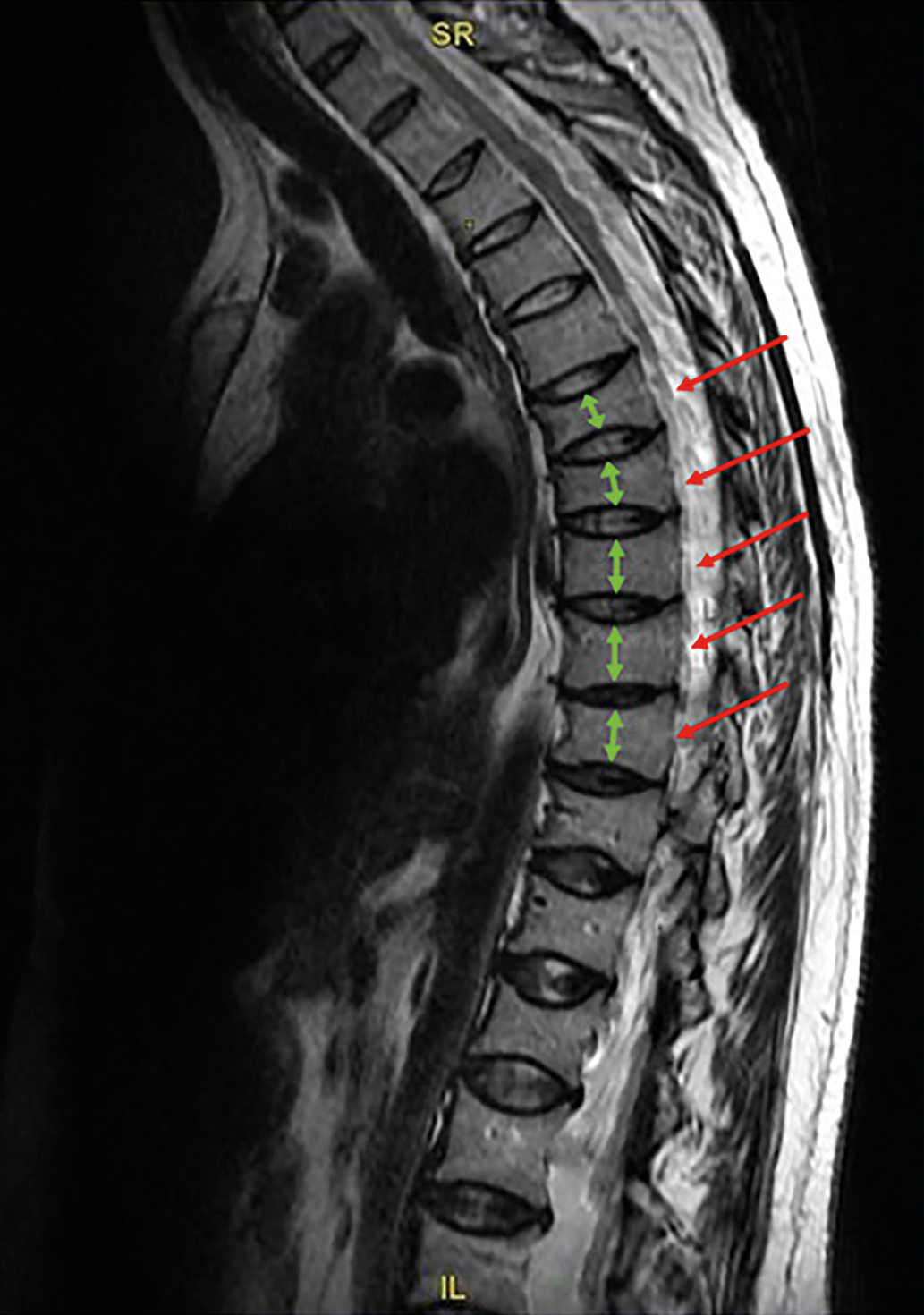
Рисунок 1. Магнитно-резонансная томография грудного отдела позвоночника пациентки Б.
Режим Т2-ВИ. Сагиттальный срез.
Определяется двояковогнутая деформация замыкательных пластин тел Th3-Th12 позвонков с формированием деформации по типу «рыбьих» позвонков. Высота тел позвонков снижена, форма тел позвонков напоминает двояковогнутую линзу. Описанные изменения наиболее выражены на уровне Th4, Th6, Th7, Th10, Th11 позвонков, где степень снижения высоты тел превышает 40% (максимальные значения достигают 46%).
Figure 1. MRI of the thoracic spine of patient B.
T2-WI. Sagittal view.
The following is observed: Biconcave deformation of the endplates in the vertebral bodies of Th3–Th12, resulting in «fish vertebrae» deformities. The vertebral body height is reduced, and their shape resembles a biconcave lens. These changes are most pronounced at the levels of Th4, Th6, Th7, Th10, and Th11, where the degree of vertebral height reduction exceeds 40% (with maximum values reaching 46%).
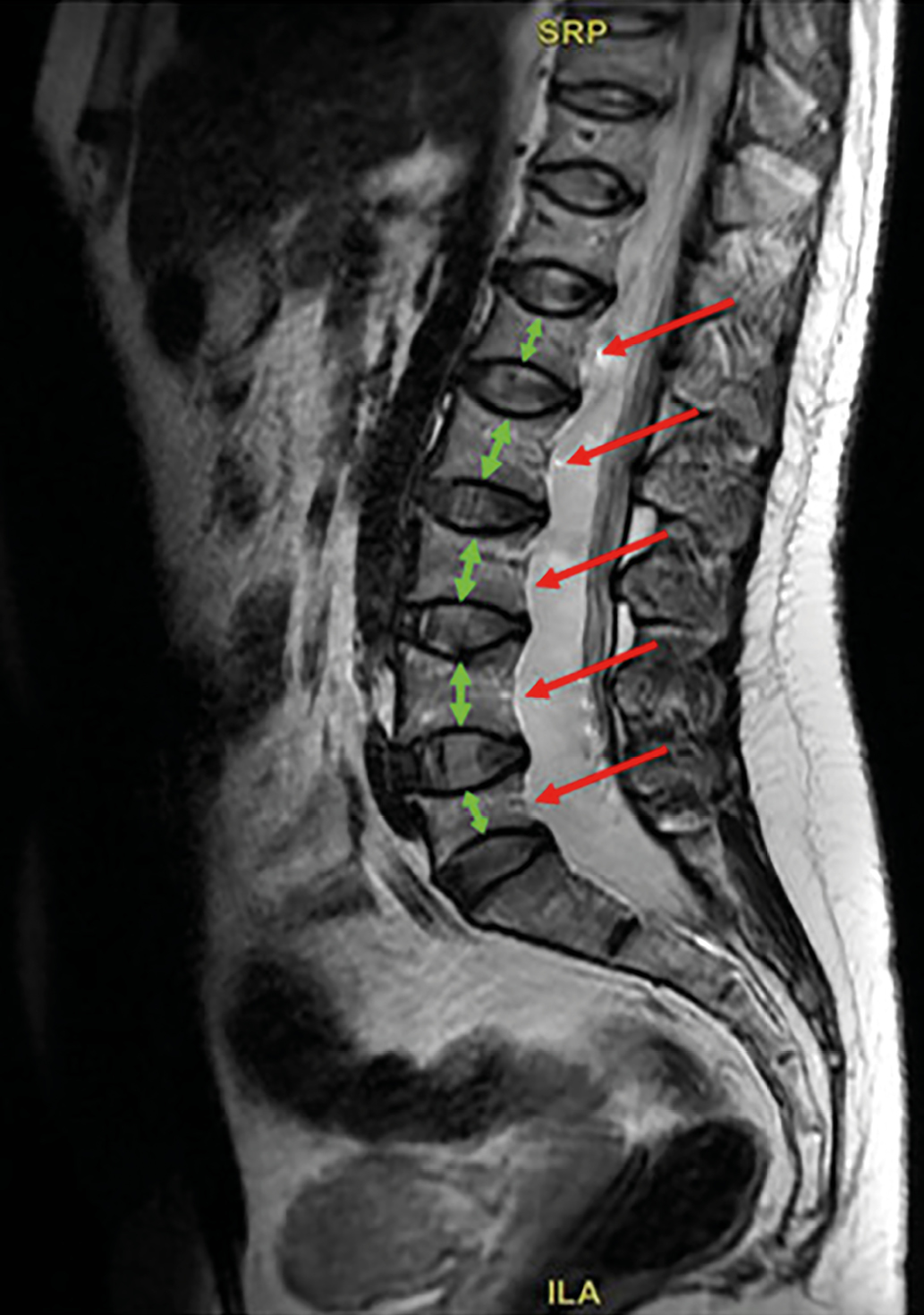
Рисунок 2. Магнитно-резонансная томография поясничного отдела позвоночника пациентки Б.
Режим Т2-ВИ. Сагиттальный срез.
Определяется двояковогнутая деформация замыкательных пластин тел L1–L5 позвонков с формированием деформации по типу «рыбьих» позвонков. Высота тел позвонков снижена, форма тел позвонков напоминает двояковогнутую линзу. Описанные изменения наиболее выражены на уровне L1 и L5 позвонков, где степень снижения высоты достигает 43 и 54%, соответственно.
Figure 2. MRI of the lumbar spine of patient B.
T2-WI. Sagittal view.
The following is observed: Biconcave deformation of the endplates in the vertebral bodies of L1–L5, resulting in «fish vertebrae» deformities. The vertebral body height is reduced, and their shape resembles a biconcave lens. These changes are most pronounced at the L1 and L5 levels, where the degree of height reduction reaches 43% and 54%, respectively.
ОБСУЖДЕНИЕ
Остеомаляция представляет собой системное поражение скелета, проявляющееся в генерализованной дефектной минерализации зрелой пластинчатой кости. В основе патогенеза заболевания лежит избыточное накопление новосинтезированного неминерализованного остеоида, что приводит к снижению объема минерализованной костной ткани [8]. К наиболее значимым причинам развития данного заболевания относятся дефицит витамина D, патологии околощитовидных желез и почек, синдром мальабсорбции, нарушение всасывания макро- и микроэлементов после бариатрических операций, наследственные формы гипофосфатемического рахита, воздействие ряда лекарственных препаратов, а также мезенхимальные опухоли, продуцирующие фактор роста фибробластов 23 [9].
Остеопороз, ассоциированный с беременностью и лактацией (ОБЛ), — редкое заболевание женщин репродуктивного возраста, патогенез и эпидемиология которого остаются недостаточно изученными. В настоящее время известно, что в третьем триместре беременности увеличивается концентрация паратгормонподобного пептида (ПТГпП), участвующего в минерализации скелета развивающегося плода. ПТГпП, секретируемый плацентой, децидуальной оболочкой и молочными железами, способствует активному транспорту материнского кальция через плацентарный барьер во время беременности и в грудное молоко при лактации. Данные изменения проявляются в виде остеоцитарного остеолиза и повышенной резорбции костной ткани, что в норме является временным и обратимым процессом [10–12].
Другая гипотеза развития ОБЛ основывается на наличии генетических мутаций, способствующих патологическому прогрессированию заболеваний костной системы. Работы С. Бутшейдта и соавт., а также Ф. Кука и его коллег продемонстрировали, что распространенность генетических вариантов достигает 50% среди пациенток с ОБЛ. Данные варианты преимущественно затрагивают гены LRP5, WNT1, COL1A1/A2, MTHFR и связаны с низкими показателями ремоделирования костной ткани, что располагает к возникновению большего количества тяжелых низкоэнергетических переломов [13][14].
Характерными симптомами остеомаляции являются двусторонние симметричные боли в костях, выраженная мышечная слабость, деформации скелета и повышенный риск патологических переломов. Болевой синдром обусловлен перерастяжением надкостницы в результате накопления избыточно гидратированного остеоида. В связи с неспецифичностью клинических проявлений костная боль при иррадиации в грудную клетку, обусловленная псевдопереломами ребер, может маскироваться под стенокардию, а при локализации в костях свода черепа — под головную боль напряжения (так называемая «остеомаляционная цефалгия»). При длительно некомпенсированном течении заболевания развивается «утиная походка», возникающая в результате сочетания выраженной мышечной слабости и болей в костях [15][16].
К основным клиническим признакам ОБЛ относятся выраженные боли в спине и, как следствие, функциональные ограничения. Данное заболевание характеризуется стремительной потерей МПК и возникновением низкотравматических, преимущественно компрессионных, переломов тел грудных и поясничных позвонков на поздних сроках беременности или в послеродовом периоде [17].
При остеомаляции наиболее частым биохимическим маркером является повышенная сывороточная щелочная фосфатаза [18]. Однако у некоторых пациенток показатель может находиться в референсном интервале даже при гистоморфометрически подтвержденном диагнозе [19]. В преобладающем большинстве случаев определяются выраженные снижения уровней 25(ОН) витамина D (<10 нг/мл) и 1,25(ОН)2D3, в том числе с сопутствующим развитием ВГПТ [20].
В норме средняя ежедневная потеря материнского кальция составляет 280–400 мг для минерализации скелета плода во время беременности и новорожденного в период лактации. Недостаток потребления кальция с пищей является дополнительным фактором, приводящим к ВГПТ и ускоренной резорбции костей в гестационном и послеродовом периодах [21].
Основные рентгенологические признаки остеомаляции включают структурные изменения костной ткани, проявляющиеся в генерализованном снижении ее видимой плотности, деформации позвонков и характерных псевдопереломах — зонах Лоозера. Последние представляют собой просветления шириной 2–5 мм, перпендикулярные длинной оси кости или надкостницы и ограниченные склеротическими краями — синдром Милкмана [22]. На МРТ-снимках симметричная двояковогнутость («рыбьи позвонки») формируется вследствие прогиба мягкой позвоночной кости под давлением межпозвоночных дисков. Эти изменения служат ключевым диагностическим признаком остеомаляции и резко контрастируют с переднеклиновидными компрессионными переломами тел позвонков, типичными для остеопороза [23].
Генерализованное снижение костной плотности на рентгенограммах может сопровождаться уменьшением МПК на DXA. Несмотря на разнообразие этиопатогенетических факторов различных видов остеомаляции, DXA не обладает достаточной чувствительностью и специфичностью для ее надежного распознавания. Гистоморфометрия биоптата костной ткани с тетрациклиновой меткой является золотым стандартом верификации диагноза [24]. Данный метод высокоинформативен, однако его применение в клинической практике ограничено рядом факторов, включая инвазивность, трудоемкость выполнения, необходимость в специализированном оборудовании и квалифицированном персонале.
При ОБЛ применение рентгенологических методов исследования в период гестации сопряжено с рисками патологического воздействия на развивающийся плод.
Лечение остеомаляции, вне зависимости от этиологии ее возникновения, направлено на устранение дефицита витамина D и коррекцию минерального обмена. Основу терапии составляет насыщающий курс колекальциферола с последующим переходом на поддерживающие дозы в комбинации с препаратами кальция. При тяжелых формах с выраженным болевым синдромом, патологическими переломами обосновано назначение активных метаболитов витамина D под контролем показателей кальция сыворотки крови [25].
Согласно данным впервые опубликованного систематического обзора и метаанализа, оценившего сравнительную эффективность терапевтических вмешательств при ОБЛ, наибольший прирост МПК через 12–24 месяца лечения при применении терипаратида в послеродовом периоде составил: от 8 до 24,4% в поясничном отделе позвоночника и 8,4–18,6% в шейке бедра. Бисфосфонаты и деносумаб показали повышение на 5–41,5% и 21,2–32,0% для поясничного отдела позвоночника и 0,7–18% и 5,6–13% в шейке бедра соответственно. На фоне комбинированного приема препаратов кальция и нативной формы витамина D отмечено увеличение МПК на 2–12,2% в поясничном отделе, а при монотерапии альфакальцидолом — на 21,4–36,6% [26].
Представленный клинический случай демонстрирует трудности дифференциальной диагностики остеомаляции и ОБЛ.
Исходно выраженный дефицит витамина D, развитие ВГПТ, положительный эффект после назначения терипаратида и коррекции дефицита витамина D у пациентки являются подтверждением нарушения процессов минерализации костей. Постоянный характер клинических проявлений между родами и по завершении грудного вскармливания наряду с повторным ухудшением состояния при нерегулярном приеме препаратов витамина D также свидетельствуют о развитии остеомаляции. Жалобы на хроническую головную боль могут быть объяснены «остеомаляционной цефалгией» — редким, но патогномоничным симптомом остеомаляции.
DXA не позволяет достоверно оценить степень нарушения минерализации костной ткани, что требует применения дополнительных методов диагностики. Отсутствие компрессионных переломов, характерных для остеопороза, и наличие двояковогнутых деформаций тел позвонков на МРТ («рыбьи позвонки») служат важным диагностическим критерием остеомаляции. Дополнительным фактором, опровергающим диагноз ОБЛ, является продолжающееся у пациентки прогрессирование болевого синдрома, несмотря на прирост МПК на фоне применения антирезорбтивной терапии.
Сочетание клинических проявлений, результатов биохимических и прежде всего рентгенологических исследований послужили основой для углубленного диагностического поиска. Это позволило ретроспективно верифицировать у пациентки остеомаляцию. Приведенный клинический случай подчеркивает важность всесторонней оценки визуализирующих и лабораторных данных, особенно в случаях атипичного течения заболевания у молодых женщин.
Заключение
Остеомаляция и ОБЛ в равной степени являются значимыми, однако часто недооцененными и труднодиагностируемыми заболеваниями. Тщательная прегравидарная подготовка, включающая выявление и коррекцию дефицита витамина D, имеет основополагающее значение в предупреждении нарушений метаболизма костной ткани во время беременности и в послеродовом периоде.
Междисциплинарный подход, персонализированные стратегии, а также грамотная интерпретация результатов различных методов исследований, в частности рентгенологических, позволят повысить осведомленность специалистов здравоохранения о данных патологиях для обеспечения своевременной диагностики и назначения эффективного патогенетического лечения, повышая качество жизни пациенток и предотвращая раннюю инвалидизацию женщин репродуктивного возраста.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена в рамках НИОКТР №124020700097-8.
Конфликт интересов. Л.К. Дзеранова — заведующий редакцией журнала «Ожирение и метаболизм»; Е.А. Пигарова — член редакционной коллегии журнала «Ожирение и метаболизм».
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы
Согласие пациента. Авторы настоящей статьи получили письменное согласие от пациента на публикацию фотографий и медицинских данных, упоминаемых в статье, в журнале «Ожирение и метаболизм».
Список литературы
1. Ritchie J. Osteomalacia: with a discussion of its aetiology and treatment. Trans Edinb Obstet Soc. 1896;21:117–15
2. Rosemblit E, Hojman D, Halpern J, Iovine E, Silbergleit S. Osteoporomalacia in old age. Sem Med. 1962;120:909–919
3. Minisola S, Colangelo L, Pepe J, Diacinti D, Cipriani C, Rao SD. Osteomalacia and Vitamin D Status: A Clinical Update 2020. JBMR Plus. 2021;5(1). doi: https://doi.org/10.1002/jbm4.10447
4. Kann PH, Pfützner A, Delling G, Schulz G, Meyer S. Transiliac bone biopsy in osteoporosis: frequency, indications, consequences and complications. An evaluation of 99 consecutive cases over a period of 14 years. Clin Rheumatol. 2006;25(1):30-34. doi: https://doi.org/10.1007/s10067-005-1132-7
5. Nordin BE, Roper A. Post-pregnancy osteoporosis; a syndrome? Lancet. 1955;268(6861):431‐434. doi: https://doi.org/10.1016/S0140-6736(55)90214-2
6. Qian Y, Wang L, Yu L, Huang W. Pregnancy- and lactation-associated osteoporosis with vertebral fractures: a systematic review. BMC Musculoskelet Disord. 2021. doi: https://doi.org/10.1186/s12891-021-04776-7
7. Cianferotti L. Osteomalacia Is Not a Single Disease. Int J Mol Sci. 2022;23(23):14896. doi: https://doi.org/10.3390/ijms232314896
8. Uday S, Högler W. Nutritional Rickets and Osteomalacia in the Twenty-first Century: Revised Concepts, Public Health, and Prevention Strategies. Curr Osteoporos Rep. 2017. doi: https://doi.org/10.1007/s11914-017-0383-y
9. Florenzano P, Gafni RI, Collins MT. Tumor-induced osteomalacia. Bone Reports. 2017. doi: https://doi.org/10.1016/j.bonr.2017.09.002
10. Kovacs CS. Maternal Mineral and Bone Metabolism During Pregnancy, Lactation, and Post-Weaning Recovery. Physiol Rev. 2016;96(2):449-547. doi: https://doi.org/10.1152/physrev.00027.2015
11. Bollerslev J, Rejnmark L, Zahn A, et al. European expert consensus on practical management of specific aspects of parathyroid disorders in adults and in pregnancy: recommendations of the ESE Educational Program of Parathyroid Disorders (PARAT 2021). Eur J Endocrinol. 2022;186(2):R33-R63. doi: https://doi.org/10.1530/EJE-21-1044
12. Ryan BA, Kovacs CS. The puzzle of lactational bone physiology: osteocytes masquerade as osteoclasts and osteoblasts. J Clin Invest. 2019;129(8):3041-3044. doi: https://doi.org/10.1172/JCI130640
13. Butscheidt S, Tsourdi E, Rolvien T, et al. Relevant genetic variants are common in women with pregnancy and lactation-associated osteoporosis (PLO) and predispose to more severe clinical manifestations. Bone. 2021;147:115911. doi: https://doi.org/10.1016/j.bone.2021.115911
14. Cook FJ, Mumm S, Whyte MP, Wenkert D. Pregnancy-associated osteoporosis with a heterozygous deactivating LDL receptor-related protein 5 (LRP5) mutation and a homozygous methylenetetrahydrofolate reductase (MTHFR) polymorphism. J Bone Miner Res. 2014. doi: https://doi.org/10.1002/jbmr.2095
15. Prakash S, Kumar M, Belani P, Susvirkar A, Ahuja S. Interrelationships between chronic tension-type headache, musculoskeletal pain, and vitamin D deficiency: Is osteomalacia responsible for both headache and musculoskeletal pain? Ann Indian Acad Neurol. 2013;16(4):650. doi: https://doi.org/10.4103/0972-2327.120487
16. Fabbriciani G, Pirro M, Leli C, Cecchetti A, Callarelli L, Rinonapoli G, Scarponi AM, Mannarino E. Diffuse musculoskeletal pain and proximal myopathy: do not forget hypovitaminosis D. Journal of Clinical Rheumatology. 2010;16(1): 34–37. doi: https://doi.org/10.1097/RHU.0b013e3181c3b2c0
17. Qian Y, Wang L, Yu L, Huang W. Pregnancy- and lactation-associated osteoporosis with vertebral fractures: a systematic review. BMC Musculoskelet Disord. 2021;22(1):926. doi: https://doi.org/10.1186/s12891-021-04776-7
18. Bhan A, Rao AD, Rao DS. Osteomalacia as a result of vitamin D deficiency. Endocrinol Metab Clin North Am. 2010;39(2):321-31. doi: https://doi.org/10.1016/j.ecl.2010.02.001
19. Bhan A, Qiu S, Rao SD. Bone histomorphometry in the evaluation of osteomalacia. Bone Rep. 2018;8:125-134. doi: https://doi.org/10.1016/j.bonr.2018.03.005
20. Uday S, Högler W. Nutritional rickets & osteomalacia: A practical approach to management. Indian J Med Res. 2020. doi: https://doi.org/10.4103/ijmr.IJMR_1961_19
21. Chandran M, Tse Tan SY. Disorders of bone and mineral metabolism in pregnancy and lactation: A case based clinical review. Osteoporos. Sarcopenia. 2025;11(1):1–8. doi: https://doi.org/10.1016/j.afos.2025.03.002
22. T -J John, T van der Made, M Conradie, A Coetzee, Osteomalacia and looser zones, QJM: An International Journal of Medicine. 2019;112(6):455. doi: https://doi.org/10.1093/qjmed/hcy293
23. Melmed S, Auchus RJ, Goldfine AB et al. Williams Textbook of Endocrinology. 15th ed. Philadelphia: Elsevier; 2024. Bhan A., Qiu S., Rao S.D. Bone histomorphometry in the evaluation of osteomalacia. Bone Reports. 2018;8:125-134. doi: https://doi.org/10.1016/j.bonr.2018.03.005
24. Пигарова Е.А., Глазьева В.С., Поваляева А.А., Дзеранова Л.К., Беловалова И.М., Дедов И.И. Особенности диагностики и лечения пациентов с дефицитом витамина D в условиях реальной клинической практики // Ожирение и метаболизм. — 2024. — Т. 21. — №2. — C. 151-160. doi: https://doi.org/10.14341/omet13094
25. Panagiotis Anagnostis, Kalliopi Lampropoulou-Adamidou, Julia K Bosdou, Georgios Trovas, Petros Galanis, et al. Comparative Effectiveness of Therapeutic Interventions in Pregnancy and Lactation-Associated Osteoporosis: A Systematic Review and Meta-analysis. The Journal of Clinical Endocrinology & Metabolism. 2024;109(3):879–901. doi: https://doi.org/10.1210/clinem/dgad548
Об авторах
Л. Г. ЭбаноидзеРоссия
Эбаноидзе Лаура Гогиевна, аспирант
117292, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
нет
И. А. Кацобашвили
Россия
Кацобашвили Илана Александровна – аспирант.
Москва
Конфликт интересов:
нет
М. С. Берлович
Россия
Берлович Мария Сергеевна – ординатор.
Москва
Конфликт интересов:
нет
Е. А. Пигарова
Россия
Пигарова Екатерина Александровна - д.м.н.; Scopus Author ID: 55655098500; Researcher ID: T-9424-2018
Москва
Конфликт интересов:
член редакционной коллегии журнала «Ожирение и метаболизм»
Л. К. Дзеранова
Россия
Дзеранова Лариса Константиновна - д.м.н.
Москва
Конфликт интересов:
заведующий редакцией журнала «Ожирение и метаболизм»
С. Ю. Воротникова
Россия
Воротникова Светлана Юрьевна - к.м.н.
Москва
Конфликт интересов:
нет
А. В. Хайриева
Россия
Хайриева Ангелина Владимировна
Москва
Конфликт интересов:
нет
Н. В. Тарбаева
Россия
Тарбаева Наталья Викторовна - к.м.н.
Москва
Конфликт интересов:
нет
Дополнительные файлы
|
|
1. Рисунок 1. Магнитно-резонансная томография грудного отдела позвоночника пациентки Б. Режим Т2-ВИ. Сагиттальный срез. Определяется двояковогнутая деформация замыкательных пластин тел Th3-Th12 позвонков с формированием деформации по типу «рыбьих» позвонков. Высота тел позвонков снижена, форма тел позвонков напоминает двояковогнутую линзу. Описанные изменения наиболее выражены на уровне Th4, Th 6, Th7, Th10, Th11 позвонков, где степень снижения высоты тел превышает 40% (максимальные значения достигают 46%). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(435KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Магнитно-резонансная томография поясничного отдела позвоночника пациентки Б. Режим Т2-ВИ. Сагиттальный срез. Определяется двояковогнутая деформация замыкательных пластин тел L1–L5 позвонков с формированием деформации по типу «рыбьих» позвонков. Высота тел позвонков снижена, форма тел позвонков напоминает двояковогнутую линзу. Описанные изменения наиболее выражены на уровне L1 и L5 позвонков, где степень снижения высоты достигает 43 и 54%, соответственно. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(437KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Эбаноидзе Л.Г., Кацобашвили И.А., Берлович М.С., Пигарова Е.А., Дзеранова Л.К., Воротникова С.Ю., Хайриева А.В., Тарбаева Н.В. Трудности дифференциальной диагностики остеомаляции и остеопороза, ассоциированного с беременностью и лактацией: клинический случай. Ожирение и метаболизм. 2025;22(2):138-144. https://doi.org/10.14341/omet13254
For citation:
Ebanoidze L.G., Katsobashvili I.A., Berlovich M.S., Pigarova E.A., Dzeranova L.K., Vorotnikova S.Y., Khairieva A.V., Tarbaeva N.V. Differential Diagnosis Challenges in Osteomalacia and Pregnancy and Lactation Associated Osteoporosis: A Case Report. Obesity and metabolism. 2025;22(2):138-144. (In Russ.) https://doi.org/10.14341/omet13254
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































