Перейти к:
Особенности метаболизма витамина D при беременности
https://doi.org/10.14341/omet13217
Аннотация
Витамин D играет важную роль в регуляции системы «мать-плацента-плод», участвуя в обеспечении нормального роста и развития плода, снижая риски гипокальциемии, мышечных судорог, инфекций дыхательных путей в детском возрасте. К настоящему времени установлено существование более 50 метаболитов витамина D, из которых наиболее изученными являются общий 25-гидроксивитамин D (25(ОН)D) и 1,25-дигидроксивитамин D (1,25(ОН)2D), что обусловлено, прежде всего, их важностью для эндокринной регуляции кальций-фосфорного обмена. Уровень 25(OH)D в крови представляет собой оптимальный, но не совершенный маркер обеспеченности витамином D, не отражает многочисленные эффекты его метаболитов. С учетом особой метаболической адаптации организма женщины в период гестации, анализ количественных изменений различных метаболитов витамина D представляет особую актуальность. В настоящем обзоре обобщены имеющиеся данные об особенностях метаболизма витамина D вне гестации и при беременности.
Для цитирования:
Кацобашвили И.А., Пигарова Е.А., Воротникова С.Ю., Бибик Е.Е., Дзеранова Л.К. Особенности метаболизма витамина D при беременности. Ожирение и метаболизм. 2025;22(2):111-117. https://doi.org/10.14341/omet13217
For citation:
Katsobashvili I.A., Pigarova E.A., Vorotnikova S.Y., Bibik E.E., Dzeranova L.K. Features of vitamin D metabolism during pregnancy. Obesity and metabolism. 2025;22(2):111-117. (In Russ.) https://doi.org/10.14341/omet13217
Основные этапы синтеза, метаболизма и действия витамина D вне гестации
Витамин D — это жирорастворимый витамин, который усиливает всасывание кальция, магния и фосфора в желудочно-кишечном тракте, а также обладает множеством плейотропных эффектов, включая регуляцию иммунной и сердечно-сосудистой систем, противоопухолевое действие и другие [1-4].
Витамин D3 (холекальциферол) образуется в организме человека в результате воздействия ультрафиолетового излучения на кожный покров, а также поступает с пищей и пищевыми добавками. Под действием солнечного света в ультрафиолетовом диапазоне В (длина волны 290–315 нм) в коже из 7-дегидрохолестерина образуется превитамин D3, который быстро изомеризуется в D3 [5][6], попадает в кровоток и обратимо связывается со специфическим белком-переносчиком (витамин D связывающий белок — VDBP). В сыворотке крови подавляющее большинство метаболитов витамина D связывается как с VDBP, так и с сывороточным альбумином. При этом связь с VDBP более прочная, что ограничивает доступность витамина в пользу тканей, имеющих такие рецепторы эндоцитоза, как кубулин и мегалин, для VDBP это плацента, околощитовидные железы и почки [6].
Витамин D3 в организме проходит 2 этапа гидроксилирования для обретения биологической активности: первый этап активации — 25-гидроксилирование ферментом 25гидроксилазой (CYP27A1) в печени с образованием 25(ОН)D (кальцидиола), основной циркулирующей формы витамина D, которая используется для оценки статуса достаточности витамина D [5][7]. Второе гидроксилирование происходит в основном в почках в положении C1α ферментом 1α-гидроксилазой (CYP27B1), в результате чего образуется 1,25(OH)2D (кальцитриол) — активная форма, способная связываться с рецептором витамина D (VDR) и реализующая биологические функции витамина D [5][7].
Следует отметить, что из пищи и пищевых добавок в организм человека, помимо D3, может поступать D2 (эргокальциферол), их общая концентрация в сыворотке обозначается как общий витамин D [5]. Человек способен усваивать витамины D2 и D3, однако эргокальциферол характеризуется меньшей биологической активностью, а в коже может синтезироваться только холекальциферол. Витамин D2 проходит идентичные этапы активации с образованием 1,25(OH)2D2 [8]. В силу отличий в строении боковой цепи витамин D2 обладает меньшим сродством к VDBP, быстрее выводится из кровотока, ограничен в конверсии в 25(ОН)D и иначе катаболизируется; однако, аффинность 1,25(OH)2D2 к VDR сравнима с аффинностью 1,25(OH)2D3 [9].
Основные этапы метаболизма витамина D суммированы на рисунке 1, однако они не исчерпывают многообразие биологических трансформаций витамина D.
Активность CYP27B1 в почках важна для продукции и поддержания физиологической концентрации циркулирующего 1,25(OH)2D [10]. Исследования последних лет продемонстрировали, что CYP27B1 имеется не только в почках, но и во многих тканях организма [11], в связи с чем инициировано активное изучение «неклассических эффектов» витамина D, обусловленных его паракринным действием.
В отличие от 25(ОН)D, уровень которого определяется относительно стабильной величиной, концентрация 1,25(OH)2D варьирует в зависимости от активации 1α-гидроксилазы паратгормоном (ПТГ), а также влияния на активность этого фермента фактором роста фибробластов-23 (FGF-23), кальцием (Са) и фосфором (Р) [12]. Кальцитриол способствует минерализации и ремоделированию костной ткани, усиливает всасывание Са в тонком кишечнике, снижает экскрецию Са и Р в почках, регулирует секрецию ПТГ по принципу отрицательной обратной связи: ПТГ стимулирует активность 1α-гидроксилазы, сам 1,25(OH)2D подавляет работу фермента и синтез ПТГ, тем самым предотвращая образование большого количества активной формы витамина D и его токсического действия на ткани. FGF-23 также блокирует 1α-гидроксилазу и стимулирует 24-гидроксилазу, отвечающую за инактивацию витамина D [12].
Другой метаболит, который вызывает значительный интерес в настоящее время, 3-epi-25(OH)D, продуцируется ферментом 3-эпимеразой из 25(OH)D. Концентрация 3-epi-25(OH)D в сыворотке вариабельна и составляет менее 25% от уровня 25(OH)D, в среднем 4,75% у взрослых [13]. 3-epi-25(OH)D обычно считается «менее активным предшественником» активного метаболита витамина D, чем 25(OH)D, поскольку 3-epi-1α,25(OH)2D обладает в 35–120 раз меньшей аффинностью к VDR, чем 1α,25(OH)2D, имеет заметно сниженную способность стимулировать абсорбцию Са в кишечнике [14-16].
Фермент CYP24A1 (24-гидроксилаза) экспрессируется в почках, катаболизирует как 25(ОН)D, так и 1,25(OH)2D в биологически неактивные формы — 23,25(ОН)2D; 24,25(OH)2D; 1,24,25(ОН)3D; 1,23,25(ОН)3D [4][6][7]. Активность этого фермента также зависит от 1,25(OH)2D [17-19]. Данный путь инактивации протекает следующим образом: в третьем гидроксилировании 1,25(OH)2D в положении C24 с образованием 1,24,25-тригидроксивитамина D (1,24,25(OH)3D) либо в положении С23 с образованием 1,25(OH)2D-26,23-лактона; оба метаболита подвергаются дальнейшему окислению до кальцитроевой кислоты и углекислого газа соответственно [10]. 25(OH)D также гидроксилируется CYP24A1 в почках, что приводит к образованию 24,25- дигидроксивитамина D (24,25(OH)2D) и 25(OH)D-26,23-лактона. В отличие от CYP27B1, CYP24A1 регулируется реципрокно, а именно стимулируется 1,25(OH)2D и FGF-23, а подавление осуществляет ПТГ [4][18].
Долгое время биологическая роль 24-гидроксилированного метаболита (24,25(OH)2D) была неизвестна [19]. Вероятно, основное биологическое значение 24-гидроксилирования заключается в предотвращении токсического действия витамина D. 24,25(OH)2D имеет наибольшую сывороточную концентрацию среди 24-гидроксилированных форм витамина D, в связи с чем именно его измерение предложено рассматривать в качестве диагностического метода [20].
VDR относится к семейству ядерных рецепторов и обеспечивает влияние витамина D на транскрипцию генов. Большинство эффектов витамина D опосредованы взаимодействием 1,25(OH)2D с рецептором VDR. После связи с кальцитриолом рецептор образует гетеродимер с ретиноидным X-рецептором (RXR) и транслоцируется в ядро. Он связывается с элементом ответа на витамин D в промоторе (VDRE), присутствующим в генах-мишенях, тем самым влияя на их экспрессию и регуляцию [21]. Помимо VDR, для реализации быстрых (не геномных) эффектов активной формы витамина D (1,25(OH)2D) необходим также 1,25D-MARRSBP — мембранный рецептор (1,25(OH)2D мембран-ассоциированный стероид-связывающий белок быстрого ответа, также известный как ERp57) [22][23].
Экспрессия VDR наблюдается в различных тканях, при этом CYP24A1 присутствует во всех клетках, содержащих VDR. Экстраренальная продукция 1,25(OH)2D осуществляется в кератиноцитах, макрофагах, моноцитах, клетках легких, молочной железы, толстого кишечника, плаценты и др. Очевидно, что 1,25(OH)2D, продуцируемый вне почек, не оказывает влияния на концентрацию витамина в сыворотке крови и менее зависит от регуляторов кальций-фосфорного обмена (ПТГ и сывороточный Са). С большей вероятностью, ренальная продукция 1,25(ОН)2D направлена на реализацию «классических» эффектов витамина D, тогда как экстраренальная — на осуществление других биологических функций, таких как иммуномодулирующее действие, регуляция роста, дифференцировка клеток и воспалительная реакция [24].
Как уже указывалось, основным транспортным белком для всех метаболитов витамина D является VDBP: в норме около 85% циркулирующих в кровотоке метаболитов связаны с VDBP, тогда как остальные 15% — с альбумином, и менее 1% метаболитов находится в кровотоке в свободном виде [25]. VDBP имеет только один сайт связывания для всех метаболитов, в отличие от альбумина, наделенным несколькими низкоаффинными сайтами [26]. VDBP является острофазным белком сыворотки крови и повышается при инфекционных процессах или небольших травмах [27]. Метаболиты витамина D имеют разную аффинность к VDBP: для 25(OH)D-лактонов характерна самая высокая, достаточно высокая — для 25(OH)D, к 1,25(OH)2D примерно в 10–100 раз меньше, чем к 25(ОН)D, а минимальная наблюдается к нативному витамину D [28]. Концентрация VDBP в кровотоке намного больше, чем сумма всех метаболитов витамина D. В связи с этим менее 5% VDBP представлено комплексом VDBP и метаболитами витамина D, и практически весь VDBP циркулирует несвязанным, что, в свою очередь, может обеспечивать защиту от токсичности витамина D, позволяя VDBP выполнять роль буфера для 25(ОН)D или иметь дополнительные функции [29].
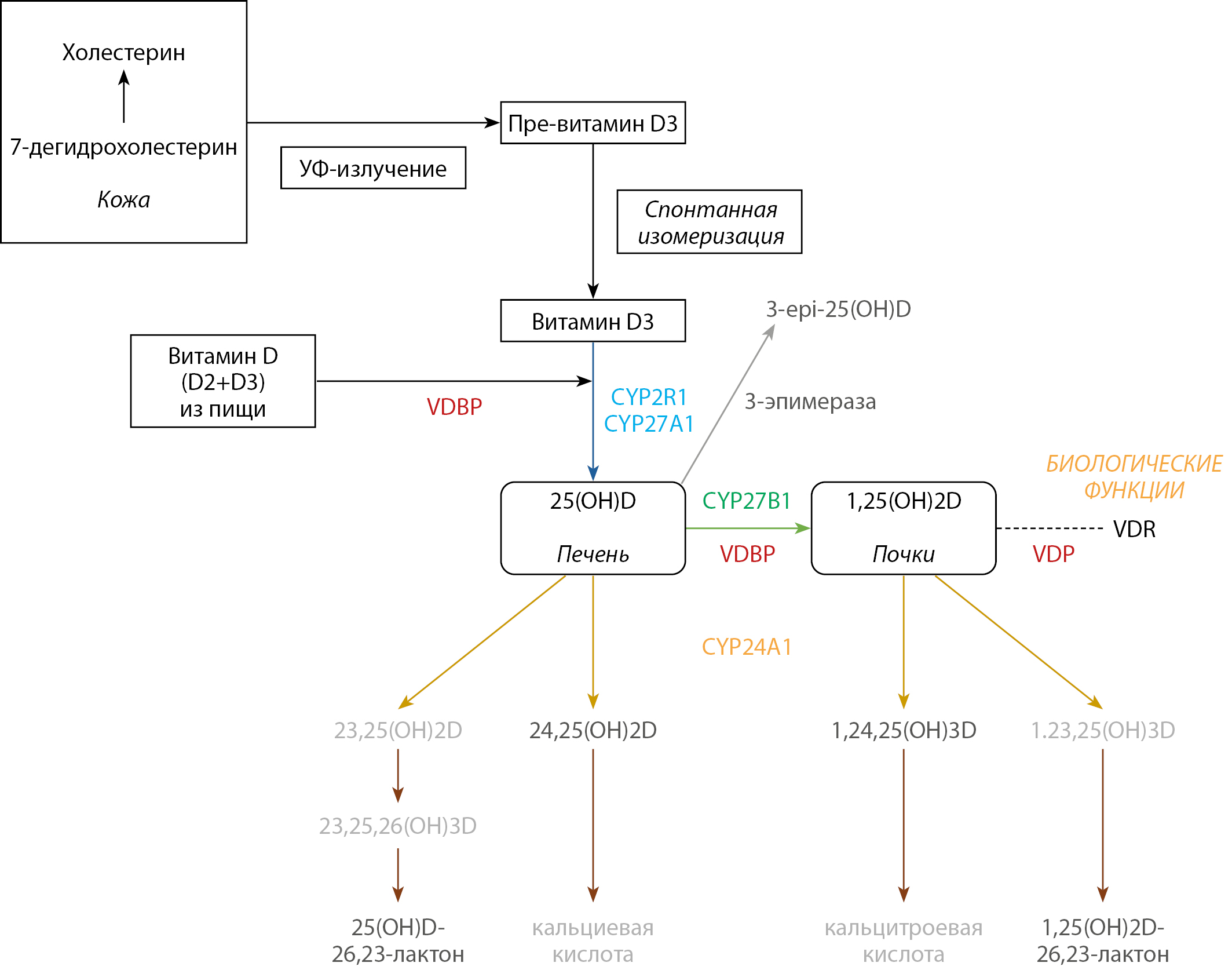
Рисунок 1. Схема основных этапов метаболизма витамина D (адаптировано из [6][9][12]).
VDR — рецептор витамина D; VDBP — белок, связывающий витамин D; СYP27А1 — 25-гидроксилаза; СYP27B1 — 1α-гидроксилаза.
Особенности обмена витамина D при беременности
Метаболизм витамина D во время беременности характеризуется значимыми отличиями. Гомеостаз витамина D в период гестации адаптирован для поддержания нормального протекания беременности путем стимуляции абсорбции Са, потребность в котором существенно возрастает, особенно в 3 триместре при обызвествлении скелета плода. Жестко регулируемый физиологический процесс всасывания Са происходит в тощей и подвздошной отделах кишки для поддержания положительного кальциевого баланса в материнской децидуальной ткани [6].
Плод не способен самостоятельно синтезировать витамин D3, поэтому большое значение приобретает запас витамина в организме матери и передача его биологически значимых метаболитов через плаценту, что важно для физиологического внутриутробного развития и здоровья ребенка на протяжении дальнейшей жизни. Материнский 25(ОН)D проникает через плацентарный барьер и представляет собой основной источник витамина D для плода [6][30]. Концентрация кальцидиола в крови матери ассоциируется как с формированием костей плода, весом при рождении [30][31], так и с процессами костного обмена в послеродовом периоде [32].
Беременность характеризуется тремя основными адаптационными механизмами в метаболизме витамина D у матери: повышением синтеза кальцитриола, поступлением материнского 25(OH)D к плоду для обеспечения оптимального статуса 25(OH)D у новорожденного и повышением концентрации VDBP. Эти изменения проявляются как в системной циркуляции, так и на плацентарном уровне, что позволяет считать плаценту ключевым звеном в обмене витамина D во время гестации [5].
В настоящее время информация об изменении отдельных метаболитов витамина D у беременных крайне ограничена, а представленные результаты требуют подтверждения с применением более точных диагностических методов. Согласно различным исследованиям [33-35] обнаружено физиологическое повышение концентрации циркулирующего метаболита 1,25(OH)2D и его белка-переносчика у матери с ранних сроков беременности, ее трехкратное увеличение в 3 триместре c последующей нормализацией в послеродовом периоде [6][36] наряду с конкордантным повышением уровня С3-эпимера — 3-epi-25(OH)D [37]. Cвязанное с гестацией накопление 1,25(OH)2D происходит в основном за счет повышенной активности CYP27B1 в почках женщины [38]. Небольшое его количество синтезируется также в трофобласте и децидуальной оболочке [39]. Показано, что уровень кальцитриола в равной мере увеличивается у женщин с одноплодной и многоплодной беременностью, что свидетельствует об отсутствии корреляции между объемом плаценты и концентрацией активного метаболита витамина D [40]. Механизмы, лежащие в основе повышения активности почечной 1α-гидроксилазы во время беременности, остаются до конца неясными, отчасти потому, что известные регуляторные факторы, в том числе ПТГ, сохраняются неизменными на протяжении всей беременности [6]. Судя по всему, ведущую роль приобретают другие гормоны, регулирующие активность этого фермента, такие как ПТГ-подобный пептид (ПТГпП), эстрадиол, пролактин и плацентарный лактоген, секреция которых значимо возрастает в 3 триместре [25][33].
ПТГпП во время беременности синтезируется в большом количестве плацентой, молочными железами, децидуальной оболочкой, максимальных значений его сывороточная концентрация достигает на позднем сроке беременности. Аминотерминальная часть молекулы пептида, структурно напоминающая ПТГ, стимулирует резорбцию костной ткани, усиливает реабсорбцию Са почками и ускоряет его транспорт через плаценту, а карбокситерминальная подавляет активность остеокластов, предотвращая таким образом избыточное повреждение костей [24][41] (рис. 2).
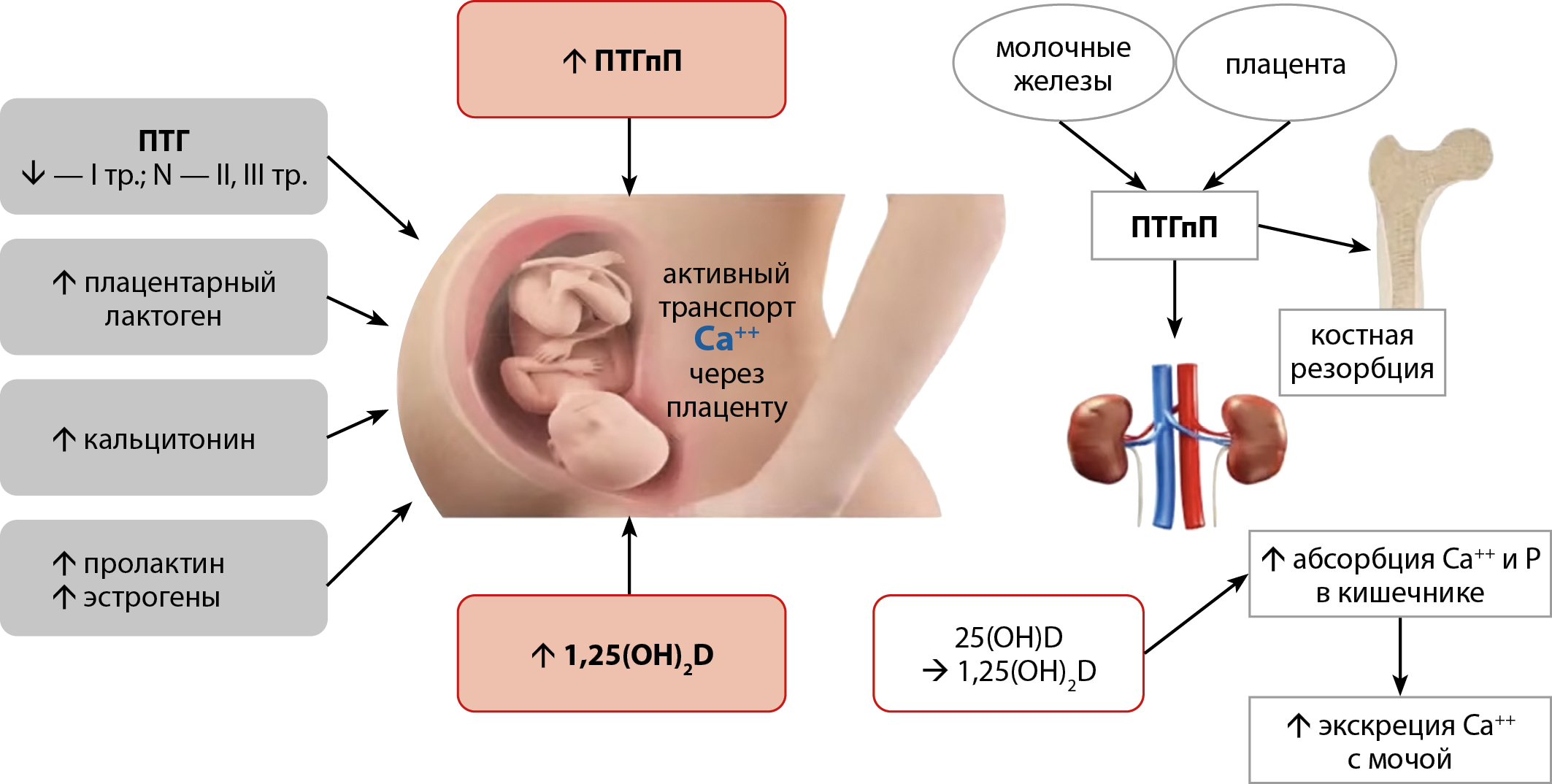
Рисунок 2. Схема особенностей регуляции кальциевого обмена во время беременности (адаптировано из [5]).
Остаются неясными физиологические основы роста уровня 1,25(ОН)2D и взаимосвязь между 1,25(OH)2D и 25(OH)D во время беременности [7], а также, по каким причинам высокая концентрация кальцитриола не приводит к фатальному повышению Са крови и не оказывает токсического действия [3]. Синтез 1,25(OH)2D, 24,25(OH)2D и ПТГ, вероятно, зависят от срока гестации и показателя 25(OH)D в сыворотке крови. Если уровень кальцидиола исходно низкий, его катаболизм в 24,25(OH)2D снижается или же остается стабильным по мере развития беременности, чтобы поддерживать постоянно повышенную сывороточную концентрацию кальцитриола [42].
Во время беременности VDR и регуляторные метаболические ферменты экспрессируются в плаценте и децидуальной оболочке [40], причем наиболее активно — в первом триместре [43]. На животных моделях продемонстрировано, что VDR появляется на 13-й день гестации в мезенхиме, служащей основой для скелетных тканей, а к 17-му дню начинает экспрессироваться в хондроцитах и остеобластах зачатков конечностей и позвоночного столба. VDR также определяется в париетальных клетках внутриплацентарного желточного мешка у мышей, где по аналогии с его ролью в кишечнике человека он регулирует экспрессию Са связывающих белков и транспортеров, таким образом, обеспечивая перенос Са от матери к плоду. Плацента и почки плода синтезируют 1,25(OН)2D, но его концентрация ниже материнской. Это обусловлено низким уровнем ПТГ и высоким — Р, которые наблюдаются у плода [44].
Витамин D также имеет решающее значение для функционирования плаценты. 25(OH)D может влиять на экспрессию плацентарных генов и белков, играющих важную роль для ее нормального развития. Результаты недавнего европейского исследования позволяют предполагать, что лежащий в основе эпигенетический ландшафт определяет транскрипционную реакцию плаценты на лечение витамином D [30].
Снабжение плода витамином D зависит не только от статуса 25(OH)D у матери, но и от плацентарной функции. Считалось, что кальцидиол пассивно проходит через плаценту и гидроксилизируется у плода до 1,25(OH)2D, так как уровни метаболитов у него коррелируют с показателем 25(OH)D, а не 1,25(OH)2D у женщины. Однако дальнейшие исследования показали, что количество витамина D, получаемое внутриутробно ребенком, на самом деле регулируется плацентой [3]. Процесс аналогичен таковому в почках и обусловлен рецепторно-опосредованным эндоцитозом витамина D [ 25(OH)D и 1,25(OH)2D], связанного с VDBP или альбумином. Помимо этого, плацентарный метаболизм материнского 25(OH)D зависит от CYP27B1 и 24-гидроксилазы CYP24A1, что влияет на количество и типы метаболитов витамина D, достигающих плода. В плаценте человека оба фермента локализованы в синцитиотрофобласте, который является основным барьером между матерью и плодом [30]. Плацентарный метаболизм 25(OH)D может способствовать увеличению концентрации 1,25(OH)2D и у матери во время беременности, что способствует физиологической адаптации организма женщины.
Таким образом, плацента влияет на уровни 25(OH)D и его метаболитов 24,25(OH)2D, и 1,25(OH)2D в крови как у плода, так и у матери, поэтому нарушение внутриплацентарного обмена и транспорта материнского 25(OH)D могут ограничивать снабжение плода и препятствовать его нормальному развитию [30]. Эти данные демонстрируют сложное взаимодействие между витамином D и плацентой. Ключевые медиаторы метаболизма, такие как CYP27B1/CYP24A1/VDR, имеют более высокие уровни экспрессии на ранних сроках гестации, что указывает на их важную роль в течение беременности [30].
Ранее считалось, что витамин D участвует только в поддержании уровня Са, однако результаты исследований [45-47] позволяют предполагать его роль в модификации иммунного ответа плода. Доказано, что недостаток и дефицит витамина D ассоциированы с повышенным риском неблагоприятных исходов беременности: гестационный сахарный диабет, преэклампсия, эклампсия [2][5], задержка роста плода, задержка развития легочной ткани и образования сурфактанта [5][34].
Кроме того, витамин D активно участвует в стимуляции функции регуляторных Т-клеток (Tregs), которые играют важную роль в подавлении иммунного ответа во время беременности [47]. В период гестации материнская иммунная система всегда сталкивается с аллоантигенами плода. «Принятие» плода частично объясняется переключением синтеза цитокинов Т-хелперов с Th1-подобных (агрессивных клеточно-опосредованных и провоспалительных) на Th2-подобные. Количество Tregs у беременных женщин выше по сравнению с небеременными. Образование Tregs увеличивается на ранних сроках гестации, достигая пика во втором триместре, снижаясь к концу беременности и послеродовому периоду. Снижение количества Tregs при нормальной беременности может быть связано с миграцией этих клеток из периферической крови в децидуальную оболочку, чтобы предотвратить острую аллогенную реакцию на плод. Дисрегуляция Tregs может приводить к таким осложнениям, как гипертензия, связанная с беременностью, и преждевременная внутриматочная активация. Преждевременные роды могут быть связаны с изменениями в составе общего пула Tregs. Недостаточность витамина D ассоциируется с многочисленными иммуноопосредованными заболеваниями, которые, как полагают, объясняются его иммуномодулирующими свойствами. Витамин D способен ингибировать образование Th1- и Th17-клеток и стимулировать — Th2 и Tregs [47].
Витамин D принимает участие в развитии легких плода. Интересно, что альвеолярные клетки II типа, которые отвечают за биосинтез поверхностно-активных веществ в легких, не только обладают рецепторами для 1α,25(OH)2D, но и сам кальцитриол также участвует в их дифференциации и созревании, а также в стимулировании синтеза и секреции сурфактанта этими клетками. В некоторых случаях 3-epi-1α,25(OH)2D проявляет даже более высокую биологическую активность по сравнению с 1α,25(OH)2D, например, в стимуляции синтеза сурфактанта во время перинатального созревания легких [48].
Заключение
Исследования показывают целесообразность одновременного определения уровней различных метаболитов (метаболома) витамина D в крови для получения более подробной информации об особенностях его метаболизма, что может являться основой для понимания механизмов заболеваний и исходов, связанных с недостаточностью/дефицитом витамина D. Имеющиеся в настоящее время данные об особенностях метаболизма витамина D у беременных женщин требуют дальнейших исследований. Это является актуальной задачей для расширения знаний о регуляции обмена витамина D во время беременности и будет способствовать пониманию его роли в формировании здоровья матери и ребенка.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Tuckey RC, Cheng CYS, Slominski AT. The serum vitamin D metabolome: What we know and what is still to discover. J Steroid Biochem Mol Biol. 2019;186:4-21. doi: https://doi.org/10.1016/j.jsbmb.2018.09.003
2. Tareke AA, Alem A, Debebe W, et al. Maternal vitamin D and growth of under-five children: a systematic review and meta-analysis of observational and interventional studies. Glob Health Action. 2022;15(1):2102712. doi: https://doi.org/10.1080/16549716.2022.2102712
3. Wagner CL, Hollis BW. The extraordinary metabolism of vitamin D. Elife. 2022;11:e77539. doi: https://doi.org/10.7554/eLife.77539
4. Christakos S, Dhawan P, Verstuyf A, Verlinden L, Carmeliet G. Vitamin D: Metabolism, Molecular Mechanism of Action, and Pleiotropic Effects. Physiol Rev. 2016;96(1):365-408. doi: https://doi.org/10.1152/physrev.00014.2015
5. Figueiredo ACC, Cocate PG, Adegboye ARA, et al. Changes in plasma concentrations of 25-hydroxyvitamin D and 1,25-dihydroxyvitamin D during pregnancy: a Brazilian cohort. Eur J Nutr. 2018;57(3):1059-1072. doi: https://doi.org/10.1007/s00394-017-1389-z
6. Karras SN, Wagner CL, Castracane VD. Understanding vitamin D metabolism in pregnancy: From physiology to pathophysiology and clinical outcomes. Metabolism. 2018;86:112-123. doi: https://doi.org/10.1016/j.metabol.2017.10.001
7. Zhang R, Naughton DP. Vitamin D in health and disease: current perspectives. Nutr J. 2010;9:65. doi: https://doi.org/10.1186/1475-2891-9-65
8. Jones G, Prosser DE, Kaufmann M. Cytochrome P450-mediated metabolism of vitamin D. J Lipid Res. 2014;55(1):13-31. doi: https://doi.org/10.1194/jlr.R031534
9. Bikle DD. Vitamin D metabolism, mechanism of action, and clinical applications. Chem Biol. 2014;21(3):319-329. doi: https://doi.org/10.1016/j.chembiol.2013.12.016
10. DeLuca HF. Overview of general physiologic features and functions of vitamin D. Am J Clin Nutr. 2004;80(6 Suppl):1689S-96S. doi: https://doi.org/10.1093/ajcn/80.6.1689S
11. Hewison M, Burke F, Evans KN, et al. Extra-renal 25-hydroxyvitamin D3-1alpha-hydroxylase in human health and disease. J Steroid Biochem Mol Biol. 2007;103(3-5):316-321. doi: https://doi.org/10.1016/j.jsbmb.2006.12.078
12. Pike JW, Christakos S. Biology and Mechanisms of Action of the Vitamin D Hormone. Endocrinol Metab Clin North Am. 2017;46(4):815-843. doi: https://doi.org/10.1016/j.ecl.2017.07.001
13. Lensmeyer G, Poquette M, Wiebe D, Binkley N. The C-3 epimer of 25-hydroxyvitamin D(3) is present in adult serum. J Clin Endocrinol Metab. 2012;97(1):163-168. doi: https://doi.org/10.1210/jc.2011-0584
14. Kamao M, Tatematsu S, Hatakeyama S, et al. C-3 epimerization of vitamin D3 metabolites and further metabolism of C-3 epimers: 25-hydroxyvitamin D3 is metabolized to 3-epi-25-hydroxyvitamin D3 and subsequently metabolized through C-1alpha or C-24 hydroxylation. J Biol Chem. 2004;279(16):15897-15907. doi: https://doi.org/10.1074/jbc.M311473200
15. Masuda S, Kamao M, Schroeder NJ, et al. Characterization of 3-epi-1alpha,25-dihydroxyvitamin D3 involved in 1alpha,25-dihydroxyvitamin D3 metabolic pathway in cultured cell lines. Biol Pharm Bull. 2000;23(2):133-139. doi: https://doi.org/10.1248/bpb.23.133
16. Nakagawa K, Sowa Y, Kurobe M, et al. Differential activities of 1alpha,25-dihydroxy-16-ene-vitamin D(3) analogs and their 3-epimers on human promyelocytic leukemia (HL-60) cell differentiation and apoptosis. Steroids. 2001;66(3-5):327-337. doi: https://doi.org/10.1016/s0039-128x(00)00142-2
17. Omdahl JL, Morris HA, May BK. Hydroxylase enzymes of the vitamin D pathway: expression, function, and regulation. Annu Rev Nutr. 2002;22:139-166. doi: https://doi.org/10.1146/annurev.nutr.22.120501.150216
18. Veldurthy V, Wei R, Campbell M, Lupicki K, Dhawan P, Christakos S. 25-Hydroxyvitamin D₃ 24-Hydroxylase: A Key Regulator of 1,25(OH)₂D₃ Catabolism and Calcium Homeostasis. Vitam Horm. 2016;100:137-150. doi: https://doi.org/10.1016/bs.vh.2015.10.005
19. Dinour D, Beckerman P, Ganon L, Tordjman K, Eisenstein Z, Holtzman EJ. Loss-of-function mutations of CYP24A1, the vitamin D 24-hydroxylase gene, cause long-standing hypercalciuric nephrolithiasis and nephrocalcinosis. J Urol. 2013;190(2):552-557. doi: https://doi.org/10.1016/j.juro.2013.02.3188
20. Azer SM, Vaughan LE, Tebben PJ, Sas DJ. 24-Hydroxylase Deficiency Due to CYP24A1 Sequence Variants: Comparison With Other Vitamin D-mediated Hypercalcemia Disorders. J Endocr Soc. 2021;5(9):bvab119. doi: https://doi.org/10.1210/jendso/bvab119
21. Delrue C, Speeckaert MM. Vitamin D and Vitamin D Binding Protein in Health and Disease 2.0. Int J Mol Sci. 2023;24(12):10316. doi: https://doi.org/10.3390/ijms241210316
22. Nemere I, Safford SE, Rohe B, DeSouza MM, Farach-Carson MC. Identification and characterization of 1,25D3-membrane-associated rapid response, steroid (1,25D3-MARRS) binding protein. J Steroid Biochem Mol Biol. 2004;89-90(1-5):281-285. doi: https://doi.org/10.1016/j.jsbmb.2004.03.031
23. Sequeira VB, Rybchyn MS, Tongkao-On W, et al. The role of the vitamin D receptor and ERp57 in photoprotection by 1α,25-dihydroxyvitamin D3. Mol Endocrinol. 2012;26(4):574-582. doi: https://doi.org/10.1210/me.2011-1161
24. Еремкина А.К., Мокрышева Н.Г., Пигарова Е.А., и др. Витамин D: влияние на течение и исходы беременности, развитие плода и здоровье детей в постнатальном периоде // Терапевтический архив. — 2018. — №10. — С.115-127. doi: https://doi.org/10.26442/terarkh20189010115-127
25. Speeckaert M, Huang G, Delanghe JR, Taes YE. Biological and clinical aspects of the vitamin D binding protein (Gc-globulin) and its polymorphism. Clin Chim Acta. 2006;372(1-2):33-42. doi: https://doi.org/10.1016/j.cca.2006.03.011
26. Moy KA, Mondul AM, Zhang H, et al. Genome-wide association study of circulating vitamin D-binding protein. Am J Clin Nutr. 2014;99(6):1424-1431. doi: https://doi.org/10.3945/ajcn.113.080309
27. Dahl B, Schiødt FV, Gehrchen PM, Ramlau J, Kiaer T, Ott P. Gc-globulin is an acute phase reactant and an indicator of muscle injury after spinal surgery. Inflamm Res. 2001;50(1):39-43. doi: https://doi.org/10.1007/s000110050722
28. Bouillon R, Schuit F, Antonio L, Rastinejad F. Vitamin D Binding Protein: A Historic Overview. Front Endocrinol (Lausanne). 2020;10:910. doi: https://doi.org/10.3389/fendo.2019.00910
29. Meier U, Gressner O, Lammert F, Gressner AM. Gc-globulin: roles in response to injury. Clin Chem. 2006;52(7):1247-1253. doi: https://doi.org/10.1373/clinchem.2005.065680
30. Ashley B, Simner C, Manousopoulou A, et al. Placental uptake and metabolism of 25(OH)vitamin D determine its activity within the fetoplacental unit. Elife. 2022;11:e71094. doi: https://doi.org/10.7554/eLife.71094
31. Mahon P, Harvey N, Crozier S, Inskip H, Robinson S, et al. Low maternal vitamin D status and fetal bone development: cohort study. Journal of Bone and Mineral Research. 2010;25:14–19. doi: https://doi.org/10.1359/jbmr.090701
32. Boyle VT, Thorstensen EB, Thompson JMD, McCowan LME, Mitchell EA, et al. The relationship between maternal 25-hydroxyvitamin D status in pregnancy and childhood adiposity and allergy: an observational study. International Journal of Obesity. 2017;41:1755–1760. doi: https://doi.org/10.1038/ijo.2017.182
33. Kiely ME, Wagner CL, Roth DE. Vitamin D in pregnancy: Where we are and where we should go. J Steroid Biochem Mol Biol. 2020;201:105669. doi: https://doi.org/10.1016/j.jsbmb.2020.105669
34. Papapetrou PD. The interrelationship of serum 1,25-dihydroxyvitamin D, 25-hydroxyvitamin D and 24,25-dihydroxyvitamin D in pregnancy at term: a meta-analysis. Hormones (Athens). 2010;9(2):136-144. doi: https://doi.org/10.14310/horm.2002.1263
35. Park H, Wood MR, Malysheva OV, et al. Placental vitamin D metabolism and its associations with circulating vitamin D metabolites in pregnant women. Am J Clin Nutr. 2017;106(6):1439-1448. doi: https://doi.org/10.3945/ajcn.117.153429
36. Wagner CL, McNeil R, Hamilton SA, et al. A randomized trial of vitamin D supplementation in 2 community health center networks in South Carolina. Am J Obstet Gynecol. 2013;208(2):137.e1-137.13. doi: https://doi.org/10.1016/j.ajog.2012.10.888
37. Bennett SE, Casey C, McPeake J, McCance DR, Manderson JG, McGinty A. 3-Epi-25 hydroxyvitamin D in pregnancy. Pregnancy Hypertens. 2014;4(3):236. doi: https://doi.org/10.1016/j.preghy.2014.03.021
38. Kirby BJ, Ma Y, Martin HM, Buckle Favaro KL, Karaplis AC, Kovacs CS. Upregulation of calcitriol during pregnancy and skeletal recovery after lactation do not require parathyroid hormone. J Bone Miner Res. 2013;28(9):1987-2000. doi: https://doi.org/10.1002/jbmr.1925
39. Kovacs CS. The role of vitamin D in pregnancy and lactation: insights from animal models and clinical studies. Annu Rev Nutr. 2012;32:97-123. doi: https://doi.org/10.1146/annurev-nutr-071811-150742
40. Nakayama S, Yasui T, Suto M, et al. Differences in bone metabolism between singleton pregnancy and twin pregnancy. Bone. 2011;49(3):513-519. doi: https://doi.org/10.1016/j.bone.2011.05.016
41. Мокрышева Н.Г., Крупинова Ю.А., Ковалева Е.В. Паратиреоидный гормон и подобные ему пептиды. Обзор литературы // Вестник Российской академии медицинских наук. — 2019. — Т. 74. — №2. — C. 136-144. doi: https://doi.org/10.15690/vramn1104
42. Best CM, Pressman EK, Queenan RA, Cooper E, Vermeylen F, O’Brien KO. Gestational Age and Maternal Serum 25-hydroxyvitamin D Concentration Interact to Affect the 24,25-dihydroxyvitamin D Concentration in Pregnant Adolescents. J Nutr. 2018;148(6):868-875. doi: https://doi.org/10.1093/jn/nxy043
43. Slominski AT, Kim TK, Shehabi HZ, et al. In vivo production of novel vitamin D2 hydroxy-derivatives by human placentas, epidermal keratinocytes, Caco-2 colon cells and the adrenal gland. Mol Cell Endocrinol. 2014;383(1-2):181-192. doi: https://doi.org/10.1016/j.mce.2013.12.012
44. Kovacs CS, Woodland ML, Fudge NJ, Friel JK. The vitamin D receptor is not required for fetal mineral homeostasis or for the regulation of placental calcium transfer in mice. Am J Physiol Endocrinol Metab. 2005;289(1):E133-E144. doi: https://doi.org/10.1152/ajpendo.00354.2004
45. Mirzakhani H, Litonjua AA, McElrath TF, O’Connor G, Lee-Parritz A, et al. Early pregnancy vitamin D status and risk of preeclampsia. The Journal of Clinical Investigation. 2016;126:4702–4715. doi: https://doi.org/10.1172/JCI89031
46. Khatiwada A, Wolf BJ, Mulligan JK, Shary JR, Hewison M, et al. Effects of vitamin D supplementation on circulating concentrations of growth factors and immune-mediators in healthy women during pregnancy. Pediatric Research. 2021;89:554–562. doi: https://doi.org/10.1038/s41390-020-0885-7
47. Zahran AM, Zharan KM, Hetta HF. Significant correlation between regulatory T cells and vitamin D status in term and preterm labor. Journal of Reproductive Immunology. 2018;129:15–22. doi: https://doi.org/10.1016/j.jri.2018.07.004
48. Rehan VK, Torday JS, Peleg S, et al. 1Alpha,25-dihydroxy-3-epi-vitamin D3, a natural metabolite of 1alpha,25-dihydroxy vitamin D3: production and biological activity studies in pulmonary alveolar type II cells. Mol Genet Metab. 2002;76(1):46-56. doi: https://doi.org/10.1016/s1096-7192(02)00022-7
Об авторах
И. А. КацобашвилиРоссия
Кацобашвили Илана Александровна
117292, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. А. Пигарова
Россия
Пигарова Екатерина Александровна - д.м.н.; Scopus Author ID: 55655098500; Researcher ID: T-9424-2018.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
С. Ю. Воротникова
Россия
Воротникова Светлана Юрьевна - к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. Е. Бибик
Россия
Бибик Екатерина Евгеньевна - к.м.н; Researcher ID: AAY-3052-2020; Scopus Author ID: 57195679482
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Л. К. Дзеранова
Россия
Дзеранова Лариса Константиновна - д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Схема основных этапов метаболизма витамина D (адаптировано из [6, 9, 12]). VDR — рецептор витамина D; VDBP — белок, связывающий витамин D; СYP27А1 — 25-гидроксилаза; СYP27B1 — 1α-гидроксилаза. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(538KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Схема особенностей регуляции кальциевого обмена во время беременности (адаптировано из [5]). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(473KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Кацобашвили И.А., Пигарова Е.А., Воротникова С.Ю., Бибик Е.Е., Дзеранова Л.К. Особенности метаболизма витамина D при беременности. Ожирение и метаболизм. 2025;22(2):111-117. https://doi.org/10.14341/omet13217
For citation:
Katsobashvili I.A., Pigarova E.A., Vorotnikova S.Y., Bibik E.E., Dzeranova L.K. Features of vitamin D metabolism during pregnancy. Obesity and metabolism. 2025;22(2):111-117. (In Russ.) https://doi.org/10.14341/omet13217
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































