Перейти к:
Инновационные подходы к лечению ожирения: от фармакотерапии к наномедицине
https://doi.org/10.14341/omet13184
Аннотация
В настоящее время 879 миллионов взрослых людей на планете страдают ожирением. Ожирение и сахарный диабет 2 типа (СД2) имеют общие ключевые патофизиологические механизмы. Снижение массы тела является неотъемлемой частью стратегии управления сахарным диабетом (СД). Успехи в изучении патогенеза ожирения способствуют разработке и внедрению в клиническую практику инновационных технологий для борьбы с эпидемией ожирения и СД. Новые лекарственные препараты реализуют свое действие на уровне центральной нервной системы, желудочно-кишечного тракта, жировой ткани, почек, печени, поджелудочной железы, скелетных мышц. Проводится оценка безопасности генной терапии, изучаются возможности особых способов доставки препаратов в ткани-мишени. Рандомизированные клинические исследования свидетельствуют, что эффективность ряда новых фармакологических препаратов в отношении снижения массы тела и нормализации показателей углеводного обмена уже практически сопоставима с результатами бариатрических операций. В данном обзоре обобщены сведения литературных источников о перспективах терапии ожирения и СД2 на основе разработок преимущественно в области пептидных препаратов, моноклональных антител, РНК-терапии
Ключевые слова
Для цитирования:
Романцова Т.И. Инновационные подходы к лечению ожирения: от фармакотерапии к наномедицине. Ожирение и метаболизм. 2024;21(4):389-404. https://doi.org/10.14341/omet13184
For citation:
Romantsova T.I. Innovative approaches to the treatment of obesity: from pharmacotherapy to nanomedicine. Obesity and metabolism. 2024;21(4):389-404. (In Russ.) https://doi.org/10.14341/omet13184
ВВЕДЕНИЕ
В настоящее время 879 миллионов взрослых людей на планете страдают ожирением, свыше 507 миллионов — сахарным диабетом 2 типа (СД2) [1][2]. Ожирение и СД2 имеют общие ключевые патофизиологические механизмы. Оба заболевания ассоциированы с высоким риском метаболических осложнений (дислипидемия, обструктивное апноэ во сне, метаболически ассоциированная жировая болезнь печени (МАЖБП) и др.), а также сердечно-сосудистых и цереброваскулярных заболеваний [3]. Снижение массы тела является неотъемлемой частью стратегии управления сахарным диабетом [4][5]. Модификация образа жизни в качестве монотерапии обеспечивает клинически значимое снижение массы тела лишь у небольшой категории больных, оперативное лечение (бариатрическая и метаболическая хирургия) сопряжено с целым рядом ограничений и нежелательных явлений. Успехи в изучении патогенеза ожирения способствуют разработке и внедрению в клиническую практику инновационных технологий для борьбы с эпидемией ожирения и СД2. С появлением в клинической практике агонистов рецепторов ГПП-1 (ГПП-1Ар) была открыта новая эра в лечении этих заболеваний. Разработка унимолекулярных мультиагонистов рецепторов энтеропанкреатических гормонов (препараты «ГПП-1 плюс»), препаратов на основе моноклональных антител и РНК-терапии открывает новые многообещающие перспективы. Проводится оценка безопасности генной терапии, изучаются возможности особых способов доставки препаратов в ткани-мишени на основе применения наночастиц. Рандомизированные клинические исследования (РКИ) свидетельствуют, что эффективность ряда новых фармакологических препаратов в отношении снижения массы тела и нормализации показателей углеводного обмена уже практически сопоставима с результатами хирургических вмешательств. Новые лекарственные средства реализуют свое действие на уровне центральной нервной системы (ЦНС), желудочно-кишечного тракта (ЖКТ), жировой ткани, почек, печени, поджелудочной железы, скелетных мышц (рис. 1) [6].
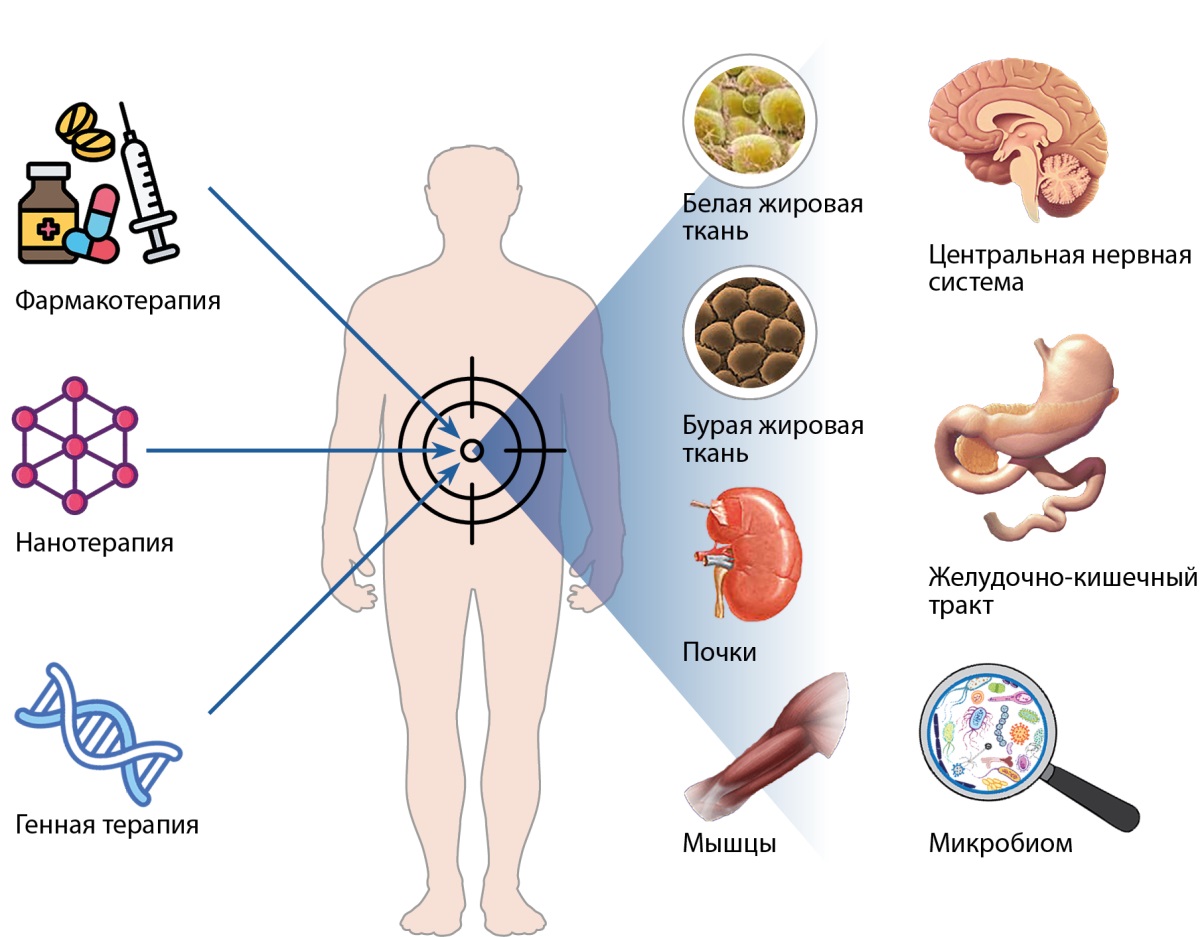
Рисунок 1. Современные технологии и мишени новых препаратов для лечения ожирения и сахарного диабета 2 типа (адаптировано из работы A.M. Angelidi и соавт., 2022) [6].
Figure 1. Modern technologies and targets of new drugs for the treatment of obesity and type 2 diabetes mellitus (adapted from the work of A.M.Angelidi et al., 2022) [6].
ПЕПТИДНЫЕ ПРЕПАРАТЫ
Пептид представляет собой короткую цепь аминокислот, связанных между собой пептидными связями между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты. Пептид отличается от белка тем, что пептидная цепь обычно состоит из 2–50 аминокислот, тогда как белок состоит из 50 и более аминокислот. В настоящее время идентифицировано свыше 7000 природных пептидов, которые активно участвуют в широком спектре физиологических процессов, в том числе обеспечении нейротрансмиссии и иммуномодуляции, регуляции активности факторов роста и антимикробной активности, реализации функции эндокринной системы. Терапия на основе эффектов эндогенных пептидов успешно применяется в лечении различных заболеваний, включая аутоиммунные расстройства, инфекции, различные виды рака, ожирение и СД2. Пептидные препараты обладают низкой иммуногенностью и высокой таргетной специфичностью, а также характеризуются относительно низкой стоимостью производства по сравнению с рекомбинантными белками и антителами. Терапевтические средства на основе пептидов разрабатываются высокими темпами: более 150 пептидов проходят клинические испытания и еще 400–600 пептидов проходят доклинические исследования [7]. В последнее время на мировой рынок вышло несколько новых препаратов, показавших высокую эффективность в лечении ожирения и СД2. Механизм действия этих лекарственных средств основан на эффектах эндогенных пептидов, вырабатывающихся преимущественно в желудочно-кишечном тракте (ЖКТ), и нейромедиаторов, вырабатывающихся в ЦНС [8]. Множество принципиально новых многообещающих пептидных препаратов для лечения ожирения и СД2 находится на различных стадиях РКИ.
ЗАРЕГИСТРИРОВАННЫЕ ПРЕПАРАТЫ
Агонисты рецепторов глюкагоноподобного пептида-1 на сегодняшний день успешно используются как при лечении СД2, так и ожирения; они доступны в большинстве стран как для однократного ежедневного, так и еженедельного применения. ГПП-1Ар нормализуют показатели гликемии, усиливая секрецию инсулина, снижая секрецию глюкагона и задерживая опорожнение желудка; а также способствуют снижению массы тела за счет действия на ЦНС. Накопленные данные о благоприятном сердечно-сосудистом эффекте этих препаратов существенно повысили их значимость для лечения пациентов с соответствующими осложнениями [9].
Лираглутид представляет собой агонист рецептора глюкагоноподобного пептида-1. После инъекции максимальная концентрация препарата в крови наблюдается через 10–14 часов, период полувыведения составляет 11–13 часов, что обеспечивает продолжительность действия в течение 24 часов. Лираглутид одобрен в США, Европе и России в дозе 1,8 мг для лечения СД2 (в РФ — Виктоза® (фармацевтическая компания Novo Nordisk), Квинлиро® (компания «Промомед»), в дозировке 3,0 мг — для лечения ожирения (в РФ — Саксенда® (Novo Nordisk), Энлигрия® (Промомед)). Программа исследований SCALE продемонстрировала значительное снижение массы тела у пациентов с ожирением на фоне применения лираглутида. В частности, в исследовании SCALE Obesity and Prediabetes потеря массы тела составила 8% через 56 недель (2,6% — на плацебо) и 6,1% — через 160 недель (1,9% — на плацебо). Применение лираглутида привело к снижению риска прогрессии диабета на 69% у пациентов с предиабетом, а также к нормогликемии — у 70% больных. У больных СД2 эффект в отношении снижения массы тела был более скромным (потеря за вычетом плацебо составила 3,9% за 1 год), тем не менее, статистически значимым. В исследовании SCALE Maintenance первоначальная потеря веса на 6% была достигнута за счет изменения образа жизни. В дальнейшем терапия была дополнена назначением 3 мг лираглутида, что привело к снижению массы тела на 12,2%. Наиболее распространенными побочными эффектами, зарегистрированными в программе SCALE, были желудочно-кишечные расстройства — преимущественно тошнота и диарея [6][10].
Семаглутид. Агонист рецепторов ГПП-1 семаглутид обладает периодом полувыведения до 160 часов, что позволят назначать его в виде инъекций 1 раз в неделю. В зарубежных странах в виде инъекций препарат применяется для лечения СД2 (Оземпик®) и ожирения (Wegovy®). У больных СД2 оценка эффективности и безопасности семаглутида в виде инъекций проведена в рамках РКИ программы SUSTAIN в виде пероральной формы — в программе PIONEER, у больных с индексом массы тела (ИМТ) от 27 кг/м2 без диабета в инъекционной форме — в программе STEP. Пероральная форма выпуска семаглутида для лечения СД2 (Ребелсас®) была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в 2019 г. и Европейским агентством по лекарственным средствам (EMA) в 2020 г. Для лечения СД2 в России зарегистрированы препараты семаглутида Оземпик® (Novo Nordisk), Квинсента® («Промомед»), Семавик® («Герофарм»), Ребелсас® (Novo Nordisk), Инсудайв® («ПСК Фарма»). Для лечения избыточной массы тела и ожирения зарегистрирован препарат Велгия® («Промомед»), содержащий семаглутид в дозе 2,4 мг.
Эффективность семаглутида при пероральном приеме несколько ниже, чем при подкожных инъекциях, следовательно, требуется гораздо более высокая доза препарата (7–14 мг/день) по сравнению с его инъекционной формой (1–2 мг/неделю). Тем не менее форма выпуска для перорального применения более экономична, поскольку не требует производства стерильных растворов для инъекций и шприц-ручек. Согласно результатам исследования фазы III PIONEER PLUS, ежедневный пероральный прием 50 мг семаглутида приводил к снижению массы тела у больных СД2 в среднем на 9,8% по сравнению с 5,4% на фоне перорального приема 14 мг препарата, а также к уменьшению гликированного гемоглобина (HbA1c) на 2,1% (versus 1,3%) [11][12]. Ребелсас® обеспечивает дополнительную возможность выбора для пациентов, не желающих применять инъекционные препараты.
Эффективность и безопасность применения семаглутида 2,4 мг в виде еженедельных инъекций для лечения избыточной массы тела и ожирения оценивали в рамках программы STEP, в которую включались пациенты с избыточной массой тела и метаболическими осложнениями (включая дислипидемию, артериальную гипертензию, апноэ во сне, сердечно-сосудистые заболевания, СД2) либо пациенты с ожирением (ИМТ≥30 кг/м2) с осложнениями или без них. По сравнению с плацебо, наименьшая потеря массы тела наблюдалась у больных СД2 (снижение на 6,2% после 68 недель терапии). У больных ожирением без диабета потеря массы тела составляла 14,9–16,0%. В прямом сравнительном исследовании семаглутида и лираглутида (STEP 8) потеря массы тела составила 15,8% на фоне семаглутида по сравнению с 6,4% в группе лираглутида, распространенность и спектр побочных эффектов были сопоставимыми. В рамках программы STEP было продемонстрировано непрерывное снижение массы тела в течение первых 60 недель терапии семаглутидом с последующей стабилизацией массы тела вплоть до 104 недели. Прекращение применения семаглутида после 20 недель лечения привело к обратному набору массы тела, тогда как продолжение введения препарата сопровождалось продолжающейся потерей веса в течение дополнительных 48 недель терапии [10].
Анорексигенное действие лираглутида и семаглутида обусловлено их влиянием на гипоталамус, ствол, кортиколимбические структуры мозга. K.S. Kim и соавт. (2024) показали, что эти препараты повышают не только ощущение постпрандиального, но и препрандиального насыщения путем активации дорсомедиальных ядер гипоталамуса [13]. Исследования у животных продемонстрировали, что по сравнению с лираглутидом семаглутид оказывает влияние на более обширный спектр регионов мозга, регулирующих массу тела. Семаглутид напрямую проникал в ствол мозга, ядро перегородки и гипоталамус, но не преодолевал гематоэнцефалический барьер; препарат оказывал свое действие через околожелудочковые структуры и несколько регионов, прилегающих к желудочкам. Семаглутид индуцировал активацию маркера нейрональной активности c-Fos в 10 областях мозга, включая латеральные парабрахиальные ядра. Транскриптомный анализ участков головного мозга крыс, получавших семаглутид, продемонстрировал повышение продукции пролактин-рилизинг-гормона и тирозингидроксилазы в области ствола (на уровне area postrema) [14]. Как лираглутид, так и семаглутид продемонстрировали высокую эффективность в отношении снижения риска неблагоприятных кардиоренальных и цереброваскулярных событий [3][12][15].
Тирзепатид. Глюкозозависимый инсулинотропный полипептид (ГИП) — гормон, секретирующийся К-клетками кишечника в ответ на прием пищи. ГИП стимулирует секрецию инсулина, усиливает выработку глюкагона и улучшает буферные свойства адипоцитов по накоплению липидов. Помимо периферических тканей, рецепторы ГИП локализованы в дугообразных, дорсомедиальных и паравентрикулярных ядрах гипоталамуса, задействованных в регуляции массы тела [16]. В 2022 г. первый унимолекулярный двойной агонист инкретиновых рецепторов (твинкретин) ГПП-1/ГИП, тирзепатид (Мунджаро® — Mounjaro®, Eli Lilly) получил одобрение FDA для лечения пациентов с СД2 (еженедельные инъекции в дозах 5, 10 и 15 мг), в 2023 г. — для лечения ожирения (Зепбаунд®, Zepbound®, Eli Lilly). Оценка эффективности и безопасности тирзепатида проведена в программах SUPRASS, SURMOUNT. Препарат вводится подкожно один раз в неделю. В исследованиях продолжительностью 40–52 недели у больных СД2 самая высокая доза тирзепатида (15 мг/неделю) снижала HbA1c на 2,5%; массу тела — на 12,9 кг. Эти показатели эффективности препарата, безусловно, были выше, чем у ГПП-1Ар. Исследования у пациентов с избыточным весом и ожирением, не страдающих диабетом, показали, что применение тирзепатида в дозе 15 мг/неделю в течение 72 недель приводит к снижению массы тела на 20% [17][18]. Как и ГПП-1Ар, тирзепатид снижает уровень глюкозы в плазме и массу тела за счет увеличения секреции инсулина, снижения секреции глюкагона, задержки опорожнения желудка и влияния на ЦНС. Относительный вклад каждого из инкретинов (ГПП-1, ГИП) в эффекты препарата пока четко не определены [9]. В настоящее время проводятся многочисленные исследования, направленные на оценку эффективности тирзепатида у больных с сердечной недостаточностью, хронической болезнью почек, МАЖБП [3]. Динамика массы тела на фоне различных методов лечения ожирения, в том числе на фоне применения тирзепатида, приведена на рисунке 2.
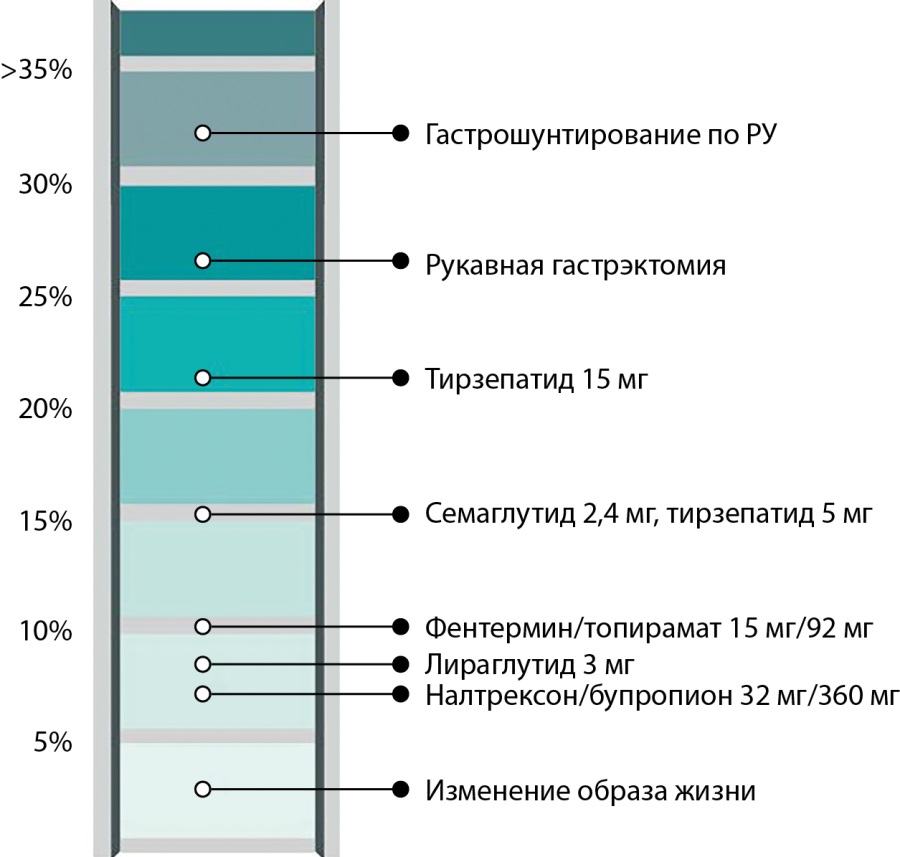
Рисунок 2. Cнижение массы тела на фоне различных методов лечения ожирения (адаптировано из работы E. Melson и соавт., 2023) [19].
Figure 2. Weight loss against the background of various methods of obesity treatment (adapted from the work of E. Melson et al., 2023) [19].
ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ МОНОГЕННОГО ОЖИРЕНИЯ
Сетмеланотид (Imcivree®, Rhythm Pharmaceuticals), ранее известный как RM-493, IRC-022493 или BIM-22493, представляет собой высокоселективный агонист рецепторов меланокортина 4 типа (MК4р), который был разработан для лечения ожирения, обусловленного дефицитом проопиомеланокортина, пропротеинконвертазы субтилизина/кексина 1-го типа либо гена — рецептора лептина. МК4р представляет собой белок, связанный с 7-трансмембранным доменом G. Лептин-меланокортиновая система играет главенствующую роль в энергетическом гомеостазе. Активация МК4р на уровне гипоталамических ядер и ствола мозга стимулирует расход энергии и снижает потребление пищи, что приводит к отрицательному энергетическому балансу и потенциальной потере веса. Дефекты гена МК4р сопровождаются нарушением энергобаланса, развитием ожирения и связанными с ним метаболическими осложнениями. В доклинических исследованиях было показано, что сетмеланотид снижает массу тела и потребление пищи, а также улучшает чувствительность к инсулину без повышения артериального давления и частоты сердечных сокращений (в отличие от предыдущего агониста МК4р LY2112688). В клиническом исследовании фазы I (clinicaltrials .gov/study NCT02431442) сетмеланотид приводил к потере веса в среднем на 0,6 кг/неделю у пациентов с ожирением вследствие дефекта гена МК4р. В другом краткосрочном исследовании фазы I (clinicaltrials .gov/study NCT01867437) исследователи изучили влияние сетмеланотида на расход энергии у 12 больных ожирением без метаболических нарушений. Сетмеланотид увеличивал энергозатраты в состоянии покоя (на 6,4% по сравнению с плацебо), а также окисление липидов. FDA одобрило препарат для постоянного контроля массы тела у пациентов в возрасте 6 лет и старше с ожирением, вызванным генетически подтвержденным дефицитом рецепторов лептина, дефектом гена проопиомеланокортина либо пропротеинконвертазы субтилизина/кексина 1-го типа. EMA присвоило сетмеланотиду статус приоритетных медицинских препаратов PRIority MEdicines (PRIME). Аналоги лептина также были протестированы при лечении ожирения, связанного с генетическим дефицитом лептина [20].
Метрелептин (Myalept®, компания Amylin Pharmaceutical, в настоящее время — компания Astra Zeneca) — аналог лептина, который был одобрен FDA в 2014 г. для пациентов с врожденным дефицитом лептина или врожденной/приобретенной липодистрофией. Ни один из препаратов для лечения моногенного ожирения не одобрен ни FDA, ни EMA в качестве средств терапии экзогенно-конституционального (полигенного) ожирения [6][20].
ИССЛЕДОВАНИЯ ЭФФЕКТИВНОСТИ НОВЫХ ПРЕПАРАТОВ
Моноагонисты рецепторов ГПП-1
Зарегистрированные в настоящее время препараты на основе эффектов энтеро-панкреатических гормонов представляют собой лишь «верхушку айсберга» в области инновационных лекарственных средств (рис. 3) [21].
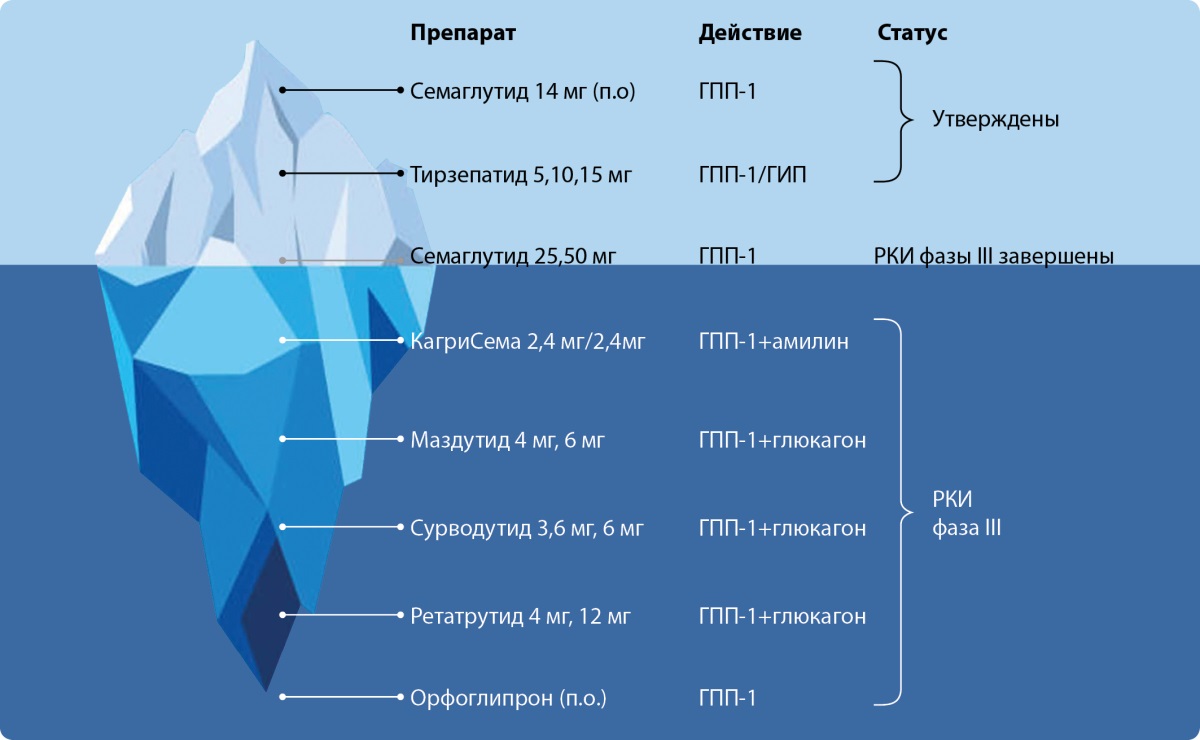
Рисунок 3. Зарегистрированные и исследуемые препараты на основе эффектов энтеропанкреатических гормонов (адаптировано из работы P. Gogineni и соавт., 2024) [21].
Сокращения: ГПП-1 — глюкагоноподобный пептид-1; ГИП — глюкозозависимый инсулинотропный полипептид; РКИ — рандомизированные клинические исследования; п.о. — пероральная форма.
Figure 3. Registered and investigated drugs based on the effects of entero-pancreatic hormones (adapted from the work of P. Gogineni et al., 2024) [21].
Abbreviations: GLP-1 — glucagon-like peptide-1, GIP — glucose–dependent insulinotropic polypeptide, RCT — randomized clinical trials, P.O. — oral form.
Продолжаются разработки новых ГПП-1Ар в виде инъекционных форм. Начата фаза II клинических исследований препаратов ноииглутид (noiiglutide, спонсор — Jiangsu Hansoh Pharmaceutical), экноглутид (ecnoglutide, спонсор — Sciwind Biosciences) [22][23]. Помимо пептидных ГПП-1Ар, для лечения ожирения и СД2 успешно разрабатываются пероральные непептидные формы агонистов рецепторов ГПП-1 (пептидомиметики). Дануглипрон (danuglipron) — пероральный непептидный ГПП-1Ар. В ранних клинических исследованиях прием дануглипрона 120 мг дважды в день приводил к плацебо-скорректированному снижению массы тела на 5,5% через 28 дней у больных СД2 и ожирением [24][25]. Учитывая большое количество выбывших пациентов вследствие побочных эффектов, компания Pfizer приняла решение временно приостановить клинические исследования дануглипрона; планируется выпуск модифицированной версии препарата. Недавно успешно завершены клинические исследования фазы II еще одного перорального непептидного ГПП-1Ар — орфорглипрона (orfoglipron, спонсор — Eli Lilly) у больных ожирением. Исходно масса тела выборки в среднем составляла 108,7 кг, индекс массы тела — 37,9 кг/м2. На 26-й неделе снижение массы тела по сравнению с исходными показателями в среднем колебалось от 8,6 до 12,6% в группах, принимавших орфорглипрон, и составляло 2,0% в группе плацебо. На 36-й неделе среднее снижение массы тела варьировало от 9,4 до 14,7% в группе орфорглипрона и 2,3% — в группе плацебо. Снижение массы тела как минимум на 10% к 36-й неделе отмечено у 46–75% участников, получавших орфорглипрон, по сравнению с 9% больных, получавших плацебо. Применение орфорглипрона сопровождалось улучшением метаболических показателей. Наиболее частыми нежелательными явлениями были желудочно-кишечные расстройства от легкой до умеренной степени тяжести. Отмена препарата вследствие побочных эффектов была у 10–17% больных [26]. Успешно завершена также фаза II исследований перорального препарата GSBR-1290 (фармацевтическая компания Structure Therapeutics) [27]. В рамках исследования фазы II проведена оценка эффективности и безопасности перорального непептидного ГПП-1Ар VCT220 (разработка компании Vincentage). Препарат продемонстрировал еще более высокую эффективность в отношении снижения массы тела по сравнению с дануглипроном, орфорглипроном, GSBR-1290, семаглутидом, тирзепатидом. Успешно завершена фаза I перорального препарата CT-996 у больных диабетом и ожирением (спонсор фазы I — Carmot Therapeutics, спонсор стартовавшей фазы II — Roche), снижение массы тела составило 6,1% за 4 недели [28].
Мультиагонисты рецепторов ГПП-1 и других гормонов желудочно-кишечного тракта
На сегодняшний день бариатрическая хирургия остается наиболее эффективным методом лечения морбидного ожирения. После оперативного вмешательства меняется секреция множества гормонов ЖКТ, что лежит в основе столь выраженного эффекта на массу тела. Для оценки потенциала применения у больных ожирением и СД2 проводится все больше исследований с пептидами, которые взаимодействуют не только с рецепторами ГПП-1, но и с рецепторами других гормонов ЖКТ (мультиагонисты, «терапия ГПП-1 плюс») (рис. 4) [19][29][30].
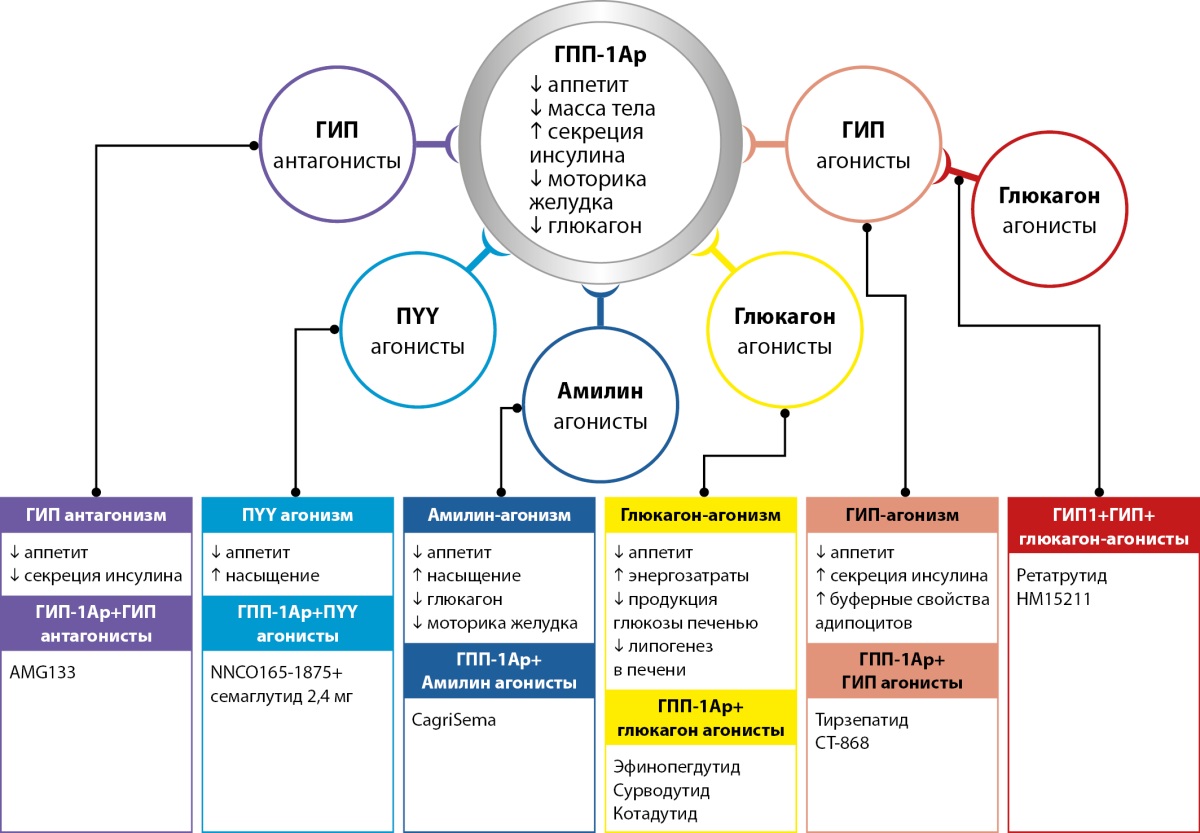
Рисунок 4. Современные направления исследований препаратов, основанных на комбинации эффектов глюкагоноподобного пептида-1 с другими гормонами желудочно-кишечного тракта (адаптировано из работы E. Melson и соавт., 2023) [19].
Сокращения: ГПП-1Ар — агонисты рецепторов глюкагоноподобного пептида-1; ГИП — глюкозозависимый инсулинотропный полипептид, ПYY — пептид YY.
Figure 4. Current research directions for drugs based on the combination of the effects of glucagon-like peptide-1 with other hormones of the gastrointestinal tract (adapted from the work of E. Melson et al., 2023) [19].
Abbreviations: GLP-1Ar — glucagon-like peptide-1 receptor agonists, GIP — glucose-dependent insulinotropic polypeptide, PYY — peptide YY.
Двойной агонизм с ГИП
Ряд фармакологических компаний продолжает разрабатывать новые твинкретины. В частности, в рамках ежегодной международной конференции Obesity Week в октябре 2023 г. (Техас, Даллас) были представлены результаты успешного завершения фазы II исследований двойного агониста рецепторов ГПП-1 и ГИП, — препарата CT 868 (компания Carmot Therapeutics Inc.) у больных СД2 на фоне ожирения. К моменту завершения исследования (26-я неделя) разница в уровне HbA1c при лечении CT-868 в дозе 4,0 мг по сравнению с плацебо в среднем составила -2,3%. До 70% участников исследования, получавших CT-868, достигли уровня HbA1c <6,5% (versus 18% участников, получавших плацебо) [31][32].
Антагонисты рецепторов ГИП в сочетании с агонизмом с рецепторами ГПП-1
К снижению массы тела приводит не только агонизм, но и антагонизм с рецепторами ГИП. В доклинических исследованиях было показано, что применение антагониста рецепторов ГИП сопровождается улучшением метаболического профиля и снижением потребления пищи. Молекулярные механизмы, объясняющие сходный эффект агонистов и антагонистов рецепторов ГИП, находятся в стадии изучения [33]. Эти эффекты дополнительно усиливаются при сочетании антагонизма с рецепторами ГИП с агонизмом с рецепторами ГПП-1. Исследования фазы I показали, что ежемесячные подкожные инъекции препарата AMG-133 (maridebart cafraglutide, спонсор — биофармацевтическая компания Amgen) сопровождались снижением массы тела от 7,2 до 14,5% через 12 недель у больных ожирением без диабета. Основными побочными эффектами были тошнота и рвота, их выраженность снижалась через 48 часов. Исследование фазы II продолжается [34].
Двойной агонизм с амилином
Амилин — гормон, секретируемый совместно с инсулином β-клетками поджелудочной железы, а также в ЦНС. Амилин участвует в центральной регуляции энергобаланса (преимущественное действие на стволовые структуры мозга) и улучшает углеводный обмен, замедляя моторику желудка и ингибируя секрецию глюкагона [21][35]. Синтетический аналог амилина прамлинтид зарегистрирован FDA для лечения больных диабетом 1 типа, а также СД2, получающих инсулинотерапию. Кагрилинтид (сagrilintide) — аналог амилина длительного действия, вводят один раз в неделю подкожно. В исследовании фазы II применение кагрилинтида в течение 26 недель в дозах до 4,5 мг приводило к существенному снижению массы тела по сравнению с плацебо у пациентов с ожирением (6,0–10,8% versus 3,0%), а в дозе 4,5 мг кагрилинтид превосходил эффективность лираглутида 3,0 мг (10,8% versus 9,0%). Кагрилинтид хорошо переносился, выбывание больных из исследования было обусловлено преимущественно желудочно-кишечными побочными эффектами, которые были сопоставимы с таковыми при приеме лираглутида [36]. В исследовании фазы Ib комбинация кагрилинтида 2,4 мг и семаглутида 2,4 мг один раз в неделю (КагриСема — CagriSema, спонсор — Novo Nordisk) у больных ожирением через 20 недель приводила к снижению веса на 17,1% по сравнению с 9,8% при использовании плацебо + семаглутид 2,4 мг при сопоставимой переносимости [37]. Результаты исследования фазы II показали, что у больных СД2 и ожирением к концу 32 недели применение CagriSema приводило к более выраженной динамике массы тела (-15,6%) по сравнению с семаглутидом 2,4 мг (-5,1%) и кагрилинтидом 2,4 мг (-8,1%) в отдельности, а также более значимому снижению HbA1c [38]. Программы фазы III (REDEFINE, REIMAGINE), оценивающие безопасность и эффективность CagriSema в группах больных ожирением и/либо СД2, продолжаются.
Подтипы рецепторов амилина человека представляют собой комплексы рецептора кальцитонина с белками, модифицирующими активность рецептора. Недавно в качестве потенциальных препаратов для лечения ожирения были разработаны агонисты рецепторов амилина и кальцитонина двойного действия (DACRA). В экспериментальных исследованиях было показано, что препараты DACRA (например, давалинтид (davalintide, AC2307), KBP, KBP-A, KBP-088) вызывают потерю веса у животных с ожирением [20][39][40].
Двойной агонизм с глюкагоном
Глюкагон секретируется α-клетками поджелудочной железы в ответ на низкий уровень глюкозы в крови. Гормон повышает уровень гликемии за счет активации продукции глюкозы печенью, а также снижает потребление пищи, увеличивает расход энергии и способствует окислению жирных кислот в печени [41]. Сочетание агонизма с рецепторами глюкагона и агонизма с рецепторами ГПП-1 приводит к выраженному снижению массы тела, при этом ГПП-1 оказывает протективное действие в отношении диабетогенных свойств глюкагона. Результаты ранних исследований на животных были чрезвычайно обнадеживающими, что привело к разработке многочисленных коагонистов рецепторов ГПП-1/глюкагона. В исследовании фазы II (спонсор — Boehringer Ingelheim) у больных СД2 и ожирением препарат BI 456906 способствовал дозозависимому снижению массы тела до 9,0% через 16 недель по сравнению с 1,2% в группе плацебо и 5,4% в группе семаглутида в дозе 1 мг [42]. Показатели HbA1c также снижались более значимо на фоне применения BI 456906 по сравнению с плацебо и семаглутидом [43].
Применение эфинопегдутида (efinopegdutide; JJ-64565111; HM12525A) приводило к дозозависимому плацебоскорректированному снижению массы тела до 7,2% после 12 недель лечения в исследовании фазы II у больных ожирением и СД2; однако существенной динамики показателей HbA1c не отмечалось (спонсор — Merck) [44]. У пациентов с ожирением без диабета самая высокая доза эфинопегдутида приводила к плацебоскорректированному снижению массы тела до 10% через 26 недель [45]. Котадутид (сotadutide; MEDI0382, AstraZeneca|MedImmune LLC) в дозе 300 мг превосходил плацебо и лираглутид по динамике массы тела (-5,02% versus -0,68% versus -3,33% соответственно) в ходе исследования продолжительностью 54 недели фазы IIb у больных СД2 и ожирением. Снижение уровня HbA1c было сопоставимо с действием лираглутида 1,8 мг [46][47]. Улучшение показателей функции печени при применении котадутида побудили исследователей к проведению РКИ фазы III по оценке его безопасности и эффективности при МАЖБП (clinicaltrial .gov/study NCT05364931). В исследовании фазы II пемвидутид (pemvidutide; АLТ-801, спонсор — фармацевтическая компания Altimmune, Inc) способствовал дозозависимому плацебоскорректированному снижению веса до 9,7% через 24 недели у пациентов с ожирением. Изучается потенциал препарата для лечения НАСГ [48]. Результаты исследования фазы II сурводутида (survodutide) у больных СД2 были представлены на очередном конгрессе Американской диабетической ассоциации в июне 2023 г. После 16 недель терапии в дозе 1,8 мг 1 раз в неделю снижение HbA1c составило 1,71% (versus 1,46% на фоне семаглутида и 0,25% — на фоне плацебо). После 46 недель лечения среднее снижение веса составило 18,7%. До 40% участников потеряли по меньшей мере 20% массы тела. Сурводутид изучается в рамках исследований фазы III в дозах 3,6 мг и 6 мг (программа SYNCHRONIZE, спонсоры — Boehringer Ingelheim и Zealand Pharma A/S). Наиболее частыми побочными эффектами при применении двойных агонистов рецепторов ГПП-1/глюкагона были желудочно-кишечные расстройства (тошнота, рвота) [21][49].
Оксинтомодулин (OКМ) представляет собой природный двойной агонист рецепторов ГПП-1 и глюкагона. Как и ГПП-1, ОКМ секретируется L-клетками желудочно-кишечного тракта; содержание гормона повышается после приема пищи. Анорексигенное влияние оксинтомодулина на гипоталамические ядра опосредовано как рецепторами ГПП-1, так и рецепторами глюкагона. ОКМ снижает потребление пищи, увеличивает расход энергии, связанный с физическими упражнениями, задерживает моторику желудка и способствует глюкозозависимому усилению секреции инсулина [50]. Оксинтомодулин является одним из перспективных кандидатов для лечения ожирения, учитывая его двойное влияние на энергетический баланс, однако короткий период полувыведения и быстрый почечный клиренс нативного ОКМ препятствовали его развитию в качестве долгосрочного метода лечения ожирения. Маздутид (mazdutide; IBI362; LY3305677, фармацевтическая компания Innovent Biologics, Inc.), аналог оксинтомодулина с присоединенной боковой цепью жирной кислоты, разработан в качестве двойного агониста рецепторов ГПП-1 и рецепторов глюкагона для лечения ожирения и СД2. В рамках исследования фазы II исследования пациенты с ожирением были рандомизированы для приема маздутида 3 мг (n=62), 4,5 мг (n=63), 6 мг (n=61) или плацебо (n=62). Изменения массы тела от исходного уровня к 24 неделе составили -6,7% на фоне маздутида 3 мг, -10,4% (0,7) на фоне 4,5 мг, -11,3% при применении 6 мг (versus 1,0% — на плацебо); разница по сравнению с плацебо колебалась от -7,7% до -12,3%. Все дозы маздутида хорошо переносились, наиболее частыми нежелательными явлениями были диарея, тошнота и инфекции верхних дыхательных путей [51]. В настоящее время изучаются эффекты препарата в рамках исследований фазы III, в частности в программе исследований DREAMS у больных СД2 [21][52][53].
Тройной агонизм (ГПП-1/ГИП/глюкагон)
Учитывая эффективность и преимущества двойного агониста рецепторов ГПП-1/ГИП тирзепатида и двойных агонистов рецепторов ГПП-1/глюкагона, тройные агонисты, нацеленные на все 3 вида рецепторов (ГПП-1/ГИП/глюкагон), потенциально могут обладать серьезными преимуществами в отношении нормализации массы тела и гликемии по сравнению с двойными агонистами [54][55]. Ретатрутид (retatrutide; LY3437943, компания Eli Lilly), тройной агонист рецепторов ГПП-1/ГИП/глюкагон, в доклинических исследованиях более значимо снижал массу тела по сравнению с тирзепатидом, а также улучшал показатели углеводного обмена [56][57]. В исследовании фазы Ib у больных СД2 ретатрутид, назначаемый подкожно один раз в неделю в течение 12 недель, приводил к плацебо-скорректированному снижению HbA1c до 1,6% и дозозависимому плацебоскорректированному уменьшению массы тела до 9 кг в группе с самой высокой дозой. Профиль безопасности LY3437943 был сопоставим с профилем безопасности других инкретиновых препаратов [58]. Недавно завершилось исследование ретатрутида в рамках фазы II (clinicaltrials .gov/study NCT04881760). Через 48 недель среднее изменение массы тела в группах ретатрутида (дозы от 0,5 мг до 12 мг 1 раз в неделю) составило -8,7% при применении 1 мг препарата, -17,1% на фоне 4 мг, -22,8% на фоне 8 мг, и 24,2% при применении 12 мг препарата по сравнению с -2,1% в группе плацебо. Снижение веса на 5% и более, 10% и более и 15% и более отмечено у 92%, 75% и 60% участников соответственно, получавших 4 мг ретатрутида; 100%, 91% и 75% получавших 8 мг; 100%, 93% и 83% получавших 12 мг; и 27%, 9% и 2% — на плацебо. Наиболее частыми нежелательными явлениями в группах ретатрутида были желудочно-кишечные явления (35% больных). Эти побочные эффекты были дозозависимыми, в основном имели легкую или умеренную степень тяжести и смягчались при более низкой стартовой дозе (2 мг против 4 мг). Дозозависимое увеличение частоты сердечных сокращений достигло пика через 24 недели, затем эти показатели нормализовались [59]. Программа исследований TRIUMPH фазы III стартовала в 2023 году.
Другие инновационные препараты
Ингибирующий макрофаги цитокин 1 (MIC1; также известный как фактор дифференцировки роста-15, GDF15) привлек внимание исследователей в качестве потенциальной мишени для лечения ожирения. GDF15 является членом суперсемейства трансформирующего ростового фактора -β (TGFβ). В физиологических условиях GDF15 экспрессируется во многих тканях в низкой концентрации, его уровень увеличивается при повреждении тканей, воспалении, ССЗ, онкологических и метаболических заболеваниях. GDF15 регулирует энергетический баланс, снижение аппетита реализуется путем активации рецептора GFRAL [60]. Экзогенное введение GDF15 и его аналогов снижает массу тела у мышей с ожирением. Некоторые (но не все) исследования продемонстрировали, что анорексигенное действие GDF15 опосредовано преимущественно индуцированием тошноты и рвоты. Для оценки безопасности препаратов на основе эффектов GDF15 продолжаются доклинические исследования [20][61].
Пептид тирозин тирозин (ПYY) — гормон, который, как и ГПП-1, секретируется L-клетками кишечника. ПYY является членом семейства нейропептида Y (НПY). После высвобождения ПYY1–36 быстро расщепляется дипептидилпептидазой-IV до его основной активной формы, ПYY3–36, высокоаффинного агониста рецепторов НПY 2 типа (Y2R) [18]. Эти рецепторы экспрессируются в парасимпатических и симпатических нейронах периферии, а также в нескольких регионах ЦНС, включая кортико-лимбические области и ствол мозга. В гипоталамусе рецепторы Y2R экспрессируются на орексигенных НПY-нейронах дугообразных ядер. Снижение потребление пищи и массы тела частично обусловлено подавлением активности НПY. Дополнительные механизмы, которые могут быть вовлечены в регуляцию потребления пищи с участием ПYY3-36, включают Y2R-опосредованную активацию мезолимбической дофаминергической системы, а также ГАМК-эргических и глутаматергических нейронов в корковых и подкорковых областях и стволе мозга. Несколько аналогов ПYY3–36 длительного действия (clinicaltrials .gov/study NN9748 и NNC0165-1875, Novo Nordisk) завершили РКИ фазы I исследований по лечению ожирения. В рамках РКИ фазы II изучается комбинация аналога ПYY NNC0165-1875 с семаглутидом. Кроме того, Lilly Research Laboratories объявила о начале I фазы исследования аналога ПYY для лечения СД2 [20][62].
Фактор роста фибробластов 21 (FGF21) регулирует чувствительность к инсулину, расход энергии и липидный обмен. Соответственно, FGF21 и его аналоги были определены как потенциально эффективные препараты для лечения СД2, ожирения и НАЖБП. FGF21 действует путем связывания с рецептором β-klotho (BKL) и рецептором фактора роста фибробластов 1c (FGFR1c), что приводит к образованию стабильного комплекса FGF21/BKL/FGFR. Исследования у животных продемонстрировали, что однократная доза FGF21 повышает чувствительность к инсулину и снижает уровень гликемии в крови более чем на 50%. Этот эффект достигается за счет прямого воздействия FGF21 на жировую ткань, что способствует повышению утилизации глюкозы белыми адипоцитами. Кроме того, было показано, что длительное применение FGF21 значительно снижает массу тела за счет увеличения расхода энергии даже без снижения потребления пищи. Молекула LY2405319 (Eli Lilly), улучшенная версия нативного FGF21, является первым аналогом FGF21, протестированным в клинических иccледованиях. В исследовании фазы 1, проведенном у пациентов с ожирением и СД2, больные были рандомизированы для подкожного введения возрастающих доз LY2405319 или плацебо ежедневно в течение 28 дней. Это исследование показало, что LY2405319 способен снижать массу тела, уровень инсулина натощак, триглицеридов, общего холестерина и холестерина липопротеинов низкой плотности, а также повышать уровень адипонектина в сыворотке и холестерина липопротеинов высокой плотности [51]. В настоящее время проводится исследование эффективности препарата NNC0194-0499 на основе эффектов FGF21 у больных ожирением в рамках фазы I (Novo Nordisk, clinicaltrials .gov/study NCT03479892). Разрабатываются комбинированные препараты FGF21 в сочетании с ГПП-1Ар [63][64][65].
Препараты на основе моноклональных антител
Разработка лекарственных препаратов на основе моноклональных антител (МкАт) является одной из наиболее активно развивающихся областей в современной фармакологии и иммунологии. Высокая специфичность терапевтических антител обеспечивает предсказуемость их эффектов. В США и странах Евросоюза к использованию по разным показаниям допущены свыше 50 лекарственных препаратов на основе МкАт и более 300 находятся на различных стадиях клинических исследований. Первым препаратом МкАТ, вышедшим на рынок в 1986 г., стал препарат для предотвращения отторжения трансплантированной почки — Orthoclone ОКТ-З/Мурономаб CD-3 [66][67]. Его полностью мышиное происхождение приводило к образованию человеческих антимышиных антител и быстрой нейтрализации терапевтического эффекта. Снизить иммуногенность МАТ удалось в начале 90-х, когда с помощью методов генной инженерии были созданы химерные МАТ: константные участки мышиного иммуноглобулина были заменены участками человеческого иммуноглобулина. За ними последовали гуманизированные МАТ, еще менее иммуногенные. До 95% молекулы гуманизированного МАТ составляет человеческий иммуноглобулин. Мышиными в них остаются лишь гипервариабельные участки, ответственные за связывание с антигеном. Наконец, стали разрабатываться МАТ последнего поколения, обладающие самой низкой иммуногенностью, — полностью человеческие. Их появление стало возможным благодаря новейшим биотехнологиям, в частности, методу «фагового дисплея». Взаимодействие антиген-антитело может приводить к: блокировке действия определенной молекулы, связыванию с определенными клетками, модулированию сигнального пути [68][69]. В настоящее время ведутся разработки ряда молекул-мишеней для лечения ожирения и СД2.
Бимагрумаб (BYM338) — полностью человеческое моноклональное антитело, исходно изучался как потенциальный метод лечения спорадического миозита, который является наиболее распространенной формой миопатии у людей старше 50 лет. Бимагрумаб блокирует рецепторы активина II типа (ActRII), тем самым препятствуя связыванию эндогенных лигандов трансформирующего фактора роста-β, таких как активины и миостатин. Указанные лиганды негативно влияют на рост скелетных мышц и вызывают их атрофию. Ингибирование ActRIIB активирует адипогенез бурой жировой ткани и повышает термогенез за счет усиления функции митохондрий [6]. В доклинических исследованиях было показано, что фармакологическая блокада передачи сигналов ActRIIB приводила к росту скелетных мышц, повышению чувствительности к инсулину, снижению содержания жира и снижению массы тела [70]. У пациентов с инсулинорезистентностью введение бимагрумаба в течение 10 недель сопровождалось увеличением мышечной массы, снижением общей жировой массы тела на 7,9%, повышением чувствительности к инсулину [71]. В рандомизированном клиническом исследовании фазы II применение бимагрумаба в течение 48 недель значительно увеличило мышечную массу, что сопровождалось снижением содержания жира в организме (на 20,5% versus 0,5% на плацебо), увеличением содержания мышечной массы (на 3,6%) и улучшением гликемического контроля у пациентов с ожирением и СД2 [72]. Клинические исследования по оценке эффективности и безопасности бимагрумаба продолжаются, в частности, изучаются перспективы его комбинации с семаглутидом (исследование BELIEVE, фаза II, спонсор — Versanis Bio) [73][74]. Ингибирование ActRII с помощью бимагрумаба может стать многообещающей стратегией лечения ожирения и сопутствующих метаболических нарушений. Мышечные спазмы и умеренная диарея являются наиболее частыми побочными эффектами на фоне применения бимагрумаба. К числу других ингибиторов рецепторов активина, изучаемых в качестве потенциальных препаратов для лечения ожирения, относится препарат талдефгробеп (taldefgrobep, спонсор — Biohaven), а также апитегромаб (apitegromab, спонсор — Scholar Rock, Inc.) в комбинации с ГПП-1Ар [75][76].
Дефицит лептина либо его рецептора приводит к морбидному ожирению, а также метаболическим нарушениям у пациентов с вторичной гиполептинемией, обусловленной генерализованной липодистрофией. Терапия, восстанавливающая передачу сигналов лептина, устраняет эти метаболические последствия. В 2023 г. было разработано человеческое моноклональное антитело (mAb) мибавадемаб (mibavademab, REGN4461), который активирует рецепторы лептина. У мышей с ожирением, обусловленным нокаутированием гена лептина, REGN4461 нормализовал массу тела, потребление пищи, уровень глюкозы в крови и чувствительность к инсулину. В модели генерализованной липодистрофии у мышей REGN4461 снижал гиперфагию, гипергликемию, резистентность к инсулину, дислипидемию, уменьшал стеатоз печени. В рандомизированном двойном слепом плацебо-контролируемом исследовании фазы I, REGN4461 хорошо переносился и имел приемлемый профиль безопасности. Лечение REGN4461 пациентов с избыточной массой тела или ожирением снижало массу тела в течение 12 недель при наличии низкой концентрации циркулирующего лептина (<8 нг/мл), но не влияло на массу тела у больных с более высоким исходным уровнем лептина. Применение препарата у одного из пациентов с атипичной частичной липодистрофией и неопределяемой концентрацией лептина, обусловленной действием нейтрализующих антител к метролептину, привело к заметному снижению содержания триглицеридов в крови и уменьшению выраженности стеатоза печени. Эти данные свидетельствуют, что моноклональное антитело-агонист рецепторов лептина может потенциально применяться при заболеваниях, сопровождающихся относительно низкими концентрациями лептина [77].
Провоспалительный цитокин интерлейкин 1 β (IL-1β) повышается при ожирении и способствует нарушению секреции инсулина, снижению пролиферации и апоптозу бета-клеток поджелудочной железы. O. Osborn и соавт. изучали эффекты антитела к IL-1β в отношении показателей углеводного обмена у мышей с гипергликемией и ожирением. После 13 недель в группе, получавшей антитела к IL-1β, наблюдалось снижение гликированного гемоглобина, снижение уровня проинсулина в сыворотке, снижение уровня инсулина и меньший размер островков по сравнению с группой, получавшей контрольное антитело. Нейтрализация IL-1β также значительно снижала уровень амилоида А в сыворотке, который является индикатором острой фазы воспаления. Несмотря на то, что существенной динамики массы тела у животных не отмечалось, с помощью этого метода лечения удалось достичь значительного улучшения гликемического контроля и функции бета-клеток, что может в перспективе замедлить либо предотвратить прогрессирование СД2 [78].
В исследовании A. Baruch и соавт. (2020 г.) было продемонстрировано, что биспецифическое антитело против комплекса FGFR1/KLB, BFKB8488A, имитирует действие FGF21 у животных и человека. У обезьян, страдающих ожирением, BFKB8488A способствовал заметной потере веса и повышению экспрессии генов-мишеней FGFR1 в жировой ткани. Клиническое исследование с участием пациентов с избыточным весом продемонстрировало, что однократная доза BFKB8488A вызывала снижение массы тела, устойчивое улучшение кардиометаболических параметров, снижение предпочтения сладкого вкуса и потребления углеводов. Эти данные позволяют предположить, что опосредованная антителом активация комплекса FGFR1/KLB имитирует эффекты FGF21 и может использоваться в качестве терапии метаболических нарушений, ассоциированных с ожирением [79].
K. Miyawaki и соавт. продемонстрировали, что, в то время как при избыточном калораже у обычных мышей развивалось ожирение и инсулинорезистентность, у мышей с дефицитом рецептора глюкозозависимого инсулинотропного полипептида, получавших идентичное питание, масса тела оставалась сохранной [80]. Другие исследования также показали, что ГИП играет важную роль в активации липогенеза, способствуя развитию ожирения, резистентности к инсулину и гиперинсулинемии [81]. Целью исследования Wolfe M.M. и соавт. (2023 г.) была оценка влияния моноклонального антитела к ГИПна снижение веса у мышей дикого типа, а также изучение влияния данного mAb на предотвращение увеличения веса у тучных мышей с дефицитом лептина (ob/ob). Мыши, получавшие фосфатно-солевой буфер (контрольная группа), прибавляли в весе значительно больше, чем мыши, получавшие антитела к ГИП, при этом не было обнаружено различий в объеме потребляемой пищи. Мыши с ожирением, получавшие жирную пищу и плацебо, продолжали набирать вес (+2,1% ± 0,9%), тогда как мыши, которым вводили mAb ГИП, потеряли 4,1% ± 1,4% массы тела. Через 8 недель мыши с дефицитом лептина, получавшие плацебо, прибавили 250,4% ± 9,1% массы тела, в то время как у животных, получавших mAb ГИП, масса тела увеличилась на 192%. Уровни триглицеридов в сыворотке, а также уровни ОХ и ЛПНП были ниже у мышей, получавших mAb ГИП, а соотношение липопоротеины высокой плотности/общий холестерин в этой группе было значительно выше, чем в контрольной группе. Более того, у мышей, получавших mAb ГИП, нормализовались базальное содержание инсулина и толерантность к глюкозе [82].
ГИП и ГПП-1 регулируют гомеостаз глюкозы и энергии. Объединение эффектов обоих инкретинов с помощью антитела-антагониста рецепторов ГИП и агониста рецепторов ГПП-1 путем создания биспецифических антител АbГИПр-Ab/ГПП-1р является одним из инновационных подходов к лечению ожирения и сопутствующих заболеваний. У мышей и обезьян эти молекулы снижают массу тела и улучшают многие метаболические параметры. S.C. Lu и соавт. (2021 г.) показали, что потеря массы тела выше при использовании АbГИПр-Ab/ГПП-1р, чем при использовании ГИП-Ab или контрольного антитела, что подтверждает синергетический эффект подобной комбинации. Одномоментное связывание обоих рецепторов и быстрая их интернализация под влиянием АbГИПр-Ab/ГПП-1р активирует выработку эндосомального циклического аденозинмонофосфата (цАМФ) в рекомбинантных клетках, экспрессирующих оба рецептора, что объясняет эффективность указанных биспецифических антител (рис. 5) [83]. Данный эффект заложен в механизм действия препарата AMG-133, разрабатываемого фармацевтической компанией Amgen [84].
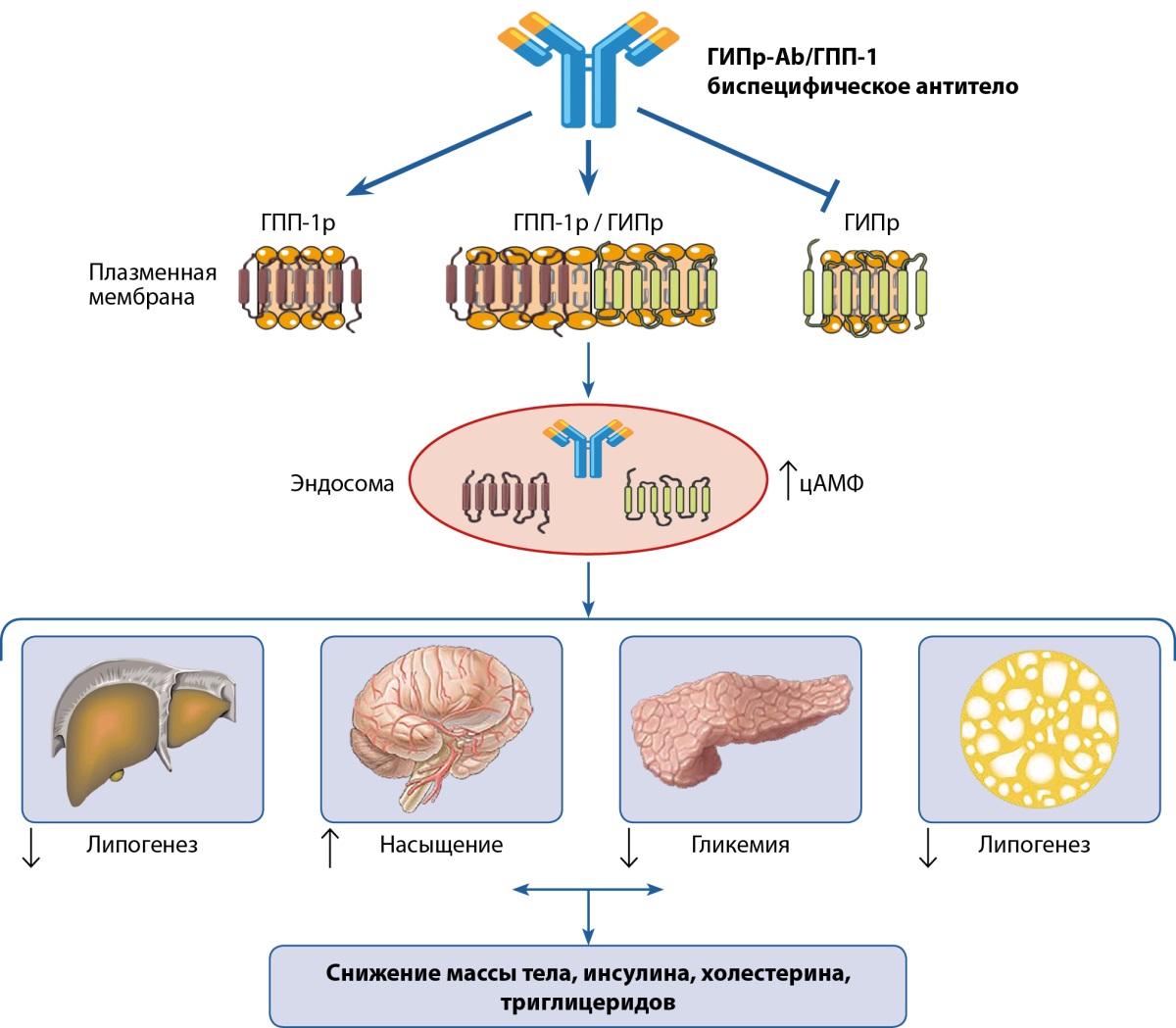
Рисунок 5. Применение биспецифических антител АbГИПр-Ab/ГПП-1р (антагонизм с рецепторами глюкозозависимого инсулинотропного полипептида (ГИПр) и агонизм с рецепторами глюкагоноподобного пептида-1 (ГПП-1р)) путем активации циклического аденозинмонофосфата (цАМФ) способствует снижению массы тела и улучшению метаболических показателей (адаптировано из работы S.C. Lu и соавт., 2021 г.) [83].
Figure 5. The use of bispecific antibodies GIPr-Ab/GLP-1 (antagonism with glucose-dependent insulinotropic polypeptide (GIPr) receptors and agonism with glucagon-like peptide-1 (GLP-1r) receptors) by activating cyclic adenosine monophosphate (cAMP) helps to reduce body weight and improve metabolic parameters (adapted from the work of S.C. Lu et al., 2021) [83].
Перспективы терапии ожирения и СД2 на основе РНК-технологий
Наномедицина на основе РНК-технологий охватывает ряд терапевтических подходов, в которых используются молекулы РНК (или молекулы, нацеленные на РНК), для лечения либо профилактики множества заболеваний. Для производства препаратов применяются антисмысловые олигонуклеотиды (antisense oligonucleotides (ASO)), малые интерферирующие РНК (small interfering RNAs (siRNA)), микроРНК (microRNAs (miRNA)), информационные РНК (messenger RNAs (mRNA)); белок 9, связанный с регулярно перемежающимися короткими палиндромными повторами (clustered regularly interspersed short palindromic repeats-associated protein 9 (CRISPR/Cas9)), одиночные направляющие РНК (single guide RNAs (sgRNA)), РНК-аптамеры (RNA aptamers) (рис. 6), включая ожирение и СД2 [85][86].
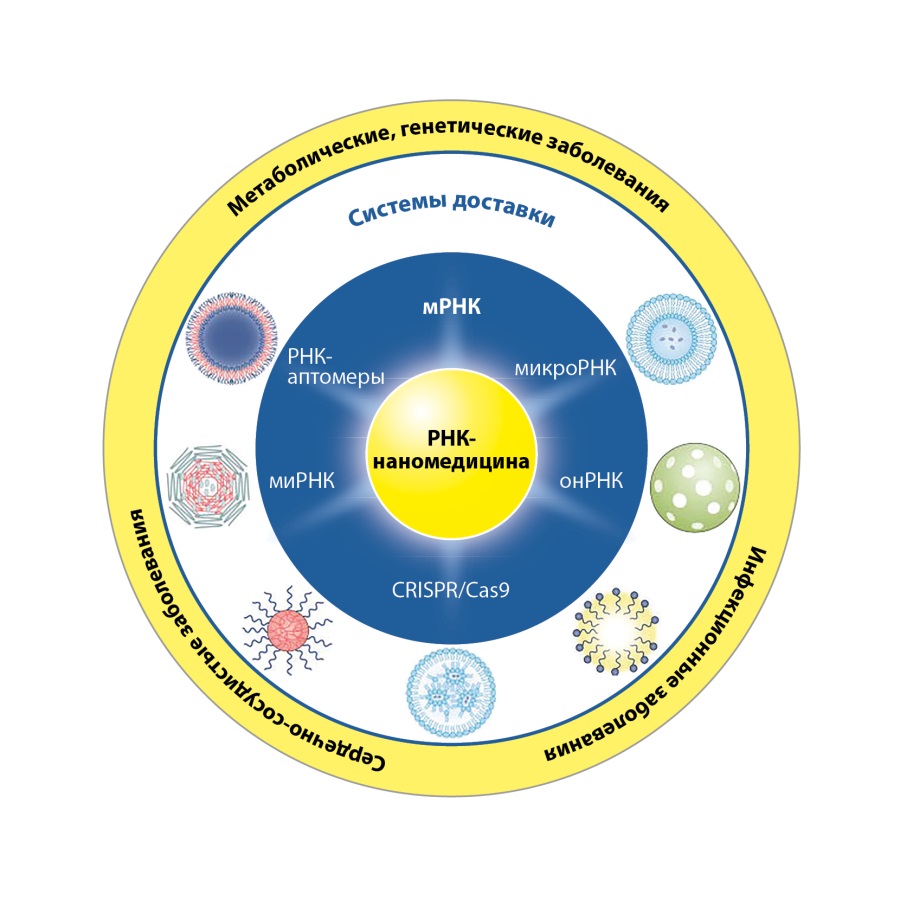
Рисунок 6. Виды и области применения наномедицины на основе РНК-технологий (адаптировано из работы L-J Su и соавт., 2023 г.) [85].
Сокращения: мРНК — матричная РНК; онРНК — одиночные направляющие РНК; миРНК — малые интерферирующие РНК; CRISPR/Cas9 — белок 9, связанный с регулярно перемежающимися короткими палиндромными повторами (clustered regularly interspersed short palindromic repeats-associated protein 9).
Figure 6. Types and applications of RNA-based nanomedicine (adapted from L-J Su et al., 2023) [85].
Abbreviations: mRNA — messenger RNA; sRNA – single guide RNA; siRNA — small interfering RNA; CRISPR/Cas9 — clustered regularly interspersed short palindromic repeats-associated protein 9.
Эти терапевтические средства оказывают свое действие путем вовлечения различных механизмов, таких как ингибирование генов, их активация, добавление, замена и редактирование. Для доставки молекул РНК в клетки используются различные системы, включая применение наночастиц на основе полимеров, липидов, конъюгатов и др. Успехи в области изучения биологии РНК послужили триггером для разработки РНК-терапии не только инфекционных и генетических болезней, но и метаболических заболеваний [85].
Препараты на основе мРНК
Cовременные препараты для лечения ожирения, одобренные FDA, ориентированы в первую очередь на снижение потребления энергии; лишь немногие из них влияют на энергозатраты. Бурая жировая ткань (БЖТ) обеспечивает термогенез и играет важнейшую роль в энергобалансе. Попытки воздействия на БЖТ с помощью разработок в области традиционной фармакотерапии пока не увенчались успехом, учитывая неизбежно развивающиеся побочные эффекты (негативное влияние на сердечно-сосудистую систему вследствие активации симпатической нервной системы). Мезодермальный фактор роста костный морфогенный протеин 7 (Bone morphogenic protein 7) Bmp7 активирует БЖТ и способствует повышению энергозатрат и снижению массы тела. Однако учитывая, что Bmp7 является цитокином с плейотропными функциями, его системное введение может сопровождаться нежелательными побочными эффектами. В исследовании Y Guo и соавт. (2021 г.) мРНК Bmp7 была загружена в систему экзосом SmartExo и размещена в сальниковой жировой ткани мышей с ожирением. Более глубокая пенетрация достигалась с помощью применения ультразвука. Эта методика обеспечила локальное потемнение (побурение) белой жировой ткани, т.е. формирование термогенных бежевых адипоцитов. Отмечалось лишь незначительное проникновение мРНК Bmp7 в другие органы. Таким образом, стратегия доставки мРНК Bmp7 на основе экзосом представляет собой новое направление в разработке препаратов для лечения ожирения [87].
Гепатокин (секреторный белок печени) фактор роста фибробластов 21 (FGF21) является перспективным терапевтическим средством для лечения СД2 и неалкогольной жировой болезни печени (НАЖБП). X. Huang и соавт. (2023 г.) изучали влияние пиоглитазона (ПИО) в сочетании с мРНК FGF21 (mFGF21) на метаболические показатели у крыс с неалкогольной жировой болезнью печени (МАЖБП). Функциональную активность белка FGF21, экспрессируемого mFGF21, in vitro оценивали на стволовых клетках жировой ткани человека (hASC). Фармакокинетические профили белка FGF21, экспрессируемого mFGF21, исследовали на здоровых крысах и крысах с МАЖБП. Результаты исследования показали, что ПИО усиливает in vitro функциональную активность белка FGF21, экспрессируемого из mFGF21 в hASC. Комбинированное лечение ПИО и mFGF21 существенно снижало массу тела, показатели глюкозы в крови натощак, уровень инсулина; улучшало липидный обмен у крыс с МАЖБП по сравнению с контролем либо обеими двумя группами монотерапии. Комбинированное лечение ПИО и mFGF21 значительно уменьшало содержание жира в печени у крыс с МАЖБП за счет активации сигнального пути SHP1/AMPK [88].
S. Bartesaghi и соавт. (2022 г.) продемонстрировали, что терапевтические значения FGF21 были достигнуты после подкожного (п/к) введениямРНК FGF21человека. Эффективность мРНК терапии оценивали после 2-недельного повторного подкожного введения мышам с ожирением, что привело к заметному снижению массы тела, уровня инсулина в плазме и стеатоза печени. Фармакокинетическое/фармакодинамическое моделирование нескольких исследований как на худых, так и на тучных DIO мышах показало, что мРНК FGF21 человека обеспечивает более надежный терапевтический эффект по сравнению с рекомбинантными белками in vivo. Это исследование является первым примером, подтверждающим эффективность подкожной мРНК-терапии, что может потенциально применяться для лечения СД2 и МАЖБП [89].
Секреторные белки печени принимают участие в поддержании энергобаланса. Молекулярные механизмы, регулирующие продукцию гепатокинов в ответ на различные стимулы (в том числе прием пищи), пока не уточнены. S. Katsumura и соавт. (2022 г.) установили, что одним из таких механизмов являются эффекты деаденилазы CNOT6L, которая подавляет экспрессию гепатокинов в ответ на физическую нагрузку и прием пищи. Ингибирование CNOT6L предотвращает деградацию мРНК GDF15 и FGF21 в печени, тем самым повышая содержание соответствующих белков в сыворотке. Наблюдающееся вслед за этим повышение содержания GDF15 приводит к подавлению аппетита на уровне ствола мозга (area postrema, ядра одиночного тракта) и снижению массы тела. Возрастание уровня FGF21 оказывает влияние на печень и жировую ткань, вызывая расход энергии и потребление липидов. Используя скрининг малых молекул, авторы идентифицировали iD1 — ингибитор деаденилазы CNOT6L, повышающий уровни гепатокинов GDF15 и FGF21, что значительно уменьшало проявления метаболического синдрома [90, 91].
Терапевтическая индукция ангиогенеза направлена на образование новых кровеносных сосудов в ишемизированных тканях путем таргетной доставки ангиогенных факторов и представляет собой многообещающий подход к лечению пациентов с классическими заболеваниями, ассоциированными с ишемией: инфаркт миокарда, сердечная недостаточность, нарушение мозгового кровообращения, СД2. Ожирение также характеризуется нарушением ангиогенеза в жировой ткани, что вносит весомый вклад в развитие инсулинорезистентности. Идентификация семейства факторов роста эндотелия сосудов (VEGF) как мощных медиаторов ангиогенеза предопределила необходимость проведения исследований человеческих рекомбинантных белков и генной терапии на основе VEGF, при этом наиболее распространенная изоформа VEGF-A, состоящая из 165 аминокислот (VEGF-A165), была признана наиболее перспективным кандидатом для разработки лекарственных средств. L.M. Gan и соавт. (2019 г.) опубликовали результаты первого применения модифицированной мРНК, кодирующей фактор роста эндотелия сосудов А (VEGF-A), у человека. Пациенты с СД2 получали внутрикожные инъекции модифицированной мРНК VEGF-A либо плацебо с буферным раствором в рандомизированных участках на предплечье. Единственными нежелательными явлениями, связанными с лечением, были легкие реакции в месте инъекции. Через 4–24 часа после введения мРНК VEGF-A при проведении микродиализа кожи выявлено повышение уровня белка VEGF-A на участках, обработанных мРНК, по сравнению с участками, обработанными плацебо. Усиление базального кровотока в коже через 4 часа и 7 дней после введения было подтверждено с помощью лазерной допплеровской флюксиметрии и визуализации. Таким образом, препараты на основе мРНК VEGF-A обладают терапевтическим потенциалом в отношении регенеративного ангиогенеза [92].
ЗАКЛЮЧЕНИЕ
Ожирение — хроническое мультифакторное заболевание, сопряженное с высоким кардиометаболическим риском. В настоящее время насчитывается порядка 220 заболеваний и неблагоприятных состояний, ассоциированных с ожирением [17]. Рост эпидемии ожирения явился триггером для совершенствования и кардинального обновления существующего арсенала методов лечения [6][93][94]. В последние годы успешно разрабатываются отечественные препараты на основе эффектов ГПП-1. В частности, на российский рынок вышел препарат Велгия® («Промомед»), содержащий семаглутид в дозе 2,4 мг. Учитывая описанные выше преимущества семаглутида, его применение в клинической практике будет способствовать изменению парадигмы терапии пациентов с избыточной массой тела и ожирением.
Бариатрические операции, метаболическая хирургия обладают гораздо более высокой эффективностью (снижение веса превышает 25%), но сопряжены с широким спектром негативных последствий. Выраженность снижения массы тела на фоне различных методов лечения имеет существенное прогностическое значение. В частности, потеря веса, необходимая для профилактики СД2, составляет от 7 до 10%; снижение массы тела на 10–15% требуется для снижения риска других сопутствующих заболеваний, таких как синдром ночного апноэ либо МАЖБП [6]. Соответственно, потенциал новых препаратов необходимо оценивать по этим контрольным значениям потери массы тела, а также по показателям долгосрочного мониторинга безопасности. Достижения в области изучения механизмов регуляции массы тела и индивидуальных особенностей пациента будут являться базисом для разработки эффективных инновационных лекарственных средств и скорейшему внедрению персонализированного подхода к лечению ожирения и СД2.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено при финансовом обеспечении компании ООО «ПРОМОМЕД ДМ». Спонсор не оказывал влияние на выбор исследований, анализ и интерпретацию данных.
Конфликт интересов. Романцова Т.И. — научный редактор журнала «Ожирение и метаболизм».
Профессор Романцова Т.И. входит в состав экспертных советов и консультативных комитетов по препаратам Саксенда®, Редуксин®, Редуксин Форте®, Веглия®, Энлигрия®; читает лекции от компаний «Ново Нордиск», «ПРОМОМЕД ДМ»; принимала участие в наблюдательных программах и клинических исследованиях, поддерживаемых компанией ООО «ПРОМОМЕД ДМ».
Участие авторов. Романцова Т.И. — анализ литературных данных, написание статьи.
Список литературы
1. NCD Risk Factor Collaboration (NCD-RisC) Worldwide trends in underweight and obesity from 1990 to 2022: A pooled analysis of 3663 population-representative studies with 222 million children, adolescents, and adults. Lancet. 2024;403:1027–1050. doi: 10.1016/S0140-6736(23)02750-2.
2. GBD 2021 Diabetes Collaborators. Global, regional, and national burden of diabetes from 1990 to 2021, with projections of prevalence to 2050: a systematic analysis for the Global Burden of Disease Study 2021. Lancet. 2023 Jul 15;402(10397):203-234. doi: 10.1016/S0140-6736(23)01301-6.
3. Sztanek F, Tóth LI, Pető A, et al. New Developments in Pharmacological Treatment of Obesity and Type 2 Diabetes-Beyond and within GLP-1 Receptor Agonists. Biomedicines. 2024 Jun 13;12(6):1320. doi: 10.3390/biomedicines12061320.
4. Lingvay I., Sumithran P., Cohen R.V., le Roux C.W. Obesity management as a primary treatment goal for type 2 diabetes: Time to reframe the conversation. Lancet. 2022; 399:394–405. doi: 10.1016/S0140-6736(21)01919-X.
5. Coutinho W, Halpern B. Pharmacotherapy for obesity: moving towards efficacy improvement. Diabetol Metab Syndr. 2024 Jan 3;16(1):6. doi: 10.1186/s13098-023-01233-4.
6. Angelidi AM, Belanger MJ, Kokkinos A, Koliaki CC, Mantzoros CS. Novel Noninvasive Approaches to the Treatment of Obesity: From Pharmacotherapy to Gene Therapy. Endocr Rev. 2022 May 12;43(3):507-557. doi: 10.1210/endrev/bnab034.
7. Barman P, Joshi S, Sharma S, et al. Strategic Approaches to Improvise Peptide Drugs as Next Generation Therapeutics. Int J Pept Res Ther. 2023;29(4):61. doi: 10.1007/s10989-023-10524-3.
8. Kumar MS. Peptides and Peptidomimetics as Potential Antiobesity Agents: Overview of Current Status. Front Nutr. 2019 Feb 18; 6:11. doi: 10.3389/fnut.2019.00011.
9. Bailey CJ, Flatt PR, Conlon JM. An update on peptide-based therapies for type 2 diabetes and obesity. Peptides. 2023 Mar; 161:170939. doi: 10.1016/j.peptides.2023.170939.
10. Andreasen CR, Andersen A, Vilsbøll T. The future of incretins in the treatment of obesity and non-alcoholic fatty liver disease. Diabetologia. 2023 Oct;66(10):1846-1858. doi: 10.1007/s00125-023-05966-9.
11. Aroda VR, Aberle J, Bardtrum L, et al. Efficacy and safety of once-daily oral semaglutide 25 mg and 50 mg compared with 14 mg in adults with type 2 diabetes (PIONEER PLUS): a multicentre, randomised, phase 3b trial. Lancet Lond Engl. 2023; 402:693–704. doi: 10.1016/S0140-6736(23)01127-3
12. Drucker DJ. Efficacy and Safety of GLP-1 Medicines for Type 2 Diabetes and Obesity. Diabetes Care. 2024 Jun 6:dci240003. doi: 10.2337/dci24-0003.
13. Kim KM, Gautron L, Godschall E, et al. GLP-1 increases preingestive satiation via hypothalamic circuits in mice and humans. Science. 2024 Jul 26;385(6707):438-446. doi: 10.1126/science.adj2537.
14. Gabery S, Salinas CG, Paulsen SJ, et al. Semaglutide lowers body weight in rodents via distributed neural pathways. JCI Insight. 2020 Mar 26;5(6):e133429. doi: 10.1172/jci.insight.133429.
15. Drucker DJ. The benefits of GLP-1 drugs beyond obesity. Science. 2024 Jul 19;385(6706):258-260. doi: 10.1126/science.adn4128.
16. Zhang Q, Delessa CT, Augustin R, et al. The glucose-dependent insulinotropic polypeptide (GIP) regulates body weight and food intake via CNS-GIPR signaling. Cell Metab. 2021 Apr 6;33(4):833-844.e5. doi: 10.1016/j.cmet.2021.01.015.
17. Le Roux C, Mondoh A. Treatment of obesity with medications binding the glucagon-like peptide 1 receptor: what is the current state of play? Expert Opin Pharmacother. 2024 Feb;25(2):131-138. doi: 10.1080/14656566.2024.2311731.
18. Melson E, Ashraf U, Papamargaritis D, Davies MJ. What is the pipeline for future medications for obesity? Int J Obes (Lond). 2024 Feb 1. doi: 10.1038/s41366-024-01473-y.
19. Melson E, Miras AD, Papamargaritis D. Future therapies for obesity. Clin Med (Lond). 2023 Jul;23(4):337-346. doi: 10.7861/clinmed.2023-0144.
20. Müller TD, Blüher M, Tschöp MH, DiMarchi RD. Anti-obesity drug discovery: advances and challenges. Nat Rev Drug Discov. 2022 Mar;21(3):201-223. doi: 10.1038/s41573-021-00337-8.
21. Gogineni P, Melson E, Papamargaritis D, Davies M. Oral glucagon-like peptide-1 receptor agonists and combinations of entero-pancreatic hormones as treatments for adults with type 2 diabetes: where are we now? Expert Opin Pharmacother. 2024 May;25(7):801-818. doi: 10.1080/14656566.2024.2356254.
22. Li Y, Cheng Z, Lu W, et al. Efficacy of noiiglutide injection on body weight in obese Chinese adults without diabetes: A multicentre, randomized, double-blind, placebo-controlled, phase 2 trial. Diabetes Obes Metab. 2024 Mar;26(3):1057-1068. doi: 10.1111/dom.15407.
23. Guo W, Xu Z, Zou H, et al. Discovery of ecnoglutide - A novel, long-acting, cAMP-biased glucagon-like peptide-1 (GLP-1) analog. Mol Metab. 2023 Sep;75:101762. doi: 10.1016/j.molmet.2023.101762.
24. Saxena AR, Gorman DN, Esquejo RM, et al. Danuglipron (PF-06882961) in type 2 diabetes: a randomized, placebo-controlled, multiple ascending-dose phase 1 trial. Nat Med 2021; 27:1079–87. doi: 10.1038/s41591-021-01391-w.
25. Fatima H, Rangwala HS, Mustafa MS, et al. Evaluating Glycemic Control Efficacy and Safety of the Oral Small Molecule Glucagon-Like Peptide 1 Receptor Agonist Danuglipron in Type 2 Diabetes Patients: A Systemic Review and Meta-Analysis. Diabetes Metab Syndr Obes. 2023 Nov 7;16:3567-3578. doi: 10.2147/DMSO.S439587.
26. Wharton S, Blevins T, Connery L, et al. Daily Oral GLP-1 Receptor Agonist Orforglipron for Adults with Obesity. N Engl J Med. 2023 Sep 7;389(10):877-888. doi: 10.1056/NEJMoa2302392.
27. Mao T, Meng Q, Zhang H. et al., Discovery of GSBR-1290, a Highly Potent, Orally Available, Novel Small Molecule GLP-1 Receptor Agonist. Diabetes 20 June 2023; 72 (Supplement_1): 760–P. doi.org/10.2337/db23-760-P.
28. Evaluation of the pharmacokinetics, pharmacodynamics, safety, and tolerability of VCT220 tablets in Chinese adult overweight/obese subjects: a 4-week randomized, double-blind, placebo-controlled phase Ib study. https://Clinicaltrial.gov/study/CTR20231482.
29. Ansari S, Khoo B, Tan T. Targeting the incretin system in obesity and type 2 diabetes mellitus. Nat Rev Endocrinol. 2024 Aug;20(8):447-459. doi: 10.1038/s41574-024-00979-9.
30. Son JW, Lim S. Glucagon-Like Peptide-1 Based Therapies: A New Horizon in Obesity Management. Endocrinol Metab (Seoul). 2024 Apr;39(2):206-221. doi: 10.3803/EnM.2024.1940.
31. Phase 2 Study of CT-868, a Novel Dual GLP-1/GIP Receptor Modulator, in Overweight/Obese T2D Adults. Obesity Week, 2023, Poster-530: October 17.
32. Chakravarthy M, Hernandez M, Elliot M. et al. Weight-Independent Effects of CT-868, a Signaling Biased Dual GLP-1/GIP Receptor Modulator, on Glucose Homeostasis in Overweight and Obese Adults with Type 2 Diabetes. Diabetes 20 June 2023; 72 (Supplement_1): 774–P. doi.org/10.2337/db23-774-P.
33. Killion EA, Lu SC, Fort M, et al. Glucose-Dependent Insulinotropic Polypeptide Receptor Therapies for the Treatment of Obesity, Do Agonists = Antagonists? Endocr Rev. 2020 Jan 1;41(1): bnz002. doi: 10.1210/endrev/bnz002.
34. Greenhill C. Phase I results for AMG 133. Nat Rev Endocrinol. 20, 193 (2024). doi.org/10.1038/s41574-024-00967-z.
35. Dehestani B, Stratford NR, le Roux CW. Amylin as a Future Obesity Treatment. J Obes Metab Syndr. 2021 Dec 30;30(4):320-325. doi: 10.7570/jomes21071.
36. Lau DCW, Erichsen L, Francisco AM, et al. Once-weekly cagrilintide for weight management in people with overweight and obesity: a multicentre, randomised, double-blind, placebo-controlled and active-controlled, dose-finding phase 2 trial. Lancet. 2021 Dec 11;398(10317):2160-2172. doi: 10.1016/S0140-6736(21)01751-7.
37. Enebo LB, Berthelsen KK, Kankam M, et al. Safety, tolerability, pharmacokinetics, and pharmacodynamics of concomitant administration of multiple doses of cagrilintide with semaglutide 2•4 mg for weight management: a randomised, controlled, phase 1b trial. Lancet. 2021 May 8;397(10286):1736-1748. doi: 10.1016/S0140-6736(21)00845-X.
38. Frias JP, Deenadayalan S, Erichsen L, et al. Efficacy and safety of co-administered once-weekly cagrilintide 2•4 mg with once-weekly semaglutide 2•4 mg in type 2 diabetes: a multicentre, randomised, double-blind, active-controlled, phase 2 trial. Lancet Lond Engl. 2023; 402:720–730. doi: 10.1016/S0140-6736(23)01163-7
39. Mathiesen DS, Lund A, Vilsbøll T, et al. Amylin and Calcitonin: Potential Therapeutic Strategies to Reduce Body Weight and Liver Fat. Front Endocrinol (Lausanne). 2021 Jan 8; 11:617400. doi: 10.3389/fendo.2020.617400.
40. Sonne N, Larsen AT, Karsdal MA, Henriksen K. The Impact of Exposure Profile on the Efficacy of Dual Amylin and Calcitonin Receptor Agonist Therapy. Biomedicines. 2022 Sep 22;10(10):2365. doi: 10.3390/biomedicines10102365.
41. Eržen S, Tonin G, Jurišić Eržen D, Klen J. Amylin, Another Important Neuroendocrine Hormone for the Treatment of Diabesity. Int J Mol Sci. 2024 Jan 26;25(3):1517. doi: 10.3390/ijms25031517.
42. Lau DCW, Erichsen L, Francisco AM, et al. Once-weekly cagrilintide for weight management in people with overweight and obesity: a multicentre, randomised, double-blind, placebo-controlled and active-controlled, dose-finding phase 2 trial. Lancet. 2021 Dec 11;398(10317):2160-2172. doi: 10.1016/S0140-6736(21)01751-7.
43. Enebo LB, Berthelsen KK, Kankam M, et al. Safety, tolerability, pharmacokinetics, and pharmacodynamics of concomitant administration of multiple doses of cagrilintide with semaglutide 2•4 mg for weight management: a randomised, controlled, phase 1b trial. Lancet. 2021 May 8;397(10286):1736-1748. doi: 10.1016/S0140-6736(21)00845-X.
44. Di Prospero NA, Yee J, Frustaci ME, et al. Efficacy and safety of glucagon-like peptide-1/glucagon receptor co-agonist JNJ-64565111 in individuals with type 2 diabetes mellitus and obesity: A randomized dose-ranging study. Clin Obes. 2021 Apr;11(2):e12433. doi: 10.1111/cob.12433.
45. Alba M, Yee J, Frustaci ME, Samtani MN, Fleck P. Efficacy and safety of glucagon-like peptide-1/glucagon receptor co-agonist JNJ-64565111 in individuals with obesity without type 2 diabetes mellitus: A randomized dose-ranging study. Clin Obes. 2021 Apr;11(2):e12432. doi: 10.1111/cob.12432.
46. Nahra R, Wang T, Gadde KM, et al. Effects of Cotadutide on Metabolic and Hepatic Parameters in Adults With Overweight or Obesity and Type 2 Diabetes: A 54-Week Randomized Phase 2b Study. Diabetes Care. 2021 Jun;44(6):1433-1442. doi: 10.2337/dc20-2151.
47. Ambery P, Parker VE, Stumvoll M, et al. MEDI0382, a GLP-1 and glucagon receptor dual agonist, in obese or overweight patients with type 2 diabetes: a randomised, controlled, double-blind, ascending dose and phase 2a study. Lancet. 2018 Jun 30;391(10140):2607-2618. doi: 10.1016/S0140-6736(18)30726-8.
48. Harrison SA, Browne SK, Suschak JJ, et al. Effect of pemvidutide, a GLP-1/glucagon dual receptor agonist, on MASLD: A randomized, double-blind, placebo-controlled study. J Hepatol. 2024 Jul 11:S0168-8278(24)02362-6. doi: 10.1016/j.jhep.2024.07.006.
49. Blüher M, Rosenstock J, Hoefler J, et al. Dose-response effects on HbA1c and bodyweight reduction of survodutide, a dual glucagon/GLP-1 receptor agonist, compared with placebo and open-label semaglutide in people with type 2 diabetes: a randomised clinical trial. Diabetologia. 2024 Apr;67(4):758. doi: 10.1007/s00125-024-06095-7.
50. Zhihong Y, Chen W, Qianqian Z, et al. Emerging roles of oxyntomodulin-based glucagon-like peptide-1/glucagon co-agonist analogs in diabetes and obesity. Peptides. 2023 Apr;162:170955. doi: 10.1016/j.peptides.2023.170955.
51. Ji L, Jiang H, Cheng Z,et al. A phase 2 randomised controlled trial of mazdutide in Chinese overweight adults or adults with obesity. Nat Commun. 2023 Dec 14;14(1):8289. doi: 10.1038/s41467-023-44067-4.
52. Blüher M, Aras M, Aronne LJ, et al. New insights into the treatment of obesity. Diabetes Obes Metab. 2023 Aug;25(8):2058-2072. doi: 10.1111/dom.15077.
53. Nalisa DL, Cuboia N, Dyab E, Jackson IL, Felix HJ, Shoki P, Mubiana M, Oyedeji-Amusa M, Azevedo L, Jiang H. Efficacy and safety of Mazdutide on weight loss among diabetic and non-diabetic patients: a systematic review and meta-analysis of randomized controlled trials. Front Endocrinol (Lausanne). 2024 Feb 14;15:1309118. doi: 10.3389/fendo.2024.1309118.
54. Coskun T, Urva S, Roell WC, et al. LY3437943, a novel triple glucagon, GIP, and GLP-1 receptor agonist for glycemic control and weight loss: From discovery to clinical proof of concept. Cell Metab. 2022 Sep 6;34(9):1234-1247.e9. doi: 10.1016/j.cmet.2022.07.013.
55. Jakubowska A, Roux CWL, Viljoen A. The Road towards Triple Agonists: Glucagon-Like Peptide 1, Glucose-Dependent Insulinotropic Polypeptide and Glucagon Receptor - An Update. Endocrinol Metab (Seoul). 2024 Feb;39(1):12-22. doi: 10.3803/EnM.2024.1942.
56. Knerr PJ, Mowery SA, Douros JD, et al. Next generation GLP-1/GIP/glucagon triple agonists normalize body weight in obese mice. Mol Metab. 2022 Sep;63:101533. doi: 10.1016/j.molmet.2022.101533.
57. Li, W., Zhou, Q., Cong, Z. et al. Structural insights into the triple agonism at GLP-1R, GIPR and GCGR manifested by retatrutide. Cell Discov 10, 77 (2024). doi.org/10.1038/s41421-024-00700-0.
58. Urva S, Coskun T, Loh MT, et al. LY3437943, a novel triple GIP, GLP-1, and glucagon receptor agonist in people with type 2 diabetes: a phase 1b, multicentre, double-blind, placebo-controlled, randomised, multiple-ascending dose trial. Lancet. 2022 Nov 26;400(10366):1869-1881. doi: 10.1016/S0140-6736(22)02033-5.
59. Jastreboff AM, Kaplan LM, Frías JP, et al. Retatrutide Phase 2 Obesity Trial Investigators. Triple-Hormone-Receptor Agonist Retatrutide for Obesity - A Phase 2 Trial. N Engl J Med. 2023 Aug 10;389(6):514-526. doi: 10.1056/NEJMoa2301972.
60. Hale C, Véniant MM. Growth differentiation factor 15 as a potential therapeutic for treating obesity. Mol Metab. 2021 Apr;46:101117. doi: 10.1016/j.molmet.2020.101117.
61. Borner T, Wald HS, Ghidewon MY, et al. GDF15 Induces an Aversive Visceral Malaise State that Drives Anorexia and Weight Loss. Cell Rep. 2020 Apr 21;31(3):107543. doi: 10.1016/j.celrep.2020.107543.
62. Guida C, Ramracheya R. PYY, a Therapeutic Option for Type 2 Diabetes? Clin Med Insights Endocrinol Diabetes. 2020 Jan 22;13:1179551419892985. doi: 10.1177/1179551419892985.
63. Gaich G, Chien JY, Fu H, Glass LC, Deeg MA, Holland WL, Kharitonenkov A, Bumol T, Schilske HK, Moller DE. The effects of LY2405319, an FGF21 analog, in obese human subjects with type 2 diabetes. Cell Metab. 2013 Sep 3;18(3):333-40. doi: 10.1016/j.cmet.2013.08.005.
64. Zhang C, Gao G, Li Y, Ying J, Li J, Hu S. Design of a Dual Agonist of Exendin-4 and FGF21 as a Potential Treatment for Type 2 Diabetes Mellitus and Obesity. Iran J Pharm Res. 2023 Aug 9;22(1):e131015. doi: 10.5812/ijpr-131015.
65. Carbonetti MP, Almeida-Oliveira F, Majerowicz D. Use of FGF21 analogs for the treatment of metabolic disorders: a systematic review and meta-analysis. Arch Endocrinol Metab. 2023 Nov 10;68:e220493. doi: 10.20945/2359-4292-2022-0493.
66. Castelli MS, McGonigle P, Hornby PJ. The pharmacology and therapeutic applications of monoclonal antibodies. Pharmacol Res Perspect. 2019 Dec;7(6):e00535. doi: 10.1002/prp2.535.
67. Makowski EK, Schardt JS, Tessier PM. Improving antibody drug development using bionanotechnology. Curr Opin Biotechnol. 2022 Apr;74:137-145. doi: 10.1016/j.copbio.2021.10.027.
68. Авдеева, Ж. И., Алпатова, Н. А., Солдатов, А. А., и соавт. Безопасность лекарственных препаратов моноклональных антител, связанная с проявлением их иммуногенности. Иммунология, 2015; 36(4), 247-256.
69. Афанасьева О.И., Ежов М.В., Покровский С.Н. Антисмысловые олигонуклеотиды и терапевтические моноклональные антитела как основа для создания новых поколений биологических липидснижающих препаратов. Российский кардиологический журнал. 2018;(8):99-109. doi.org/10.15829/1560-4071-2018-8-99-109.
70. Akpan I, Goncalves MD, Dhir R, Yin X, Pistilli EE, Bogdanovich S, Khurana TS, Ucran J, Lachey J, Ahima RS. The effects of a soluble activin type IIB receptor on obesity and insulin sensitivity. Int J Obes (Lond). 2009 Nov;33(11):1265-73. doi: 10.1038/ijo.2009.162.
71. Garito T, Roubenoff R, Hompesch M, Morrow L, Gomez K, Rooks D, Meyers C, Buchsbaum MS, Neelakantham S, Swan T, Filosa LA, Laurent D, Petricoul O, Zakaria M. Bimagrumab improves body composition and insulin sensitivity in insulin-resistant individuals. Diabetes Obes Metab. 2018 Jan;20(1):94-102. doi: 10.1111/dom.13042.
72. Heymsfield SB, Coleman LA, Miller R, et al. Effect of Bimagrumab vs Placebo on Body Fat Mass Among Adults With Type 2 Diabetes and Obesity: A Phase 2 Randomized Clinical Trial. JAMA Netw Open. 2021 Jan 4;4(1):e2033457. doi: 10.1001/jamanetworkopen.2020.33457.
73. Bays HE, Fitch A, Christensen S, Burridge K, Tondt J. Anti-Obesity Medications and Investigational Agents: An Obesity Medicine Association (OMA) Clinical Practice Statement (CPS) 2022. Obes Pillars. 2022 Apr 15;2:100018. doi: 10.1016/j.obpill.2022.100018.
74. Petricoul O, Nazarian A, Schuehly U, Schramm U, David OJ, Laurent D, Praestgaard J, Roubenoff R, Papanicolaou DA, Rooks D. Pharmacokinetics and Pharmacodynamics of Bimagrumab (BYM338). Clin Pharmacokinet. 2023 Jan;62(1):141-155. doi: 10.1007/s40262-022-01189-0.
75. Bechtold C, Ansarullah, Brynczka C, Volkan g. et al. Taldefgrobep Alfa Improves Body Composition as Monotherapy and in Combination with Semaglutide in a DIO Mouse Model. Diabetes 14 June 2024; 73 (Supplement_1): 2053–LB. doi.org/10.2337/db24-2053-LB
76. Efficacy and Safety of Apitegromab for the Treatment of Adults Who Are Overweight or Obese (EMBRAZE). Clinicaltrial.gov/study/NCT06445075
77. Gewitz A, Mendell J, Wang Y, Harris C, Olenchock BA, Podgrabinska S, Zheng W, Zhao A, Pan H, Vanhoutte F, Davis JD. Pharmacokinetics and pharmacodynamics of mibavademab (a leptin receptor agonist): Results from a first-in-human phase I study. Clin Transl Sci. 2024 Apr;17(4):e13762. doi: 10.1111/cts.13762.
78. Osborn O, Brownell SE, Sanchez-Alavez M, Salomon D, Gram H, Bartfai T. Treatment with an Interleukin 1 beta antibody improves glycemic control in diet-induced obesity. Cytokine. 2008 Oct;44(1):141-8. doi: 10.1016/j.cyto.2008.07.004.
79. Baruch A, Wong C, Chinn LW, et al. Antibody-mediated activation of the FGFR1/Klothoβ complex corrects metabolic dysfunction and alters food preference in obese humans. Proc Natl Acad Sci U S A. 2020 Nov 17;117(46):28992-29000. doi: 10.1073/pnas.2012073117.
80. Miyawaki K, Yamada Y, Ban N, et al. Inhibition of gastric inhibitory polypeptide signaling prevents obesity. Nat Med. 2002 Jul;8(7):738-42. doi: 10.1038/nm727.
81. Boer GA, Keenan SN, Miotto PM, et al GIP receptor deletion in mice confers resistance to high-fat diet-induced obesity via alterations in energy expenditure and adipose tissue lipid metabolism. Am J Physiol Endocrinol Metab. 2021 Apr 1;320(4):E835-E845. doi: 10.1152/ajpendo.00646.2020.
82. Wolfe MM, Apovian CM, Boylan MO. Glucose-dependent insulinotropic polypeptide monoclonal antibodies prevent and treat obesity in wild-type and hyperphagic mice. Obesity (Silver Spring). 2023 Jun;31(6):1499-1504. doi: 10.1002/oby.23758.
83. Lu SC, Chen M, Atangan L, et al. GIPR antagonist antibodies conjugated to GLP-1 peptide are bispecific molecules that decrease weight in obese mice and monkeys. Cell Rep Med. 2021 Apr 30;2(5):100263. doi: 10.1016/j.xcrm.2021.100263.
84. Véniant MM, Lu SC, Atangan L, et al. GIPR antagonist conjugated to GLP-1 analogues promotes weight loss with improved metabolic parameters in preclinical and phase 1 settings. Nat Metab. 2024 Feb;6(2):290-303. doi: 10.1038/s42255-023-00966-w.
85. Su L-J, Ji Z-H, Xu M-X, et al. RNA-based nanomedicines and their clinical applications. Nano Research, 2023, 16(12): 13182-13204. https://doi.org/10.1007/s12274-023-6238-5.
86. Huang X, Kong N, Zhang X, Cao Y, Langer R, Tao W. The landscape of mRNA nanomedicine. Nat Med. 2022 Nov;28(11):2273-2287. doi: 10.1038/s41591-022-02061-1.
87. Guo, Y., Wan, Z., Zhao, P. et al. Ultrasound triggered topical delivery of Bmp7 mRNA for white fat browning induction via engineered smart exosomes. J Nanobiotechnol 19, 402 (2021). https://doi.org/10.1186/s12951-021-01145-3.
88. Huang X, Xia Z, Huang Y, et al. Combined therapy with pioglitazone and FGF21 mRNA synergistically ameliorates metabolic disorders in NAFLD rats. Heliyon. 2023 Apr 1;9(4):e15146. doi: 10.1016/j.heliyon.2023.e15146.
89. Bartesaghi S, Wallenius K, Hovdal D, et al. Subcutaneous delivery of FGF21 mRNA therapy reverses obesity, insulin resistance, and hepatic steatosis in diet-induced obese mice. Mol Ther Nucleic Acids. 2022 Apr 18;28:500-513. doi: 10.1016/j.omtn.2022.04.010. PMID: 35592498; PMCID: PMC9079007.
90. Katsumura S, Siddiqui N, Goldsmith MR et al. Deadenylase-dependent mRNA decay of GDF15 and FGF21 orchestrates food intake and energy expenditure. Cell Metab. 2022 Apr 5;34(4):564-580.e8. doi: 10.1016/j.cmet.2022.03.005.
91. Tsai VWW, Husaini Y, Sainsbury A, et al. The MIC-1/GDF15-GFRAL Pathway in Energy Homeostasis: Implications for Obesity, Cachexia, and Other Associated Diseases. Cell Metab. 2018 Sep 4;28(3):353-368. doi: 10.1016/j.cmet.2018.07.018. PMID: 30184485.
92. Gan LM, Lagerström-Fermér M, Carlsson LG, et al. Intradermal delivery of modified mRNA encoding VEGF-A in patients with type 2 diabetes. Nat Commun. 2019 Feb 20;10(1):871. doi: 10.1038/s41467-019-08852-4.
93. Khera R, Murad MH, Chandar AK, et al. Association of Pharmacological Treatments for Obesity With Weight Loss and Adverse Events: A Systematic Review and Meta-analysis. JAMA. 2016 Jun 14;315(22):2424-34. doi: 10.1001/jama.2016.7602.
94. Roomy MA, Hussain K, Behbehani HM, et al. Therapeutic advances in obesity management: an overview of the therapeutic interventions. Front Endocrinol (Lausanne). 2024 Apr 23;15:1364503. doi: 10.3389/fendo.2024.1364503.
Об авторе
Т. И. РоманцоваРоссия
Романцова Татьяна Ивановна, д.м.н., профессор
125993, Москва, Баррикадная улица, 2/1, стр. 1
Дополнительные файлы
|
|
1. Рисунок 1. Современные технологии и мишени новых препаратов для лечения ожирения и сахарного диабета 2 типа (адаптировано из работы A.M. Angelidi и соавт., 2022) [6]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(722KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Cнижение массы тела на фоне различных методов лечения ожирения (адаптировано из работы E. Melson и соавт., 2023) [19]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(339KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Зарегистрированные и исследуемые препараты на основе эффектов энтеропанкреатических гормонов (адаптировано из работы P. Gogineni и соавт., 2024) [21]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(567KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Современные направления исследований препаратов, основанных на комбинации эффектов глюкагоноподобного пептида-1 с другими гормонами желудочно-кишечного тракта (адаптировано из работы E. Melson и соавт., 2023) [19]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(796KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Применение биспецифических антител АbГИПр-Ab/ГПП-1р (антагонизм с рецепторами глюкозозависимого инсулинотропного полипептида (ГИПр) и агонизм с рецепторами глюкагоноподобного пептида-1 (ГПП-1р)) путем активации циклического аденозинмонофосфата (цАМФ) способствует снижению массы тела и улучшению метаболических показателей (адаптировано из работы S.C. Lu и соавт., 2021 г.) [83]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(814KB)
|
Метаданные ▾ | |
|
|
6. Рисунок 6. Виды и области применения наномедицины на основе РНК-технологий (адаптировано из работы L-J Su и соавт., 2023 г.) [85]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(752KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Романцова Т.И. Инновационные подходы к лечению ожирения: от фармакотерапии к наномедицине. Ожирение и метаболизм. 2024;21(4):389-404. https://doi.org/10.14341/omet13184
For citation:
Romantsova T.I. Innovative approaches to the treatment of obesity: from pharmacotherapy to nanomedicine. Obesity and metabolism. 2024;21(4):389-404. (In Russ.) https://doi.org/10.14341/omet13184

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































