Перейти к:
Метформин в терапии сахарного диабета 2 типа, отягощенного саркопеническим ожирением, у лиц пожилого возраста. Фокус на плейотропные эффекты
https://doi.org/10.14341/omet13180
Аннотация
Прогрессирующее снижение мышечной силы и массы тела в сочетании с избытком жировой ткани в организме встречается преимущественно в старшей возрастной группе и является одним из основных признаков старения. Саркопения способствует прогрессированию многих хронических заболеваний, одним из которых является сахарный диабет 2 типа (СД2). Распространенность СД2 среди лиц пожилого возраста за последние годы резко возросла вслед за увеличением числа стареющего населения, при этом саркопения встречается значительно чаще у пациентов с СД2 и зарегистрирована как его новое осложнение.
Основываясь на огромном количестве исследований, доказывающих положительное влияние на скелетные мышцы, исходы сердечно-сосудистых заболеваний, риск развития злокачественных новообразований и увеличение продолжительности жизни, метформин был предложен в качестве потенциального антивозрастного препарата. Терапия метформином может способствовать профилактике возрастной саркопении путем регуляции липидного обмена в скелетных мышцах, а именно благодаря усилению липолиза и снижению воспалительных реакций за счет активации АМФК — 5’-аденозин-монофосфат-активируемой протеинкиназы. Исследования, проведенные с целью оценки эффективности использования метформина у лиц с саркопенией, подтверждают его положительное влияние на мышечную силу и позволяют рассматривать его для лечения саркопении.
Ключевые слова
Для цитирования:
Трошина Е.А., Богданова В.О., Умархаджиева З.Р. Метформин в терапии сахарного диабета 2 типа, отягощенного саркопеническим ожирением, у лиц пожилого возраста. Фокус на плейотропные эффекты. Ожирение и метаболизм. 2025;22(1):35-40. https://doi.org/10.14341/omet13180
For citation:
Troshina E.A., Bogdanova V.O., Umarkhadzhieva Z.R. Metformin in the therapy of type 2 diabetes mellitus bur dened by sarcopenic obesity in the elderly. Focus on pleiotropic effects. Obesity and metabolism. 2025;22(1):35-40. (In Russ.) https://doi.org/10.14341/omet13180
Сахарный диабет 2 типа (СД2) является одним из самых распространенных эндокринных заболеваний. Количество пожилых пациентов с СД2 в последние годы резко возросло. Общая численность пациентов с СД2 в Российской Федерации, состоящих на диспансерном учете на 01.01.2023 г., по данным регистра, составила 4 581 990 человек [1]. По прогнозам, к 2035 г. число пациентов с СД2 во всем мире увеличится до 592 миллионов, а более 50% больных СД2 будут страдать ожирением [2]. Помимо микро- и макрососудистых осложнений, у пожилых пациентов с СД2 наблюдаются сопутствующие хронические заболевания, старческая астения и другие гериатрические синдромы. Саркопения зарегистрирована как новое осложнение у таких пациентов [3][4]. По результатам недавних метаанализов, распространенность саркопении в 2–3 раза выше среди пациентов с СД2, чем среди пациентов без диабета [5][6].
Саркопения (от греч. sarx — тело, penia — снижение) — прогрессирующее генерализованное заболевание скелетной мускулатуры, ассоциированное с повышением риска таких неблагоприятных исходов, как падения, переломы и инвалидизация. В гериатрии под этим термином понимают состояние, характеризующееся прогрессирующей генерализованной потерей силы, массы и функции скелетных мышц вследствие старения в отсутствие других причин [7]. С 50 лет начинается прогрессирующее снижение мышечной массы тела на 1–2% ежегодно [8]. Метаанализ 151 исследования, включавший в общей сложности 692 056 человек со средним возрастом 68,5 года, показал, что распространенность саркопении среди лиц старше 60 лет варьирует от 10 до 27% [9]. Согласно исследованиям, саркопения увеличивает риск смертности [10].
Саркопеническое ожирение (СО) является более тяжелым состоянием. Оно определяется как функциональное и клиническое состояние, характеризующееся сосуществованием потери массы и функции скелетных мышц и избытка жировой ткани. По оценкам, в связи с быстрым ростом численности пожилого населения во всем мире в период с 2016 по 2051 гг. СО затронет 100–200 млн человек [9]. Около 30% населения в мире страдают от избыточного веса. За последние несколько десятилетий ожирение достигло масштабов пандемии. С 1980 г. распространенность избыточного веса и ожирения во всем мире увеличилась более чем в два раза у обоих полов во всех возрастных группах, однако рост пропорционально выше у пожилых людей и женщин [11]. Ожирение стало главным фактором риска преждевременной смерти, связанной с образом жизни, сместив курение, и привело к увеличению расходов на здравоохранение на 30% [12]. Сочетание саркопении и ожирения может повысить риск развития остеопороза. Однако прямые исследования связи между СО и остеопорозом ограничены [13]. Метаанализ с участием около 200 тысяч человек в возрасте 65 лет и старше показал, что индекс массы тела (ИМТ) ниже 23 кг/м² и выше 33 кг/м² связан с повышенным риском смертности, что может указывать на U-образную кривую ИМТ для смертности. Возможное объяснение этого «парадокса ожирения» заключается в том, что ИМТ не учитывает состав тела, включая разницу между мышечной и жировой массой. Высокий риск смертности ассоциирован с избыточной жировой массой и отрицательно коррелирует с мышечной массой [14].
Несмотря на всю серьезность СО, до сих пор не установлен единый диагностический критерий. Следовательно, эпидемиологическая оценка СО остается неточной, и его распространенность варьирует в зависимости от используемого определения. Южнокорейское исследование СО, проведенное на здоровых добровольцах в возрасте 20-80 лет, показало, что распространенность СО варьирует от 0,8 до 22,3% у женщин и от 1,3 до 15,4% у мужчин [15]. Согласно исследованию Dutch Lifelines, распространенность СО в возрастной категории от 18 до 90 лет составляет 1,4 и 0,9% среди женщин и мужчин соответственно. В этом же исследовании показано, что с 50 лет начинается прогрессивное увеличение числа пациентов с саркопенией, достигающее 16,7% в возрастной группе 80–89 лет [16]. Метаанализ, включающий 50 исследований с участием 86 285 человек, показал, что распространенность СО среди взрослых в возрасте 60 лет составляет 11% [17].
Ускоренная потеря мышечной массы и силы значительно чаще встречается у пациентов с СД2. Причиной тому служит хроническое гипергликемическое состояние, которое ведет к снижению секреции инсулина и повышению инсулинорезистентности, что способствует развитию саркопении [18]. Метформин, являясь одним из наиболее распространенных препаратов, используемых во всем мире уже более 60 лет, признан препаратом первой линии для лечения СД2, сахароснижающий эффект которого осуществляется благодаря ингибированию печеночного глюконеогенеза и гликогенолиза, улучшению чувствительности периферических тканей к инсулину и активации синтеза гликогена. Вместе с тем обнаружено антионкогенное, противовирусное и антивозрастное действие метформина [19].
ИНСУЛИНОРЕЗИСТЕНТНОСТЬ В ОСНОВЕ РАЗВИТИЯ САРКОПЕНИЧЕСКОГО ОЖИРЕНИЯ
СО у пожилых людей является сложным и многофакторным заболеванием. Саркопения и ожирение — два состояния в основе которых имеются общие патофизиологические особенности и факторы риска развития, такие как низкая физическая активность, пожилой возраст, неправильное питание, дефицит витамина D, снижение уровня андрогенов, эстрогенов и гормона роста (рис. 1) [20].
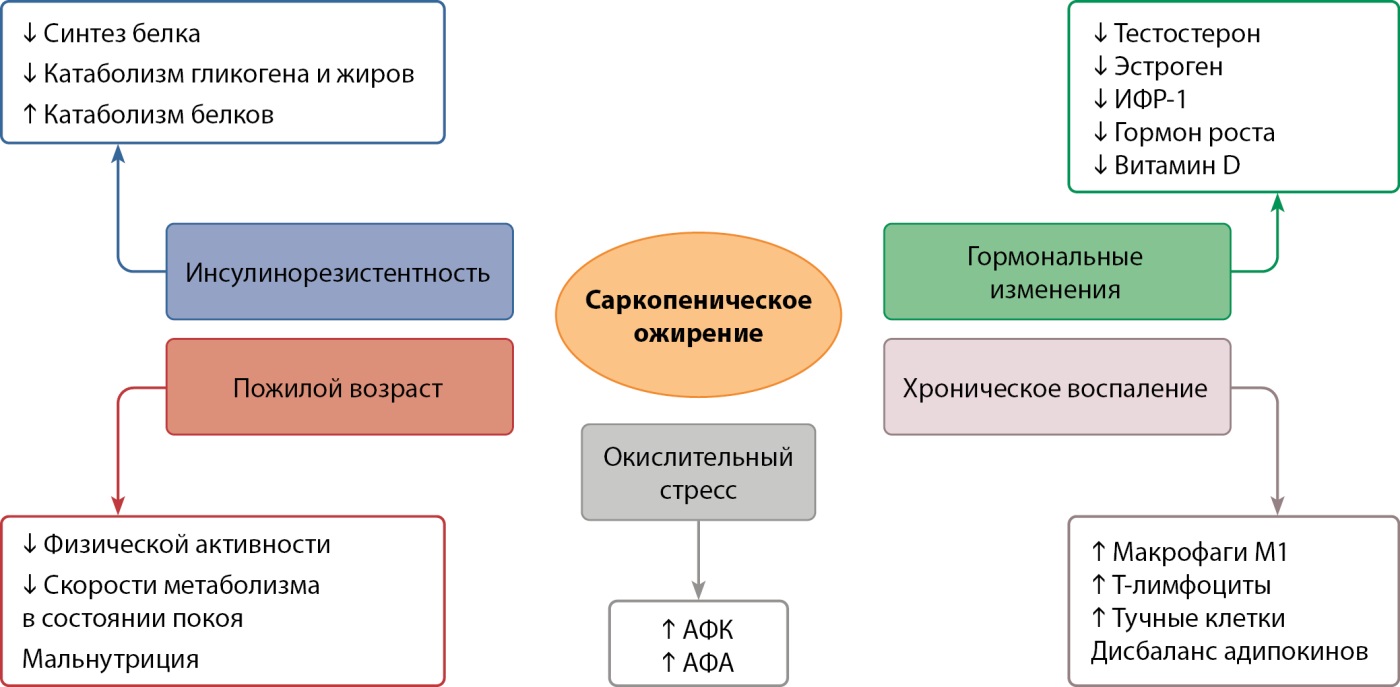
Рисунок 1. Факторы риска и основные звенья развития саркопенического ожирения.
Адаптировано из [20].
Инсулинорезистентность, хроническое воспаление и окислительный стресс признаны ключевыми звеньями в патогенезе развития СО. Резистентность к инсулину является одним из основных признаков старения и ожирения. С возрастом наблюдается увеличение преимущественно висцеральной жировой массы [21][22]. Избыточное поступление свободных жирных кислот в кровоток при ожирении способствует их накоплению в разных тканях организма, в том числе не предназначенных для их метаболизма. Отложение липидов и их метаболитов в мышечной ткани называется миостеатоз и характеризуется снижением мышечной массы и потерей мышечной силы. Миостеатоз и стеатоз печени запускают механизмы инсулинорезистентности путем ингибирования транслокации GLUT-4 через нарушение передачи сигналов инсулина при участии диацилглицерина, церамида и ацилкоэнзима А. В результате снижается утилизация глюкозы скелетными мышцами. Помимо этого, высокая концентрация свободных жирных кислот обладает липотоксическим эффектом, приводя к апоптозу и снижению пролиферации β-клеток поджелудочной железы [23, 24].
Было предложено несколько механизмов, объясняющих взаимосвязь между резистентностью к инсулину и утратой мышечной массы и силы. Одним из таких связующих факторов является регулятор синтеза белка mTORC1, активность которого контролируется инсулином. Белковый комплекс mTORC1 играет центральную роль в контроле мышечной массы. В исследованиях показано, что делеция mTORC1 приводит к выраженной атрофии мышц у мышей. Известно также, что наблюдаемое при ежедневном приеме 10 г незаменимых аминокислот 60%-ное усиление синтеза белка отсутствует при их совместном приеме с ингибиторами mTORC1. Что подтверждает тот факт, что mTORC1 является одним из ключевых факторов регуляции синтеза белка. Инсулин и аминокислоты, действуя синергетически, увеличивают мышечную массу. На молекулярном уровне инсулин подавляет ингибирующее действие комплекса TSC на mTORC1, способствуя активации АКТ, в то время как аминокислоты напрямую активируют mTORC1 [25][26]. Другим фактором, связывающим инсулинорезистентность и саркопению, является регулятор синтеза белка FoxO. Транскрипционные факторы семейства FoxO регулируют катаболизм белков путем активации протеолитической системы. На фоне инсулинорезистентности происходит деградация белка через каспазу-3 и убиквитин-протеасомный протеолитический путь, приводя к саркопении [27].
Хроническое воспаление, развивающееся при ожирении и старении, обладает многочисленными неблагоприятными свойствами в отношении скелетной мышечной ткани. Избыток жировой массы способствует секреции провоспалительных цитокинов, которые приводят к накоплению воспалительных клеток, таких как макрофаги, Т-лимфоциты и тучные клетки, не только в жировой ткани, но и в мышечной. Макрофаги являются конечной стадией дифференцировки клеток моноцитарного ряда. Активированные макрофаги делятся на 2 фенотипа: М1 (классические, провоспалительный тип) и М2 (альтернативные, противовоспалительный тип). Макрофаги М2 секретируют противовоспалительные цитокины (IL-12low, IL-10high, TGF-β), способствуя подавлению воспаления. Макрофаги М1, напротив, инициируют воспаление, значительно повышая секрецию IL-6, TNF-α, IL-1β, IL-1 α, IL-12, IL-15, IL-18, IL-23 [28]. В условиях ожирения макрофаги изменяют свой фенотип с М2 на М1. Это приводит к местному воспалению и дисбалансу адипокинов (лептин, висфатин, кемерин, адипонектин и др.). Нарушение секреции адипокинов и их сигнальных путей напрямую связано с инсулинорезистентностью, дислипидемией, изменением белкового и углеводного гомеостаза. Цитокины, продуцируемые инфильтрирующими клетками, такими как макрофаги, могут вызывать атрофию мышечной ткани, индуцируя апоптоз и деградацию белка филамента [29]. Основными причинными факторами последовательной потери мышечной массы и высокой жировой массы являются снижение растворимых факторов, таких как адипонектин, и повышение таких факторов, как С-реактивный белок (СРБ), ФНО-α, ИЛ-6 и лептин [30].
Активные формы кислорода (АФК) и активные формы азота (АФА), образующиеся в результате клеточного метаболизма, участвуют в различных клеточных процессах. Их основная роль заключается в участии в дифференцировке и пролиферации клеток, иммунном ответе и метаболизме. Источники этих активных форм могут быть как эндогенными, так и экзогенными [31]. К эндогенным относятся никотинамидадениндинуклеотидфосфат восстановленный (НАДФН), оксидаза, липоксигеназа, миелопероксидаза (МПО), ксантиноксидаза и митохондрии. Экзогенными источниками являются табак, алкоголь, наркотические вещества и промышленные загрязнители [32]. Антиоксидантная система нейтрализует избыточно продуцируемые АФК и АФА, способствуя поддержанию гомеостаза. При нарушении баланса между оксидантами и антиоксидантами возникает окислительный стресс, что приводит к повреждению клеток и накоплению АФК и АФА. Окисление жирных кислот увеличивается в митохондриях, вызывая одновременное увеличение соотношения АТФ/АДФ и уменьшение цепи переноса электронов, что ухудшает окислительное фосфорилирование, тем самым способствуя выработке АФК, воспалению и в итоге к саркопении [33].
МЕТФОРМИН — АКТИВАТОР АМФК В БОРЬБЕ С САРКОПЕНИЕЙ
Основываясь на огромном количестве исследований, доказывающих положительное влияние на скелетные мышцы, исходы сердечно-сосудистых заболеваний, риск развития злокачественных новообразований и увеличение продолжительности жизни, метформин был предложен в качестве потенциального антивозрастного препарата [34]. Первостепенным механизмом, благодаря которому осуществляется антивозрастное действие метформина, является активация 5’-аденозин-монофосфат-активируемой протеинкиназы (АМФК). АМФК — клеточная протеинкиназа, которая представляет собой гетеротример из субъединиц альфа, бета и гамма. Ее основная функция — это контроль энергетического баланса клетки. Значительное потребление энергии клетки и увеличение внутриклеточного уровня АМФ активируют АМФК, в результате чего клетка переходит в энергосберегающее состояние. Наблюдается, что у пациентов пожилого возраста с СД2, получающих сахароснижающую терапию без метформина, чаще диагностируется саркопения, чем у пациентов в составе сахароснижающей терапии которых используется метформин [18]. В исследовании Lyu Q. и соавт. [35], проведенном на мышах с саркопенией, полученные данные свидетельствовали о том, что лечение метформином может способствовать профилактике возрастной саркопении путем регуляции липидного обмена в скелетных мышцах. Наблюдалось усиление липолиза и снижение воспалительных реакций, которые являются АМФК-зависимыми процессами. Кроме того, диета с высоким содержанием жиров, была связана со снижением мышечной и увеличением жировой массы, что сопровождалось снижением толерантности к физической нагрузке. Метаанализ, проведенный с целью оценки эффективности использования метформина у лиц с саркопенией, позволил подтвердить его положительное влияние на мышечную силу, что позволяет рассматривать его для лечения саркопении [36].
БЕЗОПАСНОСТЬ И РАЦИОНАЛЬНОСТЬ ФАРМАКОТЕРАПИИ МЕТФОРМИНОМ У ПОЖИЛЫХ
Метформин не имеет ограничений по возрасту и относится к одним из приоритетных препаратов у пациентов с ожирением. В дополнение к этому, благодаря низкому риску гипогликемии и возможности комбинирования со всеми сахароснижающими препаратами, в том числе с инсулинами, этот препарат часто рекомендуется для применения у пожилых пациентов. Значимой является возможность комбинирования метформина с другими пероральными сахароснижающими препаратами без нивелирования его терапевтического эффекта [37].
Нередко сахароснижающая терапия у пожилых пациентов может быть небезопасной. Повышенное содержание метформина в крови увеличивает вероятность возникновения гипогликемии и лактатацидоза. Следует с осторожность подходить к назначению метформина у пациентов с хронической болезнью почек (ХБП), распространенность которой у лиц пожилого возраста достигает 30% [38]. В частности, согласно инструкции по медицинскому применению, при расчетной скорости клубочковой фильтрации (рСКФ) менее 30 мл/мин/1,73 м² прием метформина не рекомендован. Опасность развития лактатацидоза значительно возрастает при совместном назначении метформина с рентгеноконтрастными веществами. Данный факт требует отмены метформина за несколько дней до проведения любых исследований с внутривенным введением рентгеноконтрастных средств и в течение двух суток после их завершения [37][39]. Известно, что количество используемых препаратов повышается с возрастом, что в свою очередь сопровождается увеличением частоты межлекарственных взаимодействий [40]. Ряд лекарственных средств (циметидин, ранитидин, триамтерен, амилорид, дигоксин, морфин, прокаинамид, хинидин, хинин, ванкомицин, цефалексин) при совместном использовании с метформином конкурентно ингибируют транспортные системы в почечных канальцах, снижая его почечный клиренс. В этом случае может быть проведена коррекция терапии, путем уменьшения дозы, отмены препарата или замены на препарат с меньшим риском развития побочных эффектов [39]. Следует иметь в виду, что снижение кислотности желудочного сока и замедление перистальтики кишечника, наблюдаемые у лиц пожилого возраста, могут влиять на растворение и всасывание метформина, снижая его эффективность [41].
Заключение
Саркопения и саркопеническое ожирение становятся все более распространенными хроническими заболеваниями с многофакторным патогенезом. На сегодняшний день не существует одобренного терапевтического препарата для лечения саркопении. Метформин имеет многолетнюю историю применения в качестве перорального сахароснижающего препарата первого выбора для лечения СД2 с высоким профилем безопасности. В последнее десятилетие повышенное внимание уделяется перепрофилированию метформина для лечения других состояний. Действительно, метформин продемонстрировал многообещающие терапевтические эффекты, выходящие за рамки лечения СД2. Положительное влияние на мышечную силу позволяет рассматривать этот препарат для лечения саркопении. Необходимы дальнейшие исследования, посвященные поиску предикторов и эффективного лечения саркопении.
Дополнительная информация
Источники финансирования. Статья подготовлена в рамках государственного задания № НИОКТР 122012100180-0.
Конфликт интересов. Трошина Е.А. — член редакционной коллегии журнала «Ожирение и метаболизм».
Участие авторов. Трошина Е.А. — формулирование научной проблемы, поиск и обработка материалов, анализ полученных данных, участие в подготовке публикаций; Богданова В.О. — формулирование научной проблемы, поиск и обработка материалов, анализ полученных данных, участие в подготовке публикаций; Умархаджиева З.-Ш. Р. — формулирование научной проблемы, поиск и обработка материалов, анализ полученных данных, написание текста, участие в подготовке публикаций. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Дедов И.И., Шестакова М.В., Викулова О.К., Железнякова А.В., Исаков М.А., Сазонова Д.В., Мокрышева Н.Г. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010 – 2022 гг. // Сахарный диабет. — 2023. — Т.26 — №2. — С.104-123. doi: https://doi.org/10.14341/DM13035
2. Khan RMM, Chua ZJY, Tan JC, Yang Y, Liao Z, Zhao Y. From Pre-Diabetes to Diabetes: Diagnosis, Treatments and Translational Research. Medicina (Kaunas). 2019;55(9):546. doi: https://doi.org/10.3390/medicina55090546
3. Liccini A, Malmstrom TK. Frailty and Sarcopenia as Predictors of Adverse Health Outcomes in Persons With Diabetes Mellitus. J Am Med Dir Assoc. 2016;17(9):846-851. doi: https://doi.org/10.1016/j.jamda.2016.07.007
4. Yuan S, Larsson SC. Epidemiology of sarcopenia: Prevalence, risk factors, and consequences. Metabolism. 2023;144:155533. doi: https://doi.org/10.1016/j.metabol.2023.155533
5. Qiao YS, Chai YH, Gong HJ, et al. The Association Between Diabetes Mellitus and Risk of Sarcopenia: Accumulated Evidences From Observational Studies. Front Endocrinol (Lausanne). 2021;12:782391. doi: https://doi.org/10.3389/fendo.2021.782391
6. Feng L, Gao Q, Hu K, et al. Prevalence and Risk Factors of Sarcopenia in Patients With Diabetes: A Meta analysis. J Clin Endocrinol Metab. 2022;107(5):1470-1483. doi: https://doi.org/10.1210/clinem/dgab884
7. Российская ассоциация геронтологов и гериатров. Клинические рекомендации. Старческая астения. — М.; 2021. — С.170.
8. Mitchell WK, Williams J, Atherton P, Larvin M, Lund J, Narici M. Sarcopenia, dynapenia, and the impact of advancing age on human skeletal muscle size and strength; a quantitative review. Front Physiol. 2012;3:260. doi: https://doi.org/10.3389/fphys.2012.00260
9. Petermann-Rocha F, Balntzi V, Gray SR, et al. Global prevalence of sarcopenia and severe sarcopenia: a systematic review and meta-analysis. J Cachexia Sarcopenia Muscle. 2022;13(1):86-99. doi: https://doi.org/10.1002/jcsm.12783
10. Beretta MV, Dantas Filho FF, Freiberg RE, Feldman JV, Nery C, Rodrigues TC. Sarcopenia and Type 2 diabetes mellitus as predictors of 2-year mortality after hospital discharge in a cohort of hospitalized older adults. Diabetes Res Clin Pract. 2020;159:107969. doi: https://doi.org/10.1016/j.diabres.2019.107969
11. Kreidieh F, Temraz S. SARS-CoV-2 Infected Patient: from a Hematologist’s Perspective. Mediterr J Hematol Infect Dis. 2020;12(1):e2020078. doi: https://doi.org/10.4084/MJHID.2020.078
12. van den Broek-Altenburg E, Atherly A, Holladay E. Changes in healthcare spending attributable to obesity and overweight: payer- and service-specific estimates. BMC Public Health. 2022;22(1):962. doi: https://doi.org/10.1186/s12889-022-13176-y
13. Nnodim JO, Yung RL. Balance and its Clinical Assessment in Older Adults - A Review. J Geriatr Med Gerontol. 2015;1(1):003. doi: https://doi.org/10.23937/2469-5858/1510003
14. Winter JE, MacInnis RJ, Wattanapenpaiboon N, Nowson CA. BMI and all-cause mortality in older adults: a meta-analysis. Am J Clin Nutr. 2014;99(4):875-890. doi: https://doi.org/10.3945/ajcn.113.068122
15. Kim TN, Yang SJ, Yoo HJ, et al. Prevalence of sarcopenia and sarcopenic obesity in Korean adults: the Korean sarcopenic obesity study. Int J Obes (Lond). 2009;33(8):885-892. doi: https://doi.org/10.1038/ijo.2009.130
16. Wagenaar CA, Dekker LH, Navis GJ. Prevalence of sarcopenic obesity and sarcopenic overweight in the general population: The lifelines cohort study. Clin Nutr. 2021;40(6):4422-4429. doi: https://doi.org/10.1016/j.clnu.2021.01.005
17. Gao Q, Mei F, Shang Y, et al. Global prevalence of sarcopenic obesity in older adults: A systematic review and meta-analysis. Clin Nutr. 2021;40(7):4633-4641. doi: https://doi.org/10.1016/j.clnu.2021.06.009
18. Онучина Ю. С. и др. Особенности саркопении у пациентов с сахарным диабетом 2 типа // Сахарный диабет-2017: от мониторинга к управлению. — 2017. — С. 98-101.
19. Мкртумян А.М., Маркова Т.Н., Овчинникова М.А., Иванова И.А., Кузьменко К.В. Метформин — активатор АМФ зависимой протеинкиназы. Известные и новые механизмы действия // Сахарный диабет. — 2023. — Т.26 — №6. — С.585-595. doi: https://doi.org/10.14341/DM13044
20. Sabarathinam S, Dhanasekaran D, Ganamurali N. Insight on sarcopenic obesity and epicatechin as a promising treatment option. Diabetes Metab Syndr. 2023;17(10):102856. doi: https://doi.org/10.1016/j.dsx.2023.102856
21. Sakuma K, Yamaguchi A. Sarcopenic obesity and endocrinal adaptation with age. Int J Endocrinol. 2013;2013:204164. doi: https://doi.org/10.1155/2013/204164
22. Lim EL, Hollingsworth KG, Aribisala BS, Chen MJ, Mathers JC, Taylor R. Reversal of type 2 diabetes: normalisation of beta cell function in association with decreased pancreas and liver triacylglycerol. Diabetologia. 2011;54(10):2506-2514. doi: https://doi.org/10.1007/s00125-011-2204-7
23. Kob R, Bollheimer LC, Bertsch T, et al. Sarcopenic obesity: molecular clues to a better understanding of its pathogenesis? Biogerontology. 2015;16(1):15-29. doi: https://doi.org/10.1007/s10522-014-9539-7
24. Xie WQ, Xiao GL, Fan YB, He M, Lv S, Li YS. Sarcopenic obesity: research advances in pathogenesis and diagnostic criteria. Aging Clin Exp Res. 2021;33(2):247-252. doi: https://doi.org/10.1007/s40520-019-01435-9
25. Ruegsegger GN, Creo AL, Cortes TM, Dasari S, Nair KS. Altered mitochondrial function in insulin-deficient and insulin-resistant states. J Clin Invest. 2018;128(9):3671-3681. doi: https://doi.org/10.1172/JCI120843
26. Dickinson JM, Fry CS, Drummond MJ, Gundermann DM, Walker DK, Glynn EL, et al. Mammalian target of rapamycin complex 1 activation is required for the stimulation of human skeletal muscle protein synthesis by essential amino acids. J Nutr. 2011;141:856–62. doi: https://doi.org/10.3945/jn.111.139485
27. Dong XC, Copps KD, Guo S, et al. Inactivation of hepatic Foxo1 by insulin signaling is required for adaptive nutrient homeostasis and endocrine growth regulation. Cell Metab. 2008;8(1):65-76. doi: https://doi.org/10.1016/j.cmet.2008.06.006
28. Жгулева А.С., Зементова М.С., Сельков С.А., Соколов Д.И. Макрофаги М1/М2: происхождение, фенотип, способы получения, взаимодействие с естественными киллерами и трофобластом // Медицинская иммунология. — 2024. — Т.26. — №3. — С.425-448. doi: https://doi.org/10.15789/1563-0625-MMO-2877
29. Barazzoni R, Bischoff S, Boirie Y, et al. Sarcopenic Obesity: Time to Meet the Challenge. Obes Facts. 2018;11(4):294-305. doi: https://doi.org/10.1159/000490361
30. Xie WQ, Xiao GL, Fan YB, He M, Lv S, Li YS. Sarcopenic obesity: research advances in pathogenesis and diagnostic criteria. Aging Clin Exp Res. 2021;33(2):247-252. doi: https://doi.org/10.1007/s40520-019-01435-9
31. Zhang L, Wang X, Cueto R, et al. Biochemical basis and metabolic interplay of redox regulation. Redox Biol. 2019;26:101284. doi: https://doi.org/10.1016/j.redox.2019.101284
32. Liguori I, Russo G, Curcio F, et al. Oxidative stress, aging, and diseases. Clin Interv Aging. 2018;13:757-772. doi: https://doi.org/10.2147/CIA.S158513
33. Wang J, Leung KS, Chow SK, Cheung WH. Inflammation and age-associated skeletal muscle deterioration (sarcopaenia). J Orthop Translat. 2017;10:94-101. doi: https://doi.org/10.1016/j.jot.2017.05.006
34. Bannister CA, Holden SE, Jenkins-Jones S, et al. Can people with type 2 diabetes live longer than those without? A comparison of mortality in people initiated with metformin or sulphonylurea monotherapy and matched, non-diabetic controls. Diabetes Obes Metab. 2014;16(11):1165-1173. doi: https://doi.org/10.1111/dom.12354
35. Lyu Q, Wen Y, He B, et al. The ameliorating effects of metformin on disarrangement ongoing in gastrocnemius muscle of sarcopenic and obese sarcopenic mice. Biochim Biophys Acta Mol Basis Dis. 2022;1868(11):166508. doi: https://doi.org/10.1016/j.bbadis.2022.166508
36. Соколова А.В., Климова А.В., Драгунов Д.О., Арутюнов Г.П. Оценка влияния терапии метформином на величину мышечной массы и мышечной силы у больных с и без сахарного диабета. Метаанализ 15 исследований // РКЖ. — 2021. — №3.
37. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. — 11-й выпуск. — М.; 2023. doi: https://doi.org/10.14341/DM13042
38. De Nicola L, Zoccali C. Chronic kidney disease prevalence in the general population: heterogeneity and concerns. Nephrol Dial Transplant. 2016;31(3):331-335. doi: https://doi.org/10.1093/ndt/gfv427
39. Ловцова Л. В. и др. Взаимодействие лекарственных средств в клинической практике. — 2020.
40. Stafford G, Villén N, Roso-Llorach A, Troncoso-Mariño A, Monteagudo M, Violán C. Combined Multimorbidity and Polypharmacy Patterns in the Elderly: A Cross-Sectional Study in Primary Health Care. Int J Environ Res Public Health. 2021;18(17):9216. doi: https://doi.org/10.3390/ijerph18179216
41. Мкртумян А.М., Бирюкова Е.В. Особенности сахарного диабета в пожилом возрасте и принципы терапии // Сахарный диабет. — 2005. — Т.8. — №4. — С.14-21. doi: https://doi.org/10.14341/2072-0351-5960
Об авторах
Е. А. ТрошинаРоссия
Трошина Екатерина Анатольевна, д.м.н., профессор, член-корр. РАН
Москва
Конфликт интересов:
Трошина Е.А. — член редакционной коллегии журнала «Ожирение и метаболизм»
В. О. Богданова
Россия
Богданова Валерия Олеговна, к.м.н.
Москва
Конфликт интересов:
Автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
З.-Ш. Р. Умархаджиева
Россия
Умархаджиева Зайна-Шарифа Руслановна
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Факторы риска и основные звенья развития саркопенического ожирения. Адаптировано из [20]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(478KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Трошина Е.А., Богданова В.О., Умархаджиева З.Р. Метформин в терапии сахарного диабета 2 типа, отягощенного саркопеническим ожирением, у лиц пожилого возраста. Фокус на плейотропные эффекты. Ожирение и метаболизм. 2025;22(1):35-40. https://doi.org/10.14341/omet13180
For citation:
Troshina E.A., Bogdanova V.O., Umarkhadzhieva Z.R. Metformin in the therapy of type 2 diabetes mellitus bur dened by sarcopenic obesity in the elderly. Focus on pleiotropic effects. Obesity and metabolism. 2025;22(1):35-40. (In Russ.) https://doi.org/10.14341/omet13180

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































