Перейти к:
Образование надпочечника, продуцирующее метаболиты стероидогенеза: клинический случай и краткий обзор
https://doi.org/10.14341/omet13050
Аннотация
Избыток андрогенов и их предшественников является одной из ведущих причин нарушений менструального цикла и репродуктивной функции у женщин. Нами представлено клиническое наблюдение пациентки 32 лет с жалобами на нарушение менструального цикла, первичное бесплодие, отклонениями в стероидогенезе по результатам мультистероидного профиля (резкое повышение 17-ОН-прогестерона) и образованием надпочечника по данным мультиспиральной компьютерной томографии (МСКТ). Первоначально установленный диагноз неклассической врожденной дисфункции коры надпочечников (ВДКН) не был подтвержден в ходе дальнейшего обследования (отсутствие подавления 17-ОН-прогестерона на фоне терапии высокими дозами дексаметазона, отсутствие гирсутизма) и генетического типирования (отрицательные результаты полного секвенирования гена CYP21A2). После проведения адреналэктомии с опухолью отмечены полная нормализация уровня метаболитов стероидогенеза: прогестерона, 17-ОН-прогестерона, 21-дезоксикортизола и восстановление менструального цикла. Представленное клиническое наблюдение является особенно интересным ввиду крайне малой распространенности опухолей надпочечников с сочетанным нарушением нескольких ферментов стероидогенеза. Пациентам с клинико-лабораторными признаками гиперандрогении, у которых не удается однозначно установить причину заболевания, рекомендуются проведение мультистероидного анализа крови методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием, применение высокоточных визуализирующих методов исследования надпочечников и яичников (магнитно-резонансная томография органов малого таза, МСКТ надпочечников), генетическое исследование на выявление мутаций гена CYP21A2 как ведущей причины развития ВДКН.
Ключевые слова
Для цитирования:
Иващенко К.В., Комшилова К.А., Молашенко Н.В., Лавренюк А.А., Лапшина А.М., Ким И.В., Иоутси В.А., Анцупова М.А., Уткина М.В., Платонова Н.М., Трошина Е.А., Мокрышева Н.Г. Образование надпочечника, продуцирующее метаболиты стероидогенеза: клинический случай и краткий обзор. Ожирение и метаболизм. 2023;20(4):363-370. https://doi.org/10.14341/omet13050
For citation:
Ivashchenko K.V., Komshilova K.A., Molashenko N.V., Lavreniuk A.A., Lapshina A.M., Kim I.V., Ioutsi V.A., Antsupova M.A., Utkina M.V., Platonova N.M., Troshina E.A., Mokrysheva N.G. Steroid metabolites producing adenoma: a case report. Obesity and metabolism. 2023;20(4):363-370. (In Russ.) https://doi.org/10.14341/omet13050
ВВЕДЕНИЕ
Избыток андрогенов и их предшественников является одной из ведущих причин нарушений менструального цикла и репродуктивной функции у женщин. К самым распространенным причинам гиперандрогении относятся синдром поликистозных яичников (СПКЯ), врожденная дисфункция коры надпочечников (ВДКН), синдром Кушинга и андроген-продуцирующие опухоли различной локализации.
17-гидроксипрогестерон (17-ОН-прогестерон, или 17-OHP) — промежуточный стероид в биосинтезе андрогенов, эстрогенов и глюкокортикоидов, продукт метаболических превращений прогестерона и 17-гидроксипрегненолона [1]. Исследование уровня 17-OHP является обязательным этапом в диагностическом поиске генеза гиперандрогении. Повышение уровня базального 17-OHP выше 30 нмоль/л (выше 100 нмоль/л при стимуляции адренокортикотропного гормона (АКТГ)) в сочетании с типичными проявлениями заболевания позволяет судить о наличии у пациента ВДКН, тогда как его определение в «серой зоне» (базальный уровень 6–30 нмоль/л или 30–45 нмоль/л при стимуляции АКТГ) не всегда сочетается с наличием ВДКН, может являться следствием носительства гетерозиготных мутаций CYP21A2 и требует проведения генетического исследования [2].
Дефицит 21-гидроксилазы является наиболее распространенной причиной гиперандрогении и бесплодия у женщин детородного возраста, что нередко приводит к гипердиагностике ВДКН на основании сходства клинических симптомов и лабораторных отклонений без проведения генетического тестирования. Стоит отметить, что длительный избыток АКТГ может приводить к гиперплазии ткани надпочечников и формированию вторичных опухолей у пациентов с некомпенсированными классическими формами ВДКН. Клиническое течение андроген-продуцирующих опухолей характеризуется сходной клинической картиной с ВДКН, что затрудняет диагностику и вкупе с редкой распространенностью часто приводит к позднему выявлению и лечению заболевания.
Представленный случай является первым описанием в российской научной литературе редкого варианта опухоли надпочечника, продуцирующей метаболиты стероидогенеза, включая 17-ОНР, и применения мультистероидного гормонального анализа сыворотки крови методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием (ВЭЖХ-МС/МС) и методов генетического анализа для дифференциальной диагностики генеза гиперандрогении.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка 32 лет была госпитализирована в Институт клинической эндокринологии ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России в июле 2022 г. с жалобами на нарушение менструального цикла. Из анамнеза известно: менархе установилось в 13 лет, менструальный цикл был регулярным, беременностей не было. C 25 лет начала отмечать нарушение менструального цикла по типу олигоменореи, в течение 6 лет получала различные схемы оральных контрацептивов без значимого эффекта.
Впервые повышение уровня 17-ОНР до 20,89 нмоль/л выявлено в 2020 г. Учитывая отсутствие возможности проведения теста с синтетическим аналогом АКТГ, выполнено исследование 11 частых мутаций гена CYP21A2 — патогенных и вероятно-патогенных вариантов обнаружено не было. Учитывая повышение уровня 17-OHP и клиническую картину (нарушение менструального цикла, первичное бесплодие), заподозрена неклассическая форма ВДКН. Инициирована терапия глюкокортикоидами — дексаметазон 0,5 мг с последующей титрацией дозы до 1 мг, однако уровень 17-OHP оставался повышенным.
В феврале 2021 г. по месту жительства проведена магнитно-резонансная томография (МРТ) органов забрюшинного пространства, выявлено образование левого надпочечника размерами 2,8х2,4х2,2 см, был рекомендован динамический контроль. Через год выполнена мультиспиральная компьютерная томография (МСКТ) надпочечников с контрастным усилением, подтверждено наличие образования левого надпочечника размерами 3,9х2,9х2,6 см, неоднородной структуры, плотностью в нативную фазу 22–28 НU с неравномерным накоплением контрастного вещества. По месту жительства исследованы уровни метилированных катехоламинов: метанефрин суточной мочи — 316,0 мкг/сут, норметанефрин — 1084,0 мкг/сут (референсный интервал и факт наличия консерванта неизвестны), согласно выписному эпикризу из истории болезни, заподозрена феохромоцитома.
При осмотре в отделении обращало на себя внимание изменение внешности по кушингоидному типу: перераспределение подкожно-жировой клетчатки, «лунообразное лицо», матронизм. На фоне приема 1 мг дексаметазона уровень 17-OHP составил 76,2 нмоль/л, результаты гормонального исследования представлены в таблице 1. В связи с отсутствием клинических проявлений гирсутизма подсчет гирсутного числа не проводился.
При ультразвуковом исследовании (УЗИ) органов малого таза объем яичников: правый — 9,2 см3, левый — 8,7 см3, структура яичников однородная, со множественными фолликулами диаметром 0,4–0,8 см по периферии и в центре. Толщина эндометрия 0,3 см, признаки гипоплазии матки.
По данным МСКТ визуализировано образование левого надпочечника с четкими ровными контурами размерами 3,5х3,4х3,2 см, плотностью в нативную фазу от 12 HU до 17 HU, с наличием многочисленных сосудов в структуре, при контрастном усилении накапливает контраст, плотность по фазам 70–160–75 HU (артериальная-венозная-отсроченная) (рис. 1). Коэффициент абсолютного вымывания контрастного вещества — 59%, относительного — 53%. КТ-характеристики соответствуют злокачественному фенотипу.
Проведено исключение гормональной активности данного образования. Данных за феохромоцитому/параганглиому и первичный гиперальдостеронизм не получено (табл. 1).
Ввиду отсутствия подавления 17-OHP на фоне приема больших доз глюкокортикоидов, а также развития ятрогенного гиперкортицизма рекомендовано постепенное уменьшение дозы дексаметазона с дальнейшей отменой препарата.
В октябре 2022 г., в ходе повторной госпитализации в Центр, после отмены дексаметазона сохранялось повышение 17-OHP до 54,3 нмоль/л, снижение общего тестостерона и дегидроэпиандростерона сульфата (ДГЭА-С) (табл. 1).
Дополнительно выполнено полное секвенирование гена CYP21A2 по Сэнгеру — патогенных и вероятно патогенных вариантов, а также вариантов с неизвестной клинической значимостью не обнаружено.
Учитывая отсутствие клинических проявлений гиперандрогении, отсутствие подавления 17-OHP на фоне ранее проводимой терапии высокими дозами дексаметазона, диагноз неклассической формы ВДКН поставлен под сомнение.
На фоне отмены дексаметазона отмечалось отсутствие подавления утреннего кортизола крови в ходе ночного подавляющего теста (НПТ) с 1 мг дексаметазона, однако свободный кортизол суточной мочи и вечерней слюны оставались в пределах референсных значений, без подавления уровня АКТГ (табл. 1), что было расценено как субклинический эндогенный гиперкортицизм.
Ввиду неоднозначности клинической картины проведен мультидисциплинарный консилиум при участии эндокринологов, гинекологов и эндокринных хирургов. По итогам консилиума, учитывая высокий онкологический риск образования левого надпочечника, а также невозможность полностью исключить гиперпродукцию образованием метаболитов глюкокортикоидного ряда, принято решение о проведении оперативного лечения в объеме левосторонней адреналэктомии с опухолью.
В до- и послеоперационном периоде выполнен мультистероидный анализ сыворотки крови методом ВЭЖХ-МС/МС. После проведения левосторонней адреналэктомии отмечено снижение уровней прогестерона, 17-OHP и 21-дезоксикортизола ниже предела детектирования, что попадает в референсный интервал (табл. 2).
Гистологическая картина удаленной опухоли соответствует смешанноклеточной аденоме коры надпочечника (по системе Weiss — 0 баллов). На рис. 2 представлено микроскопическое строение опухоли. При иммуногистохимическом исследовании (ИГХ) выявлена позитивная реакция опухолевых клеток с меланом А, ингибином α и SF1, индекс пролиферации Ki67 составил 5,6%.
После адреналэктомии пациентка отметила восстановление регулярного менструального цикла без медикаментозной терапии. Через 4 мес после хирургического лечения при повторной госпитализации 17-OHP — 4,02 нмоль/л. Данных за эндогенный гиперкортицизм не получено (табл. 1).
Учитывая значение кортизола крови утром в «серой» зоне, снижение уровня кортизола в суточной моче, проведена проба с инсулиновой гипогликемией. Согласно полученным результатам (повышение кортизола крови до 507 нмоль/л на фоне гипогликемии), надпочечниковая недостаточность была исключена.
На основании данных ИГХ, нормализации гормональных лабораторных показателей стероидогенеза, уровней кортизола крови и суточной мочи в послеоперационном периоде сделан вывод об автономной гиперпродукции удаленной опухолью метаболитов стероидогенеза, включая 17-OHP.
Пациентка планирует беременность.
Таблица 1. Результаты лабораторных методов исследования за время наблюдения
Table 1. Results of laboratory testing during the observation period
Показатель | Первая госпитализация в Центр | Вторая госпитализация в Центр | Третья госпитализация в Центр | Единицы измерения | Референсный интервал |
17-OHP | 76,2 | 54,3 | 4,02 | нмоль/л | 0,8–7 |
Тестостерон | 0,451 | 0,202 | 1,09 | нмоль/л | 0,7–2,7 |
ДГЭА-С | 0,49 | 0,26 | 0,306 | мкмоль/л | 1,65–11 |
ЛГ | 2,51 | - | - | Ед/л | 2,6–12,1 |
ФСГ | 3,83 | - | - | Ед/л | 1,9–11,7 |
Эстрадиол | 109,4 | - | - | пмоль/л | 97–592 |
Пролактин | 426,1 | - | - | мЕд/л | 94–500 |
Кортизол крови, утро | 353,3 | 350,6 | 309,7 | нмоль/л | 171–536 |
Свободный кортизол суточной мочи | - | 137,2 | 31,61 | нмоль/сут | 100–379 |
Кортизол слюны, вечер | - | 9,57 | 6,77 | нмоль/л | 0,5–9,65 |
Кортизол крови утром в ходе НПТ | - | 272,6 | 5,68 | нмоль/л | <50 |
АКТГ, утро | - | 24,86 | 47,97 | пг/мл | 7,2–63,3 |
Метанефрин, суточная моча | 126,45 | - | - | мкг/сут | 25–312 |
Норметанефрин, суточная моча | 122,7 | - | - | мкг/сут | 35–445 |
Альдостерон, в покое сидя | 697 | - | - | пмоль/л | 69,8–1085,8 |
Ренин прямой | 25,14 | - | - | мЕд/л | 2,8–39,9 |
Таблица 2. Стероидный профиль до и после левосторонней адреналэктомии
Table 2. Steroid profile before and after adrenalectomy
Показатель | До операции | После операции | Единицы измерения | Референсный интервал |
17-OHP | 39.2 | 1.1 | нмоль/л | 0.2–6.0 |
11-дезоксикортизол | 2.6 | 3.2 | нмоль/л | 0.0–10.0 |
21-дезоксикортизол | 3.90 | <0.01 | нмоль/л | 0.00–1.20 |
Андростендион | 3.03 | 1.50 | нмоль/л | 0.80–9.00 |
Кортикостерон | 5.7 | 8.4 | нмоль/л | 1.0–50.0 |
Тестостерон | 1.44 | 0.46 | нмоль/л | 0.30–2.50 |
Кортизол | 172 | 211 | нмоль/л | 140–630 |
Альдостерон | 93.00 | 225.00 | пмоль/л | 70.00–980.00 |
Дезоксикортикостерон | 0.48 | 0.47 | нмоль/л | 0.00–0.58 |
Кортизон | 57 | 55 | нмоль/л | 33–97 |
Прегненолон | 3.5 | 0.3 | нмоль/л | 0.0–7.0 |
Прогестерон | 14.8 | 0.7 | нмоль/л | 0.0–1.5 |
Дегидроэпиандростерон | 2.1 | 2.1 | нмоль/л | 4.0–50.0 |
17-гидроксипрегненолон | 0.9 | 2.4 | нмоль/л | 0.0–20.0 |
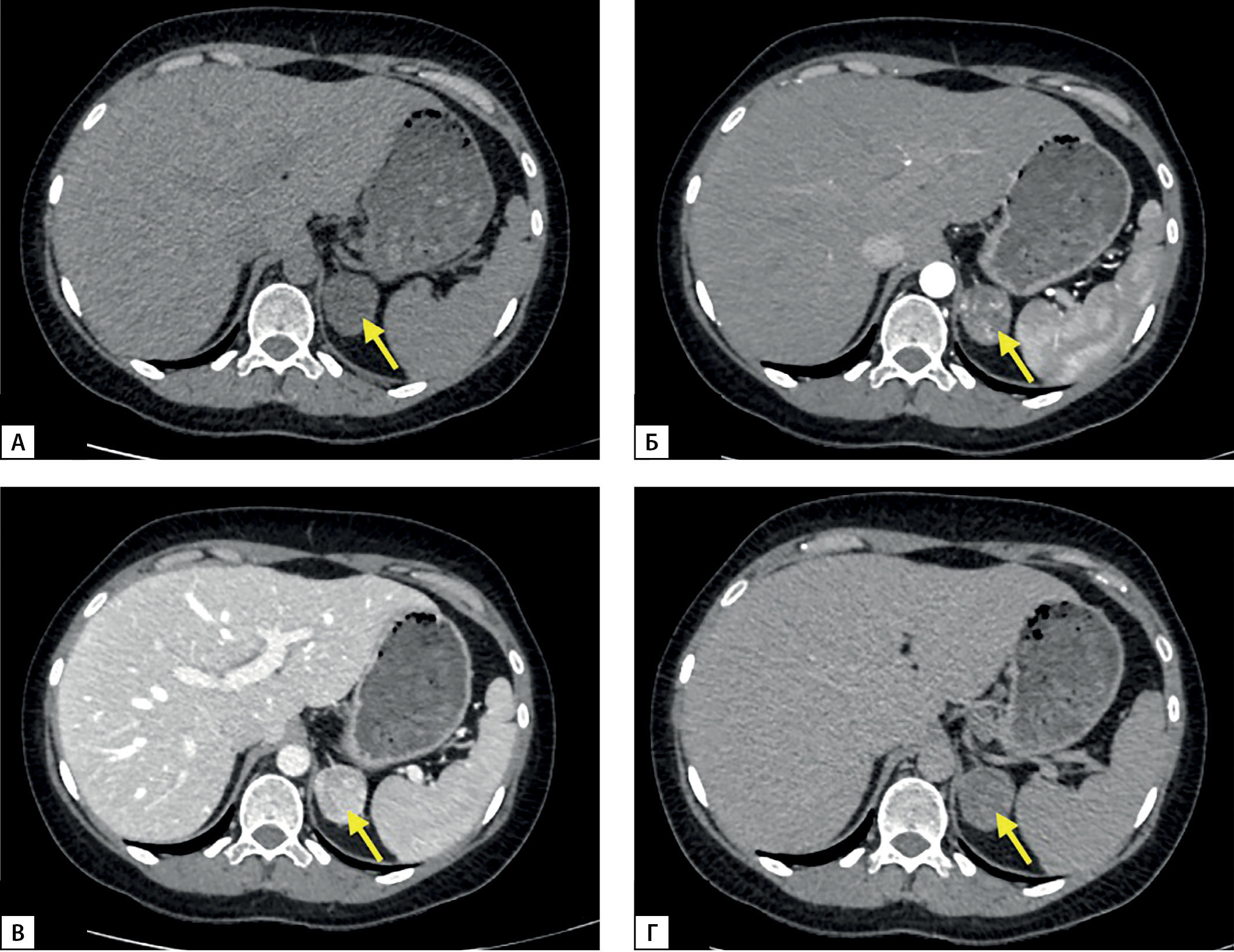
Рисунок 1. МСКТ надпочечников: А — нативная фаза; Б — артериальная фаза; В — венозная фаза; Г — отсроченная фаза.
Figure 1. MSCT scan of adrenal glands: A — native phase; B — arterial phase; C — venous phase; D — delayed phase.
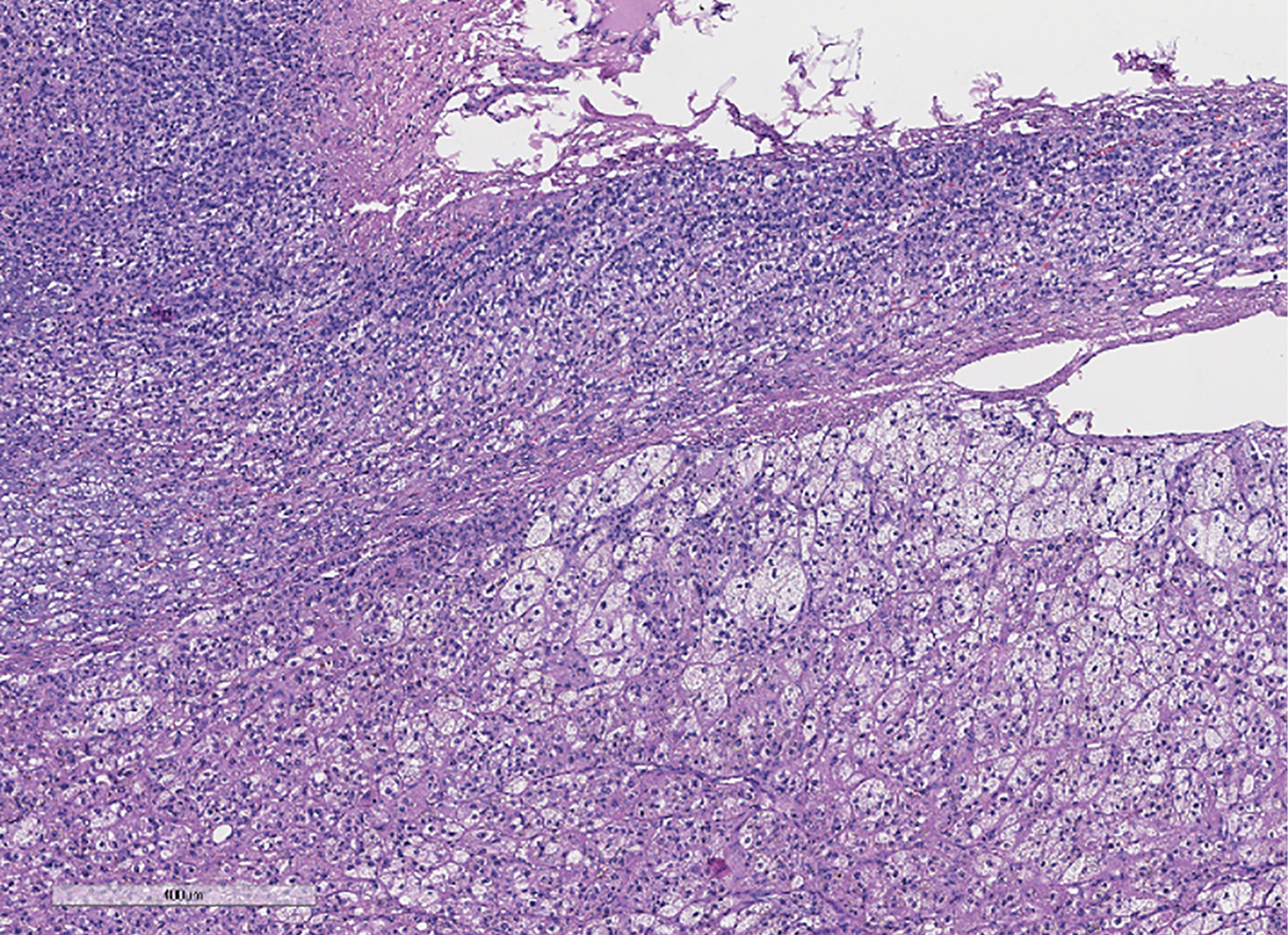
Рисунок 2. Данные патоморфологического исследования надпочечника. К надпочечнику неравномерной толщины прилежит неинкапсулированная четко отграниченная опухоль из компактных клеток и клеток с оптически «пустой» цитоплазмой, трабекулярного или альвеолярного строения (окраска гематоксилином и эозином х400).
Figure 2. Histopathological study of the adrenal gland. An unevenly thickened adrenal gland is adjacent to a non-encapsulated, well-demarcated tumor consisting of compact cells and cells with optically «empty» cytoplasm, with a trabecular or alveolar structure (stained with hematoxylin and eosin, x400).
ОБСУЖДЕНИЕ
Проблема дифференциальной диагностики синдрома гиперандрогении часто встает перед эндокринологами и гинекологами. Опухолевый генез этого состояния поддается радикальному лечению. Подходы к консервативному лечению неопухолевого генеза синдрома определены в консенсусах европейских и американских специалистов [3][4].
Нами представлено клиническое наблюдение пациентки 32 лет с жалобами на нарушение менструального цикла, первичное бесплодие, отклонениями в стероидогенезе по результатам мультистероидного профиля (повышение 17-OHP) и образованием надпочечника по данным МСКТ. Первоначально установленный диагноз нВДКН не был подтвержден по данным клинического течения заболевания (отсутствие подавления 17-ОНР на фоне терапии высокими дозами дексаметазона, отсутствие гирсутизма), отрицательных результатов полного секвенирования гена CYP21A2. После проведения адреналэктомии с опухолью отмечена полная нормализация уровня метаболитов стероидогенеза: прогестерона, 17-OHP, 21-дезоксикортизола и восстановление менструального цикла.
Проявления заболевания для большинства пациенток с нВДКН включают в себя гирсутизм и акне в сочетании с нарушениями менструального цикла, у части пациенток — первичное бесплодие или привычное невынашивание беременности. Для коррекции гиперандрогении применяется терапия препаратами оральных контрацептивов или глюкокортикоидов (по показаниям). В представленном клиническом случае пациентки проводимое лечение супрафизиологическими дозами глюкокортикоидов не только не привело к снижению уровня 17-OHP и восстановлению менструального цикла, но стало причиной развития ятрогенного гиперкортицизма.
Было предположение о наличии у пациентки вторичной опухоли надпочечника в сочетании с нВДКН. Согласно современным представлениям, развитие гиперплазии и образований надпочечников связано с их избыточной стимуляцией АКТГ и является следствием длительной декомпенсации заболевания [5]. Среди пациентов с классической формой ВДКН у 11–58% выявляется узловая гиперплазия надпочечников, а у пациентов более старшего возраста структурные изменения надпочечников могут выявляться до 82% случаев [6]. Образования надпочечников, по данным работы Nermoen I. и коллег, выявлялись в 29,3% случаев среди пациентов с дефицитом 21-гидроксилазы [5]. Согласно данным метаанализа, проведенного в 2016 г., в 0,8–5,9% случаев инциденталом надпочечников по результатам лабораторных исследований был установлен диагноз дефицита 21-гидроксилазы, при этом данные генетического тестирования позволяли однозначно верифицировать диагноз в 0,8% и свидетельствовали о носительстве в 10,2% случаев [7]. Показатель 0,8% свидетельствует о более частой встречаемости дефицита 21-гидроксилазы у пациентов с инциденталомой надпочечников по сравнению с общей популяцией. По результатам крупного популяционного исследования, проведенного шведскими учеными в 2005–2019 гг., среди 26 573 пациентов с инциденталомами в 20 случаях (0,08%) выявлялся дефицит 21-гидроксилазы (7 пациентов с классическими формами ВДКН (0,03%), 13 (0,05%) — с нВДКН) [8]. Стоит отметить, что среди 144 124 пациентов контрольной группы без подтвержденных образований надпочечников нВДКН была выявлена в единственном случае.
В представленном клиническом случае был сделан вывод о наличии у пациентки гормонально активного образования надпочечника с редкой гиперпродукцией метаболитов стероидогенеза (17-OHP, 21-дезоксикортизола, прогестерона) на фоне нарушения работы нескольких ферментов стероидогенеза: 3βHSD2, P450C17, P450c11β (рис. 3). Большую роль в постановке диагноза, подтверждении надпочечникового генеза гиперандрогении сыграл анализ мультистероидного профиля. Проведение рутинных гормональных исследований выявило только изолированное повышение уровня 17-OHP, тогда как применение хромато-масс-спектрометрических методов исследования позволило одновременно провести качественную и количественную оценку содержания различных стероидных гормонов и их метаболитов и выявить вышеописанные нарушения их синтеза.
Несмотря на злокачественный фенотип образования по данным МСКТ, гистологическое исследование удаленной опухоли определило ее доброкачественную природу. Позитивная иммуноэкспрессия мелана А, ингибина α и SF1 характерна для стероидпродуцирующих опухолей коры надпочечников независимо от их потенциала злокачественности [9].
При дефиците 21-гидроксилазы определяется повышение 17-OHP в сочетании с андростендионом и тестостероном, снижение кортизола, при сольтеряющей форме — дополнительно повышается 21-дезоксикортизол, снижается альдостерона, при дефиците — 11β-гидроксилазы: повышение 11-дезоксикортикостерона (основной маркер), 11-дезоксикортизола, тестостерона, снижение альдостерона. Для дефицита 17a-гидроксилазы характерно снижение кортизола, андрогенов, в том числе 17-OHP, тестостерона, повышение предшественников минералокортикоидов: 11-дезоксикортизола, кортикостерона.
Андроген-продуцирующие опухоли надпочечников являются крайне редкой причиной гиперандрогении у женщин. В недавнем популяционном исследовании, включавшем 1287 человек, был зарегистрирован единственный случай избытка андрогенов опухолевого генеза (0,1%) [10]. По данным другого исследования, включавшего 1205 человек, андроген-продуцирующие опухоли были выявлены у 20 человек (1,7%) [11]. Вариант автономной секреции отдельных метаболитов стероидогенеза является еще менее распространенным. В мировой литературе описание данной патологии представлено в виде единичных клинических наблюдений [12], и истинная ее частота остается неизвестной.
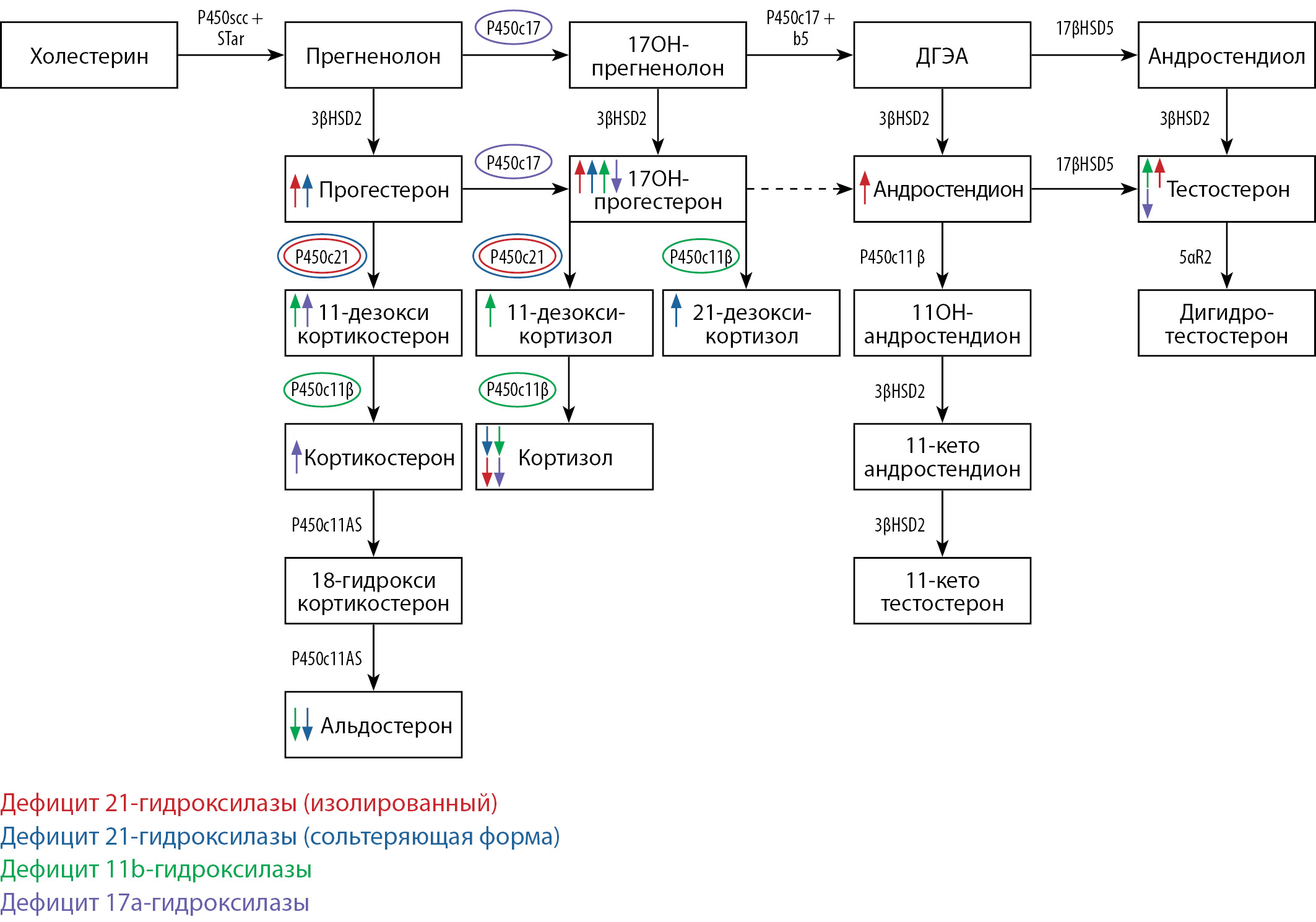
Рисунок 3. Нарушения ферментов стероидогенеза.
Figure 3. Disorders of steroidogenesis enzymes.
ЗАКЛЮЧЕНИЕ
Представленное клиническое наблюдение является особенно интересным ввиду крайне малой распространенности опухолей надпочечников, с сочетанной гиперпродукцией различных метаболитов стероидогенеза, включая 17-OHP. Диагностика осложняется схожестью клинических проявлений с нВДКН, что нередко приводит к назначению нерациональной терапии и позднему выявлению заболевания, а также отсутствием рутинных специфических диагностических тестов, позволяющих однозначно диагностировать именно образование надпочечника в качестве первопричины гиперандрогении.
Пациентам с клинико-лабораторными признаками гиперандрогении, у которых не удается однозначно установить причину заболевания, рекомендуются проведение мультистероидного анализа крови методом ВЭЖХ-МС/МС, применение высокоточных визуализирующих методов исследования надпочечников и яичников (МРТ органов малого таза, МСКТ надпочечников), генетическое исследование на выявление мутаций гена CYP21A2 как ведущей причины развития ВДКН.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена в рамках государственного задания Минздрава России «Разработка новых технологий диагностики и мониторинга опухолей коры надпочечников с использованием метаболомных и протеомных технологий», рег. No 123021300098-7.
Генетическое исследование выполнено в рамках гранта «Создание и развитие научного центра мирового уровня “Национальный центр персонализированной медицины эндокринных заболеваний”» (соглашение №075-15-20220310)», рег. No 122112200001-4.
Согласие пациента. Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Ожирение и метаболизм».
Конфликт интересов. Работа выполнена в соавторстве с членами редакционной коллегии журнала «Ожирение и метаболизм» Е.А. Трошиной и Н.Г. Мокрышевой.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
*Автор, ответственный за переписку / Corresponding author.
Список литературы
1. Wong FCK, Chan AZ, Wong WS, et al. Hyperandrogenism, elevated 17-hydroxyprogesterone and its urinary metabolites in a young woman with ovarian steroid cell tumor, not otherwise specified: case report and review of the literature. Case Rep Endocrinol. 2019;2019:1-8. doi: https://doi.org/10.1155/2019/9237459
2. Молашенко Н.В., Сазонова А.И., Трошина Е.А. Врожденная дисфункция коры надпочечников у взрослых пациентов: алгоритм диагностики и лечения // Consilium Medicum. — 2017. — Т. 19. — №4. — С. 70-74.
3. Goodman NF, Bledsoe MB, Cobin RH, et al. American Association of Clinical Endocrinologists Medical Guidelines for clinical practice for the diagnosis and treatment of hyperandrogenic disorders [published correction appears in Endocr Pract. 2008;14(6):802]. Endocr Pract. 2001;7(2):120-134. doi: https://doi.org/10.4158/EP.7.2.120
4. Martin KA, Anderson RR, Chang RJ, et al. Evaluation and treatment of hirsutism in premenopausal women: An endocrine society* clinical practice guideline. J Clin Endocrinol Metab. 2018;103(4):1233-1257. doi: https://doi.org/10.1210/jc.2018-00241
5. Nermoen I, Falhammar H. Prevalence and characteristics of adrenal tumors and myelolipomas in congenital adrenal hyperplasia: A systematic review and meta-analysis. Endocr Pract. 2020;26(11):1351-1365. doi: https://doi.org/10.4158/EP-2020-0058
6. Jaresch S, Kornely E, Kley HK, Schlaghecke R. Adrenal incidentaloma and patients with homozygous or heterozygous congenital adrenal hyperplasia. J Clin Endocrinol Metab. 1992;74(3):685-689. doi: https://doi.org/10.1210/jcem.74.3.1311000
7. Falhammar H, Torpy DJ. Congenital adrenal hyperplasia due to 21-hydroxylase deficiency presenting as adrenal incidentaloma: A systematic review and meta-analysis. Endocr Pract. 2016;22(6):736-752. doi: https://doi.org/10.4158/EP151085.RA
8. Sahlander F, Patrova J, Mannheimer B, et al. Congenital adrenal hyperplasia in patients with adrenal tumors: a population-based case–control study. J Endocrinol Invest. 2022;46(3):559-565. doi: https://doi.org/10.1007/s40618-022-01933-0
9. Sbiera S, Schmull S, Assie G, et al. High diagnostic and prognostic value of steroidogenic factor-1 expression in adrenal tumors. J Clin Endocrinol Metab. 2010;95(10):E161-E171. doi: https://doi.org/10.1210/jc.2010-0653
10. Ebbehoj A, Li D, Kaur RJ, et al. Epidemiology of adrenal tumours in Olmsted County, Minnesota, USA: a population-based cohort study. Lancet Diabetes Endocrinol. 2020;8(11):894-902. doi: https://doi.org/10.1016/S2213-8587(20)30314-4
11. Elhassan YS, Idkowiak J, Smith K, et al. Causes, patterns, and severity of androgen excess in 1205 consecutively recruited women. J Clin Endocrinol Metab. 2018;103(3):1214-1223. doi: https://doi.org/10.1210/jc.2017-02426
12. Tsai W-H, Wong C-H, Dai S-H, et al. Adrenal tumor mimicking non-classic congenital adrenal hyperplasia. Front Endocrinol (Lausanne). 2020;11(3):1214-1223. doi: https://doi.org/10.3389/fendo.2020.526287
Об авторах
К. В. ИващенкоРоссия
Иващенко Ксения Валерьевна
Москва, ул. Дмитрия Ульянова, д. 11
Конфликт интересов:
Работа выполнена в соавторстве с членами редакционной коллегии журнала «Ожирение и метаболизм» Е.А. Трошиной и Н.Г. Мокрышевой
К. А. Комшилова
Россия
Комшилова Ксения Андреевна - к.м.н.
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членами редакционной коллегии журнала «Ожирение и метаболизм» Е.А. Трошиной и Н.Г. Мокрышевой
Н. В. Молашенко
Россия
Молашенко Наталья Валерьевна - к.м.н.
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членами редакционной коллегии журнала «Ожирение и метаболизм» Е.А. Трошиной и Н.Г. Мокрышевой
А. А. Лавренюк
Россия
Лавренюк Анастасия Андреевна
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членами редакционной коллегии журнала «Ожирение и метаболизм» Е.А. Трошиной и Н.Г. Мокрышевой
А. М. Лапшина
Россия
Лапшина Анастасия Михайловна - к.м.н.
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членами редакционной коллегии журнала «Ожирение и метаболизм» Е.А. Трошиной и Н.Г. Мокрышевой
И. В. Ким
Россия
Ким Илья Викторович - к.м.н.
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членами редакционной коллегии журнала «Ожирение и метаболизм» Е.А. Трошиной и Н.Г. Мокрышевой
В. А. Иоутси
Россия
Иоутси Виталий Алексеевич - к.х.н.
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членами редакционной коллегии журнала «Ожирение и метаболизм» Е.А. Трошиной и Н.Г. Мокрышевой
М. А. Анцупова
Россия
Анцупова Мария Анатольевна
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членами редакционной коллегии журнала «Ожирение и метаболизм» Е.А. Трошиной и Н.Г. Мокрышевой
М. В. Уткина
Россия
Уткина Марина Валерьевна - к.б.н.
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членами редакционной коллегии журнала «Ожирение и метаболизм» Е.А. Трошиной и Н.Г. Мокрышевой
Н. М. Платонова
Россия
Платонова Надежда Михайловна - д.м.н.
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членами редакционной коллегии журнала «Ожирение и метаболизм» Е.А. Трошиной и Н.Г. Мокрышевой
Е. А. Трошина
Россия
Трошина Екатерина Анатольевна - д.м.н., профессор.
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членами редакционной коллегии журнала «Ожирение и метаболизм» Е.А. Трошиной и Н.Г. Мокрышевой
Н. Г. Мокрышева
Россия
Мокрышева Наталья Георгиевна - д.м.н., профессор.
Москва
Конфликт интересов:
Работа выполнена в соавторстве с членами редакционной коллегии журнала «Ожирение и метаболизм» Е.А. Трошиной и Н.Г. Мокрышевой
Дополнительные файлы
|
|
1. Рисунок 1. МСКТ надпочечников: А — нативная фаза; Б — артериальная фаза; В — венозная фаза; Г — отсроченная фаза. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(452KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Данные патоморфологического исследования надпочечника. К надпочечнику неравномерной толщины прилежит неинкапсулированная четко отграниченная опухоль из компактных клеток и клеток с оптически «пустой» цитоплазмой, трабекулярного или альвеолярного строения (окраска гематоксилином и эозином х400). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(882KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Нарушения ферментов стероидогенеза. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(361KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Иващенко К.В., Комшилова К.А., Молашенко Н.В., Лавренюк А.А., Лапшина А.М., Ким И.В., Иоутси В.А., Анцупова М.А., Уткина М.В., Платонова Н.М., Трошина Е.А., Мокрышева Н.Г. Образование надпочечника, продуцирующее метаболиты стероидогенеза: клинический случай и краткий обзор. Ожирение и метаболизм. 2023;20(4):363-370. https://doi.org/10.14341/omet13050
For citation:
Ivashchenko K.V., Komshilova K.A., Molashenko N.V., Lavreniuk A.A., Lapshina A.M., Kim I.V., Ioutsi V.A., Antsupova M.A., Utkina M.V., Platonova N.M., Troshina E.A., Mokrysheva N.G. Steroid metabolites producing adenoma: a case report. Obesity and metabolism. 2023;20(4):363-370. (In Russ.) https://doi.org/10.14341/omet13050

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































