Перейти к:
Случай дефицита 17β-гидроксистероиддегидрогеназы 3-го типа в практике взрослого эндокринолога
https://doi.org/10.14341/omet12942
Аннотация
Дефицит фермента 17β-гидроксистероиддегидрогеназы 3-го типа (17-ГСДГ-3) — одна из редких форм 46,XY нарушения формирования пола (НФП), при котором снижается конверсия андростендиона в тестостерон, а клинические проявления заболевания определяются остаточной активностью фермента. Диагностика дефицита 17-ГСДГ-3 основана на резко сниженном соотношении тестостерон/андростендион, которое при дефиците 17-ГСДГ-3 всегда менее 0,8. Пациентам с дефицитом 17-ГСД-3, как правило, предписывается женский пол, и они воспитываются соответственно. Если диагноз устанавливается до пубертата, пациент воспитывается в женском поле без каких-либо проявлений гендерного несоответствия, рекомендуется гонадэктомия, учитывая риск развития маскулинизации и назначение терапии эстрогенами с возраста пубертата. Если диагноз дефицита 17-ГСДГ-3 устанавливается в период пубертата, когда манифестирует вирилизация, тактика лечения определяется после комплексного психологического тестирования и выбора пола пациентом. У пациентов с более выраженной маскулинизацией или диагнозом, установленным вскоре после рождения, которых регистрируют и воспитывают в мужском поле, терапия препаратами тестостерона помогает добиться мужского фенотипа. Достаточно часто при дефиците 17-ГСДГ-3 из-за выраженной вирилизации в период полового созревания у пациентов происходит формирование мужского гендера. Поэтому при данной форме НФП нередко происходит формирование гендерного несоответствия, что приводит к необходимости проведения гендерно-аффирмативных процедур. В статье представлено описание клинического случая поздней диагностики дефицита 17-ГСДГ-3, связанного c родительской волей. Описаны этапы диагностического процесса и тактика ведения пациента.
Ключевые слова
Для цитирования:
Молашенко Н.В., Калинченко Н.Ю., Иоутси В.А., Гуринович О.С., Бабаева Д.М., Вознесенская А.А., Платонова Н.М., Юкина М.Ю., Колодкина А.А., Пономарева Т.А. Случай дефицита 17β-гидроксистероиддегидрогеназы 3-го типа в практике взрослого эндокринолога. Ожирение и метаболизм. 2023;20(1):73-83. https://doi.org/10.14341/omet12942
For citation:
Molashenko N.V., Kalinchenko N.Yu., Ioutsi V.A., Gurinovich O.S., Babaeva D.M., Voznesenskaya A.A., Platonova N.M., Yukina M.Yu., Kolodkina A.A., Ponomareva T.A. A case of 17-beta-hydroxysteroid dehydrogenase deficiency type 3 in adult endocrinologist practice. Obesity and metabolism. 2023;20(1):73-83. (In Russ.) https://doi.org/10.14341/omet12942
АКТУАЛЬНОСТЬ
Нарушение формирования пола (НФП) — состояние, связанное с клинико-биохимическим проявлением несоответствия между генетическим, гонадным и/или фенотипическим полом [1][2]. Частота встречаемости классических вариантов НФП 46,XY приблизительно 1:20 000. До 2006 г. для описания этой группы заболеваний использовался термин «гермафродитизм». Классификация НФП представлена в таблицах 1, 2.
Дефицит фермента 17β-гидроксистероиддегидрогеназы 3-го типа (17-ГСДГ-3) — одна из редких форм нарушения формирования пола 46,XY, при котором снижается конверсия андростендиона в тестостерон (рис. 1). Фермент представлен только в тестикулярной ткани.
Наличие Y-хромосомы (гена SRY) обуславливает формирование мужского гонадного пола, тогда как развитие мужских гениталий зависит от уровня андрогенов во время внутриутробного периода и чувствительности к ним органов-мишеней. Нарушение биосинтеза тестостерона приводит как к недостаточной вирилизации наружных гениталий, так и недоразвитию внутренних половых органов у мужчин (семенников, семявыносящих протоков, семенных пузырьков, простаты). В надпочечниках и гонадах начальные этапы стероидогенеза одинаковы, а преобразование андростендиона в тестостерон под действием фермента 17-ГСДГ-3 происходит только в яичках [1][2].
При дефиците 17-ГСДГ-3 не происходит достаточной внутриутробной маскулинизации наружных гениталий, за счет чего пациентов часто регистрируют в женском поле при рождении. Особенностью этого варианта НФП является маскулинизация в период пубертата за счет внегонадной конверсии андростендиона в тестостерон.
Клинические проявления дефицита 17-ГСДГ-3 обусловлены остаточной активностью фермента. Чаще всего пациенты с дефицитом 17-ГСДГ-3 и кариотипом 46,XY имеют строение наружных половых органов по женскому типу, в ряде случаев с клиторомегалией. Пациенты имеют слепо заканчивающееся влагалище, также может наблюдаться сращение больших половых губ. Тестикулы чаще всего располагаются в паховых каналах или губомошоночных складках, реже в брюшной полости. Производные вольфовых протоков имеют признаки гипоплазии, производные мюллеровых протоков (матка, маточные трубы, средняя и внутренняя треть влагалища) отсутствуют. Однако в литературе встречаются единичные описания МРТ органов малого таза у этой когорты пациентов. Наружные гениталии редко, но могут иметь амбивалентное строение или черты недостаточно маскулинизированных мужских гениталий.
В период полового созревания под действием гонадотропинов в тестикулах активируется стероидогенез и происходит повышение уровня андростендиона. Под действием внегонадных изоформ фермента 17-ГСДГ (в основном 17-ГСДГ 5-го типа) андростендион конвертируется в тестостерон. Нарастание уровня тестостерона закономерно приводит к вирилизации пациентов в пубертате. В лабораторных анализах у пациентов с дефицитом 17-ГСДГ-3, как правило, определяется сниженный уровень тестостерона. Под действием 17-ГСДГ 1-го и 2-го типов происходит дальнейшая конверсия андростендиона в эстрон и эстрадиол, поэтому у части пациентов развиваются признаки гинекомастии [1–4].
В статье приводится случай пациентки с дефицитом 17-ГСДГ-3, который был подтвержден на основании мультистероидного анализа крови методом тандемной хромато-масс-спектрометрии. Поздняя диагностика заболевания обусловлена нежеланием родителей уточнять генез неправильного строения наружных половых органов.
ОПИСАНИЕ СЛУЧАЯ
Пациентка Х., 20 лет, поступила в Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр эндокринологии» Министерства здравоохранения Российской Федерации в марте 2022 г. с жалобами на изменение строения тела по мужскому типу (широкие плечи, развитая мускулатура), огрубение голоса, рост волос на лице и теле, пальпируемое образование в правой паховой области, отсутствие менструаций. Из анамнеза известно, что при рождении зарегистрирована в женском поле. В возрасте 14 лет обратилась в поликлинику по месту жительства с вышеперечисленными жалобами. Полное обследование до возраста 18 лет не проводилось по религиозным убеждениям родителей. У пациентки есть сестра, здорова, имеет регулярный менструальный цикл. Близкородственный брак родители отрицают. В 18 лет, когда пациентка достигла совершеннолетия и вышла из-под опеки родителей, самостоятельно обратилась для медицинского обследования. В связи с отсутствием менструального цикла, огрублением голоса и прогрессирующей маскулинизацией выполнено кариотипирование — установлен мужской кариотип 46,ХY. По данным осмотра гинекологом: при наружном осмотре область клитора в виде головки полового члена длинной 4 см, вход во влагалище разделен тонкой поперечной перегородкой, атрезия влагалища не видна. Большие половые губы сформированы правильно.
При обследовании обращало на себя внимание: высокий рост 182 см, телосложение по мужскому типу, вес 73 кг, ИМТ 23,3 кг/кв. м избыточное оволосение на лице и теле (гирсутное число по шкале Ферримана–Галлвея 19), гипоплазия грудных желез. В правой паховой области пальпируемое мягко эластическое образование до 3 см в диаметре.
В ходе гормонального анализа выявлено: повышение лютеинизирующего гормона (ЛГ), снижение тестостерона и его свободной фракции относительно референсного интервала (РИ) у мужчин (по отношению к РИ у женщин — повышение показателей), по данным мультистероидного анализа крови: выраженное повышение андростендиона, снижение тестостерона, соотношение тестостерон/андростендион — 0,2 (табл. 3).
Результаты инструментального обследования представлены в табл. 4.
На МРТ органов малого таза: Гипоплазия мошонки. Двусторонний паховый крипторхизм. Гипоплазия предстательной железы. Дополнительная тубулярная структура. ретровезикальной локализации, более вероятно соответствующая гипоплазии левого семенного пузырька. Слепо заканчивающееся дистальная треть влагалища (рис. 2–4). Детальное описание представлено в таблице 4.
По данным УЗИ органов малого таза и паховых каналов: эхо-признаки двустороннего крипторхизма, правое яичко определяется на выходе из пахового канала, левое яичко — в области брюшной полости. За мочевым пузырем определяется жидкость содержащее образование неправильной овальной формы, размерами 4,5х1,5х1,6 см, соединяющееся с уретрой.
По результатам мультиспиральной компьютерной томографии надпочечников: КТ-картина в большей степени соответствует узелковой гиперплазии левого надпочечника.
При осмотре гинекологом: наружные половые органы неправильного строения, клитор увеличен в размерах, длиной до 4 см со сформированной головкой, шириной до 1,5 см (клиторальный индекс — 600 м2). Большие и малые половые губы гипоплазированы, слизистая у входа во влагалище розовая. Мочеиспускательный канал открывается под клитором. Вход во влагалище свободный. Virgo. Мизинец свободно проникает во влагалище. Длина по зонду 6–7 см. Справа в области нижней трети пахового канала с переходом на большую половую губу пальпируется подвижное продолговатое образование размером 3,0х2,5 см, безболезненное при пальпации.
Таким образом, на основании анамнеза и клинической картины (неправильное строение гениталий с признаками гипертрофии клитора, наличие яичка в паховом канале, появление вирилизирующих признаков в пубертате, кариотип 46,ХY), результатов гормонального и инструментального обследования: снижение отношения тестостерон/андростендион менее 0,8, данных МРТ, УЗИ органов малого таза, установлен дефицит 17-ГСДГ-3 как причина нарушения формирования пола.
В отделении проведен консилиум совместно со специалистами Института детской эндокринологии. В ходе беседы с пациенткой поднимался вопрос о ее гендерной идентификации. В амбулаторном порядке пациентка прошла обследование в Московском городском психоэндокринологическом Центре (МГПЭЦ). По заключению специалистов МГПЭЦ: «Образ “Я” определен по маскулинному типу со средними показателями по фемининности и по маскулинности. Образ “мужчины” определен по андрогинному типу со средними значениями по фемининности качеств и по маскулинности. Представление об образе “мужчины” совпадает с общепринятыми социальными представлениями, усвоен в целом верно. В ситуациях полоролевого взаимодействия пациентка стремится демонстрировать и соответствовать мужской половой роли. Образ “женщины” определен по андрогинному типу со средними значениями по фемининности и по маскулинности качеств. Представление об образе “женщины” сформировано недостаточно. Стимулы, связанные с сексуальностью, ассоциируются и с женским, и с мужским образами».
Первоначально пациентка приняла решение о продолжении жизни в женском поле и выразила согласие на проведение оперативного лечения в объеме гонадэктомии с последующим назначением заместительной гормональной терапии эстрогенами в непрерывном режиме. Однако в последующем отказалась от госпитализации для оперативного лечения до принятия своего решения о выборе пола.
Таблица 1. Изменения номенклатуры нарушений формирования пола [2]
Table 1. The changes in sex developement disorders nomenclature [2]
Старая терминология | Новая терминология |
Гермафродитизм | НФП |
Мужской гермафродитизм, неадекватная вирилизация, неполная маскулинизация плода с кариотипом 46ХY | НФП 46,ХY |
Женский гермафродитизм, вирилизация плода с кариотипом 46,ХХ | НФП 46,ХХ |
Истинный гермафродитизм | Овотестикулярное НФП |
ХY-женщина | Полный гонадный дисгенез, 46,ХY |
ХХ-мужчина | 46,ХХ — тестикулярное НФП |
Таблица 2. Классификация нарушений формирования пола [2]
Table 2. The sex developement disorders classification [2]
Хромосомное нарушение формирования пола | НФП 46,ХY | НФП 46,ХХ |
45,Х0 Синдром Шерешевского–Тернера и его варианты. 47,ХХY Синдром Клайнфельтера и его варианты. 45,Х0/46,ХY; 46,ХХ/46,ХY (смешанная овотестикулярная форма НФП, химеризм по половым хромосомам) | Нарушения формирования гонад (яичко) 1.Чистая дисгенезия яичек (синдром Swyer). 2.Смешанная дисгенезия яичек. 3.Синдром эмбриональной регрессии гонад (синдром рудиментарных яичек) | Нарушение формирования гонад (яичник) 1.Овотестикулярное НФП. 2.Тестикулярное НФП (транслокация SRY на Х хромосому, двойная копия SOX9). 3.Дисгенезия гонад |
Дефекты биосинтеза или действия тестостерона 1.Дефекты биосинтеза тестостерона: дефициты 17β-гидроксистероиддегидрогеназы, 5α-редуктазы, дефицит 3β-ГСДГ, STAR-мутации. 2.Дефекты действия тестостерона: синдром нечувствительности к андрогенам (полная и неполная формы). 3.Дефекты рецептора ЛГ: аплазия и гипоплазия клеток Лейдига. 4.Дефекты синтеза и действия анти-мюллерова гормона (синдром персистенции мюллеровых протоков) | Избыток андрогенов 1.Дефицит 21-гидроксилазы. 2.Дефицит 11β-гидроксилазы. 3.Дефицит POR 4.Фетоплацентарное НФП: дефицит ароматазы. 5.Материнское НФП: лютеома беременных; внутриутробная ятрогенная вирилизация |

Рисунок 1. Схема биосинтеза стероидных гормонов
Примечание: P450scc (CYP11A1) — 20,22-десмолаза, или «фермент, расщепляющий боковую цепь холестерина» (scc — от англ. side chain cleavage); StAR — cтероидогенный острый регуляторный белок; P450c17 (CYP17A1) — 17α-гидроксилаза; P450c17 + b5 — 17,20-лиаза (CYP17A1) + cytochrome b5; 3βHSD2 — 3β-гидроксистероиддегидрогеназа, тип 2; 17βHSD1-5 — 17β-гидроксистероиддегидрогеназа, типы 1–5; P450c21 (CYP21A2) — 21-гидроксилаза; P450c11β (CYP11B1) — 11β -гидроксилаза; 11βHSD2 — 11β-гидроксистероиддегидрогеназа, тип 2; P450c11AS (CYP11B2) — альдостеронсинтаза; ДГЭА — дегидроэпиандростерон; 5αR2 — 5α-редуктаза 2,Р450arom — ароматаза.
Figure 1. Steroid hormone biosynthesis pathway
Note. P450scc (CYP11A1) — 20,22-desmolase (cholesterol side-chain cleavage); StAR-steroidogenic acute regulatory protein; P450c17 (CYP17A1) — 17 alpha(α)-hydroxylase; P450c17 + b5-17,20-lyase (CYP17A1) + cytochrome b5; 3βHSD2 — 3β-hydroxysteroid dehydrogenase, type 2; 17βHSD1-5 — 17β-hydroxysteroid dehydrogenase, types 1-5; P450c21 (CYP21A2) — 21-hydroxylase; P450c11β (CYP11B1) — 11β-hydroxylase; 11βHSD2 — 11β-hydroxysteroid dehydrogenase, type 2; P450c11AS (CYP11B2)-aldosterone synthase; ДГЭА — dehydroepiandrosterone; 5αR2 — 5α-reductase 2; Р450arom — aromatase.

Рисунок 2 а, б. МРТ органов малого таза пациентки Х, Т2-ВИ, корональная плоскость.
Примечание: Гонады в паховых областях (стрелки).
Правое яичко (рис. 2а) расположено в области наружного пахового кольца, имеет правильную овальную форму, четкие контуры, размеры 3,8х2,5х2,1 см (объем 10,37 см3), структура яичка однородная. Придаток яичка не определяется.
Левое яичко (рис. 2б) расположено в области внутреннего пахового кольца, имеет правильную овальную форму, четкие контуры, размеры 2,6х2,1х3,3 см (объем 9,36 см3), структура яичка однородная. Придаток яичка не определяется.
Figure 2 a,b. MRI of the patient X pelvis, T2-WI, coronal plane.
Note: Gonads in the groin (arrows).
The right testicle (Fig. 2a) of an oval shape, legible contours, 3.8x2.5x2.1 cm of size (volume 10.37 cm3), with homogeneous structure is located in the external inguinal ring area. The epididymis is not defined.
The left testicle (Fig. 2b) of an oval shape, legible contours, 2.6x2.1x3.3 cm of size (volume 9.36 cm3), with homogeneous structure is located in the internal inguinal ring area. The epididymis is not defined.
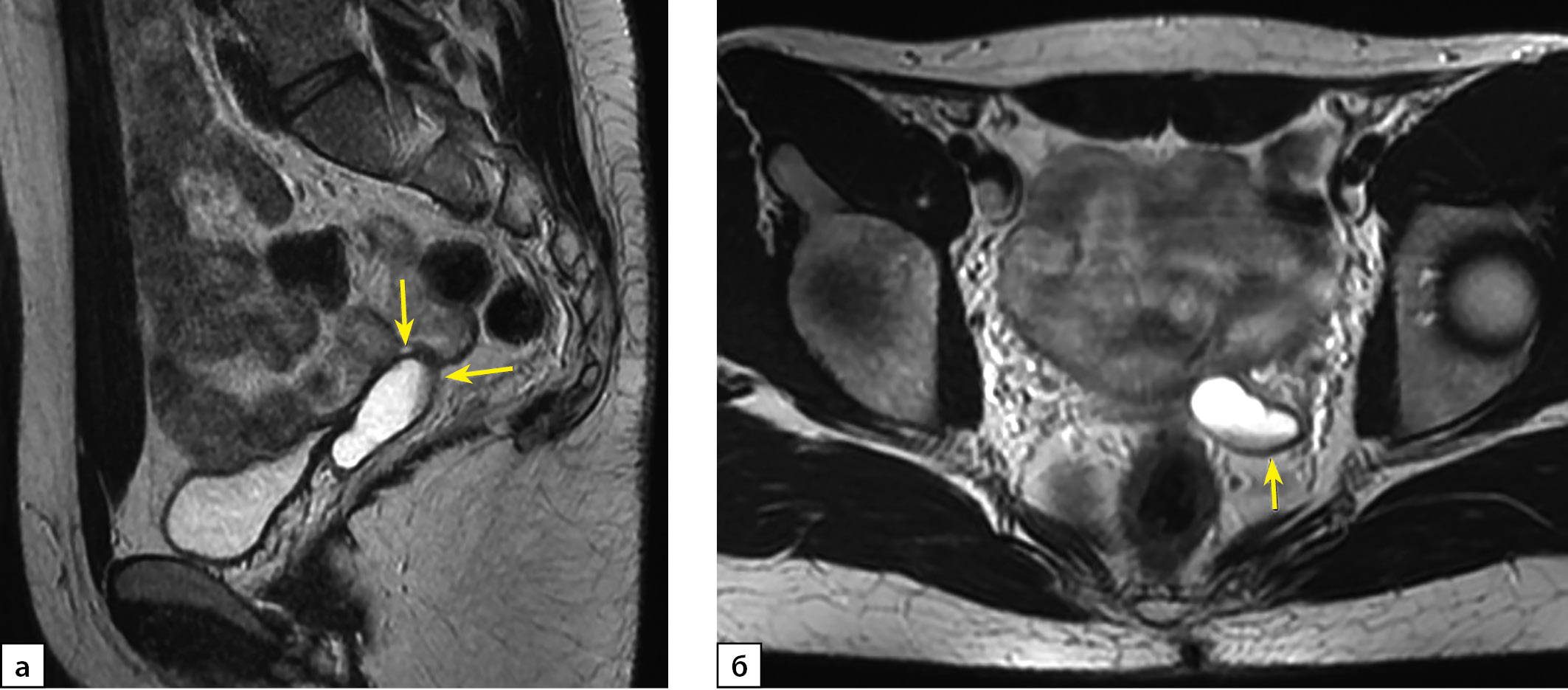
Рисунок 3 а, б. МРТ органов малого таза пациентки Х, Т2-ВИ, сагиттальная (а) и аксиальная (б) плоскости.
Примечание. Тубулярная структура ретровезикальной локализации, более вероятно соответствующая гипоплазии левого семенного пузырька. Справа семенной пузырек не визуализируется. Рис. а, б: кзади от мочевого пузыря, левее средней линии, определяется тубулярная структура с жидкостным содержимым, с неполными перегородками, максимальной толщиной стенки до 2,5 см, протяженностью до 5 см. МР-сигнал соответствует серозному содержимому с уровнем седиментации (стрелки).
Figure 3 a, b. MRI of the patient X pelvis, T2-WI, saggital (a) and axial (b) plane.
Note. The retrovesical formation of tubular structure is more likely to be the left seminal vesicle hypoplasia. The right seminal vesicle is not visible.Fig. a, b: a formation of tubular structure filled with fluid, with incomplete partitions, maximum wall thickness up to 2.5 cm and lenght up to 5 cm is defined posterior to the bladder, to the left of the midline. The MR signal corresponds to serous liquid with legible sedimentation level (arrows).

Рисунок 4. МРТ органов малого таза пациентки Х, Т2 ВИ, сагиттальная плоскость.
Примечание: Гипоплазированная ткань предстательной железы (стрелка).
Figure 4. MRI of the patient X pelvis, T2-WI, saggital plane.
Note: prostate hypoplasia (arrow).
Таблица 3. Данные лабораторного обследования в ходе госпитализации в Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр эндокринологии» Министерства здравоохранения Российской Федерации
Table 3. The results of laboratory diagnostics performed in the Endocrinology Research Centre, Moscow
Название показателя | Результат | РИ |
ФСГ | 5,04 | ж (фолликулярная фаза): 1,9–11,7 Ед/л (лютеиновая фаза): 1,4–9,6 Ед/л м: 1,6–9,7 Ед/л |
ЛГ | 38,5 | ж (фолликулярная фаза): 2,6–12,1 Ед/л (лютеиновая фаза): 0,8–15,5 Ед/л м: 2,5–11,0 Ед/л |
Тестостерон общий | 8,03 | ж: 0,7–2,7 нмоль/л м: 11,0–28,2 нмоль/л |
Тестостерон свободный | 142,0 | ж: 4,7–24,9 пмоль/л м: 180,0–410,0 пмоль/л |
ГСПГ | 37,74 | ж: 27,1–128,0 нмоль/л м: 18,3–54,1 нмоль/л |
Дегидроэпиандростеронсульфат | 11,34 | ж: 1,65–11,0 мкмоль/л м: 1,2–13,4 мкмоль/л |
Антимюллеров гормон | 23,5 | ж: 1,22–11,7 нг/мл м: 0,8–14,6 нг/мл |
17-OH прогестерон | 12,6 | ж (фолликулярная фаза): 0,8–7,0 нмоль/л (лютеинова фаза): 1,4–14,2 нмоль/л м:0,6–11,8 нмоль/л |
Эстрадиол | 109,33 | ж: 97,0–592,0 пмоль/л м: 19,7–242,0 пмоль/л |
Пролактин | 382,1 | ж: 94,0–500,0 мЕд/л м: 66,0–436,0 мЕд/л |
Кортизол, утро | 390,9 | 171,0–536,0 нмоль/л |
ТТГ | 0,568 | 0,25–3,5 мМЕ/л |
Дигидротестостерон | 456,0 п | ж: 59–572 пг/мл м: 143–842 пг/мл |
Мультистероидный анализ крови | ||
Альдостерон | 290,0 | 70,9–980,0 пмоль/л |
Кортизол | 171,0 | 140,0–630,0 нмоль/л |
Кортизон | 58,8 | 33,0–97,0 нмоль/л |
21-дезоксикортизол | 0,01 | 0–1,2 нмоль/л |
Кортикостерон | 3,2 | 1,0–50,0 нмоль/л |
11-дезоксикортизол | 0,6 | 0–10,0 нмоль/л |
Андростендион | 44,3 | 0,8–9,0 нмоль/л |
Тестостерон/андростендион | 0,2 | > 0,8 |
11-дезоксикортикостерон | 0,09 | 0–0,58 нмоль/л |
Тестостерон | 7,2 | ж: 0,3–2,5 нмоль/л м: 10,0–35,0 нмоль/л |
17-гидроксипрогестерон | 5,4 | 0,2–6,0 нмоль/л |
Дегидроэпиандростерон | 22,4 | 4–50 нмоль/л |
17-гидроксипрегненолон | 7,2 | 0–20,0 нмоль/л |
Прогестерон | 0,11 | ж: 0,1–1,5 нмоль/л м: 0,1–1,0 нмоль/л |
Прегненолон | 4,3 | 0–7,0 нмоль/л |
Таблица 4. Данные инструментального обследования в ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Министерства здравоохранения Российской Федерации
Table 4. The results of instrumental diagnostics performed in the Endocrinology Research Centre, Moscow
Название метода | Описание |
МРТ органов малого таза | На сериях МР-томограмм малого таза, выполненных в режимах Т1, Т2, DWI, жидкости в полости малого таза не выявлено. Мочевой пузырь наполнен, стенки его не утолщены. Содержимое мочевого пузыря гомогенное. Структура стенок не изменена, слои дифференцируются. Наружные контуры мочевого пузыря четкие. Дистальные отделы мочеточников не расширены, с четкими контурами. Кзади от мочевого пузыря, левее средней линии, определяется тубулярная структура с жидкостным содержимым, с неполными перегородками, максимальной толщиной стенки до 2,5 см, протяжённостью до 5 см. Содержимое образования однородное, МР-сигнал соответствует серозному содержимому с уровнем седиментации. Определяется слепо заканчивающаяся дистальная часть влагалища, длиной 4 см, полость шириной 4 мм. Гипоплазированная ткань предстательной железы слабо дифференцируется. Мошонка не сформирована. Правое яичко расположено в области наружного пахового кольца, имеет правильную овальную форму, четкие контуры, размер 3,8х2,5х2,1 см (объем 10,37 см3), структура яичка однородная. Придаток яичка не определяется. Левое яичко расположено в области внутреннего пахового кольца, имеет правильную овальную форму, четкие контуры, размеры 2,6х2,1х3,3 см (объем 9,36 см3), структура яичка однородная. Придаток яичка не определяется. Отмечается сформированный половой член. Прямая кишка не изменена, с наличием в просвете содержимого. Межпетельно слева, между листками брюшины, отмечается кистозное образование до 9 мм (дупликационная киста брюшины?). Тазовые лимфатические узлы не увеличены, структура их не изменена. Мягкие ткани, скелет малого таза на уровнях сканирования не изменены. Заключение: Гипоплазия мошонки. Двусторонний паховый крипторхизм. Гипоплазия предстательной железы. Дополнительная тубулярная структура ретровезикальной локализации слева, может соответствовать гипоплазии семенного пузырька. Правый семенной пузырек не дифференцируется. Слепо заканчивающаяся дистальная треть влагалища. |
УЗИ органов | За мочевым пузырем определяется жидкость содержащее образование неправильной овальной формы, размер 4,5х1,5х1,6 см, соединяющееся с уретрой. Справа на выходе из пахового канала определяется яичко однородной структуры, неправильной овальной формы с втяжением в верхнем полюсе, с кальцинатом в капсуле с эхотенью, размер 5,2х1,7х2,7 см, у верхнего полюса и в области втяжения определяется два анэхогенных округлых образования д. 0,3 см — кисты придатка яичка? Слева в брюшной полости определяется яичко овальной формы, размер 3,8х2,1х2,7 см, однородной структуры, рядом определяются петли кишечника. |
Мультиспиральная КТ надпочечников | Правый надпочечник не увеличен: тело 5,5 мм, медиальная ножка — 4,5 мм, латеральная — 3 мм. При контрастном усилении отмечается диффузно неоднородное накопление контрастного препарата надпочечником. Левый надпочечник имеет неровные, четкие контуры: тело 6,9 мм, в области основания медиальной ножки узелковое утолщение размером до 6х7 мм, плотностью в нативную фазу до 8 HU, распределение плотности по фазам (арт./веноз./отсроч.): 70/130/27 HU; в области латеральной ножки узелковое утолщение до 6,5 мм плотностью в нативную фазу до 11 HU, распределение плотности по фазам (арт./веноз./отсроч.): 87/91/62 HU. |
ОБСУЖДЕНИЕ
Дефицит 17-ГСДГ-3 впервые описан J. Saez и соавт. в 1971 г и относится к аутосомно-рецессивным заболеваниям. Распространенность дефицита 17-ГСДГ-3 точно не изучена. В Нидерландах распространенность заболевания 1:147 000 новорожденных мальчиков [1]. В регионах с высокой частотой близкородственных браков, например, в Секторе Газа, частота выявления дефицита 17-ГСДГ-3 достигает 1 на 100–300 новорожденных мальчиков. К настоящему времени описано 70 мутаций в гене HSD17B3, и все они ассоциированы с НФП 46,XY, наиболее распространенные: c.277 + 4A > T (Европа, Америка), R80Q (Азия), A203V(латинские страны), C206X (Африка) [3–5]. Мутации чаще встречаются в экзонах 3, 9 и 10. Большая часть мутаций приводит к полной потере активности фермента 17-ГСДГ-3, при мутации R80Q сохраняется некоторая его активность [1–9].
При дефиците 17-ГСДГ-3 отсутствует корреляция генотип-фенотип, в одной семье при одинаковой мутации у пациентов могут быть разные фенотипические проявления заболевания. Дефицит 17-ГСДГ-3 — заболевание, которое обычно первоначально диагностируется неверно. Как правило, пациентам ставится диагноз «синдром нечувствительности к андрогенам» в допубертатном возрасте и «дефицит 5α-редуктазы 2-го типа» в период полового созревания. До наступления пубертата пациенты с дефицитом 17-ГСДГ-3 чаще всего обращаются с жалобами на образования в области паховых каналов или губомошоночных складках, такая эктопия яичек характерна для синдрома нечувствительности к андрогенам. При наступлении полового созревания для пациенток, которые зарегистрированы и воспитываются в женском поле и которым не выполнено удаление гонад, характерна первичная аменорея и развитие вирилизации: грубеет голос, усиливается гирсутизм, нарастает маскулинизация, клиторомегалия может достигать 5–8 см. Такая клиническая картина очень похожа на дефицит 5α-редуктазы 2-го типа. За счет ароматизации андростендиона в эстрон у части пациентов с дефицитом 17-ГСДГ-3 наблюдается гинекомастия в пубертате [1–9].
Остаются дискутабельными причины отсутствия маскулинизации в период внутриутробного развития и ее последующее развитие в пубертате. В настоящее время наиболее признанной является роль 17-ГСДГ 5-го типа, также участвующей в конверсии андростендиона в тестостерон в яичках, простате, надпочечниках и печени, помимо конверсии андростендиона в тестостерон под воздействием 17-ГСДГ-3 в яичках. Активность фермента 17-ГСДГ 5-го типа минимальна в период внутриутробного развития и максимальна во второй декаде жизни. Дополнительным механизмом является ароматизация андростендиона плацентой, таким образом, у плода дополнительно снижается внегонадное преобразование андростендиона в тестостерон [1–10]. В настоящее время частичная вирилизация гениталий у мальчиков во внутриутробном периоде при данном синдроме рассматривается как результат достаточной активности «альтернативного» пути синтеза дигидротестостерона у эмбриона.
Диагностика дефицита 17-ГСДГ-3 в период пубертата основана на резко сниженном соотношении тестостерон/андростендион, которое при дефиците 17-ГСДГ-3 всегда менее 0,8. У детей до наступления пубертата данное соотношение необходимо оценивать после 3-дневной пробы с человеческим хорионическим гонадотропином. [9][10] Методом выбора анализа стероидных гормонов является тандемная масс-спектрометрия, при применении обычных методов уровень тестостерона может быть ложно завышен из-за его перекрестной реакции с андростендионом.
Пациентам с дефицитом 17-ГСДГ-3, как правило, предписывается женский пол и они воспитываются соответственно. В таких случаях обычно рекомендуется гонадэктомия, учитывая риск развития маскулинизации и назначение терапии эстрогенами с возраста пубертата. Если диагноз дефицита 17- ГСДГ-3 устанавливается в период пубертата, когда манифестирует вирилизация, то тактика лечения определяется после комплексного психологического тестирования и выбора пола пациентом. У пациентов, которых регистрируют и воспитывают в мужском поле (как правило, у них выражена маскулинизация или диагноз установлен после рождения), терапия препаратами тестостерона, помогает добиться мужского фенотипа. В дальнейшем этим пациентам показана хирургическая коррекция наружных гениталий [1][3].
Два важных вопроса всегда волнуют практических врачей в отношении пациентов с дефицитом 17-ГСДГ-3: насколько пациенты фертильны и возможно ли развитие злокачественных новообразований тестикул. В статье китайских специалистов [3] приведен анализ гистологии тестикул 49 пациентов с дефицитом 17-ГСДГ-3. У 9 пациентов младше 1 года гистологическая картина соответствовала норме. Таким образом, по мнению авторов, во внутриутробном периоде, возможно, из-за высокого уровня андростендиона, либо превращения его в тестостерон под действием других изоформ 17-ГСДГ, происходит нормальное развитие тестикулярной ткани. Среди 18 пациентов в возрасте от 1 года до 14 лет, у 8 (44%) определялось достаточное количество половых клеток, у 6 (33%) выявлена гиперплазия клеток Лейдига. Среди 22 пациентов в возрасте старше 14 лет, только у 22% (5 человек) определялось нормальное количество половых клеток, у 67% (15 человек) выявлена гиперплазия клеток Лейдига. У двух пациентов (1%) выявлены гистологические признаки злокачественного новообразования, у одного, в возрасте 13 лет, отмечалось положительное иммуноокрашивание препарата на плацентарную щелочную фосфатазу- маркера потенциально злокачественной трансформации половых клеток, у другого пациента, в возрасте 21 лет, была обнаружена лейдигома правого яичка. По результатам проведенного исследования выявлено, что с возрастом у больных ухудшается сперматогенез и увеличивается риск развития гиперплазии клеток Лейдига. Авторы предполагают, что, при раннем проведении орхипексии может сохраниться сперматогенез, хотя до настоящего времени не описано случаев фертильности у пациентов при дефиците 17-ГСДГ-3. Кроме того, по мнению авторов исследования, проведение оперативного лечения в максимально ранние сроки (орхипексия у пациентов, воспитывающихся в мужском поле, либо гонадэктомия при воспитании в женском поле), может служить профилактикой развития злокачественных новообразований тестикул [3].
В статье бразильских исследователей проведен анализ представленных в литературе описаний гистологии тестикул 40 пациентов с дефицитом 17-ГСДГ-3. У 5% пациентов были выявлены герминогенные опухоли. Учитывая невысокий процент выявленных новообразований, авторы делают вывод, что нет оснований не рекомендовать пациентам сохранять или изменять пол на мужской из-за риска малигнизации. Исключение могут составлять случаи, когда тестикулы не могут быть низведены в мошонку. [4]
Достаточно часто при дефиците 17-ГСДГ-3 из-за выраженной вирилизации в пубертате у пациентов происходит смена женской гендерной роли на мужскую. Поэтому, смена половой принадлежности при данной форме НФП происходит у 39—64% пациентов, воспитываемых в женском поле, особенно часто такие случаи встречаются среди арабской когорты пациентов в Израиле [11-13]. По данным китайских исследователей, среди 24 пациентов 20 (83%) предпочли остаться в женском поле, 3 (12,5%) изменили пол с женского на мужской, 1 пациент (4,5%) воспитывался в мужском поле. Пациентки, которым была произведена гонадэктомия в раннем возрасте, получающие заместительную терапию, в большинстве случаев удовлетворены своей половой принадлежностью [3][13–16].
ЗАКЛЮЧЕНИЕ
Наш клинический случай демонстрирует важную роль физиологической и социальной составляющей, определившую судьбу пациентки. Диагноз пациентке мог быть установлен в подростковом возрасте, но из-за решения родителей и зависимости пациентки от их мнения обследование было прервано, в результате чего она смогла обратиться за медицинской помощью только по достижении совершеннолетия и выходе из-под родительской опеки. Длительное пребывание в несоответствии паспортного пола и внешнего вида, возможно, изменение женской гендерной роли на мужскую под действием андрогенов, привело к началу психологических проблем и трудностям половой самоидентификации. В настоящее время пациентка находится на «психологическом распутье» и не может принять решение о своей судьбе, остаться ли ей в женском поле либо сменить пол на мужской, и нуждается в профессиональной консультации врача сексолога и психотерапевта. По желанию пациентки она продолжает консультироваться со специалистами МГПЭЦ и отложила принятие решения о проведении оперативного лечения.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Пациентка была госпитализирована в ФГБУ «НМИЦ эндокринологии» МЗ РФ и проходила обследование за счет средств фонда ОМС. Исследование гормонального профиля методом мультистероидного анализа выполнялось в рамках госзадания, код научной темы, присвоенный учредителем (организацией): 121030100030-3.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Участие авторов. Молашенко Н.В. — курация пациентки в стационаре, выбор тактики обследования и лечения, написание текста рукописи; Калинченко Н.Ю. — выбор тактики обследования и лечения, написание текста рукописи; Иоутси В.А. — лабораторное обследование, редактирование текста рукописи; Гуринович О.С. — клиническое обследование пациентки, редактирование текста; Бабаева Д.М. — инструментальное обследование пациентки, редактирование текста; Вознесенская А.А. — набор материала, редактирование текста; Платонова Н.М. — клиническое обследование пациентки, написание текста рукописи; Юкина М.Ю. — клиническое обследование пациентки, редактирование текста; Колодкина А.А. — выбор тактики обследования и лечения, написание текста рукописи; Пономарева Т.А. — клиническое обследование пациентки, редактирование текста. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациента. Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Ожирение и метаболизм».
Список литературы
1. Колодкина А.А., Калинченко Н.Ю., Нижник А.Н., и др. Клиническая, гормональная и молекулярно-генетическая характеристики двух случаев нарушения формирования пола 46XY, обусловленного дефицитом 17β-гидроксистероид-дегидрогеназы 3-го типа // Проблемы эндокринологии. — 2011. — Т. 57. — №.3. — С. 25-30.
2. Калинченко Н.Ю., Тюльпаков А.Н. Новая классификация заболеваний, связанных с нарушением формирования пола. Обсуждение международного консенсуса по пересмотру терминологии и классификации гермафродитизма // Вестник репродуктивного здоровья. — 2008.-№ 12.-С. 49-51.
3. Yang Z, Ye L, Wang W, et al. 17β-Hydroxysteroid dehydrogenase 3 deficiency: Three case reports and a systematic review. J Steroid Biochem Mol Biol. 2017;(174):141-145. doi: https://doi.org/10.1016/j.jsbmb.2017.08.012
4. Mendonca BB, Gomes NL, Costa EM, et al. 46,XY disorder of sex development (DSD) due to 17β-hydroxysteroid dehydrogenase type 3 deficiency. J Steroid Biochem Mol Biol. 2017;165(Pt A):79-85. doi: https://doi.org/10.1016/j.jsbmb.2016.05.002
5. Gonçalves CI, Carriço J, Bastos M, Lemos MC. Disorder of sex development due to 17-beta-hydroxysteroid dehydrogenase type 3 deficiency: A case report and review of 70 different HSD17B3 mutations reported in 239 patients. Int J Mol Sci. 2022;23(17):10026. doi: https://doi.org/10.3390/ijms231710026
6. Geissler WM, Davis DL, Wu L, et al. Male pseudohermaphroditism caused by mutations of testicular 17 beta-hydroxysteroid dehydrogenase 3. Nat. Genet. 1994;7(1):34-39. doi: https://doi.org/10.1038/ng0594-34
7. Luu V.The Analysis and characteristics of multiple types of human 17 beta-hydroxysteroid dehydrogenase. J. Steroid Biochem. Mol. Biol. 2001;76(1-5): 143-151. doi: https://doi.org/10.1016/s0960-0760(00)00155-2
8. Boehmer ALM, Brinkmann AO, Sandkuijl LA, et al. 17β-Hydroxysteroid Dehydrogenase-3 Deficiency: Diagnosis, Phenotypic Variability, Population Genetics, and Worldwide Distribution of Ancient and de Novo Mutations1. J Clin Endocrinol Metab. 1999;84(12):4713-4721. doi: https://doi.org/10.1210/jcem.84.12.6174
9. Faisal Ahmed S, Iqbal A, Hughes IA. The testosterone:androstenedione ratio in male undermasculinization. Clin Endocrinol (Oxf). 2000;53(6):697-702. doi: https://doi.org/10.1046/j.1365-2265.2000.01166.x
10. George MM, New MI, Ten S, et al. The clinical and molecular heterogeneity of 17betaHSD-3 enzyme deficiency. Horm Res Paediatr. 2010;74(4): 229-240. doi: https://doi.org/10.1159/000318004
11. Rosler A, Silverstein S, Abeliovich D. A (R80Q) mutation in 17 beta-hydroxysteroid dehydrogenase type 3 gene among Arabs of Israel is associated with pseudohermaphroditism in males and normal asymptomatic females. J. Clin.Endocrinol. Metab. 1996;81(5):1827-1831. doi: https://doi.org/10.1210/jcem.81.5.8626842
12. Ben Rhouma B, Kallabi F, Mahfoudh N, et al. Novel cases of Tunisian patients with mutations in the gene encoding 17β-hydroxysteroid dehydrogenase type 3 and a founder effect. J Steroid Biochem Mol Biol. 2017;(165):86-94. doi: https://doi.org/10.1016/j.jsbmb.2016.03.007
13. Chuang J, Vallerie A, Breech L, et al. Complexities of gender assignment in 17β-hydroxysteroid dehydrogenase type 3 deficiency: is there a role for early orchiectomy? Int J Pediatr Endocrinol. 2013;2013(1):15. doi: https://doi.org/10.1186/1687-9856-2013-15
14. Lee Y.S., Kirk J.M., Stanhope R.G., et al. Phenotypic variability in 17beta-hydroxysteroid dehydrogenase-3 deficiency and diagnostic pitfalls. Clin Endocrinol (Oxf.) 2007;67(1):20-28. doi: https://doi.org/10.1111/j.1365-2265.2007.02829.x
15. Mendonca BB, Inacio M, Arnhold IJ, et al. Male pseudohermaphroditism due to 17 beta-hydroxysteroid dehydrogenase 3 deficiency. Diagnosis, psychological evaluation, and managemen. Medicine. 2000;79(5):299-309. doi: https://doi.org/10.1097/00005792-200009000-00003
16. Park D, Lee PA, Witchel SF. Progressive Virilization of a Pubertal Phenotypic Female: 17β-Hydroxysteroid Dehydrogenase Deficiency. J Pediatr Adolesc Gynecol. 1996;9(1):9-11. doi: https://doi.org/10.1016/S1083-3188(96)70003-7
Об авторах
Н. В. МолашенкоРоссия
Молашенко Наталья Валерьевна, кандидат медицинских наук
117036, Москва, ул. Дмитрия Ульянова, д. 11
Н. Ю. Калинченко
Россия
Калинченко Наталья Юрьевна, кандидат медицинских наук
Москва
В. А. Иоутси
Россия
Иоутси Виталий Алексеевич, кандидат химических наук
Москва
О. С. Гуринович
Россия
Гуринович Ольга Сергеевна
Москва
Д. М. Бабаева
Россия
Бабаева Диана Мажлумовна
Москва
А. А. Вознесенская
Россия
Вознесенская Анастасия Александровна
Москва
Н. М. Платонова
Россия
Платонова Надежда Михайловна, доктор медицинских наук
Москва
М. Ю. Юкина
Россия
Юкина Марина Юрьевна, кандидат медицинских наук
Москва
ResearcherID: P-5181-2015
А. А. Колодкина
Россия
Колодкина Анна Александровна кандидат медицинских наук
Москва
Т. А. Пономарева
Россия
Пономарева Татьяна Алексеевна
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Схема биосинтеза стероидных гормонов | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(313KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2 а, б. МРТ органов малого таза пациентки Х, Т2-ВИ, корональная плоскость | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(176KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3 а, б. МРТ органов малого таза пациентки Х, Т2-ВИ, сагиттальная (а) и аксиальная (б) плоскости | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(230KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. МРТ органов малого таза пациентки Х, Т2 ВИ, сагиттальная плоскость | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(135KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Молашенко Н.В., Калинченко Н.Ю., Иоутси В.А., Гуринович О.С., Бабаева Д.М., Вознесенская А.А., Платонова Н.М., Юкина М.Ю., Колодкина А.А., Пономарева Т.А. Случай дефицита 17β-гидроксистероиддегидрогеназы 3-го типа в практике взрослого эндокринолога. Ожирение и метаболизм. 2023;20(1):73-83. https://doi.org/10.14341/omet12942
For citation:
Molashenko N.V., Kalinchenko N.Yu., Ioutsi V.A., Gurinovich O.S., Babaeva D.M., Voznesenskaya A.A., Platonova N.M., Yukina M.Yu., Kolodkina A.A., Ponomareva T.A. A case of 17-beta-hydroxysteroid dehydrogenase deficiency type 3 in adult endocrinologist practice. Obesity and metabolism. 2023;20(1):73-83. (In Russ.) https://doi.org/10.14341/omet12942

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































