Перейти к:
Влияние метформина на транскриптом и адипокином адипоцитов локальных жировых депо пациентов с ишемической болезнью сердца
https://doi.org/10.14341/omet12743
Аннотация
Обоснование. Имеющиеся на сегодняшний день сведения о влиянии метформина на транскриптомную и секреторную способность адипоцитов жировой ткани (ЖТ) человека немногочисленны и противоречивы. В исследовании проанализировано, модулирует ли метформин in vitro экспрессию генов и секрецию адипонектина и лептина в ЖТ подкожной, эпикардиальной и периваскулярной локализации пациентов с ишемической болезнью сердца (ИБС).
Цель. Оценить влияние метформина в различных концентрациях (1 и 10 ммоль/л) на уровень экспрессии генов адипонектина и лептина и их содержание в адипоцитах подкожной, эпикардиальной и периваскулярной ЖТ пациентов с ИБС.
Материалы и методы. В исследование были включены пациенты с ИБС и показаниями к прямой реваскуляризации миокарда методом аортокоронарного шунтирования. При проведении операции получены биоптаты подкожной ЖТ (ПЖТ), эпикардиальной (ЭЖТ) и периваскулярной (ПВЖТ) по 3–5 г, которые служили источниками адипоцитов. Изолированные адипоциты культивировали в течение 24 ч с добавлением метформина (1 и 10 ммоль/л) и без него. Через сутки инкубации определяли экспрессию генов ADIPOQ и LEP и уровень секреции адипонектина и лептина в культуральной среде адипоцитов. Статистическую обработку проводили с помощью пакета программ GraphPad Prism 6 (GraphPad Software, La Jolla, CA, USA) и Statistica software, 6.1 (Dell Software, Inc., Round Rock, TX, USA).
Результаты. Адипоциты ЭЖТ и ПВЖТ пациентов с ИБС характеризовались дисбалансом в системе адипокинов, проявляющимся низким уровнем экспрессии адипонектина и высокой экспрессией лептина в сравнении с адипоцитами ПЖТ. Метформин повышал уровень экспрессии ADIPOQ в ЖТ и его секрецию адипоцитами независимо от их локализации, при этом низкая концентрация (1 ммоль/л) в адипоцитах ЭЖТ оказывала более сильный эффект в сравнении с 10 ммоль/л. Метформин разнонаправленно влиял на уровень лептина в адипоцитах, что зависело от их локализации: как в низкой (1 ммоль/л), так и в высокой концентрации (10 ммоль/л) препарат снижал уровень экспрессии LEP в адипоцитах ПЖТ и секрецию белка адипоцитами данной локализации. На адипоциты ЭЖТ метформин не оказывал значимого влияния. В ПВЖТ препарат усиливал экспрессию и секрецию лептина независимо от концентрации.
Заключение. Метформин оказывает прямое влияние на адипоциты ПЖТ, ЭЖТ и ПВЖТ и способен модулировать уровень экспрессии генов адипокинов, в частности адипонектина и лептина, и их секрецию, что является перспективной стратегией для поддержания баланса адипокинов ЖТ, особенно эпикардиальной и периваскулярной локализации.
Для цитирования:
Дылева Ю.А., Груздева О.В., Белик Е.В., Бородкина Д.А., Синицкий М.Ю., Иванов С.В., Барбараш О.Л. Влияние метформина на транскриптом и адипокином адипоцитов локальных жировых депо пациентов с ишемической болезнью сердца. Ожирение и метаболизм. 2023;20(1):49-59. https://doi.org/10.14341/omet12743
For citation:
Dyleva Yu.A., Gruzdeva O.V., Belik E.V., Borodkina D.A., Sinitskiy M.Yu., Ivanov S.V., Barbarash O.L. Effect of metformin on transcriptome and adipokinome of adipocytes of local fat deposts of patients with ischemic heart disease. Obesity and metabolism. 2023;20(1):49-59. (In Russ.) https://doi.org/10.14341/omet12743
ОБОСНОВАНИЕ
Метформин (диметилбигуанидин) является производным галегина (изопренильное производное гуанидина) и представителем класса бигуанидов. Впервые синтезирован и протестирован был в 1920-х гг., хотя в клиническое использование введен только в 1950-е гг. [1].
Согласно рекомендациям Американской диабетической ассоциации (ADA), из всех противодиабетических препаратов метформин в настоящее время является рекомендуемым препаратом первой линии для лечения диабета 2 типа (СД2), значительно снижающим вес [2]. В то же время, несмотря на его клиническое применение более 60 лет, молекулярные механизмы действия метформина остаются предметом споров.
Гипогликемический эффект метформина реализуется в основном за счет снижения уровня глюкозы посредством ингибирования глюконеогенеза и гликогенолиза в печени. Помимо влияния на углеводный обмен, описаны эффекты метформина на отдельные звенья липидного обмена. Среди плейотропных эффектов метформина выделяют способность улучшать эндотелиальную функцию и микроциркуляцию, противовоспалительную активность [3]. Кроме того, в исследовании по профилактике диабета (the Diabetes Prevention Study) показано, что метформин значимо, в несколько раз, и устойчиво (в течение 10 лет наблюдения) снижает вес, при условии высокой приверженности [4]. Подобные результаты о позитивном влиянии метформина на потерю веса и снижение объемов висцеральной жировой ткани (ЖТ) у людей и мышей продемонстрированы и в других исследованиях [5][6].
В последнее время все больше данных свидетельствует в пользу способности метформина влиять на эндокринную функцию ЖТ человека, хотя они не столь многочисленны. Стоит отметить, что представление о ЖТ как об активном эндокринном органе сформировалась только после открытия двух секреторных продуктов адипоцитов — адипонектина и лептина. На сегодняшний день имеются данные о способности метформина регулировать секрецию адипокинов. Дисбаланс в системе адипокинов способствует развитию адипозопатии и связанных с этим патологическим процессом заболеваний. В частности, аберрантное продуцирование адипокинов коррелирует с развитием и прогрессированием ожирения, атеросклероза, СД2 [7–10].
Благодаря этим свойствам ЖТ представляет интерес с позиции изучения фармакологического воздействия с целью поддержания адипокинового баланса. Принимая во внимание тот факт, что все больше появляется данных о способности метформина регулировать метаболизм адипоцитов, изучение возможных плейотропных эффектов метформина на функциональную активность ЖТ является особенно перспективным.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить влияние метформина в различных концентрациях (1 и 10 ммоль/л) на уровень экспрессии генов адипонектина и лептина и их содержание в адипоцитах подкожной, эпикардиальной и периваскулярной ЖТ пациентов с ишемической болезнью сердца (ИБС).
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. НИИ КПССЗ.
Время исследования. Период проведения исследования начинается с февраля 2019 г. и заканчивается в июне 2021 г.
Изучаемые популяции
Обследована одна популяция.
Критерии включения: ИБС; возраст до 75 лет.
Критерии исключения: наличие СД 1 и 2 типа в анамнезе и/или выявленного при обследовании в период госпитализации;, инфаркт миокарда (ИМ; ), наличие клинически значимых сопутствующих заболеваний (анемия, почечная и печеночная недостаточность, онкологические и инфекционно-воспалительные заболевания в период обострения, аутоиммунные заболевания).
Способ формирования выборки из изучаемой популяции
Выборка сформирована путем сплошного включения наблюдений.
Дизайн исследования
Интервенционное одноцентровое одновыборочное одномоментное контролируемое исследование.
Описание медицинского вмешательства (для интервенционных исследований)
Получение биоматериала
При проведении операции коронарного шунтирования были получены биоптаты ЖТ (3–5 г) подкожной, эпикардиальной и периваскулярной локализации. Биоптаты подкожной ЖТ (ПЖТ) получали из подкожной клетчатки нижнего угла средостенной раны, образцы эпикардиальной ЖТ (ЭЖТ) — из правых отделов сердца (правого предсердия и правого желудочка) — зон его наибольшего присутствия, биоптаты периваскулярной ЖТ (ПВЖТ) — области правой коронарной артерии. Образцы ЖТ помещали в сбалансированный солевой раствор Хэнкса (SigmaAldrich, США) с добавлением пенициллина (100 U/L), стрептомицина (100 мг/мл), гентамицина (50 мкг/мл) и доставляли в лабораторию.
Материалы и методы
В исследование были включены пациенты с ИБС с показаниями к коронарному шунтированию по данным коронарографии. Наличие СД 1 и 2 типа, клинически значимых сопутствующих заболеваний (анемия, почечная и печеночная недостаточность, онкологические и инфекционно-воспалительные заболевания в период обострения, аутоиммунные заболевания) определяли по данным анамнеза, путем опроса при первичном осмотре пациента. Пациенты с впервые выявленным СД при обследовании в период госпитализации исключались из исследования. Критерии впервые выявленного СД: уровень глюкозы в венозной плазме натощак ≥7,0 ммоль/л или через 2 ч после перорального глюкозотолерантного теста ≥11,1 ммоль/л и HbA1c≥6,5 %.
Выделение адипоцитов из биоптатов жировой ткани
Из полученных образцов ЖТ изолировали адипоциты в стерильных условиях в вытяжном шкафу с ламинарным потоком (БОВ-001-АМС МЗМО, Миллерово, Россия) по методике, описанной нами ранее [9]. Адипоциты подсчитывали в камере Горяева. Жизнеспособность клеток оценивали в соответствии с методом, описанным Н. Suga и соавт. [11]. Изолированные адипоциты (20×105) высевали в 24-луночный планшет (Greiner Bio One International GmbH, Kremsmünster, Austria), объем в каждой лунке доводили до 1 мл полной культуральной средой М 199 (Gibco, США), содержащей 10% эмбриональную телячью сыворотку (Gibco, США), 1% Hepes буфер (Gibco, США), 1% раствор L-глутамина с пенициллином и стрептомицином (Gibco, США), 0,4% раствор амфотерицина-Б (Gibco, США), глюкозу в конечной концентрации 5 ммоль/л, метформин (USP, Norway) в концентрации 1 или 10 ммоль/л. Инкубировали в течение 24 ч при температуре 37±1°C в атмосфере 5% CO2 и 10% кислорода. В качестве негативного контроля клетки инкубировали в культуральной среде без добавления метформина.
Выделение тотальной РНК
Очистку тотальной РНК из изолированных адипоцитов проводили с использованием коммерческого набора RNeasy® Plus Universal Mini Kit (Qiagen, Hilden, Germany) по протоколу производителя с небольшими модификациями, как описано нами ранее [12]. Экстрагированную РНК хранили при -70°C до последующего использования. Количество и качество очищенной РНК оценивали с помощью спектрофотометра NanoDrop 2000 (Thermo Fisher Scientific) путем измерения поглощения света при 280 нм, 260 нм и 230 нм и расчета 260/280 (А260/280) и 260/230 (А260/280) и 260/230 (А260/280). А260/230). Целостность РНК определяли электрофорезом в агарозных гелях с последующей визуализацией с использованием системы Gel Doc™ XR + (Bio-Rad, Hercules, CA, USA).
Синтез кДНК
Синтез одноцепочечной кДНК осуществляли с использованием набора для обратной транскрипции кДНК высокой емкости (Applied Biosystems, Foster City, CA, USA) на 96-луночном термоциклере VeritiTM (Applied Biosystems, Waltham, MA, USA). Обратную транскрипцию проводили с использованием настроек программы, предложенных производителем набора. Количество и качество синтезированной кДНК оценивали с помощью спектрофотометра NanoDrop 2000. Образцы хранили при температуре -20 °C.
Определение экспрессии генов адипонектина и лептина в изолированных адипоцитах
Экспрессию генов адипонектина (ADIPOQ) и лептина (LEP) в изолированных адипоцитах ЖТ различной локализации оценивали с помощью количественной полимеразной цепной реакции в реальном времени (qPCR) с использованием анализа экспрессии генов TaqManTM (Applied Biosystems) в системе ViiA 7 Real-Time PCR (Applied Biosystems). В качестве отрицательного контроля использовали 20 мкл реакционной смеси без матрицы кДНК. Для каждого образца и отрицательного контроля были подготовлены три технических повтора. Нормализация результатов ПЦР проводилась с использованием трех референсных генов, ACTB (β-актин), GAPDH (глицеральдегид-3-фосфатдегидрогеназа), B2M (бета-2-микроглобулин) в соответствии с принятыми в настоящее время рекомендациями [13]. Для оценки эффективности ПЦР графики амплификации и стандартные кривые анализировали с помощью программного обеспечения QuantStudioTM Real-Time PCR Software v.1.3 (Applied Biosystems). Экспрессия исследуемых генов (нормализованный количественный коэффициент, NRQ) была рассчитана методом Pfaffl и представлена в логарифмической (log10) шкале как кратное изменение по сравнению с контрольными образцами (∆Ct). Эксперименты по экспрессии генов проводили в соответствии с рекомендациями MIQE [14][15].
Определение уровня секреции адипонектина и лептина в культуральной среде адипоцитов
По истечении срока инкубации со дна лунок забирали культуральную среду для последующего определения уровня секреции адипонектина и лептина методом иммуноферментного анализа с использованием тест-систем (Human Total Adiponectin/Acro30, DRP300; Human Leptin, DLP00; Human Leptin R, D0BR00) фирмы R&D Systems Inc (Minneapolis, MN, USA).
Статистический анализ
Статистический анализ выполняли с использованием GraphPad Prism 6 (GraphPad Software, La Jolla, CA, USA) и Statistica software, 6.1 (Dell Software, Inc., Round Rock, TX, USA). Тест Колмогорова–Смирнова использовался для проверки нормального распределения данных, для переменных с ненормальным распределением данные были представлены в виде медианы (Me) и 25-го и 75-го квартилей (Q1; Q3). Различия между группами сравнивали с использованием одностороннего дисперсионного теста ANOVA для непрерывных переменных. Категориальные переменные представлены в процентах и сравнивали с использованием критерия хи-квадрат или точного критерия Фишера. Значение уровня значимости (P) < 0,05 считалось статистически значимым.
Этическая экспертиза
Протокол исследования соответствовал стандартам локального этического комитета НИИ КПССЗ, разработанным в соответствии с Хельсинской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266. Все пациенты подписали информированное согласие.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
С учетом критериев включения и исключения в исследование было включено 134 пациента с ИБС, средний возраст которых составил 65.6 (49.3; 70.3) лет. Среди обследованных пациентов преобладали лица мужского пола (60%). Индекс массы тела (ИМТ) составил 28,57 (26,47; 30,28) кг/м2 (Табл 1). В анамнезе чаще фиксировались артериальная гипертензия, курение, стенокардия, отягощенная наследственность по сердечно-сосудистой патологии. У 57 пациентов в анамнезе был инфаркт миокарда (ИМ), а у 6 человек — инсульт. В течение госпитального периода все пациенты получали стандартную медикаментозную терапию, включающую гепарин, клопидогрел, аспирин, ингибиторы ангиотензинпревращающего фермента (ингибиторы АПФ), β-адреноблокаторы, статины, блокаторы кальциевых каналов и нитраты.
Основные результаты исследования
В ходе исследования установлено, что уровень экспрессии ADIPOQ в культуре адипоцитов ЭЖТ был минимальным в сравнении с адипоцитами ПЖТ (1,5 раза, р=0,028) и ПВЖТ (1,6 раза, р=0,031) (Рис. 1).
Добавление в культуральную среду адипоцитов метформина повышало экспрессию ADIPOQ во всех клеточных культурах (ПЖТ, ЭЖТ и ПВЖТ), однако сила эффекта зависела от концентрации препарата в культуральной среде (Рис. 1). Так метформин в концентрации 1 мкмоль/л усиливал экспрессию ADIPOQ в ПЖТ в 2,2 раза (р<0,001), в ЭЖТ в 2,8 раза (р=0,0003) и в ПВЖТ в 1,5 раза (р=0,024). Метформин в концентрации 10 мкмоль/л на адипоциты ПЖТ не действовал, а в адипоцитах ЭЖТ и ПВЖТ повышал уровень экспрессии гена адипонектина в 1,6 и 1,8 раза, соответственно (р=0,012, р=0,001). При этом низкая концентрация метформина (1 ммоль/л), в большей степени, чем 10 ммоль/л сопровождалась увеличением экспрессии ADIPOQ в адипоцитах ПЖТ (р=0,001) и ЭЖТ (р=0,004).
Уровень экспрессии LEP в культуральной среде эпикардиальных адипоцитов, в отличие от ADIPOQ, было выше по сравнению с ПЖТ (1,3 раза, р=0,013) и ПВЖТ (1,4 раза, р=0,004) (Рис. 2). Метформин оказывал разные эффекты в культурах адипоцитов в зависимости от типа ЖТ. Так, например, в культуре адипоцитов ПЖТ препарат снижал уровень экспрессии LEP в 1,8 раза как в низкой (р=0,024), так и в высокой концентрации (р=0,028). В адипоцитах ПВЖТ метформин, напротив, усиливал экспрессию LEP в 1,6 раза как в концентрации 1 ммоль/л, так и в концентрации 10 мкмоль/л (р=0,011 и р=0,014, соответственно). При этом в культуре адипоцитов ЭЖТ не было обнаружено значимых изменений при добавлении метформина (Рис. 2).
При изучении секреторной активности адипоцитов ЖТ выявлено, что уровень адипонектина в культуральной среде адипоцитов ЭЖТ и ПВЖТ был ниже по сравнению с адипоцитами подкожной локализации (р=0,011 и р=0,003) (Табл 2).
Изменение секреции адипонектина в ответ на добавление метформина были аналогичны изменениям экспрессии гена адипонектина. Метформин в концентрации 1 ммоль/л повышал содержание адипонектина во всех клеточных культурах адипоцитов не зависимо от их локализации, однако в адипоцитах ЭЖТ более интенсивно (в 2,6 раза) в сравнении с адипоцитами ПЖТ (р=0,021) и ПВЖТ (р=0,004) (табл 2). В то время как 10 ммоль/л метформина усиливали секрецию адипонектина только в культуре адипоцитов ЭЖТ и ПВЖТ (р=0,016 и р=0,002, соответственно). При этом, только в культуре эпикардиальных адипоцитов эффект метформина зависел от концентрации препарата, и 1 ммоль/л усиливали секрецию адипонектина в большей степени чем 10 ммоль/л (р=0,007).
Содержание лептина и уровень экспрессии его гена в культуральной среде эпикардиальных адипоцитов, в отличие от адипонектина, было выше по сравнению с ПЖТ и ПВЖТ (Табл 2). В то же время в периваскулярных адипоцитах уровень секреции лептина и экспрессии его гена был минимальным.
Метформин независимо от концентрации обладал ингибирующим эффектом на уровень секреции лептина в культуре адипоцитов ПЖТ, при этом не оказывал значимого эффекта на эпикардиальные адипоциты. Однако в периваскулярных адипоцитах, напротив, метформин повышал уровень секреции лептина в обеих концентрациях (1 и 10 ммоль/л).
Таблица 1. Клинико-анамнестическая характеристика пациентов с ишемической болезнью сердца
Table 1. Clinical and anamnestic characteristics of patients with coronary heart disease.
Параметры | n (%) / Me [ 25%; 75%] |
Лица мужского пола | 80 (60) |
Возраст, лет | 65,6 (49,3; 70,3) |
ИМТ, кг/м2 | 28,57 (26,47; 30,28) |
Избыточный вес | 45 (33,58) |
Артериальная гипертензия | 75 (56) |
Дислипидемия | 57 (42,5) |
Курение | 64 (47,8) |
Семейный анамнез ИБС | 79 (58,9) |
ИМ в анамнезе | 91 (67,9) |
ОНМК в анамнезе | 10 (7,5) |
Атеросклероз других бассейнов | 21 (15,7) |
Нет стенокардии | 4 (3) |
Стенокардия I ФК | 0 |
Стенокардия II ФК | 62 (46,3) |
Стенокардия III ФК | 68 (50,7) |
ХСН I ФК | 16 (11,9) |
ХСН II ФК | 11 (8,2) |
ХСН III ФК | 5 (3,7) |
ХСН IV ФК | 0 |
Умеренное поражение КР (≤ 22 баллов по шкале SYNTAX Score) | 61 (45,5) |
Тяжелое поражение КР (23–31 балл по шкале SYNTAX Score) | 33 (24,6) |
Крайне тяжелое поражение КР (≥32 баллов по шкале SYNTAX Score) | 40 (29,9) |
Фракция выброса, % | 51,4 (43,7; 57,2) |
Терапия в стационаре | |
Аспирин | 131 (97,8) |
Клопидогрел | 21 (15,6) |
Варфарин | 0 |
β-блокаторы | 131 (97,8) |
АПФ | 101 (75,4) |
Статины | 134 (100) |
Блокаторы кальциевых каналов | 103 (76,9) |
Нитраты | 11 (8,2) |
Диуретики | 102 (76,1) |
Примечание. ИМТ — индекс массы тела; ИБС- ишемическая болезнь сердца, ИМ — инфаркт миокарда; ОНМК — острые нарушения мозгового кровообращения, ХСН — хроническая сердечная недостаточность, ФК — функциональный класс, КА — коронарные артерии, АПФ — ангиотензинпреворащающий фермент. Данные представлены ввиде n (%) или медиана [ 25%; 75%].
Note. BMI — body mass index; CHD — coronary heart disease, MI — myocardial infarction; ACCD — acute cerebral circulatory disorders, CHF — chronic heart failure, FC — functional class, CA — coronary arteries, ACE — angiotensin converting enzyme. The data is presented as n (%) or median [ 25%; 75%].
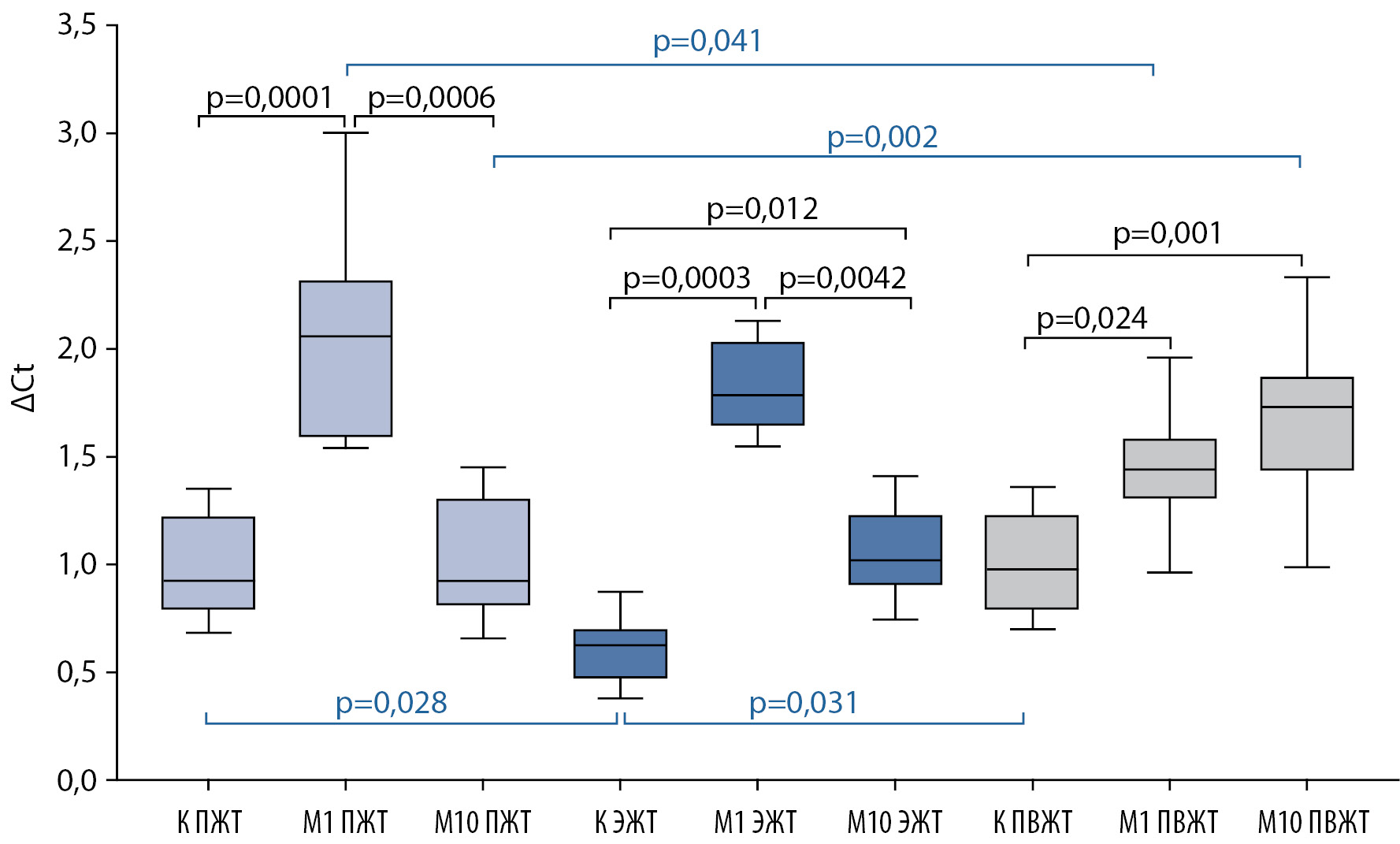
Рисунок 1. Уровень экспрессии гена адипонектина в адипоцитах различной локализации пациентов с ИБС.
Примечание. Здесь и далее: К — контроль; М1 — Метформин 1 ммоль/л; М10 — Метформин 10 ммоль/л; ПЖТ — подкожная жировая ткань; ЭЖТ — эпикардиальная жировая ткань; ПВЖТ — периваскулярная жировая ткань; р — уровень статистической значимости (р≤0,05). Данные представлены ввиде Me [ 25%; 75%].
Figure 1. The level of adiponectin gene expression in adipocytes of various localization of patients with coronary artery disease.
Note. Here and further: K — control; M1 — Metformin 1 mmol /l; M10 — Metformin 10 mmol/l; SAT — subcutaneous adipose tissue; EAT — epicardial adipose tissue; PVAT — perivascular adipose tissue; p — the level of statistical significance (p≤0.05). The data is presented in the form of Me [ 25%; 75%].
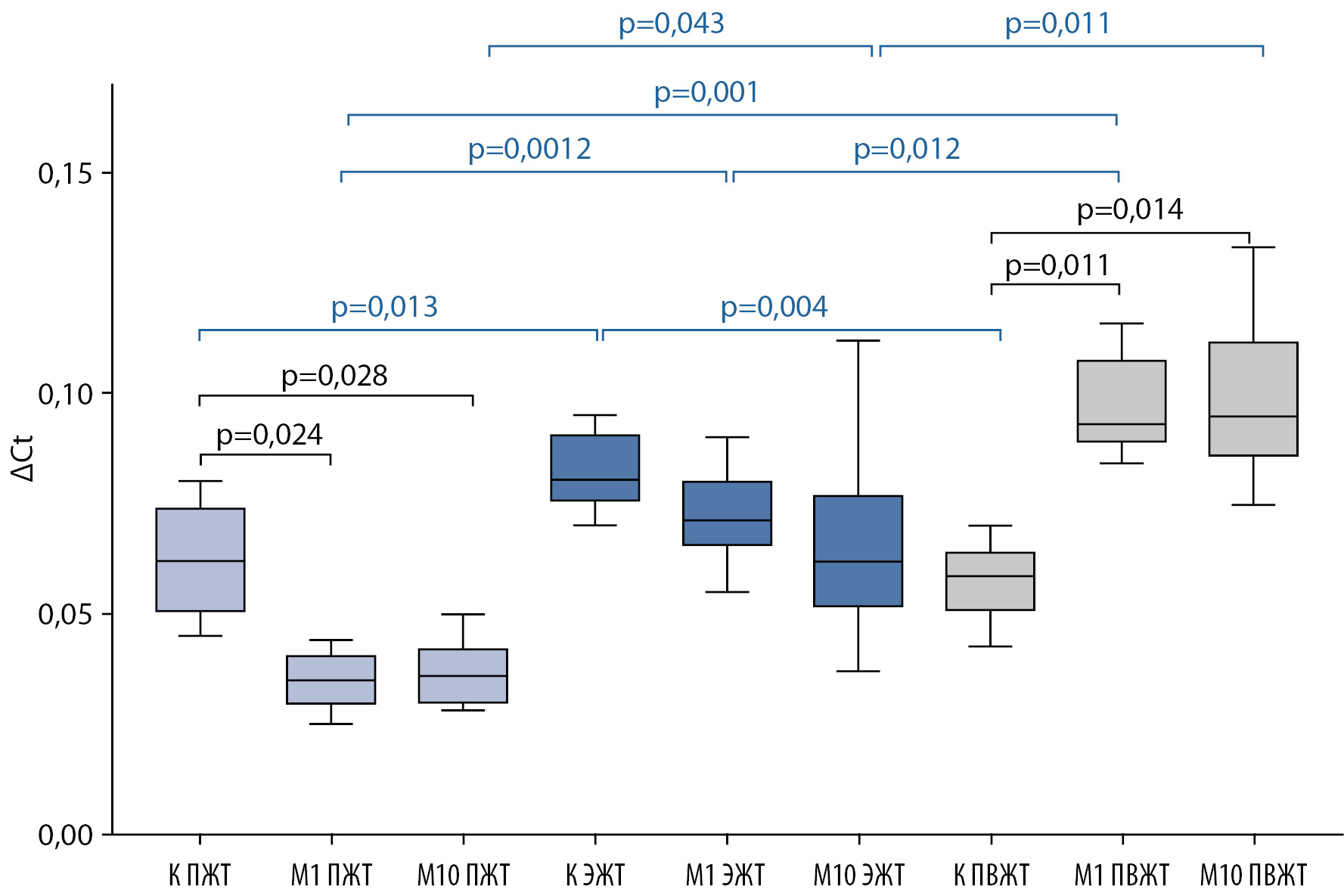
Рисунок 2. Уровень экспрессии гена лептина в адипоцитах различной локализации пациентов с ИБС.
Figure 2. The level of leptin gene expression in adipocytes of various localization of patients with coronary heart disease.
Таблица 2. Уровень секреции адипокинов в культуральной среде адипоцитов локальных жировых депо с добавлением метформина различной концентрации
Table 2. The level of adipokine secretion in the culture medium of adipocytes in local fat depots with the addition of metformin of various concentrations.
Параметры | Контроль/ Концентрация метформина | ПЖТ | ЭЖТ | ПВЖТ | Р |
1 | 2 | 3 | |||
Адипонектин, мг/мл | Без метформина | 16,93 [ 13,41; 20,79] | 13,58 [ 11,72; 15,96] | 12,58 [ 11,25; 14,06] | Р1–2 =0,0113 Р1–3=0,003 Р2–3=0,467 |
1 мкмоль/л метформина | 22,36 [ 19,9; 25,88] | 34,99 [ 29,57; 37,65] | 24,03 [ 19,05; 27,45] | Р1–2 =0,021 Р1–3=0,258 Р2–3=0,004 | |
10 мкмоль/л метформина | 17,1 [ 12,57; 21,66] | 19,35 [ 17,22; 23,16] | 25,31 [ 20,87; 34,72] | Р1–2=0,371 Р1–3=0,463 Р2–3=0,513 | |
Р | РКМ1=0,011 РКМ10=0,396 РМ1М10=0,032 | РКМ1 =0,0001 РКМ10 =0,016 РМ1М10=0,007 | РКМ1 =0,005 РКМ10 =0,002 РМ1М10=0,397 | ||
Лептин, мг/мл | Без метформина | 6,77 [ 6,37; 7,69] | 7,77 [ 6,57; 8,59] | 5,52 [ 4,46; 6,19] | Р1–2=0,023 Р1–3=0,018 Р2–3=0,012 |
1 мкмоль/л метформина | 3,01 [ 2,88; 3,16] | 5,02 [ 4,32; 6,69] | 6,73 [ 6,20; 6,98] | Р1–2 =0,003 Р1–3=0,001 Р2–3=0,252 | |
10 мкмоль/л метформина | 3,12 [ 2,99; 3,54] | 5,81 [ 4,39; 6,83] | 6,63 [ 6,09; 6,95] | Р1–2=0,029 Р1–3=0,002 Р2–3=0,317 | |
Р | РКМ1 =0,001 РКМ10 =0,002 РМ1М10=0,541 | РКМ1 =0,091 РКМ10 =0,226 РМ1М10=0,504 | РКМ1 =0,007 РКМ10 =0,005 РМ1М10=0,433 |
Примечание. ПЖТ — подкожная жировая ткань; ЭЖТ — эпикардиальная жировая ткань; ПВЖТ — периваскулярная жировая ткань; р — уровень статистической значимости. Данные представлены ввиде медиана [ 25%; 75%]. Жирным шрифтом выделены статистически значимые различия (р≤0,05).
Note. SAT — subcutaneous adipose tissue; EAT — epicardial adipose tissue; PVAT — perivascular adipose tissue; p — the level of statistical significance. The data is presented as a median [ 25%; 75%]. Statistically significant differences are highlighted in bold (p≤0.05).
ОБСУЖДЕНИЕ
Результаты настоящего исследования показали, что адипоциты ЭЖТ и ПВЖТ пациентов с ИБС характеризовались дисбалансом в системе адипокинов, проявляющимся низким уровнем экспрессии адипонектина и высокой экспрессией лептина в сравнении с адипоцитами ПЖТ. Полученные нами данные не противоречат результатам предыдущих исследований in vitro, согласно которым экспрессия лептина повышена в ЭЖТ [16], а уровень адипонектина, напротив, снижен [17]. Кроме того в большом количестве клинических исследований показано, что для пациентов с заболеваниями коронарных артерий (КА) характерны более высокий плазменный уровень лептина и гипоадипонектинемия [18][19].
Адипонектин и лептин экспрессируются исключительно зрелыми адипоцитами, и участвуют во многих сигнальных путях взаимодействия адипоцитов с другими типами клеток и тканей. Адипонектин тесно связан с функциональной активностью ЖТ и играет критическую роль в реализации антиатеросклеротических эффектов [20]. Кроме того, среди пациентов с ИБС показана обратная взаимосвязь уровня адипонектина в сыворотке крови со степенью атеросклеротического поражения КА [21]. Согласно исследованию IARS высокий уровень лептина связан с метаболическими нарушениями, ассоциированными с ожирением и ИБС [22]. Показана связь между содержанием лептина в сыворотке крови и острым ИМ, фракцией выброса левого желудочка и степенью атеросклеротического поражения [23][24]. Таким образом, на сегодняшний день имеются убедительные доказательства взаимосвязи дисбаланса в системе адипокинов в ЖТ с прогрессированием атеросклероза.
Согласно результатам Framingham Heart Study [25], мультиэтнического исследования атеросклероза MESA [24] и результатам, полученным нами ранее [26], увеличение морфометрических показателей ЖТ, в частности, эпикардиальной и периваскулярной локализации являются независимыми факторами риска ССЗ, а объем ПВЖТ — самым сильным предиктором коронарного атеросклероза [27]. Эти наблюдения позволили предполагать, что продукция адипокинов в локальных жировых депо напрямую взаимосвязана с дисфункцией коронарных сосудов.
В связи с чем, актуален поиск фармакологических агентов, способных напрямую влиять на активность адипоцитов и восстанавливать адипокиновый баланс в ЖТ. В исследованиях последних лет активно обсуждается кардиопротективный эффект метформина независимо от его антигипергликемического действия. Показано, что метформин не только улучшает морфометрические параметры ЭЖТ [28], но и оказывает влияние на адипогенез и функциональную активность адипоцитов ЭЖТ [29][30]. Ряд клинических исследований in vivo и in vitro демонстрируют, что метформин усиливает митохондриальный биогенез и термогенез в коричневых адипоцитах мышей, лечение метформином снижает массу тела, уменьшает ожирение у мышей ob/ob [31].
В ходе нашего исследования показано, что метформин повышал уровень экспрессии ADIPOQ и секрецию адипонектина адипоцитами независимо от их локализации, при этом низкая концентрация (1 ммоль/л) в адипоцитах ЭЖТ оказывала более сильный эффект в сравнении с 10 ммоль/л.
По данным одних авторов изменения содержания адипонектина у пациентов, принимающих метформин, отсутствовали в сравнении с лицами принимавшими плацебо, другие же, напротив, показали повышение уровня адипонектина на фоне лечения [32][33]. В то же время, экспериментальные исследования, в которых оценивался бы уровень экспрессии и секреции адипонектина in vitro в ЖТ человека немногочисленны, но и эти данные противоречивы. Так, в исследовании Biao Li и коллег, аналогично нашим данным, экспрессия и секреция адипонектина в ЭЖТ повышались при обработке адипоцитов метформином в концентрации 4 ммоль/л [34]. Согласно другим авторам 24-х часовая инкубация адипоцитов с 10 ммоль/л метформина приводила к значительному увеличению уровня мРНК адипонектина и секреции белка в ПЖТ, но не в адипоцитах висцеральной ЖТ [30], что несколько не согласуется с нашими данными, согласно которым наибольшую восприимчивость к действию метформина показали адипоциты именно висцеральной ЭЖТ и ПВЖТ. Противоречивость имеющихся результатов исследований может быть объяснена несколькими причинами. Во-первых, разным количеством наблюдений в исследованиях, которое зачастую составляет не более 5–10, во-вторых, это может быть связано с разным способом получения ЖТ и тем, что в основном исследуются ПЖТ и ВЖТ абдоминальной области, а количество исследований ЖТ сердечной локализации недостаточно. В-третьих, приобщающее число исследований на сегодняшний день проведено на животных или коммерческих культурах клеток. Тем не менее, кардиопротективный эффект метформина может быть опосредован именно его способностью модулировать уровень адипокинов и их рецепторов в ЖТ [30]. Важную роль в этих процессах играет AMPK (5’аденозин монофосфат-активируемая протеинкиназа), которая активируется в ответ на многие типы клеточного стресса, особенно на повышенное соотношение АМФ/АТФ, отмечающееся при ишемии миокарда [35]. Адипонектин защищает миокард от ишемии-реперфузии через ось передачи сигналов AMPK/Akt/NO. AMPK впоследствии активирует PPARγ рецепторы, которые так же оказывают противовоспалительное действие, ингибируя активацию NF-κB и уменьшая продукцию ROS [36]. Кроме того, адипонектин стимулирует фосфорилирование эндотелиальной синтазы оксида азота (eNOS) и увеличивает продукцию NO в эндотелиальных клетках, обладающего антиапоптотическими и кардиозащитными эффектами, подавляет экспрессию НАДФН-оксидазы и продукцию супероксида с помощью нескольких сложных механизмов [37]. Для метформина показаны аналогичные эффекты в ЖТ, на примере ЭЖТ. Так метформин усиливает экспрессию PPARγ, активирует AMPK, подавляет передачу сигналов ROS/NF-κB [36]. Таким образом, метформин может оказывать свои кардиозащитные эффекты, не только повышая уровень адипонектина, но и усиливая его эффекты в ЖТ.
Согласно нашим результатам, метформин разнонаправлено влиял на уровень лептина в адипоцитах, что зависело от их локализации. Метформин как в низкой (1 ммоль/л), так и в высокой концентрации (10 ммоль/л) снижал уровень экспрессии LEP и секрецию лептина в культуральной среде адипоцитов ПЖТ. Полученные результаты согласуются с данными полученными ранее [38]. На адипоциты эпикардиальной локализации метформин не оказывал значимого влияния. Однако, в исследовании Sardu C., уровень лептина в ЭЖТ в присутствии метформина снижался, при этом, пациенты, включенные в исследование, были с ИМ и признаками преддиабета [39]. В периваскулярных адипоцитах метформин, напротив, усиливал экспрессию и секрецию лептина. Sardu C и коллеги наблюдали ингибирование воспалительных процессов в перикоронарной ЖТ, в том числе и снижение содержания лептина [39], что несколько противоречит нашим данным. Стоит отметить, что у пациентов с острым инфарктом миокарда, включенных в исследование, отмечалось наличие преддиабета и пациенты принимали соответствующую гипогликемическую терапию, помимо гиполипидемической терапии (статины), для которых показано системное и локальное липидснижающее действие.
Однако, не смотря на всю противоречивость имеющихся результатов исследований, именно ЖТ периваскулярной локализации в последнее время уделяется важная роль в дестабилизации атеросклеротических бляшек в коронарных артериях [40]. Адипокины, продуцируемые периваскулярными адипоцитами, из-за отсутствия фасциального барьера между ПВЖТ и адвентицией, через хорошо развитую систему vasa vasorum попадают непосредственно в кровоток, оказывая свои системные и локальные эффекты, что подчеркивает патологический потенциал ПВЖТ в атеросклеротическом процессе [41].
Согласно полученным нами данным действие метформина на продукцию лептина не зависило от концентрации препарата. В исследовании, проведенном ранее, показан дозозависимый эффект метформина на секрецию лептина изолированными адипоцитами крыс. В низкой дозе (0,5 мМ) метформин повышал уровень лептина, а при увеличении дозы препарата от 1 до 20 мМ содержание лептина снижалось [42]. Согласно другим данным обработка метформином адипоцитов бурой ЖТ в течение 12 дней подавляла секрецию лептина на 35% при дозе препарата 500 мкмоль/л, при повышении дозы до 1 ммоль/л эффект усиливался и уровень лептина снижался на 75% [43]. Таким образом, результаты исследований противоречивы. Такое расхождение в результатах может быть вызвано ограничениями исследований, связанными с небольшим количеством участников (людей и лабораторных животных) и с использованием разных доз и концентраций препарата.
С другой стороны, выявленная в нашем исследовании активация экспрессии лептина в адипоцитах ПВЖТ в присутствии метформина, возможно, является компенсаторным механизмом вазодилятации, запускаемым при ИБС. Лептин индуцирует эндотелий-зависимую вазодилатацию путем активации PI3-киназно-независимого пути фосфорилирования eNOS, а также снижает пассивное натяжение стенок сосудов и вызванную ангиотензином II (AngII) вазоконстрикцию за счет активации индуцибельной синтазы NO (iNOS) посредством механизмов, включающих пути JAK2 / STAT3 и PI3K / Akt в ГМК [44]. Лептин так же контролирует уровень артериального давления, модулируя вазоконстрикцию, зависящую от симпатической активности, высвобождения NO эндотелием и от Ang II. Лептин подавляет базальную пролиферацию гладкомышечных клеток (ГМК) аорты и ингибирует Ang II-индуцированный рост ГМК, в которых активация рецептора лептина зависит от NO высвобождаемого эндотелием [44].
Кроме того, при дисфункциональных изменениях в ЖТ развивается резистентность к лептину на локальном уровне в ПВЖТ, как показано нами ранее [45], и увеличение содержания лептина в присутствии метформина можно расценивать как компенсаторный механизм, направленный на преодоление лептинорезистентности. Так повышение экспрессии лептина в ПВЖТ метформином, может являться одним из проявлений кардиопротективных эффектов препарата.
Клиническая значимость результатов
В ранее проведенных исследованиях проводилась оценка влияния метформина преимущественно на уровень адипокинов в циркулирующей крови, его системный эффект, в то время как влияние на функциональную активность адипоцитов ЖТ сердца и коронарных сосудов изучено недостаточно. Целью данного исследования было расширить представления о плейотропных эффектах метформина на функциональную активность ЖТ.
Ограничения исследования
В нашем исследовании было несколько ограничений. Во-первых, это было одноцентровое исследование. Во-вторых, размер нашей выборки был небольшим.
Направления дальнейших исследований
В дальнейшем планируется провести исследование по оценке влияния метформина на метаболизм других адипокинов, их рецепторов и цитокинов в жировой ткани сердечной локализации а так же в сыворотке крови пациентов с коронарогенной и некоронарогенной патологией (как группа сравнения).
ЗАКЛЮЧЕНИЕ
Выявленные изменения уровня экспрессии адипонектина и лептина в адипоцитах ЭЖТ и ПВЖТ продемонстрировали схожие закономерности в отличие от адипоцитов ПЖТ, что позволяет предположить наличие морфофункциональных различий между этими жировыми депо и ПЖТ. Принимая во внимание тот факт, что морфометрические параметры ЭЖТ и ПВЖТ коррелируют со степенью тяжести поражения КА, гипотеза о влияние локальных жировых депо на ключевые пути атерогенеза, включая окислительный стресс, воспаление, эндотелиальную дисфункцию и ремоделирование сосудов, подтверждается. Хотя клеточные механизмы пока остаются до конца не ясными. В этой связи, дисбаланс между проатерогенным лептином и антиатерогенным адипонектином в ЭЖТ и ПВЖТ может являться тригером возникновения и прогрессирования коронарной патологии. А так же представляют особый интерес с точки зрения новых терапевтических мишеней для лечения ССЗ, особенно связанных с дисфункциональными изменениями в ЖТ. Потенциальным препаратом, способным модулировать экспрессию адипокинов в ЖТ, является метформин. Мы продемонстрировали, что препарат напрямую оказывает влияние на адипоциты локальных жировых депо сердца и использование метформина, по-видимому, является жизнеспособной стратегией для поддержания баланса адипокинов ЖТ. Однако, механизмы, с помощью которых метформин поддерживает этот баланс, вероятно, являются тканеспецифичными. На сегодняшний день остается много вопросов относительно модуляции метформином адипокинов в ЖТ, особенно ПВЖТ. Будущие исследования призваны ответить на эти вопросы.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена в рамках Фундаментальной темы НИИ КПССЗ № 0419-2022-0002 «Разработка инновационных моделей управления риском развития болезней системы кровообращения с учетом коморбидности на основе изучения фундаментальных, клинических, эпидемиологических механизмов и организационных технологий медицинской помощи в условиях промышленного региона Сибири».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Дылева Ю.А. — Получение, анализ данных, интерпретация результатов; написание текста статьи; Груздева О.В. — Концепция и дизайн исследования; внесение в рукопись существенной (важной) правки с целью повышения научной ценности статьи; Белик Е.В. — Получение, анализ данных; Бородкина Д.А. — Анализ данных, интерпретация результатов; клиническое сопровождение исследования; Синицкий М.Ю. Получение, анализ данных; Иванов С.В. — Получение данных; клиническое сопровождение исследования; Барбараш О.Л. — Концепция и дизайн исследования; внесение в рукопись существенной (важной) правки с целью повышения научной ценности статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Bosi E. Metformin-the gold standard in type 2 diabetes: what does the evidence tell us? Diabetes Obes Metab. 2009; 11(2):3-8. doi: https://doi.org/10.1111/j.1463-1326.2008.01031.x
2. Pharmacologic Approaches to Glycemic Treatment: Standards of Medical Care in Diabetes-2020. Diabetes Care. 2020; 43(1):S98-S110. doi: https://doi.org/10.2337/dc20-S009.
3. Prattichizzo F, Giuliani A, Mensà E, et al. Pleiotropic effects of metformin: Shaping the microbiome to manage type 2 diabetes and postpone ageing. Ageing Res Rev. 2018; 48:87-98. doi: https://doi.org/10.1016/j.arr.2018.10.003
4. Prattichizzo F, Giuliani A, Mensà E, et al. Long-term safety, tolerability, and weight loss associated with metformin in the diabetes prevention program outcomes study. Diabetes Care. 2012; 35(4):731-737. doi: https://doi.org/10.2337/dc11-1299
5. Tokubuchi I, Tajiri Y, Iwata S, et al. Beneficial effects of metformin on energy metabolism and visceral fat volume through a possible mechanism of fatty acid oxidation in human subjects and rats. PLoS One. 2017; 12(2):e0171293. doi: https://doi.org/10.1371/journal.pone.0171293
6. Feng WH, Bi Y, Li P, et al. Effects of liraglutide, metformin, and gliclazide on body composition in patients with both type 2 diabetes and non-alcoholic fatty liver disease: A randomized trial. J. Diabetes Investig. 2018; 10(2):399-407. doi: https://doi.org/10.1111/jdi.12888
7. Su X, Chang D. Role of adiposopathy and physical activity in cardio-metabolic disorder diseases. Clin Chim Acta. 2020; 511:243-247. doi: https://doi.org/10.1016/j.cca.2020.10.028
8. Gruzdeva OV, Borodkina DA, Akbasheva OE, et al. Adipokine-cytokine profile of adipocytes of epicardial adipose tissue in ischemic heart disease complicated by visceral obesity. Obesity and metabolism. 2017; 14(4):38-45. (In Russ.)]. doi: https://doi.org/10.14341/omet2017438-45
9. Груздева ОВ, Акбашева ОЕ, Бородкина ДА и др. Взаимосвязь показателей ожирения и адипокинов с риском развития сахарного диабета 2 типа через год после перенесенного инфаркта миокарда // Российский кардиологический журнал. — 2015. — №4. — С. 59-67. doi: https://doi.org/10.15829/1560-4071-2015-4-59-67
10. Bland JM. An Introduction to Medical Statistics, 3rd edition. Oxford: Univ Press; 2000.
11. Suga H, Matsumoto D, Inoue K, et al. Numerical measurement of viable and nonviable adipocytes and other cellular components in aspirated fat tissue. Plast Reconstr Surg. 2008; 122(1):103-114. doi: https://doi.org/10.1097/PRS.0b013e31817742ed
12. Sinitsky MY, Dyleva YA, Uchasova EG, et al. Adipokine gene expression in adipocytes isolated from different fat depots of coronary artery disease patients. Arch Physiol Biochem. 2022; 128(1):261-269. doi: https://doi.org/10.1080/13813455.2019.1674338
13. Vandesompele J, De Preter K, Pattyn F, et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biol. 2002; 3(7):RESEARCH0034. doi: https://doi.org/10.1186/gb-2002-3-7-research0034
14. Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res. 2001; 29(9):е45. doi: https://doi.org/10.1093/nar/29.9.e45
15. Bustin SA, Benes V, Garson JA, et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clin Chem. 2009; 55(4):611-622. doi: https://doi.org/10.1373/clinchem.2008.112797
16. Zhang T, Yang P, Li T, et al. Leptin expression in human epicardial adipose tissue is associated with local coronary atherosclerosis. Med Sci Monit. 2019; (25):9913-9922. doi: https://doi.org/10.12659/MSM.918390
17. Cheng KH, Chu CS, Lee KT, et al. Adipocytokines and proinflammatory mediators from abdominal and epicardial adipose tissue in patients with coronary artery disease. Int J Obes (Lond). 2008; 32(2):268-74. doi: https://doi.org/10.1038/sj.ijo.0803726
18. Khafaji HAH, Bener AB, Rizk NM, Al Suwaidi J. Elevated serum leptin levels in patients with acute myocardial infarction; correlation with coronary angiographic and echocardiographic findings. BMC Res Notes. 2012; 5(1):262. doi: https://doi.org/10.1186/1756-0500-5-262
19. Nakamura Y, Shimada K, Fukuda D, et al. Implications of plasma concentrations of adiponectin in patients with coronary artery disease. Heart. 2004; 90(5):528-33. doi: https://doi.org/10.1136/hrt.2003.011114
20. Wang ZV, Scherer PE. Adiponectin, the past two decades. J Mol Cell Biol. 2016; 8(2):93-100. doi: https://doi.org/10.1093/jmcb/mjw011
21. Rahmani A, Toloueitabar Y, Mohsenzadeh Y, et al. Association between plasma leptin/adiponectin ratios with the extent and severity of coronary artery disease. BMC Cardiovasc Disord. 2020; 20(1):474. doi: https://doi.org/10.1186/s12872-020-01723-7
22. Shanker J, Rao VS, Ravindran V, et al. Relationship of adiponectin and leptin to coronary artery disease, classical cardiovascular risk factors and atherothrombotic biomarkers in the IARS cohort. Thromb Haemost. 2012; 108(4):769-780. doi: https://doi.org/10.1160/TH12-04-0263
23. Martin SS, Blaha MJ, Muse ED, et al. Leptin and incident cardiovascular disease: The Multi-Ethnic Study of Atherosclerosis (MESA). Atherosclerosis. 2015; 239(1):67-72. doi: https://doi.org/10.1016/j.atherosclerosis.2014.12.033
24. Ding J, Hsu FC, Harris TB, et al. The association of pericardial fat with incident coronary heart disease: the Multi-Ethnic Study of Atherosclerosis (MESA). Am J Clin Nutr. 2009; 90(3):499-504. doi: https://doi.org/10.3945/ajcn.2008.27358
25. Schlett CL, Massaro JM, Lehman SJ, et al. Novel measurements of periaortic adipose tissue in comparison to anthropometric measures of obesity, and abdominal adipose tissue. Int J Obes (Lond). 2009; 33(2):226-232. doi: https://doi.org/10.1038/ijo.2008.267
26. Gruzdeva O, Uchasova E, Dyleva Y, et al. Relationship between epicardial and perivascular fatty tissue and adipokine-cytokine level in coronary artery disease patients. PLoS One. 2019; 14(6):e0208156. doi: https://doi.org/10.1371/journal.pone.0208156
27. Greif M, Becker A, von Ziegler F, et al. Pericardial adipose tissue determined by dual source CT is a risk factor for coronary atherosclerosis. Arterioscler Thromb Vasc Biol. 2009; 29(5):781-786. doi: https://doi.org/10.1161/ATVBAHA.108.180653
28. H Gunes, H Gunes, S Ozmen, et al. Effects of metformin on epicardial adipose tissue and atrial electromechanical delay of obese children with insulin resistance. Cardiol Young. 2020; 30(10):1429-1432. doi: https://doi.org/10.1017/S1047951120002103
29. Evia-Viscarra ML, Rodea-Montero ER, Apolinar-Jiménez E, et al. The effects of metformin on inflammatory mediators in obese adolescents with insulin resistance: controlled randomized clinical trial. J Pediatr Endocrinol Metab. 2012; 25(1-2):67-72. doi: https://doi.org/10.1515/jpem-2011-0469
30. Zulian A, Cancello R, Girola A, et al. In vitro and in vivo effects of metformin on human adipose tissue adiponectin. Obes Facts. 2011; 4(1):27-33. doi: https://doi.org/10.1159/000324582
31. Yuan T, Li J, Zhao W-G, et al. Effects of metformin on metabolism of white and brown adipose tissue in obese C57BL/6J mice. Diabetol Metab Syndr. 2019; 11(1):96. doi: https://doi.org/10.1186/s13098-019-0490-2
32. Adamia N, Virsaladze D, Charkviani N, et al. Effect of metformin therapy on plasma adiponectin and leptin levels in obese and insulin resistant postmenopausal females with type 2 diabetes. Georgian Med News. 2007; (145):52-55.
33. Sharma PK, Bhansali A, Sialy R, et al. Effects of pioglitazone and metformin on plasma adiponectin in newly detected type 2 diabetes mellitus. Clin Endocrinol (Oxf). 2006; 65(6):722-728. doi: https://doi.org/10.1111/j.1365-2265.2006.02658.x
34. Li B, Po SS, Zhang B, et al. Metformin regulates adiponectin signalling in epicardial adipose tissue and reduces atrial fibrillation vulnerability. J Cell Mol Med. 2020; 24(14):7751-7766. doi: https://doi.org/10.1111/jcmm.15407
35. Hardie DG. Minireview: The AMP-activated protein kinase cascade: The key sensor of cellular energy status. Endocrinology. 2003; 144(12):5179-5183. doi: https://doi.org/10.1210/en.2003-0982
36. Mansour HH, El kiki SM, Galal SM. Metformin and low dose radiation modulates cisplatin-induced oxidative injury in rat via PPAR-γ and MAPK pathways. Arch Biochem Biophys. 2017; 616(12):13-19. doi: https://doi.org/10.1016/j.abb.2017.01.005
37. Motoshima H, Wu X, Mahadev K, Goldstein BJ. Adiponectin suppresses proliferation and superoxide generation and enhances eNOS activity in endothelial cells treated with oxidized LDL. Biochem Biophys Res Commun. 2004; 315(2):264-271. doi: https://doi.org/10.1016/j.bbrc.2004.01.049
38. Ida S, Murata K, Kaneko R. Effects of metformin treatment on blood leptin and ghrelin levels in patients with type 2 diabetes mellitus. J Diabetes. 2017; 9(5):526-535. doi: https://doi.org/10.1111/1753-0407.12445
39. Sardu C, D’Onofrio N, Torella M, et al. Pericoronary fat inflammation and Major Adverse Cardiac Events (MACE) in prediabetic patients with acute myocardial infarction: effects of metformin. Cardiovasc Diabetol. 2019; 18(1):126. doi: https://doi.org/10.1186/s12933-019-0931-0
40. Rittig K, Dolderer JH, Balletshofer B, et al. The secretion pattern of perivascular fat cells is different from that of subcutaneous and visceral fat cells. Diabetologia. 2012; 55(5):1514-1525. doi: https://doi.org/10.1007/s00125-012-2481-9
41. Staub D, Schinkel AF, Coll B, et al. Contrast-enhanced ultrasound imaging of the vasa vasorum: from early atherosclerosis to the identification of unstable plaques. JACC Cardiovasc Imaging. 2010; 3(7):761-71. doi: https://doi.org/10.1016/j.jcmg.2010.02.007
42. Mueller WM, Stanhope KL, Gregoire F, et al. Effects of metformin and vanadium on leptin secretion from cultured rat adipocytes. Obesity Research. 2000; 8(7):530-539. doi: https://doi.org/10.1038/oby.2000.66.
43. Klein J, Westphal S, Kraus D, et al. Metformin inhibits leptin secretion via a mitogen-activated protein kinase signalling pathway in brown adipocytes. J Endocrinol. 2004; 183(2):299-307. doi: https://doi.org/10.1677/joe.1.05646
44. Landecho MF, Tuero C, Valentí V, et al. Relevance of leptin and other adipokines in obesity-associated cardiovascular risk. Nutrients. 2019; 11(11): 2664. doi: https://doi.org/10.3390/nu11112664
45. Gruzdeva O, Dyleva Y, Belik E, et al. Expression of adipocytokine genes and their content in various adipose tissue sites in patients with heart diseases. doi: https://doi.org/10.21203/rs.3.rs-53273/v1
Об авторах
Ю. А. ДылеваРоссия
Дылева Юлия Александровна, кандидат медицинских наук
г. Кемерово, Сосновый бульвар 6, 650002
ResearcherID: O-3883-2015;
Scopus Author ID: 49360983500
О. В. Груздева
Россия
Груздева Ольга Викторовна, доктор медицинских наук, профессор
Кемерово
Е. В. Белик
Россия
Белик Екатерина Владимировна, кандидат медицинских наук
Кемерово
Д. А. Бородкина
Россия
Бородкина Дарья Андреевна, кандидат медицинских наук
Кемерово
М. Ю. Синицкий
Россия
Синицкий Максим Юрьевич, кандидат медицинских наук
Кемерово
С. В. Иванов
Россия
Иванов Сергей Васильевич, доктор медицинских наук, профессор
Кемерово
О. Л. Барбараш
Россия
Барбараш Ольга Леонидовна, доктор медицинских наук, профессор
Кемерово
Дополнительные файлы
|
|
1. Рисунок 1. Уровень экспрессии гена адипонектина в адипоцитах различной локализации пациентов с ИБС | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(186KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Уровень экспрессии гена лептина в адипоцитах различной локализации пациентов с ИБС | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(186KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Дылева Ю.А., Груздева О.В., Белик Е.В., Бородкина Д.А., Синицкий М.Ю., Иванов С.В., Барбараш О.Л. Влияние метформина на транскриптом и адипокином адипоцитов локальных жировых депо пациентов с ишемической болезнью сердца. Ожирение и метаболизм. 2023;20(1):49-59. https://doi.org/10.14341/omet12743
For citation:
Dyleva Yu.A., Gruzdeva O.V., Belik E.V., Borodkina D.A., Sinitskiy M.Yu., Ivanov S.V., Barbarash O.L. Effect of metformin on transcriptome and adipokinome of adipocytes of local fat deposts of patients with ischemic heart disease. Obesity and metabolism. 2023;20(1):49-59. (In Russ.) https://doi.org/10.14341/omet12743

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































