Перейти к:
Оценка регуляторного влияния карнозина и альфа-липоевой кислоты на цитокиновый профиль коры головного мозга крыс линии Wistar при индуцированном ожирении
https://doi.org/10.14341/omet12968
Аннотация
Обоснование. Модель ожирения в экспериментальных условиях воспроизводится путем применения у животных высококалорийных рационов. Установлено, что нарушения обмена веществ вызывают метавоспаление не только в периферических органах и тканях, но и в структурах головного мозга. Поиск эффективных нейропротекторов — антиоксидантов для супрессии воспалительных процессов в коре головного мозга при ожирении является актуальной задачей в связи с широкой распространенностью данного заболевания.
Цель. Оценка влияния минорных биологически активных веществ — карнозина (CAR) и α-липоевой кислоты (ALA) на цитокиновый профиль коры лобной доли левого полушария головного мозга у крыс самцов линии Wistar при ожирении, индуцированном высококалорийным холинодефицитным рационом (ВКХДР).
Материалы и методы. Исследования проводили на крысах-самцах линии Wistar с исходной массой тела 150±10 г. Животные были рандомизированы по массе тела на 5 групп. В течение 8 нед крысы 1-й (контрольной) группы получали полноценный модифицированный рацион AIN93М; 2-й группы — потребляли ВКХДР, содержание жира в котором составляло 45%, фруктозы — 20% от энергетической ценности рациона; 3-й группы — ВКХДР с добавлением CAR в дозе 75 мг на 1 кг массы тела; 4-й группы — ВКХДР с добавлением ALA в дозе 75 мг на 1 кг массы тела; 5-й группы — ВКХДР с добавлением комплекса CAR+ALA в суммарной дозе 150 мг на 1 кг массы тела. Выведение животных из эксперимента осуществляли путем декапитации под эфирной анестезией. Уровни триглицеридов (Тг) и свободных жирных кислот (СЖК) в плазме крови (ммоль) определяли на биохимическом анализаторе (Konelab 20i, Thermo Clinical Labsystems Oy, Финляндия). Содержание цитокинов и хемокинов (пг/мл): GM-CSF, IL-10, IL-17A, IL-12p40, IL-12p70, IL-1α, IL-2, IL-4, IL-5, IFN-γ, MCP-1, M-CSF, MIP-1α, MIP-2, MIP-3α, RANTES и TNF-α в лизатах коры головного мозга определяли методом мультиплексного иммуноанализа на анализаторе Luminex 200 (Luminex Corporation, США). Для оценки взаимосвязи между уровнем цитокинов в плазме крови и изменениями их концентраций под влиянием ВКХДР в лизатах коры лобной доли левого полушария головного мозга вычисляли соотношение: уровень цитокинов пг/мл в плазме крови содержание цитокинов пг/мл в лизатах (пл/лиз) по каждой пробе.
Результаты. На модели ожирения у крыс установлено наличие воспалительного процесса в коре головного мозга, о чем свидетельствует увеличение содержания провоспалительных факторов: IL-2, M-CSF, MIP-1α и RANTES и разной степени выраженности снижение содержания иммунорегуляторных цитокинов: IL-10, IL-17A, IL-12p40, IL-12p70, TNF-a, MIP-2 и MIP-3α у крыс 2-й группы (ВКХДР) по сравнению с контрольной группой. Обогащение ВКХДР биологически активными веществами — CAR, ALA или их комплексом обеспечило нормализацию липидного обмена, о чем свидетельствует снижение до контрольных значений соотношения циркулирующих Тг к СЖК в сыворотке крови крыс: 1-я группа (контроль) — 1,04±0,23; 2-я (ВКХДР) — 1,64±0,63; 3-я (CAR) — 0,98±0,31; 4-я (ALA) — 0,86±0,31; 5-я (CAR+ALA) — 1,02±0,38. Обогащение ВКХДР CAR, ALA или их комплексом привело к снижению содержания в коре лобной доли головного мозга крыс провоспалительных и регулирующих апоптоз цитокинов и хемокинов: IL-1α, IL-2, IL-17A, M-CSF, MCP-1, MIP-3α и RANTES наряду с повышением уровня противовоспалительного цитокина IL-10, что свидетельствует о супрессии воспалительного процесса, индуцированного потреблением крысами ВКХДР.
Заключение. Полученные данные свидетельствуют о перспективе использования CAR и ALA или их комплекса в качестве нейропротекторов — антиоксидантов для снижения воспалительного процесса в структурах головного мозга при ожирении.
Ключевые слова
Для цитирования:
Трушина Э.Н., Ригер Н.А., Тимонин А.Н., Девятов А.А., Аксенов И.В., Тутельян В.А. Оценка регуляторного влияния карнозина и альфа-липоевой кислоты на цитокиновый профиль коры головного мозга крыс линии Wistar при индуцированном ожирении. Ожирение и метаболизм. 2023;20(1):22-33. https://doi.org/10.14341/omet12968
For citation:
Trushina E.N., Riger N.A., Timonin A.N., Devyatov A.A., Aksenov I.V., Tutelyan V.A. Evaluation of the regulatory effect of carnosine and alpha-lipoic acid on the cytokine profile of the cerebral cortex of Wistar rats under induced obesity. Obesity and metabolism. 2023;20(1):22-33. (In Russ.) https://doi.org/10.14341/omet12968
ОБОСНОВАНИЕ
В настоящее время активно изучается проблема метавоспаления, которое имеет метаболический характер, ассоциировано с умеренной экспрессией провоспалительных медиаторов, сопровождается модификацией структуры метаболических тканей с инфильтрацией иммунными клетками; является хроническим и не имеет спонтанного разрешения [1–3]. Центральное и периферическое метавоспаление с нарушением врожденного и приобретенного иммунитета характерно для ожирения [4]. В генезе заболевания основную роль играют оксидативный стресс, липотоксичность, глюкотоксичность, митохондриальная дисфункция, а также хроническое воспаление в метаболически активных тканях: жировой ткани, кишечнике, мышцах, поджелудочной железе, печени [5]. Модель ожирения в экспериментальных условиях воспроизводится путем применения у животных рационов с высоким содержанием углеводов и жиров (высококалорийные рационы — ВКР). В большинстве случаев эти исследования сфокусированы на индуцированных диетой изменениях в периферических органах и тканях [6][7]. Выявленные впоследствии при метаболическом синдроме полинейропатия и когнитивные расстройства убедительно показали, что нарушения обмена веществ вызывают вялотекущее воспаление в структурах головного мозга [8][9].
Головной мозг активно взаимодействует с периферическими тканями и иммунной системой через гематоэнцефалический барьер (ГЭБ) [10]. Изменение уровней циркулирующих цитокинов при метаболических расстройствах оказывает влияние на обменные процессы в структурах головного мозга [11][12]. Основной структурой головного мозга, в наибольшей степени вовлеченной в регуляцию пищевого поведения и обмена энергии, является гипоталамус. Установлено, что применение ВКР у крыс индуцирует воспаление медиобазальных отделов гипоталамуса с вовлечением провоспалительных киназ JNK (стресс-активируемых протеинкиназ) и NF-kB (ядерного фактора каппа B), это приводит к гиперпродукции цитокинов: ФНОα, ИЛ-1β, ИЛ-6 и нарушению проведения сигналов лептина, инсулина [13]. Данные экспериментальных исследований свидетельствуют, что применение ВКР индуцирует развитие воспалительных изменений в гипоталамусе уже к 3-му дню от начала эксперимента при отсутствии фенотипа ожирения и воспаления в жировой ткани [14]. Таким образом, воспаление на уровне структур головного мозга может расцениваться как важнейший патогенетический фактор ожирения, а не его следствие [15].
В настоящее время установлено, что воспалительные процессы при ожирении не ограничиваются только гипоталамической зоной. Формирование когнитивных расстройств и нейродегенеративных заболеваний при ожирении не исключает развития вялотекущего воспаления и в других отделах центральной нервной системы, в частности, в коре головного мозга, гиппокампе, миндалине, мозжечке [8][16]. В этих исследованиях представлены доказательства меньшей толщины коры головного мозга у людей с избыточной массой тела и ожирением. Механизмы уменьшения объема серого вещества головного мозга неизвестны, предполагается, что нейровоспаление, вызванное ожирением, является важным фактором апоптотической передачи сигналов и гибели нейронов. В коре головного мозга отмечена наибольшая плотность капилляров. Через капиллярное русло мозга кровоток значительно интенсивней, чем в других органах и тканях [17]. ГЭБ представляет собой высококонсервативную структуру, строго контролирующую проникновение компонентов крови в ЦНС. Увеличение уровня липидов и глюкозы, наличие провоспалительных медиаторов в сосудистом русле вызывают нарушение проницаемости ГЭБ, способствуют инфильтрации ЦНС лейкоцитами и нейровоспалению.
В ранее опубликованных работах [1][18] на модели индуцированного приемом высококалорийного холинодефицитного рациона (ВКХДР) ожирения у крыс нами была доказана эффективность применения антиоксидантов: карнозина (CAR) и α-липоевой кислоты (ALA) для супрессии маркеров метавоспаления. Влияние этих биологически активных веществ, а также других антиоксидантов на цитокиновый профиль, характеризующий воспалительные процессы в коре головного мозга при ожирении или экспериментально вызванных метаболических нарушениях, остается открытым и требует дальнейшего изучения, что и определяет актуальность настоящего исследования.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценка влияния минорных биологически активных веществ — CAR и ALA на цитокиновый профиль коры лобной доли левого полушария головного мозга у крыс самцов линии Wistar при ожирении, индуцированном ВКХДР.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Виварий ФГБУН «ФИЦ питания и биотехнологии».
Время исследования. Эксперимент проведен с октября по ноябрь 2019 г. включительно.
Изучаемые популяции (одна или несколько)
Изучалась одна популяция.
Критерии включения. Для участия в эксперименте были выбраны крысы-самцы линии Wistar с исходной массой тела 150±10 г.
Критерии исключения. Не применялись.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Выборка формировалась произвольным способом.
Дизайн исследования
Одноцентровое экспериментальное одномоментное одновыборочное сравнительное контролируемое рандомизированное.
Дизайн исследования основан на модели «черного ящика» в рамках однофакторного многоуровневого сбалансированного эксперимента без ограничения на рандомизацию по типу 51, где фиксируемым фактором был рацион, а уровнями — модификации рациона кормления, соответствующие номенклатуре групп исследованных животных. Шкалирование уровней номинативное. Рандомизация осуществлялась с использованием генератора псевдослучайных чисел, в основе шифрования которого лежит Вихрь Мерсенна, заложенный в различных программах, в частности MS Excel. Перед началом эксперимента в объединенной выборке самцов крыс линии Wistar с исходной массой тела 150±10 животные получили рандомизированно номера, соответствующие натуральному числу их общей численности от 1 до 40. Далее в MS Excel строили таблицу, где строки соответствовали уровням плана 51, а количество столбцов соответствовало количеству животных данного уровня фиксируемого фактора, заполняли таблицу, имитирующую однофакторный пятиуровневый сбалансированный план для полной рандомизации животных, включаемых на соответствующих уровнях фактора. Полученный таким образом сгенерированный числовой ряд от 0 до 1 вновь объединяли в соответствии с уровнями фактора. Далее производили ранжирование этих чисел с использованием функции «СОРТИРОВКА И ФИЛЬТР» и в соответствии с ранжированными числами от 0 до 1 ставили натуральное число от 1 до 40 (производили ранговое кодирование исходных данных). При этом номера уровней соответствовали исходному числовому распределению. На заключительной стадии в соответствии с натуральным номером, которому до начала эксперимента соответствовало животное, его соотносили с соответствующим уровнем фиксируемого фактора, чем и достигалась полная рандомизация выборки.
Методы
Исследования проводили на крысах-самцах линии Wistar с исходной массой тела 150±10 г, полученных из питомника филиала «Столбовая» ФГБУН «Научный центр биомедицинских технологий ФМБА». Животные были рандомизированы по массе тела на 5 групп по 8 крыс в каждой. В течение 8 недель крысы 1-й (контрольной) группы получали полноценный модифицированный рацион AIN93М [19], в котором соевое масло заменено на подсолнечное масло и лярд (1:1) (энергетическая ценность рациона — 3,9 ккал/г сухого корма). Содержание жира в рационе составляло 9% от его энергетической ценности. Крысы 2-й группы потребляли ВКХДР, содержание жира в котором составляло 45%, фруктозы — 20% от энергетической ценности рациона (энергетическая ценность рациона — 4,9 ккал на 1 г сухого корма). Крысы 3-й группы получали ВКХДР с добавлением CAR (L-Carnosine, степень чистоты — не менее 99%; Qingdao Samin Chemical Co., LTD, КНР) в дозе 75 мг на 1 кг массы тела. Крысы 4-й группы получали ВКХДР с добавлением ALA (DL-α-Lipoic acid, степень чистоты — не менее 99%; Chem-Impex International, Inc., США) в дозе 75 мг на 1 кг массы тела. Крысы 5-й группы получали ВКХДР с добавлением комплекса CAR+ALA (в соотношении 52/48; патент RU 2 647 435 C2; ФГБНУ «Научный центр неврологии», РФ) в суммарной дозе 150 мг на 1 кг массы тела. Комплекс CAR+ALA в виде раствора был любезно предоставлен сотрудниками ФГБНУ «Научный центр неврологии» Федоровой Т.Н. и Стволинским С.Л. Для добавления в ВКХДР комплекс предварительно высушивали методом лиофилизации. Крысы находились в пластиковых клетках с подстилкой из опилок при температуре от 20 до 24 °С, влажности воздуха 45–65%, искусственном освещении с равной продолжительностью светлого и темного периодов. Животные получали воду ad libitum, рацион — из расчета 20 г сухого корма на крысу в сутки. Наблюдение за поедаемостью корма, общим состоянием животных: внешним видом, поведением, двигательной активностью, качеством шерстного покрова проводили ежедневно, массу тела крыс измеряли еженедельно.
Выведение животных из эксперимента осуществляли путем декапитации. Для изучения цитокинового профиля кровь собирали в мерные пробирки с 0,5 см3 1% раствора гепарина в 0,15 М NaCl, индивидуально фиксируя разведение каждой пробы. После этого кровь центрифугировали при 3000 оборотах/мин в течение 15 минут для отделения плазмы. Полученные образцы хранили в морозильной камере при -24оC.
Уровни триглицеридов (Тг) и свободных жирных кислот (СЖК) в плазме крови (ммоль) определяли на биохимическом анализаторе (Konelab 20i, Thermo Clinical Labsystems Oy, Финляндия) с использованием коммерческих реагентов (Spinreact, Испания) согласно прилагаемым инструкциям. Для оценки дислипидемии вычисляли в относительных единицах соотношение между уровнями Тг и СЖК в плазме крови для каждого животного (Тг/СЖК).
Лизаты головного мозга крыс готовили по следующей методике. Замороженную (-80°С) ткань коры лобной доли левого полушария головного мозга смешивали с 0,1М Na фосфатным буфером рН 7,4 в соотношении 1:10, гомогенизировали в стеклянном гомогенизаторе Поттера–Эльвейма с тефлоновым пестиком в течение 10 циклов при 900 об/мин и центрифугировали при 12000 об/мин в течение 15 мин при 4°С. Надосадок (постмитохондриальную фракцию) отбирали и хранили при -80°С.
Содержание цитокинов и хемокинов (пг/мл): GM-CSF, IL-10, IL-17A, IL-12p40, IL-12p70, IL-1α, IL-2, IL-4, IL-5, IFN-γ, MCP-1, M-CSF, MIP-1α, MIP-2, MIP-3α, RANTES и TNF-α в лизатах коры головного мозга определяли методом мультиплексного иммуноанализа с использованием базового набора Bio-Plex Pro™ Reagent Kit V, дополняемого реагентами Bio-Plex Pro™ (Pro-Rat 33-Plex Standarts, Rat Cytokine IL-12p40 Set, Rat Cytokine IL-12p70 Set, Rat Cytokine IL-1α Set, Rat Cytokine IL-2 Set, Rat Cytokine IL-4 Set, Rat Cytokine IL-5 Set, Rat Cytokine IL-10 Set, Rat Cytokine IL-17A Set, Rat Cytokine IFN-γ Set, Rat Cytokine GM-CSF Set, Rat Cytokine M-CSF Set, Rat Cytokine MCP-1 Set, Rat Cytokine MIP-1α Set, Rat Cytokine MIP-2 Set, Rat Cytokine MIP-3α Set, Rat Cytokine RANTES Set, Rat Cytokine TNF-α Set) производства фирмы Bio-Rad Laboratories, Inc. (США) на анализаторе Luminex 200 (Luminex Corporation, США) по технологии xMAP с использованием программного обеспечения Luminex xPONENT Version 3.1.
Для оценки взаимосвязи между уровнем цитокинов в плазме крови и изменениями их концентраций под влиянием ВКХДР в лизатах коры лобной доли левого полушария головного мозга вычисляли соотношение: уровень цитокинов пг/мл в плазме крови [20]/содержание цитокинов пг/мл в лизатах (пл/лиз) по каждой пробе.
Статистический анализ данных выполняли с использованием однофакторного дисперсионного анализа ANOVA в пакете программ SPSS 20.0 (IBM, США). Гипотезу о различии функции распределения данных в сравниваемых группах дополнительно проверяли с использованием непараметрического критерия Манна–Уитни. Различия принимали за достоверные при уровне значимости p<0,05.
Этическая экспертиза.
Исследование получило одобрение Этического комитета ФГБУН «ФИЦ питания и биотехнологии» (заседание №7 от 24.06.2019) и осуществлялось в соответствии с рекомендациями ГОСТ 33216-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами».
РЕЗУЛЬТАТЫ
Соотношение триглицеридов и свободных жирных кислот в плазме крови крыс
Результаты вычисления соотношения уровней Тг и СЖК представлены на рисунке 1. Обнаружено увеличение соотношения Тг/СЖК в плазме крови крыс, потребляющих ВКХДР (2-я группа), по сравнению с контрольной группой (p<0,05). Обогащение рациона CAR и ALA как по отдельности, так и в комплексе снижало значения Тг/СЖК до показателей у крыс в контрольной группе (рис. 1).
Содержание цитокинов и хемокинов в лизатах коры головного мозга крыс.
Общие изменения содержания цитокинов в лизатах коры лобной доли левого полушария головного мозга крыс по сравнению с контрольной группой представлены на рисунке 2, а–в. В целом под влиянием ВКХДР в разной степени значимости изменилось содержание 9 факторов. В частности, при потреблении животными ВКХДР (2-я гр.) обнаружено достоверное уменьшение содержания иммунорегуляторных цитокинов: IL-10, IL-12p40, IL-12p70, хемокинов MIP-2 и MIP-3α, а концентрация TNF-α снизилась на уровне значимой тенденции (p=0,06). Содержание IL-2, M-CSF и RANTES во 2-й группе, наоборот, достоверно увеличилось, при этом уровень RANTES вырос более чем в 7 раз по сравнению с контролем (рис. 2, а–в).
Добавление к ВКХДР CAR (3-я группа) при сравнении с 1-й группой вызвало достоверное увеличение MIP-1α и IL-12p40 и снижение IL-1α (рис. 2, а, в). Значение IL-2 при добавлении в рацион CAR оставалось достоверно повышенным (рис. 2, б), а содержание MIP-3α — достоверно сниженным (рис. 2, в) по сравнению с контролем. У крыс 4-й группы (ВКХДР с ALA) увеличилось содержание IL-12p40 по сравнению с контролем (рис. 2, а) (р<0,05). Количество IL-1α и MIP-3α в лизатах на фоне потребления ALA достоверно снизилось, было обнаружено уменьшение содержания IL-4 в сравнении с контрольной группой (рис. 2 а, в). Содержание RANTES под влиянием ALA снизилось, но оставалось достоверно больше, чем в контроле. Добавление к ВКХДР комплексного препарата (CAR+ALA) вызвало достоверное увеличение уровня IL-5 и способствовало уменьшению содержания в лизатах MIP-3α, IL-1α, IL-12p40 и TNF-α по сравнению с контрольной группой (рис. 2, а, в, р<0,05). Так же, как и в 4-й группе, сохранялось достоверно повышенной медиана RANTES (0,08 пг/мл: min — 0,04, max — 0,14 vs 0,04 пг/мл: min — 0,01, max — 0,06; p<0,05).
При оценке результатов влияния рационов, обогащенных CAR и ALA (3–5 группы), на содержание цитокинов в сравнении с группой, потреблявшей ВКХДР (2-я группа), было обнаружено, что при добавлении к рациону CAR у крыс 3-й группы достоверно увеличилось содержания IL-10, IL-12p40, MIP-2 и обнаружена тенденция к росту TNF-α (p=0,06) по сравнению со 2-й группой (рис. 3, а–б). Содержание IL-1α под влиянием CAR, наоборот, достоверно уменьшилось. Добавление к рациону ALA вызвало достоверное увеличение в лизатах содержания IL-10, IL-12p40 и достоверное снижение содержания IL-4, IL-17A и M-CSF (рис. 3, а–б). Увеличение содержания MIP-2 и уменьшение количества MCP-1 и RANTES оказалось на уровне значимой тенденции по сравнению с группой животных на ВКХДР (0,05<P<0,1).
Комбинированное обогащение рациона CAR+ALA в 5-й группе также повлияло на изменения цитокинового профиля, вызванные потреблением ВКХДР. По сравнению со 2-й группой достоверно снизилось содержание IL-17A, IL-4, M-CSF, MIP-3α, RANTES (рис. 3, а–б) и IL-2 (рис. 2, б). При этом содержание RANTES в 5-й группе уменьшилось почти в 4 раза по сравнению с данным показателем у крыс 2-й группы, но оставалось по-прежнему больше, чем в контроле (рис. 2–3). В отличие от перечисленных изменений, обогащение рациона комплексом CAR+ALA привело к достоверному увеличению содержания в лизатах IL-5 и IFN-γ (рис. 3, а).
Соотношение уровней цитокинов и хемокинов в плазме крови и их содержания в лизатах коры головного мозга крыс (пл/лиз)
Результаты определения уровней цитокинов и хемокинов в плазме крови при содержании животных на ВКХДР с добавлением CAR и ALA представлены в ранее опубликованной работе [1]. Под влиянием ВКХДР выявлено достоверное уменьшение показателя пл/лиз для IL-1α, IL-2, GM-CSF, M-CSF, MIP-1α и увеличение соотношения для MIP-3α по сравнению с контрольной группой (рис. 4, а; p<0,05). Соотношение пл/лиз для RANTES во 2-й группе снижалось по сравнению с контролем на уровне тенденции (p=0,06).
Потребление животными ВКХДР с CAR вызвало рост значений пл/лиз для IL-2, IL-17A, MIP-3α (рис. 4, б; p<0,05) и способствовало увеличению этого показателя в отношении M-CSF и снижению — GM-CSF (p=0,06 для каждого фактора) по сравнению с 1-й группой. Под влиянием ALA достоверное увеличение пл/лиз по сравнению с контролем было обнаружено для IL-4, IL-10, IL-17A и MIP-3α (рис. 4, в; p<0,05). Потребление животными ALA также увеличивало соотношение между плазмой и лизатами для IL-5 (p=0,08) и снижало значения пл/лиз для GM-CSF (p=0,06) и M-CSF (p<0,05). Добавление комплекса CAR+ALA к ВКХДР редуцировало число изменений соотношения пл/лиз, вызванных потреблением животными ВКХДР, по сравнению с другими опытными группами и контролем (рис. 4, а-г).
На этом рационе оставался сниженным показатель только для M-CSF и стойко повышенным, как и в остальных опытных группах, для MIP-3α (p<0,05).
ОБСУЖДЕНИЕ
Достоверное увеличение соотношения Тг/СЖК во 2-й группе (рис. 1) свидетельствует о развитии дислипидемии у крыс при потреблении ВКХДР. Изменение уровней липидов с увеличением содержания Тг вызывает активацию эндотелия, перицитов, элементов базальной мембраны, астроцитов и периваскулярных макрофагов, функционально интегрированных в ГЭБ, вызывая повышение его проницаемости [20]. Таким образом, становится возможным проникновение циркулирующих в сосудистом русле цитокинов, которые могут в тканях головного мозга стимулировать активность как клеток ГЭБ, так и нейроглии и микроглии. Активация микроглии (микроглиоз) и астроцитов (астроцитоз) приводит к синтезу провоспалительных цитокинов, оказывающих повреждающее действие на нейроны. Кроме того, нарушение интеграции ГЭБ способствует инфильтрации ЦНС лейкоцитами и последующему нейровоспалению [8]. В нашем исследовании у животных 2-й группы, потреблявших ВКХДР, выявлено достоверное увеличение в лизатах лобной доли коры головного мозга содержания IL-2, M-CSF, MIP-1α и RANTES (рис. 2, а-в), регулирующих вялотекущее воспаление при метаболических расстройствах [21][22]. Дислипидемия в условиях потреблении ВКХДР приводит к активации иммунной системы, т.к. циркулирующие жирные кислоты способны взаимодействовать с TLR4-белком (толл-подобный рецептор 4, CD284). Активация жирными кислотами TLR4 in vitro индуцирует воспалительные сигнальные пути в астроцитах, микроглии и нейронах. В частности, после контактов с TLR4 запускаются медиаторы воспаления JNK протеинкиназы и NF-kB, который регулирует экспрессию цитокинов и хемокинов посредством эпигенетических и транскрипционных механизмов [23][24]. Это вызывает индукцию механизмов вялотекущего воспаления. Выявленное под влиянием ВКХДР уменьшение соотношения пл/лиз, при котом наблюдается относительное увеличение содержания в лизатах по сравнению с уровнем в плазме: IL-1α, IL-2, GM-CSF, M-CSF, MIP-1α и RANTES (рис. 4, а-г), может быть следствием стимуляции продукции этих цитокинов резидентными макрофагами и клетками нейроглии, способными к выработке про- и противовоспалительных факторов [25][26]. Таким образом, на модели ожирения показано наличие воспалительного процесса в коре головного мозга крыс, о чем свидетельствует увеличение как абсолютного, так и относительного (по показателю соотношения пл/лиз) содержания провоспалительных факторов: IL-2, M-CSF, MIP-1α и RANTES и разной степени выраженности снижение содержания иммунорегуляторных цитокинов: IL-10, IL-17A, IL-12p40, IL-12p70, TNF-a, MIP-2 и MIP-3α по сравнению с контролем (Рис. 2–4).
Современные подходы к диетотерапии ожирения основываются на способности нутриентов активно воздействовать на метаболические процессы, баланс накопления и утилизации жира, что позволяет уменьшать интенсивность воспаления с супрессией активации микроглии в анатомических структурах головного мозга [27][28]. Используемые в проведенном нами исследовании CAR и ALA как по отдельности, так и комплексно при добавлении к ВКХДР снижают соотношение Тг/СЖК в 3, 4 и 5-й группах до контрольных значений (рис. 1).
CAR и ALA — биологически активные вещества, обладающие способностью уменьшать выраженность воспалительных процессов при ожирении. Механизмы антиоксидантного влияния этих биологически активных веществ различаются и не до конца изучены. Установлено, что ALA, являясь природным антиоксидантом, может оказывать метаболический и иммуномодулирующий эффект при воспалительных процессах различного генеза. К механизмам протективного действия ALA относят способность данного биологически активного вещества уменьшать липогенез в печени, угнетая экспрессию генов ChREBP (углевод-реагирующий элемент-связывающий белок) и SREBP-1c (регуляторный элемент стерола-связывающий белок-1с) и стимулировать экспрессию генов липолиза CPT-1 (карнитин-пальмитоилтрансфераза-1), PPAR-a (рецепторы-альфа, активируемые пероксисомными пролифераторами) и ACOX (ацил-CoA оксидаза), снижающих также всасывание липидов в кишечнике, биосинтез липидов и улучшающих обмен жиров [29].
CAR, так же, как и ALA, достаточно эффективно редуцирует уровень липидов и улучшает обменные процессы [30]. Механизм позитивного влияния CAR связан с подавлением активности ферментов FAS (синтаза жирных кислот), HMG-CoA (3-гидрокси-3-метилглутарил-Co-A) редуктазы и SREBP-1a, -1c и -2 в печени и жировой ткани, что ведет к уменьшению объема жировой ткани и достоверному снижению уровня триглицеридов и холестерина [31].
В нашем исследовании обогащение ВКХДР биологически активными веществами, как CAR, так и ALA, оказывает влияние на механизмы липидного обмена, обеспечивающие снижение соотношения Тг/СЖК у крыс опытных групп до значений в контроле, что является одной из предпосылок редукции воспалительного процесса в структурах головного мозга [24]. При этом отчетливо прослеживается тенденция к снижению содержания в лизатах лобной доли коры больших полушарий головного мозга крыс провоспалительных и регулирующих апоптоз цитокинов и хемокинов: IL-1a, IL-2, IL-17A, M-CSF, MCP-1, MIP-3a и RANTES по сравнению с группой крыс, потреблявших ВКХДР, и возврат для большинства цитокинов соотношения пл/лиз к значениям в контрольной группе (рис. 2–4).
Установлено, что CAR, обладая способностью облегчать проявления окислительного стресса за счет прямого антиоксидантного действия, способствует сохранению и восстановлению эндогенных антиокислительных механизмов в ткани мозга [32]. Иммуномодулирующее действие CAR реализуется также за счет активации карнозин-гистидин-гистаминового метаболического пути с образованием из CAR гистамина, который оказывает иммуномодулирующее действие, связываясь со специфическими гистаминовыми рецепторами H1–H4 [33][34]. Результатом становится супрессия продукции и иммуномодулирующих эффектов IL-1 и IFN-γ. В ответ активируются экспрессия и синтез IL-10, регулирующего про- и противовоспалительные механизмы (рис. 2–4). Очевидно, что прогрессивное увеличение содержания IL-10 в 3-й группе по сравнению со 2-й и уменьшение — IL-1α становится результатом активации этого метаболического пути (рис. 2–3).
ALA также обладает иммуномодулирующей активностью, действуя в качестве агониста PPAR-γ (рецептор, активируемый пероксисомными пролифераторами-γ). PPAR-γ считается ключевым негативным регулятором дифференцировки Th17 и селективно ингибирует активность Th1 и Th17 за счет активации Treg-клеток и Th2. На рисунке 3, а, б показано, что использование в рационе ALA (4-я гр.) и сочетанно с CAR (5-я гр.) значимо снижает содержание IL-17A, что способствует уменьшению содержания и остальных провоспалительных факторов: IL 12p40, IL-1α, M-CSF, MIP-3α, RANTES по сравнению с группой, потреблявшей ВКХДР (2-я гр.). В исследованиях на моделях с экспериментальным аутоиммунным энцефалитом и оксидативными изменениями в ЦНС при сахарном диабете установлено негативное влияние ALA на экспрессию молекул адгезии ICAM-1 и VCAM-1, супрессируя клеточную миграцию [35], что подтверждает снижение значений указанных выше хемокинов: M-CSF, MIP-3α, RANTES и повышение, так же как и под влиянием CAR, содержания в лизатах IL-10 (рис. 3, а).
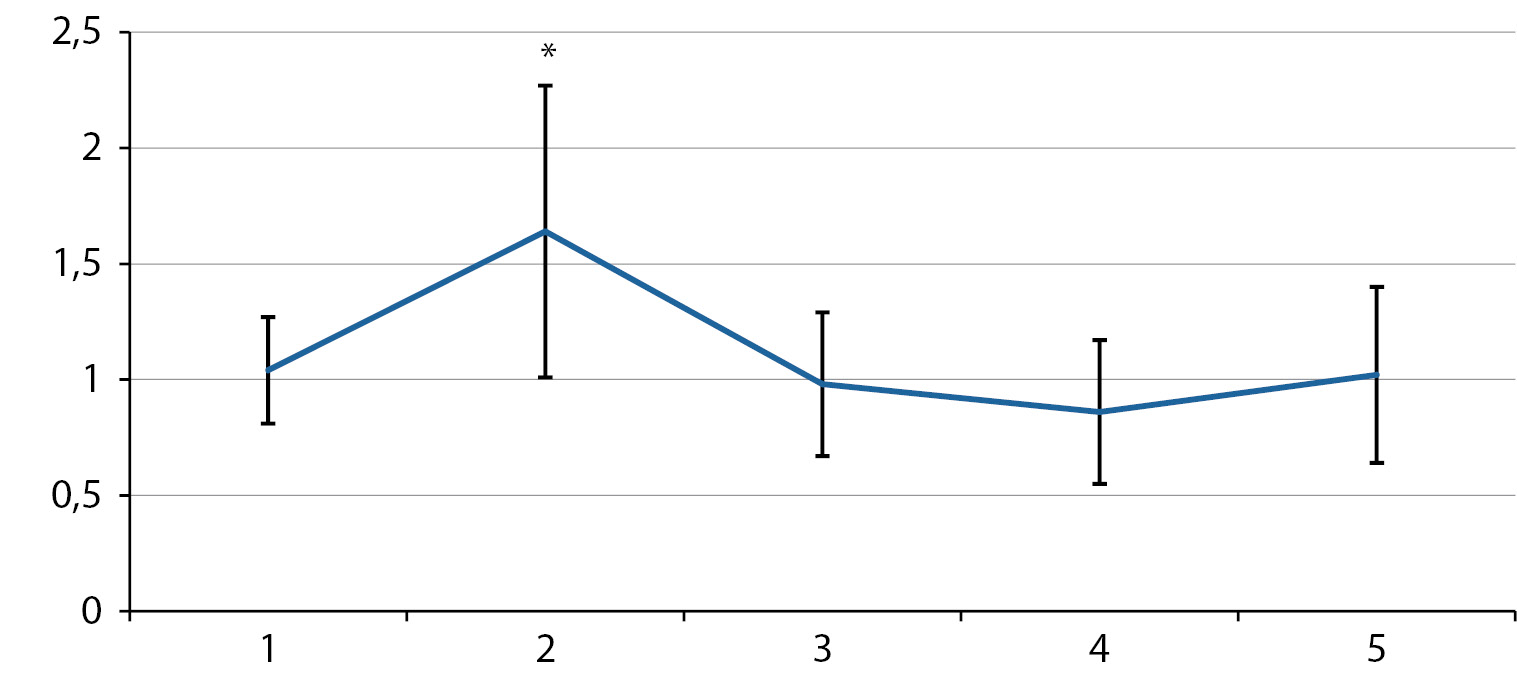
Рисунок 1. Соотношение уровней триглицеридов (Тг) в плазме крови и свободных жирных кислот (СЖК) — Тг/СЖК. По оси Y — Тг/СЖК в условных единицах; по оси X — номера групп.
Примечание. Здесь и на рис. 2–4: 1 гр. — контроль, 2 гр. — ВКХДР, 3 гр. — ВКХДР+ CAR, 4 — ВКХДР + ALA, 5 гр. — ВКХДР с комплексом CAR+ ALA. * — статистически значимое отличие от показателя контрольной группы (р<0,05). В качестве разбросов представлены минимальные и максимальные полученные значения
Figure 1. The ratio of triglycerides (Tg) in blood plasma to free fatty acids (FFA) — Tg / FFA. Along the Y axis — Tg / FFA in arbitrary units; along the X axis, group numbers.
Note. 1 gr. — control, 2 gr. — HCHDR, 3 gr. — HCHDR + CAR, 4 — HCHDR + ALA, 5 gr. — HCHDR with CAR+ ALA complex. * — statistically significant difference from the control group (p<0,05). The minimum and maximum obtained values are presented as spreads.
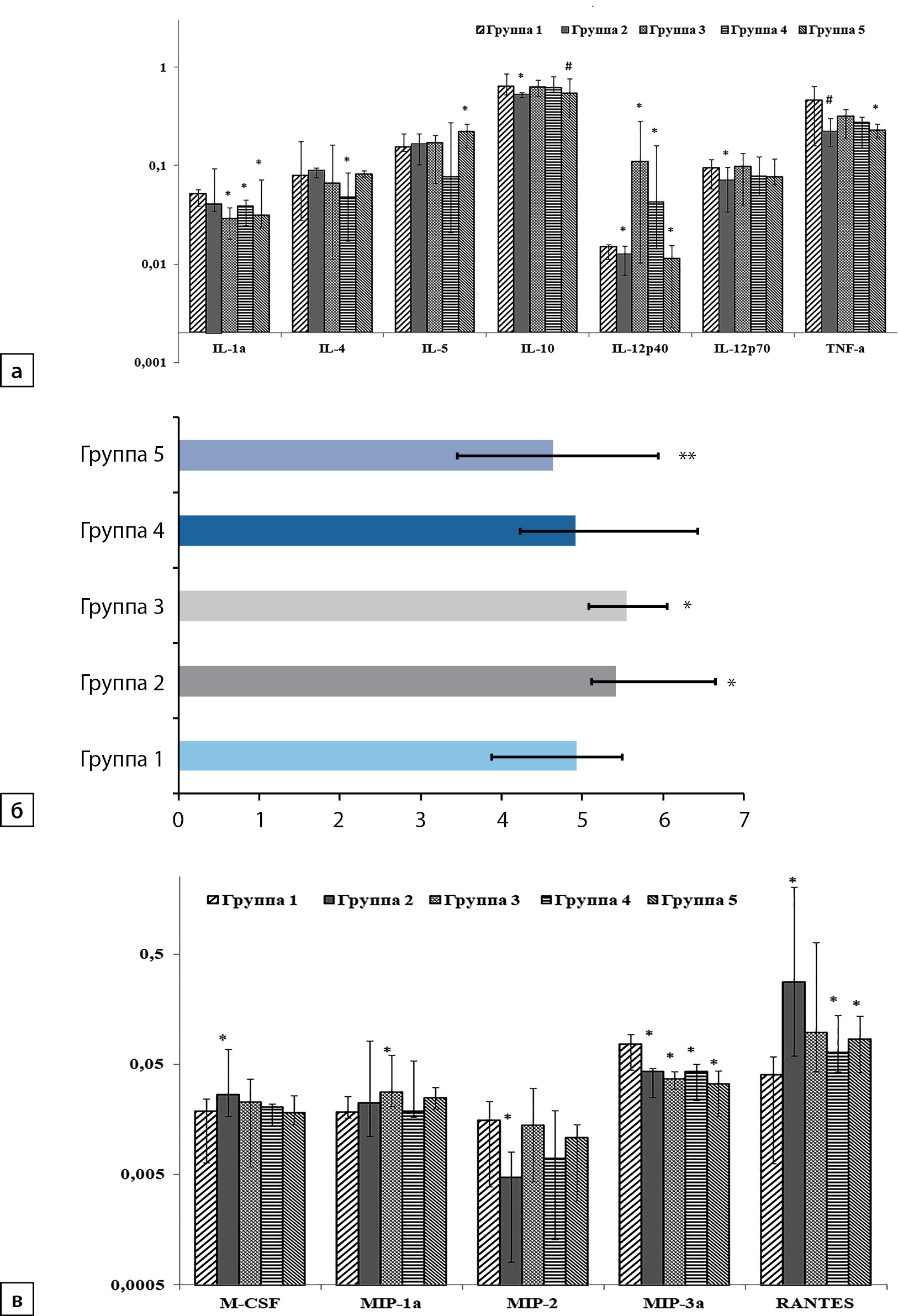
Рисунок 2. Содержание цитокинов и хемокинов в коре лобной доли левого полушария головного мозга крыс опытных групп по сравнению с контрольной: а — содержание цитокинов: IL — интерлейкин; TNF-α — фактор некроза опухолей альфа; по оси Y содержание цитокинов (пг/мл); б — содержание IL-2; по оси X содержание IL-2 (пг/мл); в — содержание хемокинов: CSF — колониестимулирующие факторы; MIP —макрофагальные белки воспаления; RANTES — экспрессируемый и секретируемый T-клетками при активации хемокин; по оси Y содержание хемокинов (пг/мл).
* — различия между контролем и опытными группами p<0,05; # — различия на уровне тенденции 0,05<p<0,1; ** — на рис. 2б различия между 2-й и 5-й группами p<0,05.
Figure 2. The content of cytokines and chemokines in the cortex of the frontal lobe of the left cerebral hemisphere of the rats of the experimental groups compared with the control. 2a — content of cytokines: IL-interleukin; TNF-α — tumor necrosis factor alpha; along the Y axis, the content of cytokines (pg/ml). 2b — content of IL-2; along the X axis, the content of IL-2 (pg/ml). 2c — content of chemokines: CSF — colony stimulating factors; MIP- macrophage inflammatory proteins; RANTES — chemokine expressed and secreted by T cells upon activation; along the Y axis, the content of chemokines (pg / ml).
Note. see fig.1. *- differences between control and experimental groups p<0,05; # — differences at the trend level 0,05<p<0,1; ** — in fig. 2b differences between the 2nd and 5th groups p<0,05.
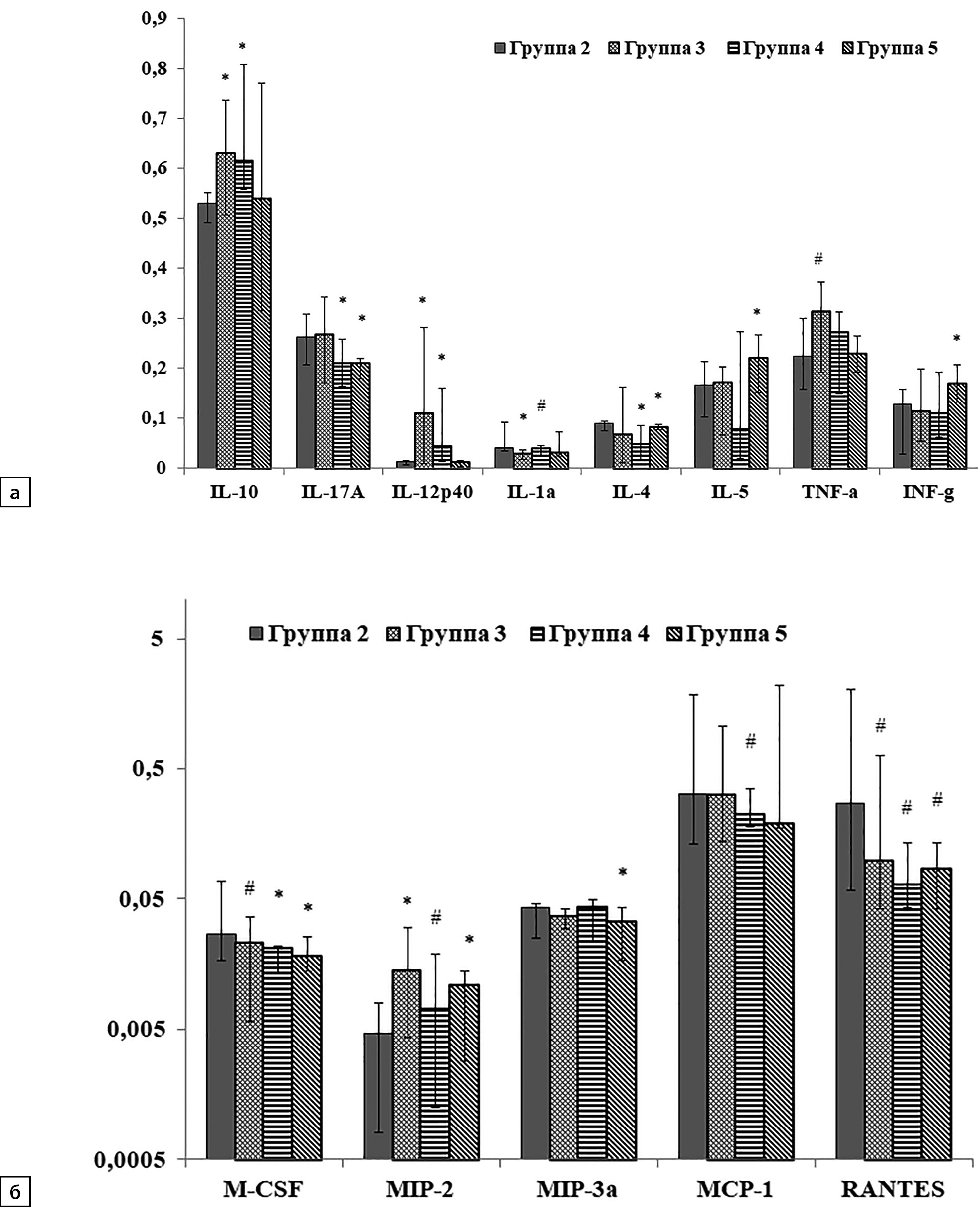
Рисунок 3. Содержание цитокинов и хемокинов в коре лобной доли левого полушария головного мозга крыс опытных групп по сравнению со 2-й группой: а — содержание цитокинов: IL — интерлейкин; TNF-a — фактор некроза опухолей альфа; IFN-γ — интерферон гамма; по оси Y содержание цитокинов (пг/мл); б — содержание хемокинов: CSF — колониестимулирующие факторы; MIP-макрофагальные белки воспаления; RANTES- экспрессируемый и секретируемый T-клетками при активации хемокин; MCP-1 — моноцитарный хемоаттрактантный белок; по оси Y — содержание хемокинов (пг/мл).
Примечание. * — различия между опытными группами p<0,05; # — различия на уровне тенденции 0,05<p<0,1.
Figure 3. The content of cytokines and chemokines in the cortex of the frontal lobe of the left cerebral hemisphere of the rats of the experimental groups compared with the 2nd group. 3a — content of cytokines: IL-interleukin; TNF-a, tumor necrosis factor alpha; IFN-γ — interferon gamma; along the Y axis, the content of cytokines (pg/ml). 3b — content of chemokines: CSF — colony-stimulating factors; MIP- macrophage inflammatory proteins; RANTES — chemokine expressed and secreted by T cells upon activation; MCP-1 — monocytic chemotractive protein; along the Y axis — the content of chemokines (pg/ml).
Note. see fig.1. *— differences between the experimental groups p<0,05; # — differences at the trend level 0,05<p<0,1
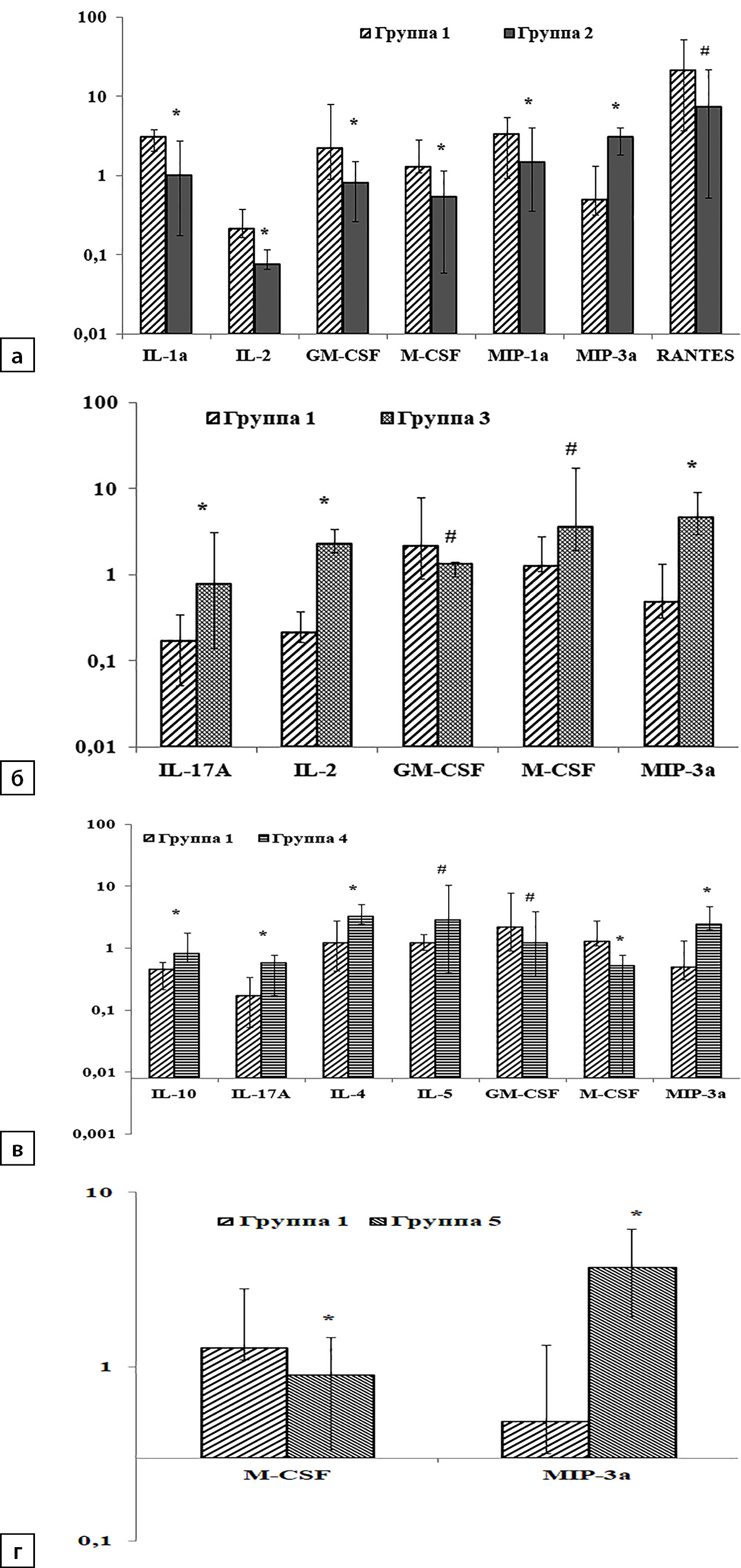
Рисунок 4. Соотношение уровня цитокинов в плазме крови и содержания в лизатах головного мозга (пл/лиз). По оси Y содержание цитокинов и хемокинов (пг/мл).
Примечание. * — различия между опытными группами и контрольной p<0,05; # — различия на уровне тенденции 0,05<p<0,1
Figure 4. The ratio of the level of cytokines in blood plasma to the content in brain lysates (pl/lys). On the Y axis, the content of cytokines and chemokines (pg / ml):
Note. see fig.1. *- differences between the experimental groups and control p<0,05; # — differences at the trend level 0,05<p<0,1.
ЗАКЛЮЧЕНИЕ
Таким образом, обогащение ВКХДР биологически активными веществами: CAR, ALA или их комплексом обеспечивает нормализацию липидного обмена, о чем свидетельствует снижение до контрольных значений соотношения циркулирующих Тг и СЖК в сыворотке крови крыс. Нейропротекторное действие данных биологически активных веществ заключается в снижении содержания в коре лобной доли головного мозга крыс провоспалительных и регулирующих апоптоз цитокинов и хемокинов: IL-1α, IL-2, IL-17A, M-CSF, MCP-1, MIP-3α и RANTES наряду с повышением уровня противовоспалительного цитокина IL-10, что свидетельствует о супрессии воспалительного процесса, индуцированного потреблением крысами ВКХДР.
КЛИНИЧЕСКАЯ ЗНАЧИМОСТЬ РЕЗУЛЬТАТОВ
Полученные данные свидетельствуют о перспективе использования CAR и ALA или их комплекса в качестве нейропротекторов — антиоксидантов для снижения воспалительного процесса в структурах головного мозга при ожирении.
НАПРАВЛЕНИЯ ДАЛЬНЕЙШИХ ИССЛЕДОВАНИЙ
Результаты исследования свидетельствуют о необходимости дальнейшего изучения и научного обоснования применения биологически активных веществ, обладающих антиоксидантным действием, в диетотерапии для улучшения комплаентности к основному лечению пациентов с алиментарно-зависимыми заболеваниями, в том числе ожирением.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование проведено за счет средств субсидии на выполнение государственного задания.
Конфликт интересов. Авторы статьи заявляют об отсутствии конфликта интересов.
Участие авторов. Ригер Н.А., Трушина Э.Н., Тимонин А.Н. — сбор и обработка материалов; Девятов А.А., Аксенов И.В. — концепция и дизайн исследования; Ригер Н.А., Трушина Э.Н. — анализ полученных данных, написание текста; Тутельян В.А. — редактирование, утверждение окончательного варианта статьи; ответственность за целостность всех частей статьи — все авторы.
Благодарности. Авторы выражают глубокую благодарность сотрудникам ФГБУН «ФИЦ питания и биотехнологии»: Гусевой Г.В., Трусову Н.В., Авреньевой Л.И. и Балакиной А.С. за помощь в проведении исследований.
Список литературы
1. Ригер Н.А., Трушина Э.Н. , Тимонин А.Н. и др. Влияние карнозина и альфа-липоевой кислоты на цитокиновый профиль у самцов крыс линии Wistar при ожирении // Аллергология и иммунология. — 2022. — Т. 23. — №1. — С. 22-28.
2. Gregor MF, Hotamisligil GS. Inflammatory mechanisms in obesity. Annu Rev Immunol. 2011;29(1):415-445. doi: https://doi.org/10.1146/annurev-immunol-031210-101322
3. Романцова Т.И., Сыч Ю.П. Иммунометаболизм и метавоспаление при ожирении // Ожирение и метаболизм. — 2019. — Т. 16. — №4. — С. 3-17. doi: https://doi.org/10.14341/omet12218
4. McLaughlin T, Ackerman SE, Shen L, Engleman E. Role of innate and adaptive immunity in obesity-associated metabolic disease. J Clin Invest. 2017;127(1):5-13. doi: https://doi.org/10.1172/JCI88876
5. Lee YS, Wollam J, Olefsky JM. An integrated view of immunometabolism. Cell. 2018;172(1-2):22-40. doi: https://doi.org/10.1016/j.cell.2017.12.025
6. Gunawan S, Aulia A, Soetikno V. Development of rat metabolic syndrome models: A review. Vet World. 2021;14(7):1774-1783. doi: https://doi.org/10.14202/vetworld.2021.
7. Hotamisligil GS. Inflammation, metaflammation and immunometabolic disorders. Nature. 2017;542(7640):177-185. doi: https://doi.org/10.1038/nature21363
8. Fuente-Martín E, Mellado-Gil JM, Cobo-Vuilleumier N, et al. Dissecting the Brain/Islet Axis in Metabesity. Genes (Basel). 2019;10(5):350. doi: https://doi.org/10.3390/genes10050350
9. Pugazhenthi S, Qin L, Reddy PH. Common neurodegenerative pathways in obesity, diabetes, and Alzheimer’s disease. Biochim Biophys Acta. 2017;1863(5):1037-1045. doi: https://doi.org/10.1016/j.bbadis.2016.04.017
10. Guillemot-Legris O, Muccioli GG. Obesity-induced neuroinflammation: Beyond the hypothalamus. Trends Neurosci. 2017;40(4):237-253. doi: https://doi.org/10.1016/j.tins.2017.02.005
11. Koyama A, O’Brien J, Weuve J, et al. The role of peripheral inflammatory markers in dementia and alzheimer’s disease: A meta-analysis. Journals Gerontol Ser A Biol Sci Med Sci. 2013;68(4):433-440. doi: https://doi.org/10.1093/gerona/gls187
12. Di Filippo M, Chiasserini D, Gardoni FB, et al. Effects of central and peripheral inflammation on hippocampal synaptic plasticity. Neurobiol Dis. 2013:(52);229-236. doi: https://doi.org/10.1016/j.nbd.2012.12.009
13. De Souza CT, Araujo EP, Bordin S, et al. Consumption of a fat-rich diet activates a proinflammatory response and induces insulin resistance in the hypothalamus. Endocrinology. 2005;146(10):4192-4199. doi: https://doi.org/10.1210/en.2004-1520
14. Thaler J.P., Yi C.X., Schur E.A. et al. Obesity is associated with hypothalamic injury in rodents and humans. J Clin Invest. 2012;(122):153-162. doi: https://doi.org/10.1172/JCI59660
15. Jais A, Bruning JC. Hypothalamic inflammation in obesity and metabolic disease. J Clin Invest. 2017;127(1):24-32. doi: https://doi.org/10.1172/JCI88878.
16. Gómez-Apo E, Mondragón-Maya A, Ferrari-Díaz M, Silva-Pereyra J. Structural brain changes associated with overweight and obesity. J Obes. 2021;2021:1-18. doi: https://doi.org/10.1155/2021/6613385
17. Lindstedt L, Schaeffer PJ. Use of allometry in predicting anatomical and physiological parameters of mammals. Lab Anim. 2002;36(1):1-19. doi: https://doi.org/10.1258/0023677021911731
18. Ригер Н.А., Трушина Э.Н. , Тимонин А.Н. и др. Патогенетические механизмы развития гематологических нарушений при индуцированной жировой дистрофии печени у крыс линии Wistar и оценка регуляторного влияния карнозина и α-липоевой кислоты // Вопросы питания. — 2021. — Т. 90. — .№3. — С. 6-19. doi: https://doi.org/10.33029/0042-8833-2021-90-3-6-19
19. Reeves PG, Nielsen FH, Fahey GC Jr. AIN-93 purified diets for laboratory rodents: final report of the American Institute of Nutrition ad hoc writing committee on the reformulation of the AIN-76A rodent diet. J Nutr. 1993;123(11):1939-1951. doi: https://doi.org/10.1093/jn/123.11.1939
20. Bogush M, Heldt NA, Persidsky Y. Blood brain barrier injury in diabetes: unrecognized effects on brain and cognition. J Neuroimmune Pharmacol. 2017;12(4):593-601. doi: https://doi.org/10.1007/s11481-017-9752-7.
21. Shi J, Fan J, Su Q, Yang Z. Cytokines and Abnormal Glucose and Lipid Metabolism. Front Endocrinol (Lausanne). 2019;(10):703. doi: https://doi.org/10.3389/fendo.2019.00703
22. Fahed G, Aoun L, Bou Zerdan M, et al. Metabolic Syndrome: Updates on pathophysiology and management in 2021. Int J Mol Sci. 2022;23(2):786. doi: https://doi.org/10.3390/ijms23020786
23. Mitchell J.P., Carmody R. J. NF-κB and the transcriptional control of inflammation. Int Rev Cell Mol Biol. 2018;(335):41-84. doi: https://doi.org/10.1016/bs.ircmb.2017.07.007.
24. Seong J., Kang J.Y., Sun J.S., Kim K.W. Hypothalamic inflammation and obesity: a mechanistic review. Arch Pharm Res. 2019;42(5):383-392. doi: https://doi.org/10.1007/s12272-019-01138-9
25. Kettenmann H, Hanisch UK, Noda M, Verkhratsky A. Physiology of microglia. Physiol Rev. 2011;91(2):461-553. doi: https://doi.org/10.1152/physrev.00011
26. Zhu H, Hu S, Li Y, et al. Interleukins and Ischemic Stroke. Front Immunol. 2022;(13):41-84. doi: https://doi.org/10.3389/fimmu.2022.828447
27. Deledda A, Annunziata G, Tenore GC, et al. Diet-derived antioxidants and their role in inflammation, obesity and gut microbiota modulation. Antioxidants (Basel). 2021;10(5):708. doi: https://doi.org/10.3390/antiox10050708.
28. Sugiyama A, Kato H, Takakura H, et al. Effects of physical activity and melatonin on brain‐derived neurotrophic factor and cytokine expression in the cerebellum of high‐fat diet‐fed rats. Neuropsychopharmacol Reports. 2020;40(3):291-296. doi: https://doi.org/10.1002/npr2.12125
29. Ghelani H, Razmovski-Naumovski V, Nammi S. Chronic treatment of (R) – α-lipoic acid reduces blood glucose and lipid levels in high-fat diet and low-dose streptozotocin-induced metabolic syndrome and type 2 diabetes in Sprague-Dawley rats. Pharmacol Res Perspect. 2017;5(3):e00306. doi: https://doi.org/10.1002/prp2.306
30. Forsberg E.A., Botusan I.R., Wang J. et al. Carnosine decreases IGFBP1 production in db/db mice through suppression of HIF-1. J Endocrinol. 2015;225(3):159-167. doi: https://doi.org/10.1530/JOE-14-0571
31. Mong MC, Chao CY, Yin MC. Histidine and carnosine alleviated hepatic steatosis in mice consumed high saturated fat diet. Eur J Pharmacol. 2011;653(1-3):82-88. doi: https://doi.org/10.1016/j.ejphar.2010.12.001
32. Berezhnoy DS, Stvolinsky SL, Lopachev AV, et al. Carnosine as an effective neuroprotector in brain pathology and potential neuromodulator in normal conditions. Amino Acids. 2019;51(1):139-150. doi: https://doi.org/10.1007/s00726-018-2667-7
33. Bae O-N, Majid A. Role of histidine/histamine in carnosine-induced neuroprotection during ischemic brain damage. Brain Res. 2013;1527(3):246-254. doi: https://doi.org/10.1016/j.brainres.2013.07.004
34. Virdi JK, Bhanot A, Jaggi AS, Agarwal N. Investigation on beneficial role of l -carnosine in neuroprotective mechanism of ischemic postconditioning in mice: possible role of histidine histamine pathway. Int J Neurosci. 2020;130(10):983-998. doi: https://doi.org/10.1080/00207454.2020.1715393
35. Wang KC, Tsai CP, Lee CL, et al. α-Lipoic acid enhances endogenous peroxisome-proliferator-activated receptor-γ to ameliorate experimental autoimmune encephalomyelitis in mice. Clin Sci (Lond). 2013;125(7):329-340. doi: https://doi.org/10.1042/CS20120560
Об авторах
Э. Н. ТрушинаРоссия
Трушина Элеонора Николаевна, кандидат медицинских наук
109240, г. Москва, Устьинский проезд, д. 2/14
eLibrary SPIN: 9908-6436
Н. А. Ригер
Россия
Ригер Николай Александрович, доктор медицинских наук, профессор
Москва
А. Н. Тимонин
Россия
Тимонин Андрей Николаевич, кандидат биологических наук
Москва
А. А. Девятов
Россия
Девятов Александр Андреевич, кандидат биологических наук
Москва
И. В. Аксенов
Россия
Аксенов Илья Владимирович, кандидат медицинских наук
Москва
В. А. Тутельян
Россия
Тутельян Виктор Александрович, доктор медицинских наук, профессор
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Соотношение уровней триглицеридов (Тг) в плазме крови и свободных жирных кислот (СЖК) — Тг/СЖК. По оси Y — Тг/СЖК в условных единицах; по оси X — номера групп | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(74KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Содержание цитокинов и хемокинов в коре лобной доли левого полушария головного мозга крыс опытных групп по сравнению с контрольной: а — содержание цитокинов: IL — интерлейкин; TNF-α — фактор некроза опухолей альфа; по оси Y содержание цитокинов (пг/мл); б — содержание IL-2; по оси X содержание IL-2 (пг/мл); в — содержание хемокинов: CSF — колониестимулирующие факторы; MIP —макрофагальные белки воспаления; RANTES — экспрессируемый и секретируемый T-клетками при активации хемокин; по оси Y содержание хемокинов (пг/мл) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(580KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Содержание цитокинов и хемокинов в коре лобной доли левого полушария головного мозга крыс опытных групп по сравнению со 2-й группой: а — содержание цитокинов: IL — интерлейкин; TNF-a — фактор некроза опухолей альфа; IFN-γ — интерферон гамма; по оси Y содержание цитокинов (пг/мл); б — содержание хемокинов: CSF — колониестимулирующие факторы; MIP-макрофагальные белки воспаления; RANTES- экспрессируемый и секретируемый T-клетками при активации хемокин; MCP-1 — моноцитарный хемоаттрактантный белок; по оси Y — содержание хемокинов (пг/мл) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(588KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Соотношение уровня цитокинов в плазме крови и содержания в лизатах головного мозга (пл/лиз). По оси Y содержание цитокинов и хемокинов (пг/мл) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(567KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Трушина Э.Н., Ригер Н.А., Тимонин А.Н., Девятов А.А., Аксенов И.В., Тутельян В.А. Оценка регуляторного влияния карнозина и альфа-липоевой кислоты на цитокиновый профиль коры головного мозга крыс линии Wistar при индуцированном ожирении. Ожирение и метаболизм. 2023;20(1):22-33. https://doi.org/10.14341/omet12968
For citation:
Trushina E.N., Riger N.A., Timonin A.N., Devyatov A.A., Aksenov I.V., Tutelyan V.A. Evaluation of the regulatory effect of carnosine and alpha-lipoic acid on the cytokine profile of the cerebral cortex of Wistar rats under induced obesity. Obesity and metabolism. 2023;20(1):22-33. (In Russ.) https://doi.org/10.14341/omet12968

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































