Перейти к:
Первый опыт применения анализа бета-гидроксибутирата капиллярной крови в диагностике недиабетических гипогликемий у взрослых
https://doi.org/10.14341/omet12822
Аннотация
Обоснование. Диагностический порог β-гидроксибутирата (БГБ) на фоне гипогликемии при инсулиноме разработан для венозной крови много лет назад, когда отсутствовали альтернативные возможности измерения кетонов. В работах ряда авторов, в основном на пациентах с сахарным диабетом, выявлены различия при измерении данного показателя в венозной и капиллярной крови, но результаты оказались противоречивыми. Более того, ранее данное исследование на территории Российской Федерации в диагностике недиабетических гипогликемий (НДГ) у взрослых не применялось.
Цель. Оценить эффективность метода определения БГБ в капиллярной крови и его место в диагностике НДГ.
Материалы и методы. В экспериментальное одномоментное сравнительное исследование включены пациенты с подозрением на НДГ, которым проводилась стандартная проба с длительным голоданием. Уровень БГБ капиллярной крови определялся каждые 6 ч на фоне пробы с голоданием и при ее завершении.
Результаты. На основании результатов пробы с голоданием участники (n=154) разделены на группы: с гиперинсулинемическим вариантом НДГ и ИФРомой (n=98; группа 1), с гипоинсулинемическим вариантом НДГ/отсутствием НДГ (n=56; группа 2). При сравнении уровня БГБ на фоне завершения голодания между группами 1 и 2 получены значимые различия (p<0,001). По данным ROC-анализа, исследование БГБ для определения гипер- и гипоинсулинемического вариантов гипогликемии характеризуется отличным качеством модели (AUC=99,1% [98,0%; 100,0%]). Определено, что максимальной диагностической точностью метод исследования БГБ в капиллярной крови обладает при отрезной точке ≤1,4 ммоль/л (Se 98,0%, Sp 96,4%, РPV 98,0%, NPV 96,4%, Ас 97,4%). Превышение диагностического порога БГБ впервые зафиксировано через сутки голодания; в этой же точке определена значимая разница при сравнении показателей БГБ в двух последовательных измерениях (между 18 ч и 24 ч).
Заключение. Исследование БГБ капиллярной крови является высокочувствительным и высокоспецифичным дополнительным методом дифференциальной диагностики вариантов НДГ. Диагностический порог БГБ капиллярной крови, позволяющий дифференцировать гипер- и гипокетонемический варианты НДГ, составляет ≤1,4 ммоль/л. Инициировать контроль БГБ в крови целесообразно не ранее чем через 18 ч от начала пробы с голоданием.
Для цитирования:
Юкина М.Ю., Трошина Е.А., Нуралиева Н.Ф., Мокрышева Н.Г. Первый опыт применения анализа бета-гидроксибутирата капиллярной крови в диагностике недиабетических гипогликемий у взрослых. Ожирение и метаболизм. 2022;19(2):134-141. https://doi.org/10.14341/omet12822
For citation:
Yukina M.Yu., Troshina E.A., Nuralieva N.F., Mokrysheva N.G. The first experience of using beta-hydroxybutyrate analysis of capillary blood in the diagnosis of non-diabetic hypoglycemia in adults. Obesity and metabolism. 2022;19(2):134-141. (In Russ.) https://doi.org/10.14341/omet12822
ОБОСНОВАНИЕ
Недиабетическая гипогликемия (НДГ) определяется как клиническое состояние у пациентов без сахарного диабета, при котором уровень глюкозы в венозной крови составляет <3 ммоль/л, в большинстве случаев сопровождающееся специфическими симптомами. НДГ может быть симптомом целого ряда заболеваний и состояний. Для уточнения причины НДГ проводятся соответствующие диагностические тесты [1]. Особенности лечения зависят от причины НДГ.
В целом гипогликемию можно разделить на два основных варианта: гиперинсулинемический (опосредованный инсулином) и гипоинсулинемический (независимый от инсулина). Инсулин-опосредованная гипогликемия наблюдается при инсулиноме иавтономной гиперфункции бета-клеток поджелудочной железы (микроаденоматоз) [1][2], при преднамеренном приеме секретагогов инсулина (например, препаратов сульфонилмочевины и глинидов) [3], инсулиновом аутоиммунном синдроме и упостбариатрических пациентов [1].
Гипоинсулинемическая НДГ может регистрироваться при приеме алкоголя, печеночной, почечной и надпочечниковой недостаточности, тяжелом сепсисе, опухолях, продуцирующих инсулиноподобные факторы роста 2 (ИФРома). Важно отметить, что лекарственная гипогликемия (за исключением антигипергликемических препаратов), гипогликемия при врождённых нарушениях метаболизма глюкозы и секреции инсулина, а также гипогликемия, вызванная введением инсулина, в зависимости отконкретного случая, могут регистрироваться как на фоне относительно высокого уровня инсулина, так и супрессированного [1].
В большинстве случаев, как и у здоровых лиц на фоне длительного голодания, гипоинсулинемическая гипогликемия протекает на фоне кетоза вследствие запуска липолиза (кетотическая). Во время длительного голодания кетоновые тела (ацетоацетат, β-гидроксибутират (БГБ) и ацетон), продукты окисления жирных кислот в печени, могут легко преодолевать гематоэнцефалический барьер и обеспечивать дополнительный источник энергии для головного мозга. У здоровых индивидуумов вне голодания уровни циркулирующих кетонов низкие (0–0,5 ммоль/л), однако во время длительного голодания могут повышаться до 7–8 ммоль/л [4].
Инсулин обладает антикетогенным действием и при его избытке даже при длительном голодании уровни БГБ в плазме крови остаются менее 2,7 ммоль/л. Примечательно, что инсулиноподобный фактор роста 2 (и его предшественник), так же, как иинсулин, обладает антикетогенным эффектом, поэтому у пациентов с ИФРомой можно наблюдать некетотическую гипоинсулинемическую гипогликемию [1].
Таким образом, определение кетонов имеет важное значение в дифференциальной диагностике вариантов НДГ. Согласно последним клиническим рекомендациям Endocrine Society от 2009 г., исследование БГБ показано всем пациентам с подозрением на НДГ [1]. Исследователи клиники Майо определили диагностический порог БГБ в сыворотке на фоне гипогликемии для диагностики инсулиномы ≤2,7 ммоль/л, который обладает 100% чувствительностью и специфичностью [5]. Однако данный диагностический критерий разработан для венозной крови (сыворотки или плазмы) много лет назад, когда отсутствовали альтернативные возможности измерения кетонов. В последние годы, в первую очередь для пациентов с сахарным диабетом, появились портативные устройства для самостоятельного измерения не только глюкозы, но и кетонов в капиллярной крови. В работах ряда авторов, в основном на пациентах с сахарным диабетом, выявлены различия при измерении данного показателя в венозной и капиллярной крови, но результаты оказались противоречивыми [6][7].
Важно заметить, что ранее данное исследование на территории Российской Федерации в диагностике НДГ у взрослых не применялось. Учитывая тот факт, что НДГ является достаточно редкой патологией, приобретение медицинским учреждением диагностических наборов для определения БГБ в венозной крови является, по нашему мнению, нерентабельным.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Определить эффективность метода исследования БГБ в капиллярной крови и его место в диагностике НДГ.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. В исследование включены пациенты с подозрением на НДГ, обследованные в Федеральном государственном бюджетном учреждении «Национальный медицинский исследовательский центр эндокринологии» Министерства здравоохранения Российской Федерации.
Время исследования. C января 2017 по декабрь 2021 гг.
Изучаемые популяции (одна или несколько)
В исследование на основании соответствия критериям включения и при отсутствии критериев исключения включены пациенты с подозрением на НДГ.
Критерии включения: мужской и женский пол; возраст 18 лет и старше; подозрение на НДГ: симптомы/признаки гипогликемии (сердцебиение, тремор, возбуждение, потливость, чувство голода, парестезии, поведенческие нарушения, выраженная слабость, спутанность сознания, судороги и кома), купирующиеся после перорального или парентерального поступления углеводов, и/или зарегистрирован низкий уровень глюкозы капиллярной или венозной крови (менее 3 ммоль/л минимум однократно или 3,9–3,0 ммоль/л минимум двукратно).
Критерии исключения: острые инфекции; обострение хронических заболеваний; тяжелые, угрожающие жизни состояния (декомпенсация ХСН, ХБП, легочная и печеночная недостаточности); тяжелые психические заболевания; прием препаратов, обладающих гипергликемическим эффектом (аналоги соматостатина, глюкокортикоиды, диазоксид, ингибиторы альфа-глюкозидазы, ингибиторы протеинкиназы).
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Использован сплошной способ формирования выборки.
Дизайн исследования
Данное исследование является одноцентровым экспериментальным одномоментным одновыборочным сравнительным.
Описание медицинского вмешательства (для интервенционных исследований)
Всем участникам проводилась стандартная проба с длительным голоданием (максимально до 72 ч). При завершении пробы исследовались уровни глюкозы, инсулина, С-пептида и проинсулина сыворотки крови. Уровень БГБ капиллярной крови определялся каждые 6 ч на фоне пробы с голоданием и при ее завершении. Кроме того, после ночного голодания производился забор крови для определения инсулина и глюкозы для расчета индекса HOMA-IR.
Методы
Проба с голоданием выполнялась в соответствии с общепринятым алгоритмом.
Биохимический и гормональные исследования проводились в клинико-диагностической лаборатории ФГБУ «НМИЦ эндокринологии» Минздрава России. Забор крови производился в вакуумные пробирки с инертным гелем и этилендиаминтетрауксусной кислотой. Полученные пробы центрифугировались не позднее чем через 15 минут после забора с использованием центрифуги Eppendorf 5810R при температуре 4°С на скорости 3000 оборотов в минуту в течение 15 минут и затем поступали в работу. Исследование глюкозы, инсулина, С-пептида, проинсулина осуществлялось методом иммуноферментного анализа.
Индекс массы тела (ИМТ; индекс Кетле) рассчитывали как отношение массы тела (кг) к квадрату роста (м2). Для оценки инсулинорезистентности (ИР) рассчитан индекс HOMA-IR: HOMA-IR = (инсулин × глюкоза)/22,5.
Количественное определение БГБ капиллярной крови осуществлялось с помощью системы FreeStyle Optium и соответствующих тест-полосок (производитель Abbott Diabetes Care Inc.; диапазон определяемых концентраций БГБ составляет 0,0–8,0 ммоль/л). С этой целью производилось введение тест-полоски в глюкометр до упора. При помощи прокалывающего устройства получали каплю крови из боковой поверхности пальца пациента и подносили ее к зоне белого цвета на конце тест-полоски. После впитывания крови в тест-полоску удерживали каплю на зоне белого цвета до появления звукового сигнала. Далее ожидали появления второго сигнала и результата на дисплее.
Статистический анализ
Статистическая обработка полученных результатов проводилась с помощью стандартных методов статистического анализа с использованием программного обеспечения: Statistica 10 (StatSoft Inc., США). Для количественных признаков указаны медиана и интерквартильный интервал, а также минимальное и максимальное значение (в отношении отдельных параметров). Для выявления связи между параметрами определялся коэффициент корреляции Спирмена. С целью сравнения количественных данных двух независимых выборок применялся однофакторный дисперсионный анализ (при нормальном распределении признака) или критерий Манна–Уитни (при распределении, отличном от нормального), качественных признаков — тест Хи-квадрат. ROC-анализ осуществлялся с использованием программного обеспечения Microsoft Excel XLSTAT. Различия принимались как статистически значимые при р<0,05.
Этическая экспертиза
Протокол исследования одобрен локальным этическим комитетом ФГБУ «НМИЦ эндокринологии» Минздрава России (протокол №1 заседания локального этического комитета от 27.01.2016 г.).
Все пациенты подписывали информированное согласие, одобренное локальным этическим комитетом ФГБУ «НМИЦ эндокринологии» МЗ РФ.
РЕЗУЛЬТАТЫ
На основании полученных результатов пробы с длительным голоданием участники (n=154) разделены на группы: с гиперинсулинемическим вариантом НДГ и ИФРомой (n=98; группа 1), с гипоинсулинемическим вариантом НДГ/отсутствием НДГ (n=56; группа 2). Количество женщин и мужчин составило 117 и 37 соответственно, средний возраст обследуемых — 47 лет (диапазон от 19 до 80 лет). Клинико-лабораторная характеристика обследованных лиц и сравнение групп 1 и 2 приведены в табл. 1.
Таблица 1. Клинико-лабораторная характеристика пациентов и сравнительный анализ
n | Длительность голодания, ч | БГБ при завершении голодания, ммоль/л | |
Группа 1 | 98 | 11,5 [ 3,0; 16,0]* | 0,2 [ 0,1; 0,3] |
Инсулинома | 96 | 11,5 [ 3,0; 16,0] | 0,2 [ 0,1; 0,3] |
Врожденный гиперинсулинизм | 1 | 40,8 | 1,1 |
ИФРома | 1 | 8 | 0 |
Группа 2 | 56 | 72 [ 72; 72] | 4,8 [ 3,5; 5,6] |
НДГ не подтверждена | 48 | 72 [ 72; 72] | 4,8 [ 3,2; 5,6] |
Наследственное нарушение метаболизма глюкозы | 8 | 72 [ 42; 72] | 4,8 [ 4,0; 6,5] |
ргруппа1 vs группа2 | - | <0,001 | <0,001 |
Примечание. *Me [Q1; Q3].
БГБ — β-гидроксибутират; НДГ — недиабетическая гипогликемия; ИФРома — опухоль, продуцирующая инсулиноподобные факторы роста 2.
При сравнении уровня БГБ на фоне завершения голодания получены значимые различия между группами 1 и 2 (рис. 1).
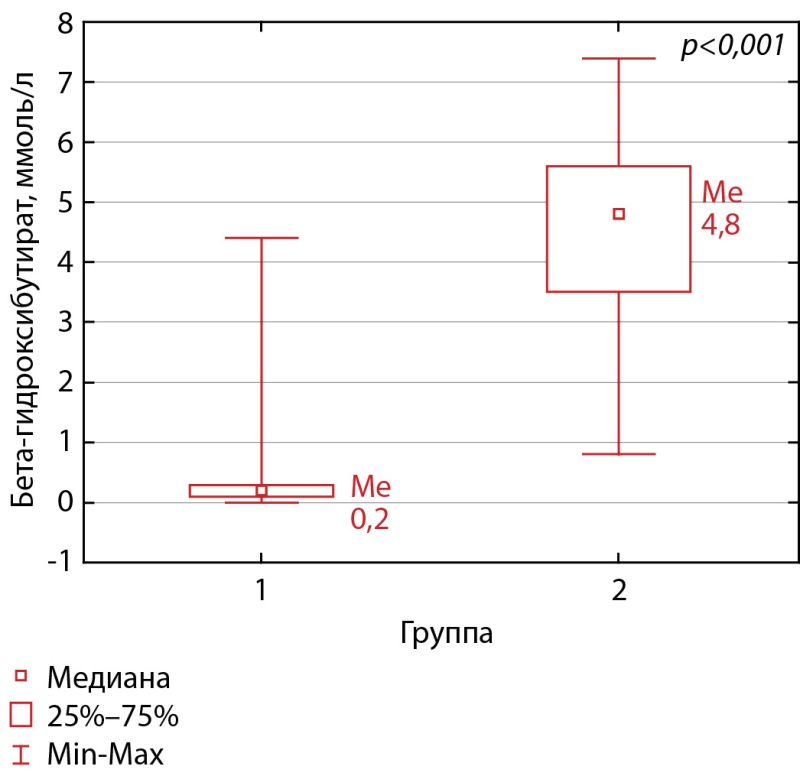
Рисунок 1. Уровень БГБ при завершении пробы с голоданием в группах 1 и 2.
Figure 1. The level of beta-hydroxybutyrate at the end of the fasting test in groups 1 and 2.
Учитывая тесную связь кетогенеза с показателями углеводного обмена, а соответственно и с массой тела пациента, проведена оценка корреляции уровня БГБ и инсулина/С-пептида/проинсулина при завершении пробы, а также индекс HOMA-IR (пациент с ИФР-омой в данном анализе исключен, так как гипокетонемия у него обусловлена действием не инсулина, а ИФР). Кроме того, проведена оценка корреляции уровня БГБ и длительности пробы с голоданием (табл. 2).
Таблица 2. Корреляции между уровнем БГБ при завершении пробы с голоданием с прочими показателями
Группа 1+2 | Группа 1 | Группа 2 | |
HOMA-IR (n=99) | -0,272 | -0,315 | -0,442 |
ИМТ, кг/м2 | -0,431 | -0,251 | -0,320 |
Инсулин, мкЕд/мл | -0,782 | -0,471 | -0,297 |
С-пептид, нг/мл | -0,789 | -0,526 | NS |
Проинсулин, пмоль/л (n=86) | -0,626 | NS | NS |
Длительность голодания, ч | 0,832 | 0,490 | NS |
Примечание. NS — не значимо; ИМТ — индекс массы тела.
По данным ROC-анализа (рис. 2), исследование БГБ для определения гипер- и гипоинсулинемического вариантов гипогликемии характеризуется отличным качеством модели.
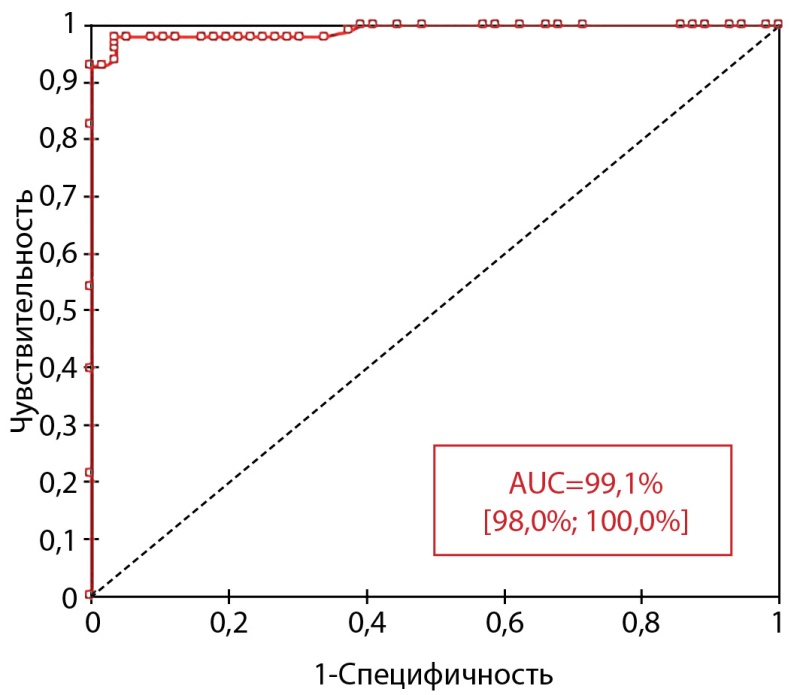
Рисунок 2. ROC-кривая прогностической ценности уровня БГБ при завершении голодания для диагностики варианта НДГ.
Figure 2. The ROC-curve of predictive value of the beta-hydroxybutyrate level at the end of fasting for the diagnosis of the variant of non-diabetic hypoglycemia.
Определено, что максимальной диагностической точностью метод исследования БГБ в капиллярной крови обладает при отрезной точке ≤1,4 ммоль/л в сравнении с порогом ≤2,7 ммоль/л (табл. 3).
Таблица 3. Диагностическая точность исследования БГБ при завершении голодания при различных отрезных точках, %
БГБ при завершении голодания | Se, 95% ДИ | Sp, 95% ДИ | PPV | NPV | Ac |
≤1,4 ммоль/л | 98,0 [ 92,3; 99,8] | 96,4 [ 87,0; 99,6] | 98,0 | 96,4 | 97,4 |
≤2,7 ммоль/л | 98,0 [ 92,3; 99,8] | 82,1 [ 69,9; 90,1] | 90,6 | 95,8 | 92,2 |
Примечание. БГБ — β-гидроксибутират; ДИ — доверительный интервал; Se — чувствительность; Sp — специфичность; PPV — прогностическая ценность положительного результата; NPV — прогностическая ценность отрицательного результата; Ac — точность.
В группах проведен анализ ложноотрицательных результатов БГБ с учетом отрезных точек для венозной и капиллярной крови. Клинико-лабораторная характеристика обследованных лиц и сравнение групп приведены в табл. 4.
Таблица 4. Клинико-лабораторная характеристика пациентов и сравнительный анализ ложноотрицательных результатов
n | БГБ при завершении голодания >2,7 ммоль/л, n (%) | БГБ при завершении голодания >1,4 ммоль/л, n (%) | |
Группа 1 | 98 | 2 (2) | 2 (2) |
Инсулинома | 96 | 2 (2) | 2 (2) |
Врожденный гиперинсулинизм | 1 | 0 | 0 |
ИФРома | 1 | 0 | 0 |
Группа 2 | 56 | 47 (84) | 54 (96) |
НДГ не подтверждена | 48 | 40 (83) | 47 (98) |
Наследственное нарушение метаболизма глюкозы | 8 | 7 (88) | 7 (88) |
ргруппа1 vs группа2 | - | <0,001 | <0,001 |
Примечание. БГБ — β-гидроксибутират.
С целью уточнения длительности голодания, при котором определение БГБ будет наиболее эффективным, 49 участникам исследования показатель был исследован каждые 6 ч в ходе теста (результаты представлены в табл. 5).
Таблица 5. Показатели БГБ в ходе пробы с голоданием в группах 1 и 2
Группа | БГБ, ммоль/л | р1,2 | |||||||||||
6 ч | 12 ч | 18 ч | 24 ч | 30 ч | 36 ч | 42 ч | 48 ч | 54 ч | 60 ч | 66 ч | 72 ч | ||
1 | 0,1 (0,0, 0,5), [ 0,0; 0,3]* | 0,2 (0,0, 1,1),[ 0,1; 0,3] | 0,2 (0,0, 1,4),[ 0,1; 0,4] | 0,3 (0,1, 0,6),[ 0,3; 0,4] | 0,4 (0,0, 1,2),[ 0,3; 0,9] | 0,4 (0,3, 0,6),[ 0,3; 0,6] | 0,8 (0,4, 1,1),[ 0,4; 1,1]** | 3,0 (1,5, 4,4),[ 1,5; 4,4]** | 2,8*** | 2,8*** | 4,3*** | - | 18 vs 24: 0,044 |
2 | 0,3 (0,1, 0,7),[ 0,2; 0,4] | 0,2 (0,1, 1,2),[ 0,1; 0,3] | 0,4 (0,1, 0,8),[ 0,2; 0,5] | 0,7 (0,1, 1,9),[ 0,4; 1,1] | 0,8 (0,2, 2,2),[ 0,4; 1,4] | 1,1 (0,2, 4,9), [ 0,6; 2,5] | 2,7 (0,2, 5,6), [ 0,9; 3,1] | 2,8 (0,5, 5,6), [ 1,0; 4,1] | 3,1 (0,8, 6,4), [ 1,7; 4,4] | 3,3 (0,7, 6,6), [ 2,3; 4,8] | 4,1 (0,9, 5,7), [ 2,7; 4,8] | 4,8 (0,8, 6,7), [ 3,7; 5,6] | 18 vs 24: 0,008; 66 vs 72:0,034 |
Примечание.
*Me (min, max), [Q1; Q3].
**N=2.
***N=1.
БГБ — β-гидроксибутират.
1 Проводилось сравнение между двумя последовательными измерениями.
2 Указаны только при значимых отличиях.
ОБСУЖДЕНИЕ
Полученные результаты во многом согласуются с данными других авторов [5][8–13]. Так, у пациентов с гиперинсулинемической гипогликемией и у больного с ИФРомой медиана уровня БГБ составила ≤2,7 ммоль/л (0,2 [ 0,1; 0,3]), а у пациентов с гипоинсулинемической гипогликемией и у здоровых — >2,7 ммоль/л (4,8 [ 3,5; 5,6]).
В рамках поиска факторов, которые могли оказать влияние на различия в уровне БГБ между группами, нами проведен ряд корреляционных анализов. Мы выявили отрицательную корреляционную связь между уровнем БГБ и показателем ИМТ. Эти данные согласуются с результатами других авторов [14]: предполагается, что снижение продукции БГБ при избыточной массе тела обусловлено нарушением β-окисления жирных кислот. Так же, как и Buffet A. и соавт. [15], мы обнаружили отрицательную корреляционную связь между уровнем БГБ и гормонами (инсулином, С-пептидом и проинсулином) в момент завершения пробы. Отсутствие корреляционной связи между уровнем БГБ и проинсулином в группе 1 при отдельном анализе (в отличие от общей когорты), возможно, обусловлено более независимым от гликемии уровнем данного прогормона (в отличие от С-пептида и инсулина), а в группе 2 — небольшим числом пациентов, которым проведено такое исследование (n=21). Наличие положительной корреляции с длительностью голодания в группе 1, несмотря на супрессирующий эффект инсулина, является проявлением физиологического адаптационного механизма в ответ на депривацию пищи [16]. С учетом того, что вобщей выборке корреляционная связь БГБ как с инсулином, так и с С-пептидом определенно усиливается в сравнении с группой 1, возможно, отсутствие значимой корреляции в группе 2 объясняется недостаточным числом пациентов.
По данным проведенного нами ROC-анализа, исследование БГБ для уточнения варианта гипогликемии характеризуется высокой прогностической ценностью: AUC 99,1% [ 98,0%; 100,0%]. Кроме того, определено, что максимальной диагностической точностью метод исследования БГБ в капиллярной крови обладает при отрезной точке ≤1,4 ммоль/л, а не ≤2,7 ммоль/л (97,4% против 92,2%). Таким образом, наше исследование показало, как и работа Armer J. и соавт. [7], что для капиллярной крови пороговые значения БГБ будут более низкими по сравнению с венозной. Важно также отметить, что исследований диагностической эффективности БГБ капиллярной крови в диагностике НДГ, как и сравнительного анализа данного показателя вкапиллярной и венозной крови на подобной когорте пациентов, ранее в мире не проводилось (в большинстве случаев на выборке пациентов с сахарным диабетом).
С учетом определения новой отрезной точки для БГБ капиллярной крови, в группах проведен анализ ложноотрицательных результатов. Так, у большинства пациентов с инсулиномой (98%), а также у больного с ИФРомой уровень БГБ на фоне гипогликемии составлял ≤1,4 ммоль/л. Единичные случаи превышения данного значения у пациентов с инсулиномой на фоне пробы с голоданием также ранее описаны в литературе [15][17][18]. Schneider D.A. и соавт. в публикации клинического случая предположили, что высокий уровень БГБ может быть обусловлен наличием у пациента инсулинорезистентности [17]. Однако данная гипотеза в настоящем исследовании не подтверждена: в обеих группах определялась значимая отрицательная корреляционная связь.
Также высокий уровень БГБ на фоне гипогликемии описан у пациентов с рецидивом эндогенного гиперинсулинизма после парциальной панкреатэктомии, что, наиболее вероятно, обусловлено снижением инсулинемии и, соответственно, ингибирующего действия на кетогенез [15]. Однако необходимо отметить, что в нашем исследовании у всех пациентов с рецидивом инсулиномы после резекции поджелудочной железы отмечалась супрессия БГБ.
Превышение диагностического порога 1,4 ммоль/л в нашем исследовании отмечалось у двух пациентов с инсулиномой. Данные пациенты (женщины 43 (N1) и 44 (N2) лет с длительностью голодания 51 и 64 ч, уровнем БГБ 4,4 и 4,3 ммоль/л соответственно) имели множественные опухоли поджелудочной железы с мультигормональной секрецией в рамках синдрома множественной эндокринной неоплазии 1 типа: у N1 — инсулин, панкреатический полипептид (ПП), глюкагоноподобный пептид 1 (ГПП1); у N2 — инсулин, ПП. Примечательно, что у N1 также отмечалась супрессия соматостатина (согласно данным, полученным на животных моделях, БГБ стимулирует секрецию соматостатина в нормальной ткани поджелудочной железы [19]). Также недавно выявлено увеличение уровня ГПП1 под действием БГБ [20]. Какой-либо связи между гиперсекрецией ПП и БГБ, по данным литературы, не обнаружено.
Необходимо отметить еще одну особенность пациента N1 — наличие патогенной мутации гена ABCC8, описанной при врожденном гиперинсулинизме. Мнения экспертов относительно диагностического порога БГБ на фоне гипогликемии при данном заболевании в детской когорте пациентов расходятся [21][22]. У другого пациента в нашем исследовании с генетически подтвержденным диагнозом врожденного гиперинсулинизма уровень БГБ в момент гипогликемии был супрессирован и составил 1,1 ммоль/л.
Другие авторы предполагают, что у пациентов с гиперкетонемической гипогликемией профиль секреции инсулиномы схож с таковым нормальных β-клеток поджелудочной железы [15]. Мы сравнили уровень инсулина при завершении голодания у пациентов N1 и N2 (12,9 и 3,65 мкЕ/мл), участников с неподтвержденной НДГ — формально с нормальными β-клетками поджелудочной железы (2,8 [ 1,5; 5,3] мкЕ/мл) — и пациентов с инсулиномой и гипокетонемической гипогликемией (25,1 [ 13,9; 38,9] мкЕ/мл). Между участниками с неподтвержденной НДГ и пациентами N1 и N2 значимых отличий действительно не получено (р=0,206), тогда как между пациентами N1 и N2 и пациентами с инсулиномой и гиперкетонемической гипогликемией выявлены различия на уровне статистической тенденции (р=0,081). С учетом малочисленности выборки пациентов с инсулиномой и гиперкотонемической гипогликемией, однозначных выводов в настоящее время сделать невозможно, требуется дальнейшее накопление данных.
Таким образом, причиной повышения БГБ у пациентов с инсулиномой, на наш взгляд, может являться именно мультигормональная секреция опухоли. Получение подобных результатов должно насторожить врача на предмет наличия у пациента наследственного синдрома, ассоциированного с инсулиномой и другими нейроэндокринными новообразованиями.
Так же, как и в ранее опубликованных работах [5][8][9][12–13], у большинства здоровых индивидуумов и у пациентов с гипоинсулинемическим вариантом НДГ, не опосредованным действием ИФР, уровень БГБ на фоне гипогликемии составлял >2,7 ммоль/л: диагностическое повышение зафиксировано в 84% случаев. А при применении отрезной точки 1,4 ммоль/л увеличилась специфичность метода (диагностическое повышение зафиксировано в 96% случаев). Так, ложноположительный результат определялся только в двух случаях: у участника с неподтвержденной НДГ и инсулинорезистентностью, что согласуется с полученными нами данными об отрицательной корреляционной связи индекса HOMA-IR с уровнем БГБ, и у пациента с глутаровой ацидурией 2-го типа атипичного (мягкого) течения. Как известно, при глутаровой ацидурии 2-го типа развивается дефицит переносчиков и ферментов, в норме обеспечивающих окисление жирных кислот, что приводит к снижению синтеза АТФ, избыточному накоплению в органах липидов и нарушению глюконеогенеза с развитием гипогликемии (как правило, гипокетотической) [23].
Значительный интерес представляют данные в отношении изменения показателей БГБ в ходе пробы с голоданием. Подобное исследование проводилось только Service F.J. и соавт. в 2005 г. [8], при этом авторы исследовали БГБ в сыворотке. В данной работе, включавшей 55 участников, впервые диагностический уровень БГБ зафиксирован на 12 ч пробы. В нашем исследовании превышение диагностического порога БГБ (как >2,7 ммоль/л, так и >1,4 ммоль/л) впервые зафиксировано через сутки голодания; в этой же точке определена значимая разница при сравнении показателей БГБ при двух последовательных измерениях (между 18 ч и 24 ч). С учетом этих данных, а также принимая во внимание физиологические особенности запуска кетогенеза при отсутствии поступления глюкозы (начиная с 12–16 ч голодания [16]), представляется целесообразным исследовать БГБ у пациентов с длительностью пробы не ранее чем через 18 ч.
ЗАКЛЮЧЕНИЕ
Исследование БГБ капиллярной крови является высокочувствительным и высокоспецифичным дополнительным методом дифференциальной диагностики вариантов НДГ; инициировать контроль БГБ в крови целесообразно не ранее чем через 18 ч от начала пробы с голоданием. Диагностический порог БГБ капиллярной крови, позволяющий дифференцировать гипер- и гипокетонемический варианты НДГ, отличается от такового в венозной крови и составляет ≤1,4 ммоль/л (Se 98,0%, Sp 96,4%, РPV 98,0%, NPV 96,4%, Ас 97,4%). Превышение данного уровня при завершении голодания у пациентов с гиперинсулинемическим вариантом НДГ может свидетельствовать о мультигормональной гиперсекреции в рамках наследственного синдрома. Уровень БГБ≤1,4 ммоль/л при завершении голодания у пациентов с гипоинсулинемическим вариантом НДГ может свидетельствовать о наличии определенных врожденных нарушений метаболизма глюкозы.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Мокрышева Н.Г. и Трошина Е.А. — члены редакционной коллегии журнала «Ожирение и метаболизм».
Участие авторов. Юкина М.Ю. — разработка концепции исследования, проведение обследования участникам исследования, сбор и обработка материала, статистический анализ данных, анализ данных литературы, написание текста статьи; Нуралиева Н.Ф. — проведение обследования участникам исследования, сбор материала, подготовка статьи к публикации; Трошина Е.А. — утверждение концепции исследования, редактирование текста статьи; Мокрышева Н.Г. — утверждение концепции исследования и финального текста статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Cryer PE, Axelrod L, Grossman AB, et al. Evaluation and Management of Adult Hypoglycemic Disorders: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2009;94(3):709-728. doi: https://doi.org/10.1210/jc.2008-1410
2. Kapoor RR, Flanagan SE, James C, et al. Hyperinsulinaemic hypoglycaemia. Arch Dis Child. 2009;94(6):450-457. doi: https://doi.org/10.1136/adc.2008.148171
3. Bonaventura A, Montecucco F, Dallegri F. Update on strategies limiting iatrogenic hypoglycemia. Endocr Connect. 2015;4(3):R37-R45. doi: https://doi.org/10.1530/EC-15-0044
4. Nedoboy PE, Cohen M, Farnham MM-J. Slow but Steady— The Responsiveness of Sympathoadrenal System to a Hypoglycemic Challenge in Ketogenic Diet-Fed Rats. Nutrients. 2021;13(8):2627. doi: https://doi.org/10.3390/nu13082627
5. Placzkowski KA, Vella A, Thompson GB, et al. Secular Trends in the Presentation and Management of Functioning Insulinoma at the Mayo Clinic, 1987–2007. J Clin Endocrinol Metab. 2009;94(4):1069-1073. doi: https://doi.org/10.1210/jc.2008-2031
6. Norgren J, Sindi S, Sandebring-Matton A, et al. Capillary blood tests may overestimate ketosis: triangulation between three different measures of β-hydroxybutyrate. Am J Physiol Endocrinol Metab. 2020;318(2):E184-E188. doi: https://doi.org/10.1152/ajpendo.00454.2019
7. Armer J, Hunt N, Kaushal K, et al. Limitations to using point of care blood ketone testing to monitor DKA treatment. Pract Diabetes. 2013;30(9):380-383. doi: https://doi.org/10.1002/pdi.1818
8. Service FJ, O’Brien PC. Increasing Serum Betahydroxybutyrate Concentrations during the 72-Hour Fast: Evidence against Hyperinsulinemic Hypoglycemia. J Clin Endocrinol Metab. 2005;90(8):4555-4558. doi: https://doi.org/10.1210/jc.2005-0033
9. O’Brien T, O’Brien PC, Service FJ. Insulin surrogates in insulinoma. J Clin Endocrinol Metab. 1993;77(2):448-451. doi: https://doi.org/10.1210/jcem.77.2.8345050
10. Chammas N, Teale J, Quin J. Insulinoma: how reliable is the biochemical evidence? Ann Clin Biochem Int J Lab Med. 2003;40(6):689-693. doi: https://doi.org/10.1258/000456303770367315
11. Popa SG, Ungureanu BS, Săftoiu A, et al. Pitfalls in diagnosing a pancreatic neuroendocrine tumor: a case report. Rom J Morphol Embryol. 2015;56(4):1495-1502.
12. Garla V, Sonani H, Palabindala V, et al. Nonislet Cell Hypoglycemia: Case Series and Review of the Literature. Front Endocrinol (Lausanne). 2019;10:316. doi: https://doi.org/10.3389/fendo.2019.00316
13. Dynkevich Y, Rother KI, Whitford I, et al. Tumors, Igf-2, And Hypoglycemia: Insights From The Clinic, The Laboratory, And The Historical Archive. Endocrine Reviews. 2013;34(6):798-826. doi: https://doi.org/10.1210/er.2012-1033
14. Vice E, Privette JD, Hickner RC, Barakat HA. Ketone body metabolism in lean and obese women. Metabolism: Clinical and Experimental. 2005;54(11):1542-1545. doi: https://doi.org/10.1016/j.metabol.2005.05.023
15. Buffet A, Vezzosi D, Maiza JC, et al. Increased plasma β-hydroxybutyrate levels during the fasting test in patients with endogenous hyperinsulinaemic hypoglycaemia. Eur J Endocrinol. 2013;169(1):91-97. doi: https://doi.org/10.1530/EJE-13-0020
16. Newman JC, Verdin E. β-Hydroxybutyrate: A Signaling Metabolite. Annu Rev Nutr. 2017;37(1):51-76. doi: https://doi.org/10.1146/annurev-nutr-071816-064916
17. Schneider DA, Zare M, Behnia F, et al. Biochemical and Clinical Features of Insulinoma in a Patient with Turner Syndrome. Case Rep Endocrinol. 2019;2019(1):1-4. doi: https://doi.org/10.1155/2019/6809479
18. Wiesli P, Spinas G, Pfammatter T, et al. Glucoseinduced hypoglycaemia. Lancet. 2002;360(9344):1476. doi: https://doi.org/10.1016/S0140-6736(02)11475-9
19. Hermansen K. Stimulatory effect of beta-hydroxybutyrate on the release of somatostatin from the isolated pancreas of normal and streptozotocin-diabetic dogs. Diabetes. 1982;31(3):270-274. doi: https://doi.org/10.2337/diab.31.3.270
20. Zhang Z, Liang X, Tong L, et al. The Metabolite β-Hydroxybutyrate of Lactobacillus Plantarum YZX21 Improves Type 2 Diabetes By Promoting Intestinal Secretion of GLP-1. Preprint. 2021. doi: https://doi.org/10.21203/rs.3.rs-850464/v1
21. Ferrara C, Patel P, Becker S, et al. Biomarkers of Insulin for the Diagnosis of Hyperinsulinemic Hypoglycemia in Infants and Children. J Pediatr. 2016;168:212-219. doi: https://doi.org/10.1016/j.jpeds.2015.09.045
22. de León DD, Stanley CA. Determination of Insulin for the Diagnosis of Hyperinsulinemic Hypoglycemia. Best Pract Res Clin Endocrinol Metab. 2013;27(6):763-769. doi: https://doi.org/10.1016/j.beem.2013.06.005
23. Юкина М.Ю., Нуралиева Н.Ф., Трошина Е.А., и др. Генетически детерминированные причины гипогликемического синдрома у взрослых пациентов без сахарного диабета // Медицинский совет. — 2018. — Т. 168. — №4. — С. 66-73. doi: https://doi.org/10.21518/2079-701X-2018-4-66-73
Об авторах
М. Ю. ЮкинаРоссия
Юкина Марина Юрьевна, к.м.н.
Researcher ID: P-5181-2015
Scopus Author ID: 57109367700
eLibrary SPIN: 4963-8340
117036, Москва, ул. Дмитрия Ульянова, 11
Е. А. Трошина
Россия
Трошина Екатерина Анатольевна, д.м.н., профессор
eLibrary SPIN: 8821-8990
Москва
Конфликт интересов:
Трошина Е.А. — член редакционной коллегии журнала «Ожирение и метаболизм».
Н. Ф. Нуралиева
Россия
Нуралиева Нурана Фейзуллаевна
eLibrary SPIN: 7373-2602
Москва
Н. Г. Мокрышева
Россия
Мокрышева Наталья Георгиевна, д.м.н., профессор
eLibrary SPIN: 5624-3875
Москва
Конфликт интересов:
Мокрышева Н.Г. — член редакционной коллегии журнала «Ожирение и метаболизм».
Дополнительные файлы
|
|
1. Рисунок 1. Уровень БГБ при завершении пробы с голоданием в группах 1 и 2. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(110KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. ROC-кривая прогностической ценности уровня БГБ при завершении голодания для диагностики варианта НДГ. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(112KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Юкина М.Ю., Трошина Е.А., Нуралиева Н.Ф., Мокрышева Н.Г. Первый опыт применения анализа бета-гидроксибутирата капиллярной крови в диагностике недиабетических гипогликемий у взрослых. Ожирение и метаболизм. 2022;19(2):134-141. https://doi.org/10.14341/omet12822
For citation:
Yukina M.Yu., Troshina E.A., Nuralieva N.F., Mokrysheva N.G. The first experience of using beta-hydroxybutyrate analysis of capillary blood in the diagnosis of non-diabetic hypoglycemia in adults. Obesity and metabolism. 2022;19(2):134-141. (In Russ.) https://doi.org/10.14341/omet12822

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































