Перейти к:
Результаты иммуногистохимического исследования антител к CYP11B2 при первичном гиперальдостеронизме
https://doi.org/10.14341/omet12741
Аннотация
Обоснование. Альдостерон-продуцирующая аденома (АПА) — наиболее частая причина диагностированного первичного гиперальдостеронизма (ПГА). Известно, что ключевым ферментом синтеза альдостерона, участвующим в патогенезе ПГА, является альдостеронсинтаза (CYP11B2). Недавние исследования показали, что различные факторы влияют на экспрессию и функцию CYP11B2 при АПА. В частности, соматические мутации, приводящие к повышенной и сниженной функции CYP11B2, были идентифицированы в нескольких генах, каждый из которых кодирует ключевой белок, влияющий на кальциевый сигнальный путь, экспрессию CYP11B2 и продукцию альдостерона. С другой стороны, CYP11B2 также катализирует превращение кортизола в 18-гидроксикортизол и впоследствии превращает 18-гидроксикортизол в 18-оксокортизол. Также в статье обсуждается клиническое значение 18-оксокортизола — важного биомаркера для диагностики ПГА. Соматические мутации в генах-драйверах альдостерона тесно связаны с экспрессией CYP11B2 и были обнаружены только в CYP11B2-положительной области опухоли, что указывает на неоднородную экспрессию CYP11B2 в опухолевых клетках.
Цель. Оценить экспрессию антител к CYP11B2 в новообразованиях коркового слоя надпочечников при первичном гиперальдостеронизме.
Материалы и методы. Ретроспективная оценка опухолей надпочечников, удаленных в ходе адреналэктомии, у пациентов с лабораторно подтвержденным ПГА (n=20). По данным мультиспиральной компьютерной томографии односторонняя аденома была выявлена у 19 пациентов (95% от общего числа), во всех случаях подтверждена односторонняя гиперпродукция альдостерона данными сравнительного селективного забора крови из надпочечниковых вен. На отобранных опухолях проводилось иммуногистохимическое исследование с использованием антител к CYP11B2. В соответствии со стандартными протоколами использовался biotin-free Bond Polymer Refine Detection system (Leica) с автоматизированной системой Bond max (Leica). В каждой опухоли было выбрано окрашенное поле, увеличенное в 200 раз. Эти поля были оцифрованы в виде изображений JPEG с использованием цифровой камеры (Leica, DFC 490). После чего была оценена экспрессия CYP11B2 в аденоме и в соседней коре надпочечников.
Результаты. При иммуногистохимическом исследовании опухоли надпочечников у пациентов с ПГА (n=20) получена положительная экспрессия с антителом к CYP11B2 во всех случаях, при этом: в 50% случаев (n=10) — выявлена интенсивная реакция в опухоли и прилежащем корковом слое, в 10% случаев (n=2) — умеренная реакция в опухоли и прилежащем корковом слое, в 15% (n=3) — слабая реакция в опухоли и прилежащем корковом слое, а также в 25% случаев (n=5) — интенсивная реакция в прилежащем корковом слое более выражена, чем в опухоли надпочечника.
Заключение. Доказана функциональная гетерогенность опухоли надпочечников при ПГА.
Ключевые слова
Для цитирования:
Романова Н.Ю., Селиванова Л.С., Платонова Н.М., Бельцевич Д.Г., Трошина Е.А. Результаты иммуногистохимического исследования антител к CYP11B2 при первичном гиперальдостеронизме. Ожирение и метаболизм. 2021;18(3):245-253. https://doi.org/10.14341/omet12741
For citation:
Romanova N.Yu., Selivanova L.S., Platonova N.M., Beltsevich D.G., Troshina E.A. The results of immunohistochemical study of antibodies to CYP11B2 in primary hyperaldosteronism. Obesity and metabolism. 2021;18(3):245-253. (In Russ.) https://doi.org/10.14341/omet12741
ОБОСНОВАНИЕ
Альдостеронсинтаза (АС) — фермент, кодируемый геном CYP11B2, принадлежит к семейству цитохрома P450 и регулирует синтез гормона альдостерона. Ген расположен в области g21 8 хромосомы и состоит из девяти экзонов и восьми интронов [1]. Ген CYP11B2 катализирует последнюю стадию синтеза альдостерона из дезоксикортикостерона [2]. АС участвует в ключевых реакциях синтеза альдостерона — 11-гидроксилировании, 18-гидроксилировании и, наконец, 18-окислении [2]. Вначале происходит 11-бета-гидроксилирование 11-дезоксикортикостерона до кортикостерона, затем — 18-гидроксилирование кортикостерона до 18-гидроксикортикостерона и, наконец, 18-оксидирование 18-гидроксикортикостерона до альдостерона. Ген CYP11B2 кодирует ключевой фермент синтеза альдостерона 18-гидроксилазу, которая присоединяет гидроксильную группу (ОН) к С18 остатку [3]. Этот ген в высокой степени гомологичен гену CYP11B1, кодирующему также митохондриальный фермент 11-бета-гидроксилазу, который катализирует синтез кортизола в стероидогенезе [3]. Таким образом, заключительный и ключевой этап в биосинтезе альдостерона регулируется CYP11B2.
В структуре надпочечника человека нет четкого разделения клубочковой и пучковой зон, и клетки с положительной экспрессией CYP11B2 присутствуют очагово в субкапсулярной области, а также в кластерах — альдостерон-продуцирующих клеточных кластерах (АПКК) [4]. При морфологическом исследовании эти кластеры имеют выраженную однородную иммунореактивность экспрессии CYP11B2 в клубочковой зоне, которая простирается к пучковой зоне без экспрессии CYP11B1 [4]. При морфологическом исследовании надпочечников в норме в детском возрасте (0–11 лет) есть четкое распределение областей с экспрессией CYP11B2, занимающих бóльшую часть клубочковой зоны, а также отсутствуют АПКК. Эта закономерность расположения зон надпочечника претерпевает изменения с возрастом, при этом в клубочковой зоне уменьшается экспрессия CYP11B2, в то время как число АПКК увеличивается [4].
Значительным достижением в патогенезе альдостерон-продуцирующей аденомы (АПА) является открытие соматических мутаций в активировании G белка калиевого канала GIRK4 [5], кодируемого геном KCNJ5, который, как было показано, присутствует в 35–70% случаев [6–8]. Более высокая распространенность мутации была обнаружена у лиц Восточной Азии [6][7]. Мутации в ионных каналах, включая мутации в гене ATP1A1 (альфа-субъединица 1 АТФазы), гене ATP2B3 и субъединице кальциевого канала Cav1.3 (ген CACNA1D), объясняют приблизительно 50–80% случаев АПА [9]. В некоторых случаях односторонней гиперпродукции альдостерона с микро- или макронодулярной гиперплазией могут встречаться различные мутации в ионных каналах [10]. Интересно, что частота мутаций CACNA1D и ATP1A1 при АПКК достигает 30%, но при этом АПКК с мутацией KCNJ5 не были обнаружены [11].
Одним из механизмов гиперпродукции альдостерона в АПА является повышенная экспрессия CYP11B2 [12]. Исследование Bassett et al. (2005) с использованием микрочипа и количественной полимеразной цепной реакции (ПЦР) обратной транскриптазы показало, что уровни мРНК CYP11B2 пвыше в АПА в сравнении с мРНК в нормальной ткани надпочечников [12]. Кроме того, экспрессия CYP11B2 в АПА в недавнее время изучена из-за наличия CYP11B2-специфического моноклонального антитела [13]. Аминокислотная последовательность CYP11B2 на 93% идентична 11β-гидроксилазе (CYP11B1), которая участвует в заключительном этапе синтеза кортикостерона [14]. Gomez-Sanchez et al. разработали специфические моноклональные антитела к CYP11B1 и CYP11B2, что позволило проводить анализ экспрессии CYP11B1 и CYP11B2 в ткани AПА [13]. В другом исследовании было показано, что уровень экспрессии CYP11B1 значительно ниже, в то время как CYP11B2 значимо выше в AПA меньшего размера, чем в АПА большего размера [15]. Кроме того, была выявлена корреляция уровня экспрессии CYP11B1 с размерами опухоли, в то время как экспрессия CYP11B2 имела обратную корреляцию [15]. Эти открытия легли в основу предположения, что оба фермента, CYP11B1 и CYP11B2, играют определенную роль в продукции альдостерона в АПА. Кроме того, существует небольшое число опухолевых клеток, коэкспрессирующих CYP11B1/B2 (гибридная клетка типа A), гибридные гены CYP11B2/17 (гибридная клетка типа B), CYP11B1/17 (гибридная клетка типа C) и CYP11B1/B2/17 в АПА [16].
Следовательно, существует гипотеза о том, что АПА состоит из гетерогенных клеток или же из смеси кортикальных клеток разных зон надпочечника. Кроме того, эти гибридные клетки могут представлять собой происхождение «автономных» опухолевых клеток, образующих АПА.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить экспрессию антител к CYP11B2 в новообразованиях коркового слоя надпочечников при первичном гиперальдостеронизме (ПГА).
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Все клинические, лабораторные и инструментальные манипуляции, выполненные в рамках данного исследования, были проведены на базе одного учреждения (ФГБУ «НМИЦ эндокринологии» Минздрава России, Москва) в 2017–2019 гг.
Время исследования. В исследовании использовали биологический материал пациентов, прооперированных с 2017 по 2019 гг. по поводу альдостеромы.
Изучаемые популяции
В исследование вошли пациенты с альдостеромой, верифицированной данными сравнительного селективного забора крови из надпочечниковых вен (ССВЗК).
Критерии включения:
- подтвержденный диагноз ПГА [1];
- возраст старше 18 лет.
Критерии исключения: в исследование не были включены и не подвергались анализу ткани: в случае малого количества ткани опухоли, предоставленной для морфологического исследования; опухоли надпочечника с обильными кровоизлияниями различной степени давности.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Простая случайная выборка.
Дизайн исследования
Проведено одноцентровое интервенционное одномоментное одновыборочное неконтролируемое исследование.
Методы
Для иммуногистохимического исследования были отобраны достаточные по объему образцы опухолей надпочечников пациентов с подтвержденным диагнозом ПГА — уровень альдостерон-ренинового соотношения более 91 пмоль/мЕд, постинфузионный уровень альдостерона более 277 пмоль/л в ходе теста с физиологическим раствором и/или уровень альдостерона крови более 550 пмоль/л в сочетании с низким уровнем прямого ренина плазмы крови и гипокалиемией у пациентов в возрасте до 35 лет. Хирургическое вмешательство проводилось у пациентов с лабораторно подтвержденным ПГА. В качестве визуализирующего метода пациентам проведена мультиспиральная компьютерная томография (МСКТ) надпочечников. Средний размер образования составлял 2 см (1,5–3), плотность — от -1 до +10 HU. В случаях одностороннего образования по данным МСКТ у пациентов старше 35 лет и при двусторонних образованиях надпочечников с целью уточнения латерализации гиперсекреции альдостерона проводился ССВЗК в утренние часы.
Материал, полученный от пациентов, фиксировали в 10% забуференном формалине, обрабатывали в аппарате гистологической проводки фирмы Leica и заливали в парафин. Суммарное время фиксации, проводки и заливки материала не превышало, как правило, 48 ч. Затем готовили серийные срезы (не менее 10) толщиной 3–4 мкм, которые помещали на полилизиновые стекла (Leica, Германия) и инкубировали в термостате при температуре 370C в течении 12 ч. Далее срезы депарафинировали последовательно в ряде растворов, состоящих из 3 ксилолов, 2 абсолютных спиртов, 80% и 70% спирта и дистиллированной воды. Затем препараты окрашивали гематоксилином и эозином по стандартной методике. Исследование проводили на полностью автоматизированном иммуногистостейнере Leica Bond max (Германия), позволяющем депарафинизировать срезы, проводить инкубацию с антителами при постоянной заданной температуре, проводить энзиматическую демаскировку антигенов, высокотемпературную демаскировку антигенов в буфере pH 7,2, подкрашивать препараты гематоксилином. Исследование проводилось по стандартным протоколам, рекомендованным фирмой-производителем с антителами CYP11B2 (PA5-61902) Thermo Fisher Scientific, использовали разведение 1:100.
Для иммуногистохимических реакций ставили положительные и отрицательные контроли, которые выбирали в соответствии со спецификациями от фирмы-производителя. При микроскопическом исследовании обработанных иммуногистохимическим методом тканей аденом с увеличением ×200 на каждом срезе было выбрано поле с максимальной реакцией. Полуколичественным методом оценивали долю (в процентах) позитивно окрашенных клеток в опухоли надпочечника и прилежащей ткани. Оценка иммуногистохимической реакции проводилась полуколичественным методом в баллах по количеству позитивно окрашенных клеток. Оценку интенсивности реакции проводили в опухоли и прилежащем корковом слое надпочечника по 3-бальной шкале: 3 балла — от 80 до 100% окрашенных клеток; 2 балла — от 40 до 80% окрашенных клеток; 1 балл — до 40% окрашенных клеток. Фиксацию цифровых изображений выбранных полей проводили с помощью камеры Leica DFC 490. Для обработки цифровых изображений использовали программное обеспечение Leica Application Suite V3. Все препараты были отсканированы на сканирующей системе Leica.
Основным исходом исследования считалось наличие или отсутствие экспрессии антител к CYP11B2 в ткани новообразования коры надпочечника полуколичественным методом.
Этическая экспертиза
Одобрено локальным этическим комитетом ФГБУ «НМИЦ эндокринологии» Минздрава России (протокол No8 от 25.04.18). Все пациенты подписали информированное согласие на участие в исследовании.
РЕЗУЛЬТАТЫ
В работу было включено 20 альдостером, при макроскопическом исследовании которых в корковом слое надпочечника чаще обнаруживали одиночный, хорошо очерченный узел охряно-желтого цвета небольших размеров (обычно не более 2,0 см). Клинико-морфологические характеристики пациентов сведены в табл. 1.
При микроскопическом исследовании опухоли состояли преимущественно из светлых, богатых липидами клеток, напоминающих клетки пучковой зоны коры надпочечника, местами отмечались признаки внутриопухолевой гетерогенности: среди участков, представленных зрелыми мономорфными клетками коры, встречались очаги с выраженным клеточным и ядерным полиморфизмом. Прилежащий корковый слой надпочечника, как правило, не характеризовался признаками атрофии. При оценке злокачественного потенциала по шкале Weiss все опухоли имели сумму баллов 0.
В результате иммуногистохимического исследования во всех опухолях (n=20) получена положительная экспрессия с антителами к CYP11B2, при этом: в 50% случаев (n=10) — выявлена интенсивная реакция в опухоли и прилежащем корковом слое, в 10% случаев (n=2) — умеренная реакция в опухоли и прилежащем корковом слое, в 15% (n=3) — слабая реакция в опухоли и прилежащем корковом слое, а также в 25% случаев (n=5) — интенсивная реакция в прилежащем корковом слое более выражена, чем в опухоли надпочечника (рис. 1, 2). CYP11B2 обычно характеризовался диффузным окрашиванием, но в части случаев отмечалась неоднородная очаговая экспрессия.
Таблица 1. Клинико-морфологические характеристики пациентов.
Пациент | ИМТ, кг/м2 | Возраст, | Пол | САД max, мм рт. ст. | ДАД max, мм рт. ст. | Длит-сть АГ, годы | Компонентность терапии | Альдостерон, пмоль/л | Ренин (прямой), мЕд/л | АРС | Калий, | Гематоксилин и эозин | СYP11B2 |
1 | 31,8 | 54 | м | 180 | 85 | 10 | 3 | 455 | 0,04 | 11,3 | 3,7 | аденома | + |
2 | 32,3 | 50 | ж | 225 | 100 | 3 | 5 | 972 | 0,73 | 1,315 | 2,6 | аденома | + |
3 | 22,8 | 62 | ж | 210 | 100 | 19 | 3 | 1160 | 2,8 | 414 | 2,9 | аденома | + |
4 | 31,6 | 70 | м | 220 | 110 | 20 | 4 | 970 | 0,8 | 1212 | 2,8 | аденома | + |
5 | 23,3 | 35 | ж | 200 | 120 | 3 | 1 | 1660 | 0,78 | 2128 | 2,8 | аденома | + |
6 | 43,4 | 60 | ж | 300 | 150 | 9 | 2 | 1400 | 1,72 | 813 | 2,4 | аденома | + |
7 | 26,0 | 63 | ж | 170 | 115 | 7 | 3 | 452 | 2,034 | 222 | 3,9 | аденома | + |
8 | 35,7 | 52 | ж | 160 | 90 | 20 | 2 | 750 | 1,37 | 547 | 3,3 | аденома | + |
9 | 21,4 | 32 | ж | 150 | 100 | 1 | 1 | 2270 | 1,2 | 1897 | 3,5 | аденома | + |
10 | 24,2 | 49 | ж | 300 | 200 | 1 | 1 | 27700 | 3,1 | 8935 | 2,0 | аденома | + |
11 | 20,3 | 36 | ж | 250 | 140 | 7 | 1 | 2770 | 10,1 | 274 | 2,2 | аденома | + |
12 | 23,2 | 52 | ж | 200 | 100 | 9 | 4 | 2770 | 0,5 | 5540 | 2,4 | аденома | + |
13 | 31,1 | 46 | ж | 180 | 100 | 10 | 3 | 396 | 0,82 | 482 | 3,8 | аденома | + |
14 | 20,6 | 41 | ж | 170 | 100 | 10 | 4 | 971 | 0,5 | 1942 | 2,6 | аденома | + |
15 | 20,8 | 40 | ж | 170 | 100 | 2 | 2 | 805 | 2,3 | 350 | 3,6 | аденома | + |
16 | 24,9 | 55 | ж | 240 | 120 | 12 | 3 | 378 | 0,5 | 756 | 3,4 | аденома | + |
17 | 32,3 | 31 | м | 260 | 140 | 3 | 4 | 846 | 5,2 | 162 | 2,7 | аденома | + |
18 | 31,7 | 64 | м | 220 | 120 | 20 | 4 | 1130 | 0,5 | 2260 | 3 | аденома | + |
19 | 18,5 | 35 | ж | 220 | 120 | 2 | 3 | 1960 | 0,51 | 3843 | 2,3 | аденома | + |
20 | 30,2 | 56 | м | 215 | 120 | 26 | 3 | 282 | 0,1 | 2820 | 2,6 | аденома | + |
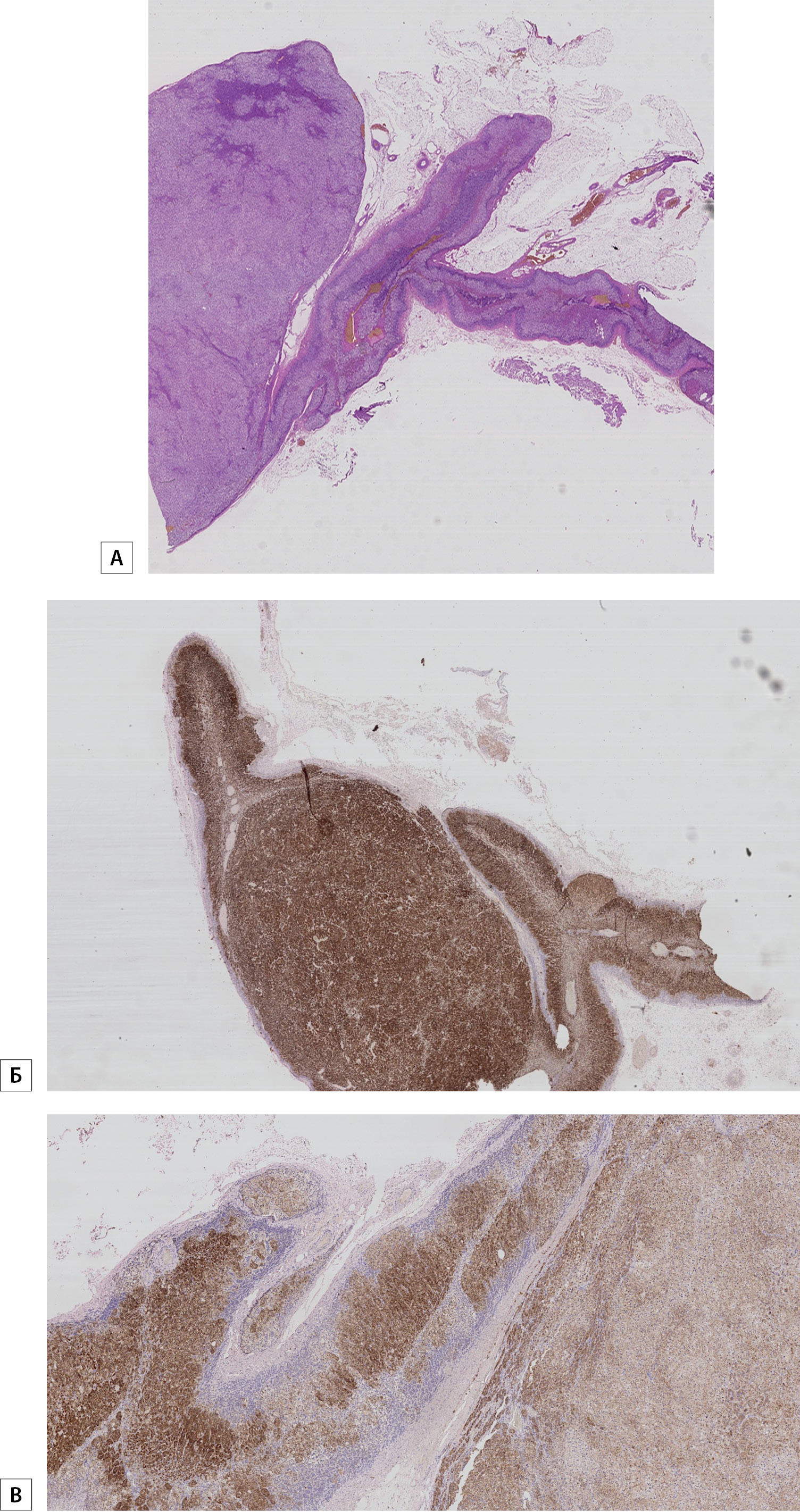
Рисунок 1. Интенсивная реакция антител к CYP11B2 с экспрессией и в опухоли, и в окружающей коре.
А — альдостерома. Интенсивная реакция антител к CYP11B2 с экспрессией и в опухоли, и в окружающей коре. Окрашивание гематоксилином и эозином. Увеличение × 50.
Б — альдостерома. Интенсивная реакция антител к CYP11B2 с экспрессией и в опухоли, и в окружающей коре. Увеличение × 50.
В — альдостерома. Интенсивная реакция антител к CYP11B2 с экспрессией и в опухоли, и в окружающей коре. Увеличение × 100.
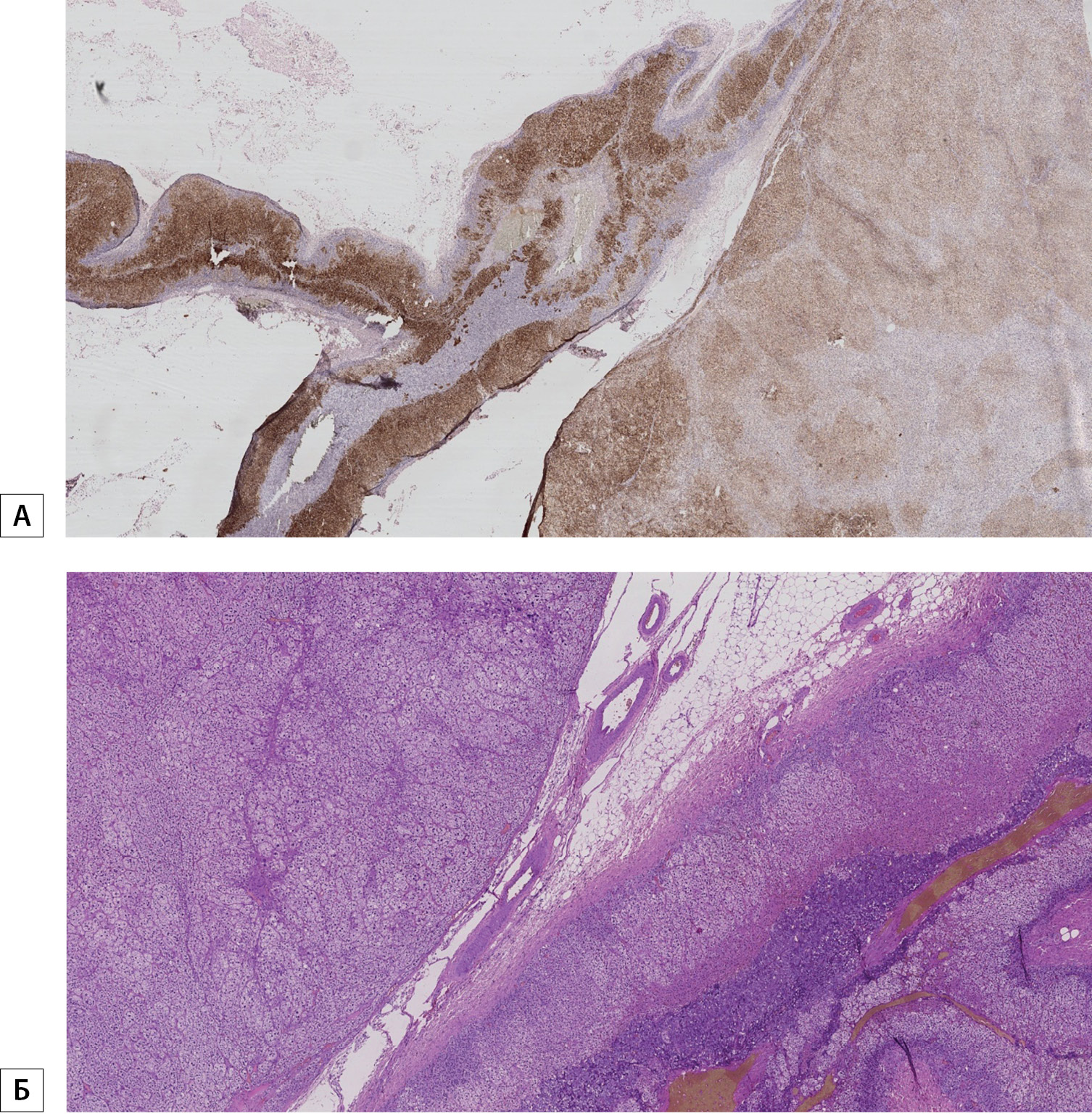
Рисунок 2. Интенсивная реакция антител к CYP11B2 с экспрессией в прилежащей коре надпочечника, умеренная в опухоли.
А — альдостерома. Интенсивная реакция антител к CYP11B2 с экспрессией в прилежащей коре надпочечника, умеренная в опухоли. Увеличение × 50.
Б — альдостерома. Интенсивная реакция антител к CYP11B2 с экспрессией в прилежащей коре надпочечника, умеренная в опухоли. Окрашивание гематоксилином и эозином. Увеличение × 100.
ОБСУЖДЕНИЕ
Сопоставление с другими публикациями
Внутриопухолевая гетерогенность при АПА достаточно изучена и является актуальной темой, представляющей интерес в этой области. АПА обладает внутриопухолевой гетерогенностью в клеточной морфологии и молекулярной физиологии [17]. Интересно, что соматические мутации CACNA1D:F747C, KCNJ5:L168R и ATP1A1:L104R были обнаружены только в CYP11B2-позитивной области опухоли [18]. CYP11B2 в опухолевых тканях обычно иммунолокализованы диффузно, неоднородно. Было показано, что примерно 15% АПА имеют выраженную гетерогенность в CYP11B2-позитивной и негативной областях [18]. В исследовании Nanba et al. (2016) сообщили, что только в одном случае были обнаружены различные соматические мутации генов в одной и той же опухоли в различных CYP11B2-позитивных участках [18] Однако не было подтверждено наличие этих мутаций в генах-драйверах альдостерона. Эти соматические генные мутации играют существенную роль в автономной секреции альдостерона и могут быть ассоциированы с туморогенезом; однако патофизиология остается спорной и требует дальнейшего изучения. Наличие факторов транскрипции гена CYP11B2 считается ключевым моментом патофизиологии АПА.
Клиническое значение CYP11B2
Биосинтез альдостерона происходит в клубочковой зоне надпочечников через множество ферментативных реакций из холестерина. Большинство ферментов, участвующих в биосинтезе альдостерона, также экспрессируются в пучковой зоне, однако терминальный фермент биосинтеза альдостерона CYP11B2 экспрессируется только в клубочковой зоне, в то время как CYP11B1 — только пучковой и сетчатой зонах [19][20]. Наличие CYP11B2 верифицирует клетки надпочечников, которые вырабатывают альдостерон. В пучковой зоне надпочечника имеется два уникальных фермента — CYP17A1 и CYP11B1; которые отвечают за синтез кортизола. Первые специфические поликлональные антитела к CYP11B1 и CYP11B2 были описаны Нишимото и использовались для иммуногистохимии с низкой амплификацией [21]. Высокоспецифичные моноклональные антитела затем были широко изучены и в настоящее время используются для иммуногистохимического исследования надпочечников, полученных в ходе адреналэктомии у пациентов с ПГА [22–24].
Недавние исследования также осветили еще одну характеристику CYP11B2 — это участие в преобразовании кортизола в 18-оксокортизол (18oxoF) [25]. 18-оксокортизол — это так называемый «гибридный стероид», т.к. в своей структуре имеет особенности как глюкокортикоидов, так и минералокортикоидов [25]. Ulick et al. (1983) впервые сообщили о наличии 18oxoF в тканях надпочечников, но в небольшом количестве [26]. Однако у пациентов с глюкокортикоид-зависимым гиперальдостеронизмом (редкая разновидность ПГА, проявляющаяся аутосомно-доминантным наследованием) отмечается чувствительность секреции альдостерона к АКТГ и более высоким уровнем 18oxoF вследствие генетической рекомбинации между CYP11B1 и CYP11B2 (химерный ген CYP11B1/ CYP11B2) [27].
Разработка антител к альдостеронсинтетазе CYP11B2 позволила охарактеризовать нормальную ткань надпочечника и удаленную в ходе адреналэктомии у пациентов с ПГА [28]. В нормальной ткани надпочечника присутствуют два типа клеточной экспрессии CYP11B2: относительно равномерная экспрессия фермента по всей клубочковой зоне и группы клеток, экспрессирующие CYP11B2, называемые АПКК. Существует также группа клеток внутри АПА, которые экспрессируют различные ферменты, в отличие от нормальной ткани надпочечника [27]. Примерно у 30% пациентов с односторонним вариантом ПГА не визуализируется АПА, но при этом наблюдаются либо микроаденомы с положительной экспрессией CYP11B2, либо гиперплазия клубочковой зоны [28].
Иммуногистохимическое исследование при ПГА.
ССВЗК используется для уточнения латерализации гиперсекреции альдостерона. В большинстве случаев односторонняя выработка альдостерона возникает вследствие АПА обычно больше 0,5 см в диаметре, что видно на исследовании МСКТ. Существуют данные, что одновременно при АПА в надпочечнике также могут присутствовать АПКК в гиперплазированной клубочковой зоне [29–31]. Односторонняя гиперсекреция при ПГА может быть обусловлена и более редкими формами. Одностороннюю гиперплазию надпочечника, на которую приходится 2-3% ПГА, следует заподозрить в случае выявления латерализации по данным ССВЗК в отсутствии изменений на КТ [32]. Кроме того, в 1% случаев ПГА обсуловлен альдостерон-продуцирующей карциномой [32].
У пациентов с более крупными по размерам аденомами выработка альдостерона обычно больше, чем у пациентов с таковыми, меньшими по размерам [33]. В исследовании Ono et al. [33] в группе пациентов с более крупными аденомами площадь опухоли была в 9 раз больше, чем в группе меньших аденом, однако концентрация альдостерона в плазме была всего в 2,0–2,5 раза выше в группе пациентов с большими аденомами. Таким образом, продукция альдостерона гораздо больше в опухолях, меньших по размеру аденом, а также более высокая экспрессия CYP11B2 наблюдалась в группе меньших опухолей [33]. Кроме того, количество иммунореактивных клеток с экспрессией CYP11B2 в группе более крупных аденом было очень вариабельно, причем некоторые аденомы проявляли относительно однородную экспрессию в сравнении с гетерогенной экспрессией фермента в других клетках с большим количеством иммунореактивно-отрицательных клеток [33]. Экспрессия других ферментов, в том числе CYP17A1, была ниже в группе меньших аденом [33].
Многие АПА проявляют внутриопухолевую гетерогенность экспрессии ферментов, которые обычно специфичны для определенной зоны надпочечников. В недавнем исследовании с использованием двойной и тройной иммунофлуоресценции окрашивания АПА с антителами к CYP11B2, CYP11B1 и CYP17A1 Nakamura et al. [34] показали, что существуют клетки ко-экспрессии CYP11B2 и CYP11B1 (2,1%), CYP11B2 и CYP17A1 (0,6%), CYP11B1 и CYP17A1 (0,6%) и небольшое количество тройных иммунореактивно-окрашенных клеток (0,03%). Однако пропорции смешанных иммунофлуоресцентных клеток были очень вариабельны между аденомами. Наличие клеток, которые совместно экспрессируют CYP11B2 и CYP17A1, вероятно, объясняет повышенную секрецию гибридных стероидов — 18-гидроксикортизола и 18-оксокортизола [35].
Таким образом, изучение экспрессии альдостеронсинтазы, которая осуществляет последние этапы биосинтеза альдостерона, подтверждает значительную сложность в гистологических особенностях надпочечников при ПГА. В то время как нормальный надпочечник имеет характерную экспрессию стероидных гормонов определенными зонами, многие аденомы характеризуются неупорядоченным стероидогенезом и, как следствие, появлением гибридных стероидов. Вариабельность гистопатологических особенностей аденом и одновременное наличие АПКК повышают вероятность того, что большинство случаев односторонней продукции альдостерона на самом деле может представлять собой двустороннюю асимметричную узловую гиперплазию, часто вследствие соматических мутаций.
Клиническая значимость результатов
В ходе данного пилотного исследования, включавшего 20 пациентов, было показано наличие экспрессии с антителами к CYP11B2 в альдостеромах различной морфологической структуры. При этом альдостеромы характеризовались как морфологической, так и иммуногистохимической внутриопухолевой гетерогенностью.
Ограничения исследования
К основным ограничениям исследования относятся довольно небольшой объем выборки, а также отсутствие оценки экспрессии антител к CYP11B1 и CYP11B2 в кортизол-альдостерон-продуцирующих аденомах, что не входило в протокол настоящего исследования.
Направления дальнейших исследований
Целесообразно исследование стероидов конечного звена синтеза альдостерона, таких как 18-гидроксикортикостерон, 18-гидроксикортизол, 18-оксокортизол, методом ВЭЖХ-МС для уточнения дефекта стероидогенеза.
ЗАКЛЮЧЕНИЕ
Подтверждено наличие экспрессии антител к CYP11B2 в альдостеромах, что позволяет верифицировать АПА. Полученные данные могут служить основой для дальнейших исследований экспрессии антител к CYP11B2 в аденомах надпочечников с целью анализа ее взаимосвязи с морфологическими и иммуногистохимическими характеристиками опухолей и роли в прогнозе заболеваний.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено в рамках темы научно-исследовательской работы «Клинико-патогенетические механизмы и факторы, определяющие развитие кардиомиопатий при сахарном диабете и других эндокринопатиях», регистрационный номер: АААА-А20-120011790178-1 на 2020–2022 гг.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Романова Н.Ю. — существенный вклад в получение, анализ данных, написание статьи, ведение пациентов; Селиванова Л.С. — существенный вклад в получение, анализ данных и интерпретацию результатов, гистологическое, иммуногистохимическое исследование опухолей, подготовку иллюстративного материала; Платонова Н.М. — существенный вклад в концепцию исследования, внесение в рукопись правки с целью повышения научной ценности статьи; Бельцевич Д.Г. — существенный вклад в дизайн исследования, ведение пациентов, внесение в рукопись правки с целью повышения научной ценности статьи; Трошина Е.А. — существенный вклад в концепцию исследования, внесение в рукопись правки с целью повышения научной ценности статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Funder JW, Carey RM, Mantero F, et al. The Management of Primary Aldosteronism: Case Detection, Diagnosis, and Treatment: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2016;101(5):1889-1916. doi: https://doi.org/10.1210/jc.2015-4061
2. Curnow KM, Tusie-Luna M-T, Pascoe L, et al. The Product of the CYP11B2 Gene Is Required for Aldosterone Biosynthesis in the Human Adrenal Cortex. Mol Endocrinol. 1991;5(10):1513-1522. doi: https://doi.org/10.1210/mend-5-10-1513
3. Reincke M, Fischer E, Gerum S, et al. Observational Study Mortality in Treated Primary Aldosteronism. Hypertension. 2012;60(3):618-624. doi: https://doi.org/10.1161/HYPERTENSIONAHA.112.197111
4. Nishimoto K, Seki T, Hayashi Y, et al. Human Adrenocortical Remodeling Leading to Aldosterone-Producing Cell Cluster Generation. Int J Endocrinol. 2016;2016:1-6. doi: https://doi.org/10.1155/2016/7834356
5. Choi M, Scholl UI, Yue P, et al. K+ Channel Mutations in Adrenal Aldosterone-Producing Adenomas and Hereditary Hypertension. Science (80- ). 2011;331(6018):768-772. doi: https://doi.org/10.1126/science.1198785
6. Williams TA, Monticone S, Mulatero P. KCNJ5 Mutations Are the Most Frequent Genetic Alteration in Primary Aldosteronism. Hypertension. 2015;65(3):507-509. doi: https://doi.org/10.1161/HYPERTENSIONAHA.114.04636
7. Fernandes-Rosa FL, Williams TA, Riester A, et al. Genetic Spectrum and Clinical Correlates of Somatic Mutations in Aldosterone-Producing Adenoma. Hypertension. 2014;64(2):354-361. doi: https://doi.org/10.1161/HYPERTENSIONAHA.114.03419
8. Taguchi R, Yamada M, Nakajima Y, et al. Expression and Mutations of KCNJ5 mRNA in Japanese Patients with Aldosterone-Producing Adenomas. J Clin Endocrinol Metab. 2012;97(4):1311-1319. doi: https://doi.org/10.1210/jc.2011-2885
9. Scholl UI, Stölting G, Nelson-Williams C, et al. Recurrent gain of function mutation in calcium channel CACNA1H causes early-onset hypertension with primary aldosteronism. Elife. 2015;4. doi: https://doi.org/10.7554/eLife.06315
10. Yamazaki Y, Nakamura Y, Omata K, et al. Histopathological classification of cross-sectional image-negative hyperaldosteronism. J Clin Endocrinol Metab. 2017;102:1182–1192. doi: https://doi.org/10.1210/jc.2016-2986
11. Nishimoto K, Tomlins SA, Kuick R, et al. Aldosterone-stimulating somatic gene mutations are common in normal adrenal glands. Proc Natl Acad Sci. 2015;112(33):E4591-E4599. doi: https://doi.org/10.1073/pnas.1505529112
12. Bassett MH, Mayhew B, Rehman K, et al. Expression Profiles for Steroidogenic Enzymes in Adrenocortical Disease. J Clin Endocrinol Metab. 2005;90(9):5446-5455. doi: https://doi.org/10.1210/jc.2005-0836
13. Gomez-Sanchez CE, Qi X, Velarde-Miranda C, et al. Development of monoclonal antibodies against human CYP11B1 and CYP11B2. Mol Cell Endocrinol. 2014;383(1-2):111-117. doi: https://doi.org/10.1016/j.mce.2013.11.022
14. Nakamura Y, Felizola SJA, Satoh F, et al. Dissecting the molecular pathways of primary aldosteronism. Pathol Int. 2014;64(10):482-489. doi: https://doi.org/10.1111/pin.12200
15. Ono Y, Nakamura Y, Maekawa T, et al. Different Expression of 11β-Hydroxylase and Aldosterone Synthase Between Aldosterone-Producing Microadenomas and Macroadenomas. Hypertension. 2014;64(2):438-444. doi: https://doi.org/10.1161/HYPERTENSIONAHA.113.02944
16. Nakamura Y, Kitada M, Satoh F, et al. Intratumoral heterogeneity of steroidogenesis in aldosterone-producing adenoma revealed by intensive double- and triple-immunostaining for CYP11B2/B1 and CYP17. Mol Cell Endocrinol. 2016;422:57-63. doi: https://doi.org/10.1016/j.mce.2015.11.014
17. Романова Н.Ю., Селиванова Л.С., Платонова Н.М., и др. Иммуногистохимические характеристики аденом надпочечников при первичном гиперальдостеронизме / Сборник тезисов VIII (XXVI) Национального конгресса эндокринологов с международным участием «Персонализированная медицина и практическое здравоохранение». 2019. С. 278.
18. Nanba K, Chen AX, Omata K, et al. Molecular Heterogeneity in Aldosterone-Producing Adenomas. J Clin Endocrinol Metab. 2016;101(3):999-1007. doi: https://doi.org/10.1210/jc.2015-3239
19. Miller WL, Auchus RJ. The Molecular Biology, Biochemistry, and Physiology of Human Steroidogenesis and Its Disorders. Endocr Rev. 2011;32(1):81-151. doi: https://doi.org/10.1210/er.2010-0013
20. Hattangady NG, Olala LO, Bollag WB, Rainey WE. Acute and chronic regulation of aldosterone production. Mol Cell Endocrinol. 2012;350(2):151-162. doi: https://doi.org/10.1016/j.mce.2011.07.034
21. Nishimoto K, Nakagawa K, Li D, et al. Adrenocortical Zonation in Humans under Normal and Pathological Conditions. J Clin Endocrinol Metab. 2010;95(5):2296-2305. doi: https://doi.org/10.1210/jc.2009-2010
22. Yamazaki Y, Nakamura Y, Omata K, et al. Histopathological classification of cross-sectional image negative hyperaldosteronism. J Clin Endocrinol Metab. 2017;102:1182-1192. doi: https://doi.org/10.1210/jc.2016-2986
23. Nakamura Y, Maekawa T, Felizola SJA, et al. Adrenal CYP11B1/2 expression in primary aldosteronism: Immunohistochemical analysis using novel monoclonal antibodies. Mol Cell Endocrinol. 2014;392(1-2):73-79. doi: https://doi.org/10.1016/j.mce.2014.05.002
24. Teo AE Der, Garg S, Johnson TI, et al. Physiological and Pathological Roles in Human Adrenal of the Glomeruli-Defining Matrix Protein NPNT (Nephronectin). Hypertension. 2017;69(6):1207-1216. doi: https://doi.org/10.1161/HYPERTENSIONAHA.117.09156
25. Freel EM, Shakerdi LA, Friel EC, et al. Studies on the Origin of Circulating 18-Hydroxycortisol and 18-Oxocortisol in Normal Human Subjects. J Clin Endocrinol Metab. 2004;89(9):4628-4633. doi: https://doi.org/10.1210/jc.2004-0379
26. Ulick S, Chu MD, Land M. Biosynthesis of 18-oxocortisol by aldosterone-producing adrenal tissue. J Biol Chem. 1983;258(9):5498-5502. doi: https://doi.org/10.1016/S0021-9258(20)81918-8
27. Takeda Y. Genetic Analysis of Aldosterone Synthase in Patients with Idiopathic Hyperaldosteronism. J Clin Endocrinol Metab. 1999;84(5):1633-1637. doi: https://doi.org/10.1210/jc.84.5.1633
28. Omura M, Sasano H, Saito J, et al. Clinical Characteristics of Aldosterone-Producing Microadenoma, Macroadenoma, and Idiopathic Hyperaldosteronism in 93 Patients with Primary Aldosteronism. Hypertens Res. 2006;29(11):883-889. doi: https://doi.org/10.1291/hypres.29.883
29. Boulkroun S, Samson-Couterie B, Dzib J-FG, et al. Adrenal Cortex Remodeling and Functional Zona Glomerulosa Hyperplasia in Primary Aldosteronism. Hypertension. 2010;56(5):885-892. doi: https://doi.org/10.1161/HYPERTENSIONAHA.110.158543
30. Nanba K, Tsuiki M, Sawai K, et al. Histopathological Diagnosis of Primary Aldosteronism Using CYP11B2 Immunohistochemistry. J Clin Endocrinol Metab. 2013;98(4):1567-1574. doi: https://doi.org/10.1210/jc.2012-3726
31. Nanba AT, Nanba K, Byrd JB, et al. Discordance between imaging and immunohistochemistry in unilateral primary aldosteronism. Clin Endocrinol (Oxf). 2017;87(6):665-672. doi: https://doi.org/10.1111/cen.13442
32. Chao C-T, Wu V-C, Kuo C-C, et al. Diagnosis and management of primary aldosteronism: An updated review. Ann Med. 2013;45(4):375-83. doi: https://doi.org/10.3109/07853890.2013.785234
33. Ono Y, Nakamura Y, Maekawa T, et al. Different expression of 11beta-hydroxylase and aldosterone synthase between aldosterone-producing microadenomas and macroadenomas. Hypertension. 2014;64:438-444.
34. Nakamura Y, Kitada M, Satoh F, et al. Intratumoral heterogeneity of steroidogenesis in aldosterone-producing adenoma revealed by intensive double- and triple-immunostaining for CYP11B2/B1 and CYP17. Mol Cell Endocrinol. 2016;422:57-63. doi: https://doi.org/10.1016/j.mce.2015.11.014
35. Mulatero P, di Cella SM, Monticone S, et al. 18-Hydroxycorticosterone, 18-Hydroxycortisol, and 18-Oxocortisol in the Diagnosis of Primary Aldosteronism and Its Subtypes. J Clin Endocrinol Metab. 2012;97(3):881-889. doi: https://doi.org/10.1210/jc.2011-2384
Об авторах
Н. Ю. РомановаРоссия
Романова Наталья Юрьевна; eLibrary SPIN: 5288-2968
ул. Дмитрия Ульянова, д. 11, 117036 Москва, Россия
Л. С. Селиванова
Россия
Селиванова Лилия Сергеевна, к.м.н.; eLibrary SPIN: 5151-3675
Москва
Н. М. Платонова
Россия
Платонова Надежда Михайловна, д.м.н.; eLibrary SPIN: 4053-3033
Москва
Д. Г. Бельцевич
Россия
Бельцевич Дмитрий Германович, д.м.н., профессор; eLibrary SPIN: 4475-6327
Москва
Е. А. Трошина
Россия
Трошина Екатерина Анатольевна, д.м.н., профессор; eLibrary SPIN: 8821-8990
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Интенсивная реакция антител к CYP11B2 с экспрессией и в опухоли, и в окружающей коре. А — альдостерома. Окрашивание гематоксилином и эозином. Увеличение × 50. Б — альдостерома. Увеличение × 50. В — альдостерома. Увеличение × 100. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1022KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Интенсивная реакция антител к CYP11B2 с экспрессией в прилежащей коре надпочечника, умеренная в опухоли. А — альдостерома. Увеличение × 50. Б — альдостерома. Окрашивание гематоксилином и эозином. Увеличение × 100. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(865KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Романова Н.Ю., Селиванова Л.С., Платонова Н.М., Бельцевич Д.Г., Трошина Е.А. Результаты иммуногистохимического исследования антител к CYP11B2 при первичном гиперальдостеронизме. Ожирение и метаболизм. 2021;18(3):245-253. https://doi.org/10.14341/omet12741
For citation:
Romanova N.Yu., Selivanova L.S., Platonova N.M., Beltsevich D.G., Troshina E.A. The results of immunohistochemical study of antibodies to CYP11B2 in primary hyperaldosteronism. Obesity and metabolism. 2021;18(3):245-253. (In Russ.) https://doi.org/10.14341/omet12741
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































