Перейти к:
Сложности в диагностике аденом со смешанной секрецией соматотропного гормона и пролактина
https://doi.org/10.14341/omet12669
Аннотация
Гиперпролактинемия — стойкое избыточное содержание пролактина в сыворотке крови. Возникающий на фоне гиперпролактинемии симптомокомплекс в первую очередь, заключается в нарушении функции репродуктивной системы. Секреция пролактина находится под сложным нейроэндокринным контролем, в котором участвуют различные по своей природе факторы: нейромедиаторы, гормоны периферических эндокринных желез. В большей мере пролактин изолированно синтезируется и секретируется клетками гипофиза — лактотропами, но в ряде случаев гиперсекреция пролактина сочетается с избыточной продукцией гормона роста, что характерно для опухолей, исходящих из линии клеток-предшественников лактотропов и соматотропов гипофиза, маммосоматотропов. В этом случае симптомокомплекс гиперпролактинемии сопровождается клиническими проявлениями акромегалии. У пациентов с акромегалией возможно развитие гиперпролактинемии как вследствие компрессии ножки гипофиза, так и при смешанной секреции пролактина и соматотропного гормона клетками аденомы. Совместная дифференцировка лактотропных и соматотропных клеток гипофиза под влиянием фактора транскрипции Pit-1 определяет тесную связь этих клеточных линий и, наиболее вероятно, является одной из причин образования аденом со смешанной секрецией. В литературе описаны случаи отсроченной инициации секреции соматотропного гормона у пациентов с ранее диагностированными пролактиномами.
Клинические проявления гиперпролактинемии могут стать причиной обращения пациентов к врачу до развития внешних изменений, характерных для акромегалии. Необходимо внимательное отношение как к первичной диагностике, так и к клиническому течению заболевания у пациентов с гиперпролактинемией и аденомой гипофиза: при первичном обследовании необходимо провести полноценную оценку гормонального статуса с обязательным исследованием инсулиноподобного фактора роста 1 (ИФР-1), при дальнейшем наблюдении пациента целесообразно рассмотреть не только оценку снижения уровня пролактина и уменьшения размеров аденомы при лечении агонистами дофаминовых рецепторов, но и периодическое определение уровня ИФР-1. Аденомы гипофиза со смешанной секрецией соматотропного гормона и пролактина могут характеризоваться более неблагоприятным прогнозом.
Для цитирования:
Дзеранова Л.К., Абойшева Е.А., Федорова Н.С., Воротникова С.Ю., Пигарова Е.А., Лапшина А.М. Сложности в диагностике аденом со смешанной секрецией соматотропного гормона и пролактина. Ожирение и метаболизм. 2020;17(3):233-240. https://doi.org/10.14341/omet12669
For citation:
Dzeranova L.K., Aboishava L.A., Fedorova N.S., Vorotnikova S.Y., Pigarova E.A., Lapshina A.M. Difficulties in diagnosis of adenomas with mixed prolactin and growth hormone secretion: case presentation. Obesity and metabolism. 2020;17(3):233-240. (In Russ.) https://doi.org/10.14341/omet12669
АКТУАЛЬНОСТЬ
Гиперпролактинемия — стойкое избыточное содержание пролактина (ПРЛ) в сыворотке крови. Возникающий на фоне гиперпролактинемии симптомокомплекс, в первую очередь, заключается в нарушении функции репродуктивной системы. Секреция ПРЛ находится под сложным нейроэндокринным контролем, в котором участвуют различные по своей природе факторы: нейромедиаторы, гормоны периферических эндокринных желез. В большей мере ПРЛ изолированно синтезируется и секретируется клетками гипофиза — лактотропами, но в ряде случаев гиперсекреция ПРЛ сочетается с избыточной продукцией соматотропного гормона (СТГ), что характерно для опухолей, исходящих из линии клеток-предшественников лактотропов и соматотропов гипофиза, маммосоматотропов. В этом случае симптомокомплекс гиперпролактинемии сопровождается клиническими проявлениями акромегалии [1].
Акромегалия — редкое, тяжелое заболевание, вызванное хронической избыточной секрецией гормона роста, чаще всего аденомой гипофиза. Распространенность акромегалии составляет примерно 2,8–13,7 случаев на 100 тыс. населения [1]. Акромегалия характеризуется патологическим диспропорциональным периостальным ростом костей, хрящей, мягких тканей, внутренних органов, а также нарушением функционального состояния сердечно-сосудистой, легочной системы, периферических эндокринных желез и различных видов метаболизма [2].
Постепенное развитие патологических изменений нередко приводит к задержке диагностики на 5–10 и более лет от начала развития заболевания [3]. Длительное течение заболевания ассоциировано с развитием поражения органов и систем, которое может быть необратимым даже при достижении нормализации уровня СТГ и инсулиноподобного фактора роста 1 (ИФР-1). Первое место в структуре смертности больных с акромегалией занимают сердечно-сосудистые заболевания, также большую значимость имеют респираторные (апноэ сна, дыхательная недостаточность) и метаболические нарушения (нарушение толерантности к глюкозе, cахарный диабет, дислипидемия) [4]. Ранняя диагностика и своевременное лечение позволяют избежать развития тяжелых осложнений акромегалии и снизить смертность больных.
Нередко причиной обращения пациенток с акромегалией за медицинской помощью являются нарушения менструального цикла. Физиологическим субстратом репродуктивной дисфункции у пациенток с акромегалией могут быть гиперпролактинемия, масс-эффект опухоли и прямое влияние СТГ и ИФР-1 [5]. Гиперпролактинемия, вызванная компрессией ножки гипофиза или смешанной секрецией СТГ и ПРЛ, развивается приблизительно у 30% пациентов с акромегалией [6]. Клинические проявления гиперпролактинемии могут быть причиной обращения женщины к специалисту до развития явных внешних изменений, связанных с избыточной секрецией гормона роста. Крайне важна настороженность эндокринологов и смежных специалистов по отношению к гиперпролактинемии как к одной из «масок» акромегалии.
Согласно классификации ВОЗ 2017 г., к соматотропным аденомам относятся плотногранулированные (30–40%) и редкогранулированные аденомы (20–30%), маммосоматотропные аденомы (5–8%) и смешанные аденомы из соматотропных и лактотропных клеток (20–25%) [7]. Для дифференциации маммосоматотропных и смешанных аденом необходимо проведение электронной микроскопии [7]. В маммосоматотропных аденомах секреция ПРЛ и СТГ происходит совместно в одной клетке, а в смешанных аденомах из соматотропных и лактотропных клеток — в разных клетках. Лактотропные аденомы морфологически представлены тремя типами: редкогранулированные, плотногранулированные аденомы и ацидофильно-клеточные аденомы из стволовых клеток. Ацидофильно-клеточная аденома из стволовых клеток может стать причиной акромегалии и гиперпролактинемии. Cреди пациентов, прооперированных по поводу акромегалии, встречается в 0,8% случаев [7]. Согласно классификации ВОЗ 2017 г., в отдельную группу выделены плюригормональные аденомы — PIT1-позитивные аденомы, СТГ/ПРЛ/ТТГ-продуцирующие гормонально-активные аденомы. По данным исследования послеоперационных материалов, плюригормональные аденомы гипофиза являются причиной акромегалии в 3–6% случаев [7].
Обоснование связи лакто- и соматотропных клеток
Тесная связь лактотропных и соматотропных клеток гипофиза определяется особенностями развития клеток аденогипофиза. Дифференцировка клеток гипофиза происходит под контролем факторов транскрипции, таких как T-pit, RPx/Hesx-1, Ptx1, Ptx2, Lhx3/P-lim, Prop-1, Pit-1, SF-1, NeuroD-1, GATA-2 [8]. Транскрипционный фактор Pit-1 регулирует дифференциацию клеток аденогипофиза в соматотропные, лактотропные и тиреотропные клетки [9]. GHRH-R, эстрогеновый рецептор (ER) и GATA-2 — ко-факторы, играющие вспомогательную роль и содействующие влиянию Pit-1. Гипофизарные аденомы сохраняют способность подчиняться действию транскрипционных факторов и ко-факторов. Так, соматотропные аденомы регулируются Pit-1 и GHRH-R, пролактотропные — Pit-1 и ER, тиреотропиномы — Pit-1 и GATA-2 [9]. Совместная дифференцировка клеточных линий является одной из причин образования аденом с сочетанной секрецией [10].
Развитие и функционирование аденогипофиза находятся под влиянием гипоталамических и периферических гормонов, гипофизарных факторов роста и цитокинов. В образование аденомы гипофиза вовлечен каскад событий, вызванных как генетическими изменениями, так и гипоталамическими эндокринными и паракринными ростовыми факторами. Развитие смешанной секреции также может быть связано с изменениями в разных звеньях этой цепи регуляции. Так, например, описан случай инициации секреции СТГ в аденоме, до этого секретировавшей только ПРЛ, ассоциированной с появлением de novo мутации в гене GNAS [11]. Мутация в гене GNAS является самой частой соматической мутацией у пациентов с акромегалией и встречается с частотой около 40% [12].
Митрофанова Л.Б. и соавт. исследовали наличие плюригормональных клеток в материалах аденогипофиза взрослых людей [8]. По результатам исследования авторы подтвердили гипотезу о ко-экспрессии ПРЛ, CТГ и ТТГ с другими гормонами аденогипофиза и предположили, что в аденогипофизе в течение жизни сохраняется некоторое количество плюригормональных клеток, способных стать источником развития аденом при воздействии пусковых факторов [8].
Клинические особенности аденом со смешанной секрецией
Диагностика аденом гипофиза со смешанной секрецией СТГ и ПРЛ может представлять трудности для практикующих врачей. Основное значение имеет проведение дифференциальной диагностики опухолей с изолированной секрецией ПРЛ и СТГ и смешанных аденом гипофиза.
У пациентов с пролактиномами уровень ПРЛ, как правило, коррелирует с размерами аденомы. При макроаденомах ПРЛ обычно превышает 250 нг/л (5300 мМЕ/л) и практически у всех составляет более 100 нг/л (2120 мМЕ/л). У большинства пациентов с микропролактиномами уровень ПРЛ варьирует от 50 до 150 нг/л (1060–3180 мМЕ/л) [13]. Тем не менее даже при получении клинических данных, соответствующих наличию у пациента пролактиномы (корреляции уровня гиперпролактинемии с размерами аденомы, снижение уровня ПРЛ и размеров аденомы на фоне применения агонистов дофамина), у лечащего врача должна сохраняться настороженность относительно акромегалии. Согласно клиническим рекомендациям Эндокринного общества, у пациентов с гиперпролактинемией рекомендовано проведение обследования на предмет наличия акромегалии [14]. Более того, опубликованы данные, свидетельствующие о возможности отсроченного развития акромегалии у пациентов, длительно наблюдавшихся по поводу пролактиномы и ранее имевших нормальный уровень ИФР-1, что обуславливает целесообразность проведения периодической, а не единовременной оценки уровня ИФР-1 [11][15–17].
В 2010 г. были опубликованы данные одномоментного исследования с участием 121 пациента с пролактиномой без фенотипических признаков акромегалии, находящихся на терапии агонистами дофаминовых рецепторов [18]. По итогам исследования, у 4,1% пациентов, находящихся на эффективной терапии агонистами дофаминовых рецепторов (нормализация уровня пролактина и уменьшение размеров аденомы на фоне лечения один из критериев включения в исследование), была обнаружена активная акромегалия.
Клинические проявления СТГ/ПРЛ-секретирующих аденом гипофиза обуславливаются гормональной секрецией и масс-эффектами опухоли. В настоящее время нет определенных клинических характеристик, которые могли бы служить вспомогательным фактором в понимании, какой морфологический тип аденомы вызывает симптомы у пациента.
При сравнении данных двух групп пациентов с акромегалией, разделенных по результатам иммуногистохимического исследования послеоперационного материала на группу с ПРЛ/СТГ-положительными аденомами и только СТГ-положительными, был сделан вывод о более частом проявлении акромегалоидных изменений внешности, избыточного потоотделения, головных болей и сниженного либидо в группе пациентов с ПРЛ/СТГ-положительными аденомами [19]. Также в группе смешанной секреции был отмечен более высокий уровень ИФР-1 и ПРЛ.
В то же время в ином исследовании при сравнении двух групп пациентов, разделенных на основании предоперационных лабораторных исследований СТГ и ПРЛ, были получены противоположные результаты [20]. У пациентов с предоперационным повышением СТГ и ПРЛ при сравнении с группой, в которой отмечалось повышение только СТГ, были выявлены меньшая выраженность акромегалоидных изменений внешности и относительно более низкий уровень СТГ на фоне более выраженных нарушений менструального цикла и галактореи [20].
При сравнении характеристик гиперпролактинемии у пациентов с сочетанием акромегалии и гиперпролактинемии и пациентов, имевших только гиперпролактинемию, были получены данные об относительно более низких значениях ПРЛ сыворотки крови у пациентов с сочетанием гиперсекреции СТГ и ПРЛ [21].
Возможно, причиной противоречивых результатов исследований является множество морфологических вариантов аденом, способных секретировать ПРЛ и СТГ. Важно отметить, что меньшая выраженность симптомов акромегалии может быть одной из причин недообследования пациентов и длительного лечения заболевания как пролактиномы. Своевременная диагностика и лечение акромегалии значительно улучшают прогноз пациентов.
Мы бы хотели представить два клинических случая аденом у пациенток с секрецией СТГ и ПРЛ.
ОПИСАНИЕ СЛУЧАЯ 1
Пациентка З. впервые отметила нарушение менструального цикла в 2008 г. в возрасте 30 лет, когда в течение года после окончания грудного вскармливания не восстановились менструации. В октябре 2010 г. при обращении к эндокринологу впервые выявлена гиперпролактинемия, назначен агонист дофамина — бромокриптин 7,5 мг в день. Лечащим врачом был исключен феномен макропролактинемии, проведена оценка уровней гормонов щитовидной железы, тиреотропного гормона (ТТГ), кортизола и адренокортикотропного гормона (АКТГ) — результаты соответствовали референсным значениям. При проведении МРТ гипофиза в декабре 2010 г. выявлена макроаденома размерами 12х8х8 мм. С декабря 2010 г. пациентка переведена на терапию каберголином с постепенным увеличением дозы максимально до 4 мг в неделю.
Несмотря на терапию, стабильной нормализации уровня ПРЛ достичь не удавалось (рис. 1). Клинически заболевание длительно проявлялось нарушением менструального цикла (олигоменорея, опсоменорея), слабостью, утомляемостью.
На фоне приема каберголина отмечалась отрицательная динамика размеров образования. По данным МРТ головного мозга от 2015 г., размеры аденомы составляли 16х15х11 мм, в 2018 г. — 23х15х13 мм. Течение заболевания было расценено как частичная резистентность к агонистам дофамина.
В ноябре 2019 г. больная поступила для определения тактики дальнейшего лечения в ФГБУ «НМИЦ эндокринологии» Минздрава России. При подробном расспросе пациентки выяснено, что в последние два года появились изменения во внешности — увеличение размера ноги с 38 до 39, размера кольца, а также усиление потливости. Жалобы на слабость, головную боль и нарушение менструального цикла по типу олигоменореи сохранялись. Еженедельная доза каберголина при поступлении составляла 3 мг в неделю. По данным проведенного гормонального обследования выявлено повышение пролактина — 675,7 мЕд/л (64–395). Учитывая наличие характерных для акромегалии жалоб, также проведено исследование уровня ИФР-1, по результатам которого было выявлено значительное повышение показателя — 684,7 нг/мл (82–283). Пациентке был установлен диагноз акромегалии. При проведении обследования на предмет осложнений акромегалии у пациентки выявлена гипертоническая болезнь 1 степени.
По данным МРТ головного мозга — макроаденома с супра-, пара-, инфраселлярным распространением размерами 17х19х17 мм (рис. 2). Учитывая данные проведенного обследования, характер секреции аденомы был расценен нами как смешанный, характерный для маммосоматотропиномы, и пациентка направлена на хирургическое лечение. Снижение показателя СТГ на 6-е сутки после транссфеноидальной аденомэктомии до 0,599 нг/мл свидетельствовало в пользу ремиссии акромегалии. Также было достигнуто снижение уровня пролактина до 30,8 мЕд/л (64–395).
При проведении иммуногистохимического исследования использованы панели антител на СТГ, ПРЛ, низкомолекулярный цитокератин САМ5.2, PIT-1, рецепторы эстрогенов альфа, Ki-67, дофаминовые рецепторы 2 типа, соматостатиновые рецепторы 2 и 5 типа. По результатам исследования экспрессия маркеров соответствовала наличию у пациентки редкогранулированной соматотропиномы (выраженная экспрессия PIT-1, позитивные клетки в опухоли к CТГ и ПРЛ, окрашивание к низкомолекулярному цитокератину в виде фиброзных телец, отсутствие экспрессии эстрогеновых рецепторов альфа (рис. 3)). Выявлена умеренно выраженная экспрессия рецепторов соматостатина 2 и 5 подтипов, положительная иммуноэкспрессия дофаминовых рецепторов 2 типа. Примечательно также высокое значение Ki-67% — 10,6%.
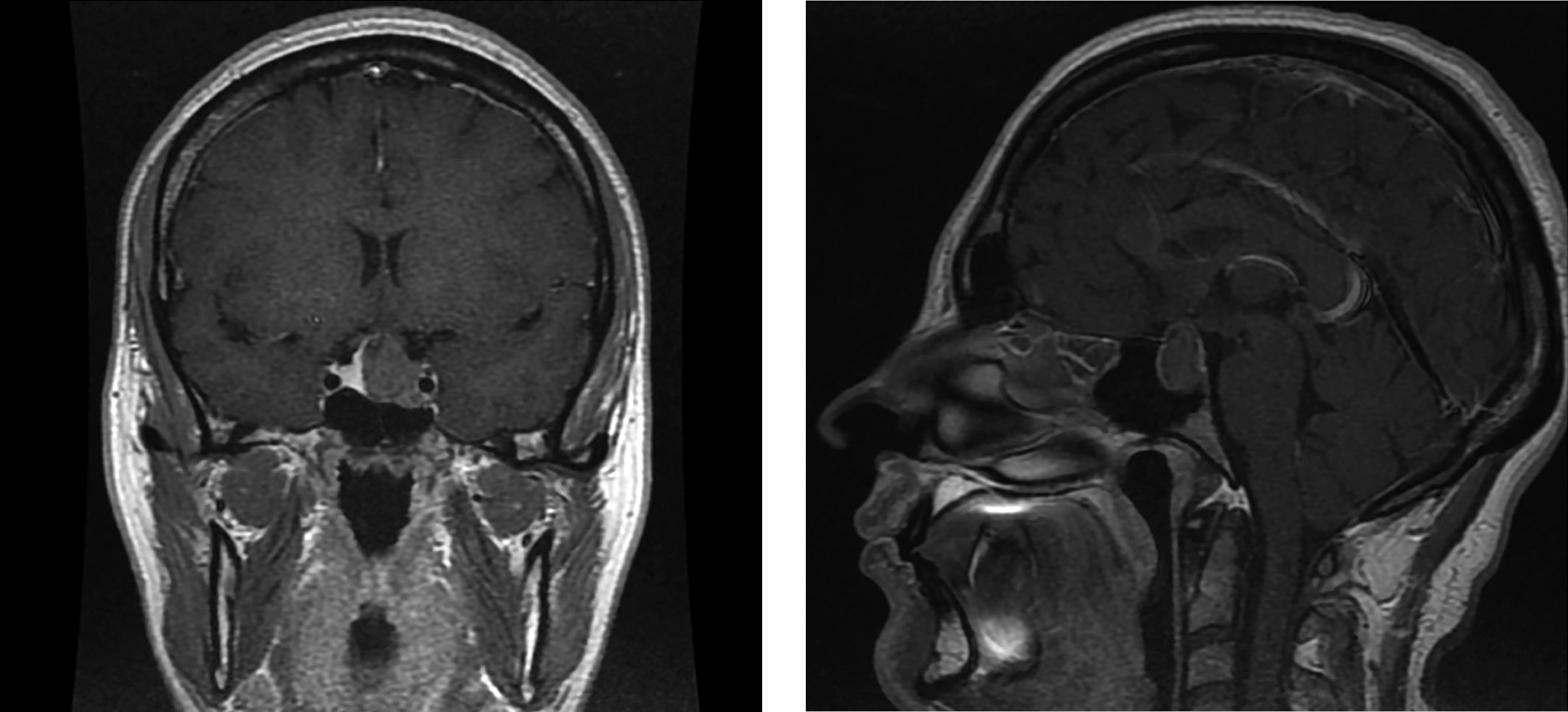
Рисунок 1. Динамика показателей пролактина и дозы каберголина с начала заболевания до проведения хирургического лечения
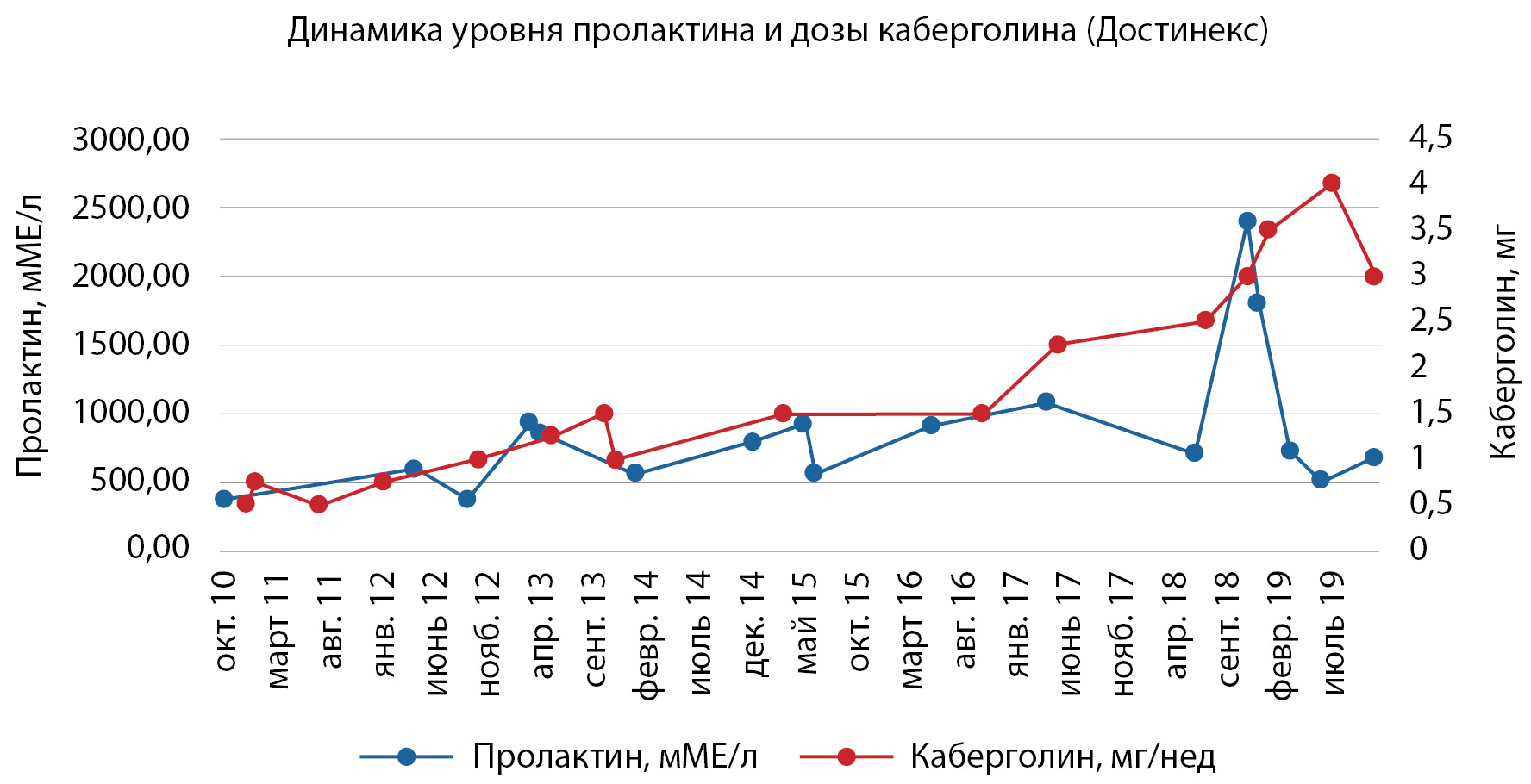
Рисунок 2. Макроаденома с супра-, пара-, инфраселлярным распространением размерами 17×19×17 мм

Рисунок 3. Экспрессия PIT-1, CТГ. Визуализация фиброзных телец при окрашивании к низкомолекулярному цитокератину (CAM 5.2). Индекс Ki-67=10,6%
ОПИСАНИЕ СЛУЧАЯ 2
Пациентка E. в 2011 г. самостоятельно забеременела, до беременности менструальный цикл был регулярным. В течение лактации длительностью 1 год и 7 месяцев менструальный цикл не восстановился, после завершения лактации отмечалась олигоменорея. Также после родов пациентка впервые отметила увеличение размера кистей и выраженную отечность рук, однако значимости этим явлениям не придала.
С 2013 г. пациентка наблюдалась у гинеколога по поводу нарушений менструального цикла, гормональных исследований не проводилось. Гинекологом была инициирована терапия препаратами гестагенов без положительной динамики. В январе 2016 г. проведено исследование уровня ПРЛ, и выявлена умеренная гиперпролактинемия — 29,27 нг/мл (4,79–23,30), инициирована терапия оригинальным каберголином Достинекс 0,5 мг 1 раз в неделю, на фоне чего достигнута нормопролактинемия.
В феврале 2016 г. пациентка впервые обратилась к эндокринологу. В ходе сбора анамнеза выявлены жалобы, характерные для акромегалии, — небольшое утолщение пальцев рук и увеличение размера обуви, периодическое ощущение онемения рук (проявление синдрома карпального канала). По результатам лабораторных исследований ИФР-1 повышен до 985,0 нг/мл (117–329), СТГ — более 40,0 нг/мл (до 8). По данным МРТ — макроаденома 16х18х20 мм с супра-, пара- и инфраселлярным распространением. Пациентке была проведена трансназальная транссфеноидальная аденомэктомия, результаты послеоперационных исследований свидетельствовали в пользу ремиссии заболевания (подавление СТГ менее 1 нг/мл при проведении орального глюкозотолерантного теста (ОГТТ) на 7-е сутки после операции).
Результаты иммуногистохимического исследования соответствовали наличию маммосоматотропиномы (положительная иммуноэкспрессия к СТГ, ПРЛ и PIT-1, большинства клеток — к низкомолекулярному цитокератину, 1–2% клеток — к эстрогеновым рецепторам альфа (рис. 4)).
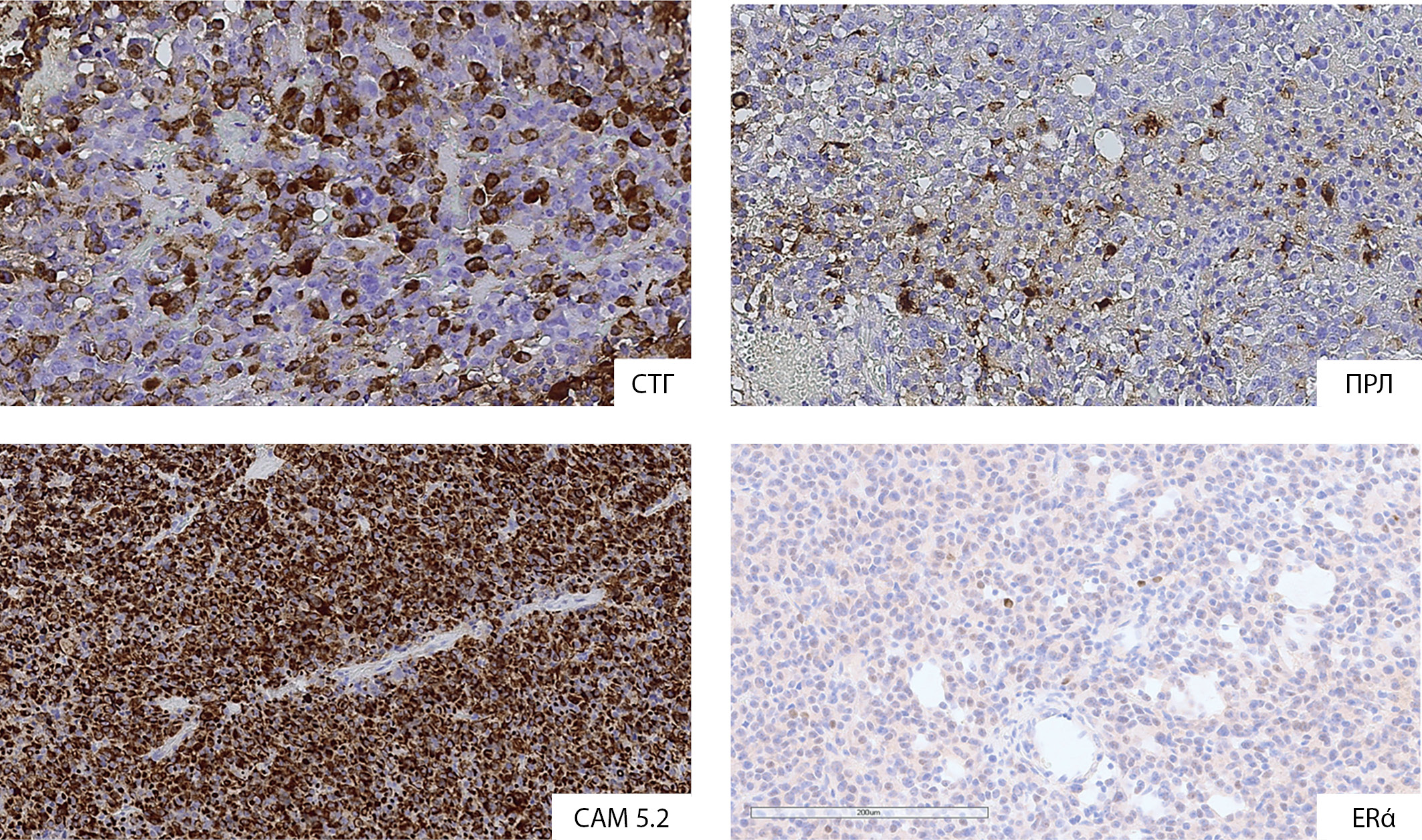
Рисунок 4. Положительная иммуноэкспрессия клеток к соматотропному гормону, низкомолекулярному цитокератину. В 1–2% клеток — положительная иммуноэкспрессия к пролактину и эстрогеновым рецепторам альфа
В 2017 г. на фоне нормализации гормональных показателей пациентка забеременела второй раз, беременность протекала без осложнений, период грудного вскармливания составил 1 год и 5 месяцев. Менструальный цикл восстановился через 9 месяцев после родов. На данный момент у пациентки сохраняется ремиссия акромегалии и гиперпролактинемии.
ОБСУЖДЕНИЕ
В случае пациентки З. длительное отсутствие внимания лечащего врача к оценке уровня ИФР-1 отсрочило своевременные диагностику и лечение. Пролактиномы являются самыми частыми аденомами гипофиза с распространенностью 25 до 63 на 100 тыс. населения [22], безусловно, превышающей таковую для акромегалии. При наличии у пациента гиперпролактинемии и аденомы гипофиза пролактинома действительно является вероятным диагнозом, однако нужно учитывать возможность как смешанной секреции, так и вторичной гиперпролактинемии из-за компресcии ножки гипофиза.
В течение длительного периода (около 7 лет) единственными жалобами пациентки З. были нарушение менструального цикла и слабость, характерные для гиперпролактинемии. Учитывая наличие в анамнезе высоких значений ПРЛ сыворотки крови (более 2000 мМЕ/л) и иммуноэкспрессию пролактина при проведении иммуногистохимического исследования, мы полагаем, что гиперпролактинемия в данном случае была вызвана секрецией гормона аденомой. Одной из вероятных гипотез, объясняющих течение заболевания пациентки, является не одновременная инициация секреции ПРЛ и СТГ.
В работе 2003 г. Andersen M. и соавт. были опубликованы результаты 5-летнего наблюдения за группой 78 пациентов с пролактиномами. Всем пациентам регулярно проводилось исследование уровня ИФР-1. По итогам исследования у 8 пациентов с пролактиномами отмечено повышение уровня ИФР-1, у 3 из них развились как клинические, так и биохимические проявления акромегалии (повышение уровня ИФР-1 и отсутствие снижения СТГ по результатам ОГТТ, удовлетворяющие критериям постановки диагноза) [17]. Авторами предположено наличие группы пациентов с аденомами гипофиза, у которых секреция ПРЛ и СТГ развивается не одновременно, и рекомендовано ежегодное измерение уровня ИФР-1 у пациентов, наблюдающихся по поводу пролактиномы. Схожие данные опубликованы различными авторами в клинических случаях. Dessimoz C. и соавт. описали повышение уровня ИФР-1 и развитие клинической картины акромегалии у пациентки, длительно наблюдавшейся по поводу гиперпролактинемии [16]. Два клинических случая развития акромегалии у пациентов после 10- и 20-летнего периода наблюдения по поводу пролактиномы описали Manuylova E. и соавт. [15]. Авторы подчеркивают, что пациенты длительно принимали агонисты дофаминовых рецепторов, и это позволило добиться контроля симптомов гиперпролактинемии и нормализации уровня ПРЛ. Опубликован клинический случай инициации секреции СТГ у пациентки с агрессивной пролактиномой и мутацией в гене GNAS, сопровождающейся развитием резистентности к агонистам дофаминовых рецепторов после 15 лет лечения [11].
Таким образом, случаи развития акромегалии у пациентов, длительно наблюдавшихся по поводу гиперпролактинемии, описаны многими авторами. Механизмы, лежащие в основе возможного изменения гормонального профиля клеток аденомы, в настоящее время не до конца ясны и, предположительно, могут быть связаны как с развитием de novo мутации, позволяющей клетке секретировать СТГ, так и с потерей клеткой дифференцировки и переходом на более раннюю стадию своего развития.
Данные клинические наблюдения подтверждают важность внимательного отношения как к диагностике, так и к клиническому течению заболевания. При первичном обследовании пациента с гиперпролактинемией и аденомой гипофиза необходимо провести оценку гормонального статуса с обязательным исследованием ИФР-1 [14]. При дальнейшем наблюдении пациента целесообразно рассмотреть не только оценку снижения ПРЛ и уменьшения размеров аденомы при лечении агонистами дофаминовых рецепторов, но и периодическое определение уровня ИФР-1.
У пациентов с акромегалией методом выбора является хирургическое лечение — проведение трансназальной транссфеноидальной аденомэктомии [23]. У пациентов с пролактиномами приоритет отдается консервативному лечению, золотым стандартом которого является каберголин (оригинальный препарат Достинекс) [13][14]. При применении каберголина достижение значительного уменьшения или полного исчезновения опухоли возможно у 80% и 58% впервые леченных пациентов с макропролактиномами соответственно [24]. Согласно рекомендациям Российской ассоциации эндокринологов, длительность лечения каберголином должна составлять не менее 2 лет при условии нормализации уровня ПРЛ и уменьшения размеров опухоли [25].
У пациентов со смешанной секрецией СТГ и ПРЛ применение агонистов дофаминовых рецепторов также уместно в рамках купирования гиперпролактинемии. Однако данная группа препаратов имеет ограниченную эффективность в нормализации уровней СТГ и ИФР-1 [18]. По данным приведенных выше клинических случаев отсроченной манифестации секреции СТГ аденомами, ранее диагностированными как пролактиномы, и исследования Rosario P.W. и соавт., манифестация секреции СТГ происходила на фоне приема пациентами агонистов дофаминовых рецепторов [11][15–18].
В послеоперационном периоде иммуногистохимический метод исследования дает окончательный вердикт касательно морфологического типа аденомы и является ценным для определения прогноза и выбора оптимальной тактики дальнейшего наблюдения и лечения. Аденомы со смешанной секрецией СТГ и ПРЛ могут характеризоваться более неблагоприятным прогнозом, однако этот вопрос требует дальнейших исследований [19][21].
ЗАКЛЮЧЕНИЕ
Для правильной диагностики заболевания у пациентов с аденомами гипофиза крайне важна адекватная оценка гормонального статуса опухоли при первичном обращении. Тесная связь сомато- и лактотропных клеток аденогипофиза, наличие общих предшественников определяют развитие аденом со смешанной ПРЛ/СТГ-секрецией. Учитывая литературные данные о возможности неодновременной инициации секреции СТГ и ПРЛ, необходимо внимательное отношение к клиническому течению заболевания и при необходимости периодическое измерение ИФР-1. Аденомы со смешанной ПРЛ/СТГ-секрецией могут характеризоваться более неблагоприятным прогнозом.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Дзеранова Л.К. — концепция и идея статьи, получение данных, написание статьи; Абойшева Е.А. — концепция статьи, получение данных, анализ данных, интерпретация результатов, написание статьи; Федорова Н.С. — анализ данных, написание статьи; Пигарова Е.А. — концепция статьи, внесение в рукопись существенных правок; Воротникова С.Ю. — получение и анализ данных, интерпретация результатов, написание статьи; Лапшина А.М. — получение данных, интерпретация результатов, внесение в рукопись существенных правок. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациента. Пациенты добровольно подписали информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Ожирение и Метаболизм».
Список литературы
1. Lavrentaki A, Paluzzi A, Wass JAH, Karavitaki N. Epidemiology of acromegaly: review of population studies. Pituitary. 2017;20(1):4-9. doi: https://doi.org/10.1007/s11102-016-0754-x
2. Молитвословова Н.Н. Акромегалия: современные достижения в диагностике и лечении // Проблемы эндокринологии. — 2011. — Т. 57. — №1. — C. 46-59. doi: https://doi.org/10.14341/probl201157146-59
3. Vilar L, Vilar CF, Lyra R, Lyra R, Naves LA. Acromegaly: clinical features at diagnosis. Pituitary. 2017;20(1):22-32. doi: https://doi.org/10.1007/s11102-016-0772-8
4. Pivonello R, Auriemma RS, Grasso LFS, et al. Complications of acromegaly: cardiovascular, respiratory and metabolic comorbidities. Pituitary. 2017;20(1):46-62. doi: https://doi.org/10.1007/s11102-017-0797-7
5. Grynberg M, Salenave S, Young J, Chanson P Female Gonadal Function before and after Treatment of Acromegaly. J Clin Endocrinol Metab. 2010;95(10):4518-4525. doi: https://doi.org/10.1210/jc.2009-2815
6. Lugo G, Pena L, Cordido F. Clinical Manifestations and Diagnosis of Acromegaly. Int J Endocrinol. 2012;2012(10):1-10. doi: https://doi.org/10.1155/2012/540398
7. Syro L V., Rotondo F, Serna CA, Ortiz LD, Kovacs K. Pathology of GH-producing pituitary adenomas and GH cell hyperplasia of the pituitary. Pituitary. 2017;20(1):84-92. doi: https://doi.org/10.1007/s11102-016-0748-8
8. Mitrofanova LB, Konovalov P V., Krylova JS, Polyakova VO, Kvetnoy IM. Plurihormonal cells of normal anterior pituitary: Facts and conclusions. Oncotarget. 2017;8(17):29282-29299. doi: https://doi.org/10.18632/oncotarget.16502
9. Osamura RY, Egashira N, Miyai S, et al. Molecular pathology of the pituitary. In: George Kontogeorgos, Kalman Kavacs, editors. Molecular Pathology of the Pituitary Front Horm Res. Basel, Karger. 2004;32:20-33.
10. Labadzhyan A, Melmed S. Plurihormonal Adenomas. In: Tritos N.A., Klibanski A., editors. Prolactin Disorders: From Basic Science to Clinical Management. Humana Press; 2019: 205-217.
11. Lania AG, Ferrero S, Pivonello R, et al. Evolution of an Aggressive Prolactinoma into a Growth Hormone Secreting Pituitary Tumor Coincident with GNAS Gene Mutation. J Clin Endocrinol Metab. 2010;95(1):13-17. doi: https://doi.org/10.1210/jc.2009-1360
12. Gadelha MR, Kasuki L, Korbonits M. The genetic background of acromegaly. Pituitary. 2017;20(1):10-21. doi: https://doi.org/10.1007/s11102-017-0789-7
13. Chanson P Maiter D. The epidemiology, diagnosis and treatment of Prolactinomas: The old and the new. Best Pract Res Clin Endocrinol Metab. 2019;33(2):101290. doi: https://doi.org/10.1016/jbeem.2019.101290
14. Melmed S, Casanueva FF, Hoffman AR, et al. Diagnosis and Treatment of Hyperprolactinemia: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2011;96(2):273-288. doi: https://doi.org/10.1210/jc.2010-1692
15. Manuylova E, Calvi LM, Hastings C, et al. Late presentation of acromegaly in medically controlled prolactinoma patients. Endocrinol Diabetes Metab Case Reports. 2016;2016(2):273-288. doi: https://doi.org/10.1530/EDM-16-0069
16. Dessimoz C, Browaeys P Maeder P et al. Transformation of a Microprolactinoma into a Mixed Growth Hormone and Prolactin-Secreting Pituitary Adenoma. Front Endocrinol (Lausanne). 2012;2(2):273-288. doi: https://doi.org/10.3389/fendo.2011.00116
17. Andersen M, Hagen C, Frystyk J, Schroeder H, Hagen C. Development of acromegaly in patients with prolactinomas. Eur J Endocrinol. 2003;2(2):17-22. doi: https://doi.org/10.1530/eje.0.1490017
18. Rosario PW, Purisch S. Biochemical acromegaly in patients with prolactinoma during treatment with dopaminergic agonists. Arq Bras Endocrinol Metabol. 2010;54(6):546-549. doi: https://doi.org/10.1590/S0004-27302010000600006
19. Rick J, Jahangiri A, Flanigan PM, et al. Growth hormone and prolactin-staining tumors causing acromegaly: a retrospective review of clinical presentations and surgical outcomes. J Neurosurg. 2019;131(1):147-153. doi: https://doi.org/10.3171/2018.4JNS18230
20. Wang M, Mou C, Jiang M, et al. The characteristics of acromegalic patients with hyperprolactinemia and the differences in patients with merely GH-secreting adenomas: clinical analysis of 279 cases. Eur J Endocrinol. 2012;166(5):797-802. doi: https://doi.org/10.1530/EJE-11-1119
21. Huan C, Cui G, Ren Z. The characteristics of acromegalic patients with hyperprolactinemia and the differences with hyperprolactinemia patients. PakJPharmSci. 2015;28(2 Suppl):713-718.
22. Petersenn S, Giustina A. Diagnosis and management of prolactinomas: current challenges. Pituitary. 2020;23(1):1-2. doi: https://doi.org/10.1007/s11102-019-01025-y
23. Katznelson L, Laws ER, Melmed S, et al. Acromegaly: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2014;99(11):3933-3951. doi: https://doi.org/10.1210/jc.2014-2700
24. Vilar L, Freitas MC, Naves LA, et al. Diagnosis and management of hyperprolactinemia: Results of a Brazilian multicenter study with 1234 patients. J Endocrinol Invest. 2008;31(5):436-444. doi: https://doi.org/10.1007/BF03346388
25. Мельниченко Г.А., Дзеранова Л.К., Пигарова Е.А., и др. Федеральные клинические рекомендации по клинике, диагностике, дифференциальной диагностике и методам лечения гиперпролактинемии. // Проблемы эндокринологии. — 2013. — Т. 59. — №6. — С. 19-26. doi: https://doi.org/10.14341/probl201359619-26
Об авторах
Лариса Константиновна ДзерановаРоссия
Дзеранова Лариса Константиновна, д.м.н., ORCID: https://orcid.org/0000-0002-0327-4619, eLibrary SPIN: 2958-5555, e-mail: dzeranovalk@yandex.ru
Конфликт интересов: отсутствие конфликтов интересов
Елизавета Андреевна Абойшева
Россия
Абойшева Елизавета Андреевна, ординатор, ORCID: https://orcid.org/0000-0002-0306-6588, eLibrary SPIN 3828-3502, e-mail: lizaveta.aboisheva@gmail.com.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов: отсутствие конфликтов интересов
Наталья Сергеевна Федорова
Россия
Федорова Наталья Сергеевна, к.м.н., ORCID: https://orcid.org/0000-0002-9816-5043, eLibrarySPIN: 6599-5612, e-mail: fedorova.n.s.12@gmail.com
Конфликт интересов: отсутствие конфликтов интересов
Светлана Юрьевна Воротникова
Россия
Воротникова Светлана Юрьевна, ORCID: https://orcid.org/0000-0001-7470-1676, eLibrary SPIN: 6571-1206, e-mail: bra_svetix@list.ru
Конфликт интересов: отсутствие конфликтов интересов
Екатерина Александровна Пигарова
Россия
Пигарова Екатерина Александровна, д.м.н., ORCID: https://orcid.org/0000-0001-6539-466X, eLibrary SPIN: 6912-6331, e-mail: kpigarova@gmail.com
Конфликт интересов: отсутствие конфликтов интересов
Анастасия Михайловна Лапшина
Россия
Лапшина Анастасия Михайловна, к.м.н., ORCID: https://orcid.org/0000-0003-4353-6705, eLibrary SPIN: 1582-5033, email: nottoforget@yandex.ru
Конфликт интересов: отсутствие конфликтов интересов
Дополнительные файлы
|
|
1. Рисунок 1. Динамика показателей пролактина и дозы каберголина с начала заболевания до проведения хирургического лечения | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(218KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Макроаденома с супра-, пара-, инфраселлярным распространением размерами 17×19×17 мм | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(204KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Экспрессия PIT-1, CТГ. Визуализация фиброзных телец при окрашивании к низкомолекулярному цитокератину (CAM 5.2). Индекс Ki-67=10,6% | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Положительная иммуноэкспрессия клеток к соматотропному гормону, низкомолекулярному цитокератину. В 1–2% клеток — положительная иммуноэкспрессия к пролактину и эстрогеновым рецепторам альфа | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Дзеранова Л.К., Абойшева Е.А., Федорова Н.С., Воротникова С.Ю., Пигарова Е.А., Лапшина А.М. Сложности в диагностике аденом со смешанной секрецией соматотропного гормона и пролактина. Ожирение и метаболизм. 2020;17(3):233-240. https://doi.org/10.14341/omet12669
For citation:
Dzeranova L.K., Aboishava L.A., Fedorova N.S., Vorotnikova S.Y., Pigarova E.A., Lapshina A.M. Difficulties in diagnosis of adenomas with mixed prolactin and growth hormone secretion: case presentation. Obesity and metabolism. 2020;17(3):233-240. (In Russ.) https://doi.org/10.14341/omet12669

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































