Перейти к:
Особенности течения и последствия COVID-19 у пациентов с избыточным весом и ожирением. Уроки текущей пандемии
https://doi.org/10.14341/omet12663
Аннотация
Трудности в лечении COVID-19 определили необходимость выявления прогностических факторов риска развития осложненного течения заболевания, критических состояний и смерти. Эндокринные и метаболические нарушения, связанные с ожирением, в том числе нарушение чувствительности к инсулину, хроническое воспаление и нарушение метаболизма липидов и жирных кислот, усиливают иммунологическую дисрегуляцию и делают подобных пациентов более подверженными развитию инфекционных заболеваний. Данные проведенных исследований позволяют выделить ожирение в качестве фактора риска отягощенного течения COVID-19, а также более длительного периода до элиминации вируса, а следовательно, опасности заражения окружающих. В обзоре представлены данные литературы об особенностях течения и механизмах развития осложнений у пациентов с новой коронавирусной инфекцией и ожирением. Потенцирование сердечно-сосудистых факторов риска, увеличение продукции провоспалительных цитокинов, коагулопатии — факторы развития неблагоприятных исходов у таких пациентов. Обсуждены возможности терапии ожирения с помощью комбинированного препарата, содержащего в одной таблетке сибутрамин и метформин, с учетом необходимости восстановления метаболического здоровья для повышения адаптивных и резистентных возможностей организма в условиях угрозы нового роста распространенности COVID-19.
Для цитирования:
Демидова Т.Ю., Волкова Е.И., Грицкевич Е.Ю. Особенности течения и последствия COVID-19 у пациентов с избыточным весом и ожирением. Уроки текущей пандемии. Ожирение и метаболизм. 2020;17(4):375-384. https://doi.org/10.14341/omet12663
For citation:
Demidova T.Yu., Volkova E.I., Gritskevich E.Yu. Peculiarities of the COVID-19 course and consequences in overweight and obese patients. Lessons from the current pandemic. Obesity and metabolism. 2020;17(4):375-384. (In Russ.) https://doi.org/10.14341/omet12663
ВВЕДЕНИЕ
Ожирение — хроническое, перманентно прогрессирующее полиэтиологичное заболевание, связанное с нарушением энергетического баланса, гормональной регуляции, метаболизма и гемодинамики, ассоциированное с патологическим накоплением жировой ткани в организме, приводящее к развитию осложнений [1].
По данным ВОЗ, в 2016 г. около 13% взрослого населения планеты (11% мужчин и 15% женщин) страдали ожирением [2]. В России, по данным исследования ЭССЕ-РФ, средняя распространенность ожирения среди взрослого населения составляла 29,7±0,3% (у женщин 30,8±0,4%, у мужчин 26,6±0,5%) [3]. Высокая распространенность этой патологии в мире и в России актуализирует проблему ожирения не только как самостоятельного заболевания, но и в связи с пандемией коронавирусной инфекции 2019 (COVID-19).
Методология поиска первоисточников
Для основного поиска источников использовали интернет-ресурс PubMed, а также базу данных ELIBRARY. Сайты издательств Springer и Elsevier использовались для доступа к полному тексту статей. Этапы и ключевые слова поиска: 1-й этап: obesity, COVID-19, 2-й этап: COVID-19 comorbidities, risk factors for severe disease COVID-19, pathophysiology, mechanisms of development of complications of obesity, 3-й этап: markers/mediators of obesity, adipocines; 4-й этап: treatment/therapy/management of obesity, sibutramine, metformin.
ФАКТОРЫ ПРОГНОЗА РАЗВИТИЯ КРИТИЧЕСКИХ СОСТОЯНИЙ И СМЕРТИ
Пандемия COVID-19 заставила направить значительные усилия на выявление прогностических факторов риска развития критических состояний и смерти. Пожилой возраст, сердечно-сосудистые заболевания (ССЗ), сахарный диабет, хронические легочные заболевания, артериальная гипертензия и онкологическая патология были связаны с повышенным риском смерти при COVID-19 в соответствии с данными из Китая и Европы, впоследствии европейские и американские исследователи расширили потенциальные группы риска, включив в них пациентов с ожирением [4][5]. Ожирение потенцирует множественные сердечно-сосудистые факторы риска, лежащие в основе клинического cердечно-сосудистого континуума, приводя к развитию ССЗ и неблагоприятных сердечно-сосудистых исходов [6]. В настоящее время активно изучается роль биологических молекул — медиаторов воспаления, которые участвуют в сердечно-сосудистом континууме. Хроническое воспаление и ожирение играют ключевую роль в развитии этого континуума, а пациенты с ожирением более подвержены развитию инфекционных заболеваний [7].
В китайском анализе 44 672 подтвержденных случаев инфекции, наибольшая смертность наблюдалась при сопутствующих ССЗ (10,5%), сахарном диабете (7,3%), по 6% при хронических респираторных заболеваниях, гипертонии и злокачественных новообразованиях, однако данные об ожирении не были представлены [8]. В апреле 2020 г. опубликованы данные американского исследования, анализирующего госпитализированных по поводу COVID-19 в марте 2020 г. [9]. Исследование включает данные из 99 округов в 14 штатах, что составляет около 10% от общей численности населения США. Почти 90% пациентов, поступивших с COVID-19, имели сопутствующие заболевания. Артериальная гипертония была наиболее распространенным сопутствующим заболеванием (49,7%), за которым следовали ожирение (48,3%), хронические заболевания легких (34,6%), сахарный диабет (28,3%) и ССЗ (27,8%). Эти данные перекликаются с результатами китайского исследования [10], в котором выявлено, что сахарный диабет диагностировался у 42,3% пациентов с COVID-19. Артериальная гипертония (АГ), сахарный диабет (СД) и ишемическая болезнь сердца (ИБС) были связаны с гораздо более высоким уровнем смертности, что помогло исследователям сделать вывод, что сопутствующие заболевания могут быть важным фактором в смертности пациентов с COVID-19. Отдельного внимания заслуживают данные о связи тяжести этого инфекционного заболевания и ожирения, поскольку ожирение считают неинфекционной пандемией в связи с крайне высокой распространенностью. Во французском исследовании риск инвазивной ИВЛ у пациентов с инфекцией COVID-19, поступивших в отделение интенсивной терапии, более чем в 7 раз выше для тех, у кого индекс массы тела (ИМТ) >35 по сравнению с ИМТ <25 кг/м2 [11]. При анализе данных пациентов в возрасте до 60 лет в Нью-Йорке отмечено, что в сравнении с пациентами с ИМТ <30 кг/м2, у лиц с ИМТ 30–34,9 кг/м2 и более 35 кг/м2 в 1,8 и в 3,6 раза соответственно выше шансы попасть в отделение интенсивной терапии при COVID-19 [8]. Кроме того, ожирение усиливает риск тромбоза [12], что весьма актуально, учитывая связь между тяжелым течением COVID-19 и протромботической диссеминированной внутрисосудистой коагуляцией и большой частотой венозной тромбоэмболии. Обобщенные данные о повышении риска инфицирования и развития осложнений при COVID-19 представлены на рисунке 1 [13].
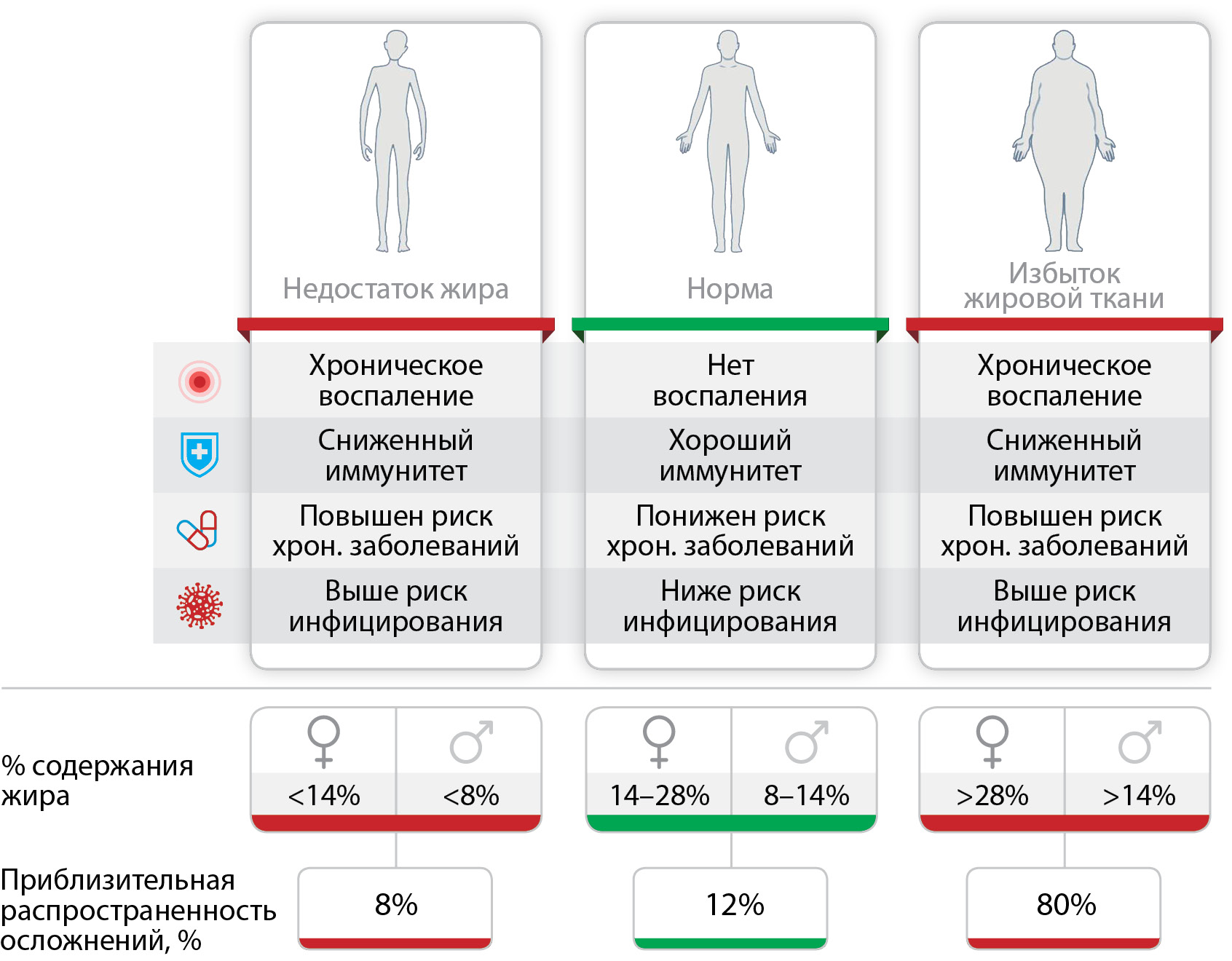
Рисунок 1. Отклонение количества жировой ткани от нормы повышает риск инфицирования и осложнений на фоне COVID-19 [13].
Необходимы дальнейшие исследования для оценки ожирения в качестве возможного предиктора тяжелого течения и риска смертности COVID-19.
ПОТЕНЦИАЛЬНЫЕ МЕХАНИЗМЫ ВЛИЯНИЯ ОЖИРЕНИЯ НА ТЕЧЕНИЕ COVID-19
Исследователи из Великобритании предположили, что возможными механизмами влияния ожирения и избыточной массы тела на тяжесть течения COVID-19 могут быть снижение защитного кардиореспираторного резерва и нарушение иммунной регуляции, которые способствуют прогрессированию заболевания вплоть до развития критического состояния и органной недостаточности у части пациентов с COVID-19 [14]. Помимо кардиометаболических и тромботических последствий, ожирение оказывает негативное воздействие на функцию легких, уменьшение объема форсированного выдоха и форсированной жизненной емкости легких. Вопрос о том, является ли ожирение независимым фактором риска подверженности инфекции, требует дальнейших исследований
Ожирение и метаболический синдром общепризнанно являются источником хронического воспаления, поскольку сопровождаются продукцией провоспалительных цитокинов и увеличением белков острой фазы. Пациенты с ожирением имеют более высокую активность ядерного фактора транскрипции (NF-κB) и более высокую экспрессию РНК провоспалительных цитокинов, таких как фактор некроза опухоли-α (ФНО-α), интерлейкин-1 (ИЛ-1) и интерлейкин-6 (ИЛ-6), которые являются ключевыми в патогенезе метаболического синдрома [15]. Также провоспалительная роль ИЛ-6 часто описывается в патогенезе заболеваний легких, особенно при астме и у пациентов с острым респираторным дистресс-синдромом (ОРДС) [5][11]. Цитокиновый шторм, который встречается при многих респираторных вирусных инфекциях, включая COVID-19, проявляется активацией продукции интерферона, интерлейкинов, хемокинов, ФНО-α и колониестимулирующего фактора. ИЛ-10, продуцируемый макрофагами и T-лимфоцитами, имеет противовоспалительное действие, тогда как ИЛ-6 и его растворимый рецептор усиливают активность ИЛ-6 на клетках-мишенях, обеспечивая механизм для повышения активности ФНО-α и ИЛ-1-β, обладающих провоспалительным действием. Таким образом, баланс между про- и противовоспалительными механизмами имеет решающее значение для поддержания гомеостаза легочной ткани [16][17]. Возможно, если один или несколько из этих регуляторных элементов нарушены или отсутствуют, то это может способствовать цитокиновому шторму в легких или в других тканях, таких как жировая ткань, где существует аберрантная активация цитокинов (рис. 2) [13][18].

Рисунок 2. Ожирение и индуцированное вирусом гипервоспаление [13].
Примечание. В гипертрофированной жировой ткани повышаются активность иммунных клеток и секреция цитокинов, адипокинов, хемокинов, которые сами выделяют провоспалительные молекулы, включая ИЛ-6, ФНО-α, нейтрофилы, B1, B2, NK, врожденные лимфоидные клетки — это приводит к гипервоспалению и повышению риска развития «цитокинового шторма» [18].
Исследования динамики цитокинов на человеческих моделях «цитокинового шторма» показывают, что ИЛ-6 поддерживает активацию нескольких путей цитокинов в течение многих дней после первоначального иммунного ответа [19]. Интересно, что в ранних исследованиях COVID-19 ИЛ-6 был сильным независимым предиктором смертности.
Жировая ткань человека является основным источником ИЛ-6 и его рецептора ИЛ-6R и, таким образом, может обеспечивать резервуар для активации ИЛ-6 и каскадной передачи сигналов при вирусной инфекции [20]. Распространение вируса из пораженных органов в окружающую их жировую ткань может занять несколько дней с последующим длительным выделением вируса, что способствует отсроченному цитокиновому шторму и последующему повреждению тканей у пациентов с COVID-19 [21]. Таким образом, ключевая роль ИЛ-6 в опосредовании ответа острой фазы и его значение как прогностического биомаркера при сепсисе и различных острых повреждениях органов широко изучены в клинических и экспериментальных исследованиях. В соответствии с этим ингибирование ИЛ-6 было предложено в качестве лечения COVID-19, и ожидаются результаты испытаний тоцилизумаба [22].
У пациентов с ожирением может наблюдаться более значительное выделение вируса, что предполагает больший риск заражения вирусом других людей, особенно если несколько членов семьи имеют избыточный вес. Все эти наблюдения указывают на потенциально неблагоприятную взаимосвязь между вирусом и иммунным ответом организма при ожирении. Эндокринные и метаболические нарушения, в том числе нарушение чувствительности к инсулину и метаболизма липидов и жирных кислот, усиливают иммунологическую дисрегуляцию. Резидентные миелоидные и лимфоидные клетки многочисленны в жировой ткани, а ожирение связано с дисфункцией макрофагальной и лимфоцитарной систем [18]. Увеличение количества различных Т-лимфоцитов памяти в жировой ткани также может активировать аберрантные иммунные ответы с более широким повреждением ткани при заражении вирусом. SARS-CoV-2 индуцирует патологический иммунный ответ у пациентов с тяжелым течением COVID-19, характеризующимся снижением количества циркулирующих T-лимфоцитов памяти, а также снижением уровня T-хелперов. Исследователи предполагают, что дисфункция иммунного ответа у субъектов с ожирением усиливает этот эффект SARS-CoV-2 на функцию Т-клеток [16].
В литературе широко обсуждается также роль активации системы ренин-ангиотензина (РАС) в патогенезе осложнений COVID-19, поскольку попадание вируса в клетки может быть опосредовано ангиотензинпревращающим ферментом (АПФ2). АПФ2 экспрессируется в клетках эндотелия, гладкомышечных клетках, в ацинарных клетках поджелудочной железы и почечном канальцевом эпителии, в адипоцитах [20].
В жировой ткани мишенями для вирусов могут быть как сами адипоциты (H1N1, грипп типа A и аденовирус), так и стромальные клетки (Adenovirus 36, CMV), эндотелиальные клетки (SARS-CoV), макрофаги (грипп A, SARS-CoV, аденовирус 36, ВИЧ) и лимфоциты (SARS-CoV, ВИЧ). Хотя SARS-CoV-2 был обнаружен только в небольших количествах крови в исследовании на людях [23], нельзя исключить гематогенное распространение в жировой ткани, учитывая очень высокое сродство вируса к его рецептору на клетках-мишенях [21]. Альтернативные пути распространения SARS-CoV-2 в жировой ткани включают локальный выход вируса из инфицированных органов в окружающие жировые клетчаточные пространства в средостении, эпикарде, паранефрии, сальнике. Наконец, общий вирусный тропизм к эпителию легких и жировой ткани уже был показан при инфицировании вирусом H5N1 [24]. Продолжительность выделения вируса у инфицированных гриппом людей с ожирением значительно продлевается за счет висцеральной жировой ткани [24]. При сходном тропизме SARS-CoV-2 к жировой ткани пациентов с COVID-19, страдающих ожирением, существует вероятность длительной персистенции вируса в жировой ткани с расширенной активацией локальных «предварительно активированных» иммунных систем и локальных путей передачи цитокиновых сигналов.
Одним из патогенетических механизмов ожирения является инсулинорезистентность, что впоследствии может приводить к нарушению функции бета-клеток, развитию нарушений углеводного обмена, в том числе, к сахарному диабету, который ассоциирован с более тяжелым течением коронавирусной инфекции [25][26]. В целом комплексная регуляция метаболизма, необходимая для сложных клеточных взаимодействий и для эффективной защиты организма пациента, нарушается, что приводит к функциональному дефициту. Вирус COVID-19 может также непосредственно разрушать бета-клетки поджелудочной железы, проникая в них посредством взаимодействия с AПФ2 [25]. Наконец, COVID-19 часто ассоциируется с гипокалиемией; это было связано с подавлением легочной АПФ2, снижением деградации ангиотензина-II и последующим повышением секреции альдостерона. Гипокалиемия, в свою очередь, может ухудшить контроль гликемии у пациентов с сахарным диабетом 1 и 2 типа [27].
Так как большая часть исследований COVID-19 была сосредоточена на пожилых людях, стоит отметить, что у пожилых развивается саркопения, но при этом увеличивается относительное содержание жировой ткани в организме. Люди более старшего возраста, аналогично молодым людям с ожирением, имеют меньший кардиореспираторный резерв, чтобы справиться с инфекцией COVID-19. Известно, что у пожилых людей наблюдается возрастное снижение защитных функций иммунной системы [18], что также может влиять на динамику течения и исходы вирусной инфекции. Cтоит также отметить, что при морбидном ожирении (ИМТ>40 кг/м2) уход за пациентами, поступающими в отделения интенсивной терапии, часто затрудняется, так как таких пациентов труднее переворачивать, транспортировать, использовать визуализирующие методы исследования и, следовательно, лечить и реабилитировать [14].
Каковы же выводы этих новых наблюдений и задачи для будущих исследований в области связи ожирения и COVID-19? С целью прогнозирования необходимо выделять пациентов с повышением ИМТ, как наиболее подверженных риску тяжелых исходов.
Понимание взаимосвязи между ожирением и тяжелым течением COVID-19 может предполагать терапевтические вмешательства, чтобы потенциально снизить риск развития неблагоприятных исходов COVID-19. Данный вопрос становится особенно актуальным, учитывая получаемые данные европейских исследователей о прибавке массы тела и изменении пищевого поведения при проведении национальных карантинных мероприятий во время пандемии новой коронавирусной инфекции. Так, было проведено итальянское исследование «Пищевые привычки и изменения образа жизни во время пандемии COVID-19» (Eating Habits and Lifestyle Changes in COVID19 lockdown), в которое были включены 3533 человека в возрасте от 12 до 86 лет. 1214 (34,4%) респондентов отмечали усиление аппетита, 40,3% отмечали незначительную прибавку в массе тела, в то время как 8,3% отмечали значительную прибавку массы тела во время проведения национальных карантинных мероприятий [28].
Таким образом, в условиях текущей эпидобстановки и в связи с высокой вероятностью ежегодного эпидемиологического характера COVID-19 необходимы осознание взаимоотягощающего влияния ожирения и новой коронавирусной инфекции друг на друга и принятие мер, направленных на профилактику развития и прогрессирования хронических заболеваний и снижения иммунного ответа организма, связанных с наличием метаболических нарушений (рис. 3).

Рисунок 3. Взаимоотягощающее влияние COVID-19, ожирения и нарушений углеводного обмена.
Известно, что снижение массы тела обеспечивает достоверное уменьшение уровней ИЛ-1β, ИЛ-8, ИЛ-6 и ФНО-α в крови и уменьшение выраженности хронического воспаления в целом. В связи с этим можно предположить, что превентивное уменьшение веса у пациентов с ожирением будет способствовать снижению риска развития различных ассоциированных осложнений, в частности, отягощенного течения COVID-19.
ЛЕЧЕНИЕ ОЖИРЕНИЯ
Лечение этих пациентов должно базироваться на постановке реалистичных целей в отношении снижения массы тела без вреда для здоровья и дальнейшего удержания достигнутой массы тела. Следует проводить беседы с пациентами, что ожирение является хроническим заболеванием, поэтому важно избегать кратковременных «разгрузочных диет», но при этом сфокусироваться на формировании здорового пищевого поведения. Подход к лечению ожирения должен быть комплексным и включать изменение характера питания с обязательным ведением пищевого дневника, сокращение размеров порций, калорийности еды и напитков, отказ от приема пищи непосредственно перед сном, избегание эпизодов компульсивного переедания [29].
В дополнение к мероприятиям, направленным на изменение образа жизни, лечение ожирения может быть дополнено лекарственной терапией ожирения и сопутствующих заболеваний. Медикаментозная терапия показана пациентам с ИМТ>30 кг/м2 или с ИМТ>27 кг/м2 при наличии сопутствующих заболеваний. Есть больные, отвечающие и не отвечающие на лекарственную терапию. Критерием ответа на лечение является потеря веса на 5% у пациентов без диабета и >3% веса у больных диабетом после 3-месячного курса. В противном случае препарат следует отменить. Эти препараты противопоказаны детям, беременным и кормящим женщинами. При неэффективности консервативной терапии, ИМТ более 40 кг/м2 или более 35 кг/м2 и наличии ассоциированных с ожирением заболеваний возможно рассмотреть вопрос о проведении бариатрических хирургических вмешательств [30].
Выбор лекарственных средств для снижения веса как в нашей стране, так и за рубежом ограничен. В странах Евросоюза одобрены 3 препарата: лираглутид 3 мг, орлистат, налтрексон/бупропион. В США разрешены для применения 5 препаратов: орлистат, лираглутид 3 мг, налтрексон/бупропион, лоркасерин, фентермин/топирамат [29]. Для клинического применения в Российской Федерации одобрены: орлистат, лираглутид 3 мг и сибутрамин, в т.ч. в форме фиксированной комбинации с метформином [30].
Лираглутид является аналогом глюкагоноподобного пептида 1. Это инкретин (кишечный гормон), который выделяется в подвздошной кишке в ответ на прием пищи. Оказывает стимулирующее влияние на центры насыщения и подавляющее влияние на центры аппетита в гипоталамической области, снижает моторику желудка, что также ускоряет наступление насыщения. Стимулирует глюкозозависимую секрецию инсулина. Препарат инъекционный, и продолжительность его действия составляет около 24 ч. Используется для лечения диабета 2 типа в дозе 0,6–1,8 мг/сут. Для лечения ожирения в Российской Федерации зарегистрирована дозировка 3 мг/сут. Лираглутид 3,0 мг может рассматриваться как предпочтительный вариант для пациентов с ожирением и наличием сопутствующих ССЗ в связи с доказанным снижением сердечно-сосудистых рисков. Наиболее частым нежелательным явлением (НЯ) при назначении лираглутида является тошнота (до 15%). Использование препаратов группы лираглутида также связано с риском развития панкреатита. При подозрении на панкреатит прием лираглутида необходимо немедленно отменить. Пациенты, которые получают лираглутид, должны быть проинформированы о риске обезвоживания в связи с нежелательными побочными реакциями со стороны ЖКТ и о необходимости соблюдения мер предосторожности, чтобы избежать гиповолемии [30][31].
Орлистат является мощным и селективным ингибитором липазы поджелудочной железы, уменьшая всасывание жира в кишечнике. Препарат существует в дозировках 60 мг/день и 120 мг/сут. Обе дозировки даются перед каждым приемом пищи, содержащей жиры, вызывая умеренную потерю массы тела, большую, чем при сравнении с плацебо. Основным побочным эффектом является стеаторея, так как невсосавшиеся в кишечнике жиры выводятся с калом. Последнее обстоятельство может привести к дефициту жирорастворимых витаминов, поэтому может быть целесообразным назначение вместе с орлистатом поливитаминов [29].
Сибутрамин представляет собой ингибитор обратного захвата нейромедиаторов: серотонина (53%), норадреналина (54%) и дофамина (16%), вследствие чего возрастает концентрация этих медиаторов в синаптическом пространстве. Вследствие такого двойного механизма действия препарат оказывает влияние на обе стороны энергетического баланса, т.е., усиливая и пролонгируя чувство насыщения, уменьшает поступление энергии за счет снижения количества потребляемой пищи и увеличивает ее расход вследствие усиления термогенеза [32]. Стоит отметить, что сибутрамин является единственным из представленных в РФ лекарственных средств для лечения ожирения, влияющих на термогенез. Усиление термогенеза на фоне применения сибутрамина устраняет характерное при снижении массы тела замедление скорости основного обмена, что вносит дополнительный вклад в достижение отрицательного энергобаланса. Активация бурой жировой ткани способствует окислению липидов, повышению утилизации глюкозы, а связанное с этим снижение веса повышает возможности восстановления метаболического здоровья. Снижение массы тела сопровождается увеличением концентрации в сыворотке крови липопротеинов высокой плотности и снижением количества триглицеридов, общего холестерина, липопротеинов низкой плотности, мочевой кислоты, глюкозы и гликированного гемоглобина (у пациентов с СД2) [33].
В качестве начальной дозы сибутрамин назначают по 10 мг утром 1 р/сут, независимо от приема пищи. При снижении массы тела за 1-й месяц лечения менее чем на 2 кг следует увеличить дозу до 15 мг при условии приемлемой переносимости. Предиктором успешного снижения и долговременного удержания массы тела является потеря более 2 кг за 1-й месяц лечения или более 5% исходной массы за 3 мес. Препарат противопоказан больным с неконтролируемой АГ, ИБС, декомпенсированной хронической сердечной недостаточностью, аритмиями, цереброваскулярными заболеваниями (транзиторными нарушениями мозгового кровообращения, инсультом), при тяжелых поражениях печени и почек, которые часто встречаются при морбидном ожирении, в случае одновременного приема или спустя менее 2 нед после отмены ингибиторов моноаминоксидазы или других препаратов, действующих на ЦНС. Нежелательные побочные явления, а именно запор, сухость во рту, бессонница, головная боль, потливость, имеют преходящий характер, чаще проявляются в 1-й месяц лечения, слабо выражены и обычно не требуют отмены лечения. Следует отметить, что подобные побочные проявления в целом характерны для большинства препаратов центрального действия, используемых при лечении ожирения в мировой практике.
Терапия ожирения сибутрамином требует обязательного врачебного контроля. Оценка АД и пульса необходима у всех больных до начала лечения, далее с 1-го по 3-й месяц лечения — каждые 2 нед, с 4-го по 6-й месяц — ежемесячно, с 6-го по 12-й месяц — каждые 3 мес. Препарат отменяют при повторяющихся на двух визитах подряд учащении пульса более чем на 10 в минуту, повышении АД более чем на 10 мм рт. ст., а также в случае, если оно превышает 140/90 мм рт. ст. при ранее компенсированной АГ, если прогрессируют одышка, боли в груди или отеки суставов [30].
Исследование SCOUT (Sibutramine Cardiovascular OUTcomes) было первым проспективным исследованием, целью которого являлась оценка исходов снижения веса на фоне изменения образа жизни и фармакотерапии сибутрамином у пациентов с избыточным весом и ожирением с уже существующими ССЗ [34]. Было зафиксировано повышение риска первичных сердечно-сосудистых событий на 16% в группе сибутрамина, а число всех случаев составило 11,4% в группе сибутрамина по сравнению с 10,0% в группе плацебо; в том числе риск развития несмертельного инфаркта миокарда и несмертельного инсульта были 4,1% и 2,6% в группе сибутрамина и 3,2% и 1,9% в группе плацебо. При этом риск смерти от сердечно-сосудистых событий или смерти от всех причин был сравним с группой плацебо [34]. Стоит отметить, что в этом исследовании все пациенты имели в анамнезе ССЗ, такие как ИБС, инсульт или облитерирующее поражение периферических сосудов и/или СД 2-го типа с наличием хотя бы одного дополнительного кардиоваскулярного фактора риска (гипертензия, дислипидемия, курение или диабетическая нефропатия). Прием препарата продолжался 3,4 года вне зависимости от ответа на терапию. В связи с полученными данными в 2010 г. по рекомендации американских и европейских органов по надзору за лекарственными препаратами (FDA, EMA) была полностью прекращена продажа препарата в странах Евросоюза, в США препарат был ограничен применением у пациентов с ССЗ.
Отсутствие иных эффективных препаратов для лечения ожирения привело к дальнейшим международным исследованиям препарата, а также пересмотру исследования SCOUT — была продемонстрирована безопасность применения сибутрамина у пациентов с ССЗ в течение короткого периода лечения (до 6 мес) [35][36], а также безопасность его долгосрочного [37] применения у пациентов, не имеющих в анамнезе ССЗ.
В России после анализа результатов исследования SCOUT была организована система мониторинга безопасности применения сибутрамина (а именно комбинированного препарата сибутрамин+МКЦ) в рутинной клинической практике, реализованная в рамках крупномасштабных наблюдательных программ: «Весна», «Примавера», «Аврора», включавших 139 305 пациентов [38–40]. В ходе этих исследований было показано, что на фоне предложенной терапии в течение 6–12 мес снижение веса достигало 15,0±6,22–20,0±8,62 кг соответственно, а уменьшение окружности талии за этот период составляло 10,6±6,30–16,0±8,94 см. Значимое снижение веса на 5% и более за 3 мес терапии было отмечено более чем у 92,4% пациентов, причем более половины пациентов в течение года снизили вес на 10–20%. Нежелательные явления не превышали 5%, в большинстве случаев были обратимыми и не требовали отмены препарата. Показано, что снижение массы тела при длительной терапии редуксином сопровождалось снижением уровня АД и не приводило к увеличению ЧСС, что доказывает, что прием сибутрамина под контролем врача у пациентов без противопоказаний не сопровождается риском серьезных НЯ.
Особенностью терапии сибутраминсодержащими препаратами является положительное влияние на пищевое поведение, что способствует сохранению достигнутых результатов снижения веса. Так, показано, что через 8 мес после отмены терапии сибутрамином 79% пациентов смогли сохранить сниженную массу тела. Сибутрамин и его метаболиты не влияют на высвобождение моноаминов, не ингибируют моноаминоксидазу, не обладают сродством к большому числу нейромедиаторных рецепторов, поэтому не способствуют развитию привыкания, лекарственной зависимости и синдрома отмены, а следовательно, сибутрамин не снижает своей терапевтической эффективности на протяжении всего курса лечения [41].
При лечении ожирения зачастую для компенсации метаболических нарушений необходимо дополнительное патогенетическое воздействие, направленное на снижение инсулинорезистентности, гиперинсулинемии и липо- и глюкозотоксичности. С патогенетической точки зрения препаратом первого выбора для лечения подобных состояний является метформин [42]. Основными свойствами препарата являются способность влиять на инсулинорезистентность, глюконеогенез, уменьшать повышенную продукцию глюкозы печенью, тормозить всасывание глюкозы в тонком кишечнике [43]. Метформин не оказывает непосредственного влияния на секрецию инсулина, чем и обусловлено отсутствие гипогликемических эпизодов при его назначении. В результате терапии метформином улучшается чувствительность рецепторов к инсулину, уменьшается гиперинсулинемия, понижается аппетит, что также способствует снижению массы тела. В контексте рассматриваемой проблемы взаимосвязи ожирения и осложненного течения COVID-19 стоит отметить наблюдаемое на фоне терапии метформином улучшение функции гемостаза, снижение воспаления и оксидативного стресса [44]. Более того, известно, что метформин повышает экспрессию АПФ-2 посредством активации АМФК, что с учетом известной на данный момент патофизиологии SARS-Cov-2 может рассматриваться как протективный эффект [45]. Ряд исследований показал протективный эффект метформина и в отношении легочной ткани. Так, в экспериментальных работах метформин снижал выраженность поражения легких при гипероксии или ИВЛ-ассоциированном поражении [46–48]. В ретроспективном исследовании Jo et al. наблюдался меньший процент смертельных исходов, связанных с ОРДС, у пациентов, ранее принимавших метформин (42,4% vs 55,3% соответственно) [49]. Схожие результаты были получены в рамках обсервационного исследования в Китае, где наблюдалась более низкая летальность у пациентов с COVID-19, получавших метформин для лечения диабета, по сравнению с пациентами, получавшими другую терапию [50].
Можно заключить, что назначение метформина клинически оправдано как для метаболического здоровья, так и в связи с широким спектром протективных эффектов, но минимальная динамика снижения веса на его фоне (1–5 кг в год) не позволяет использовать препарат в качестве монотерапии для лечения ожирения [51]. Метформин может быть рекомендован в качестве комбинированной терапии с другими препаратами, зарегистрированными для снижения массы тела, с нашей точки зрения, оптимально — вместе с препаратом центрального действия.
В исследовании А.С. Аметова и соавт. (2020) с использованием комбинированного препарата Редуксин®Форте была подтверждена клиническая обоснованность совместного применения сибутрамина и метформина [52]. Клинически значимого снижения веса на 5% и более за 6 мес терапии достигли 94% пациентов, при этом 91% пациентов удалось снизить вес на 10% и более. Снижение веса сопровождалось уменьшением окружности талии, атерогенных фракций крови, а также снижением уровня свободных жирных кислот, что говорит о снижении выраженности липотоксичности и оксидативного стресса. Более того, у пациентов с ранними нарушениями углеводного обмена наблюдалось достоверное снижение глюкозы крови натощак, постпрандиальной глюкозы крови и уровня гликированного гемоглобина на 12,9, 16 и 7,5% соответственно. При этом достижение нормальных значений параметров гликемии наблюдалось у 93,2% пациентов. На фоне лечения препаратом Редуксин®Форте, по данным показателей суточного мониторирования артериального давления, достоверно увеличилось число «dippers» до 86,3%. В целом по популяции наблюдения отмечалось некоторое снижение систолического и диастолического артериального давления и отсутствовали значимые изменения показателей ЧСС. Полученные результаты свидетельствовали о хорошей переносимости пациентами принимаемого препарата. Серьезных нежелательных побочных явлений зарегистрировано не было. Побочные эффекты встречались редко: преобладали сухость во рту (9%) и потливость (8%), также имели место бессонница (7%), головные боли (4%) и тошнота (3%). Все побочные эффекты носили временный характер и не требовали прекращения лечения [52].
Таким образом, за счет разнонаправленного действия метформина и сибутрамина и широкого спектра плейотропных эффектов применение данной комбинации позволяет не только повысить эффективность снижения массы тела. Это говорит о целесообразности применения данной комбинации у пациентов с ожирением для уменьшения уязвимости и повышения резистентных возможностей организма, что особенно актуально в период высокого риска инфицирования SARS-Cov-2.
Учитывая вышесказанное, представляется интересным проведение ретроспективных исследований, посвященных оценке тяжести течения COVID-19 у пациентов, ранее принимавших сибутрамин и метформин для лечения ожирения.
ЗАКЛЮЧЕНИЕ
Людей во всем мире следует поощрять менять их образ жизни, чтобы уменьшить риск как на текущей, так и на последующих волнах COVID-19, которые можно ожидать, по прогнозам исследователей. В дополнение к повышению уровня физической активности необходимо распространять информацию о правильном рациональном питании, сосредоточившись на более простых советах, чтобы помочь людям принять устойчивые изменения. Это особенно сложно с текущими правилами пребывания дома, ограничивающими уровни активности, так как самоизоляция ведет к набору массы тела. Еще большее беспокойство вызывает то, что экономический спад может усугубить ожирение, особенно в наиболее уязвимых слоях, — проблему, с которой придется столкнуться при выходе из нынешней пандемии. Действительно, эта пандемия подчеркнула, что необходимо направлять большие усилия на борьбу с ожирением во всем мире и предотвращать ассоциированные с ним хронические заболевания, усиливающие негативные последствия пандемии. В арсенале врачей Российской Федерации есть препараты, позволяющие воздействовать на наиболее уязвимые патогенетические триггеры развития ожирения и сопутствующей патологии: процессы голода и насыщения, снижение чувствительности к инсулину, развитие липотоксичности и хронического воспаления.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Обзор подготовлен при поддержке компании «Промомед».
Конфликт интересов. Спонсор не оказывал влияния на выбор исследований, анализ и интерпретацию данных.
Вклад авторов: Демидова Т.Ю. — обзор публикаций по теме статьи, проверка критически важного содержания, редактирование текста, утверждение рукописи для публикации; Волкова Е.И. — обзор публикаций по теме статьи, написание текста рукописи; Грицкевич Е.Ю. — обзор публикаций по теме статьи, участие в написании статьи, редактирование текста. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Yumuk V, Tsigos C, Fried M, et al. European Guidelines for Obesity Management in Adults. Nerurkar P V., ed. Obes Facts. 2015;8(6):402-424. doi: https://doi.org/10.1159/000442721
2. WHO. Obesity and overweight. Available from: https://www.who.int/ru/news-room/fact-sheets/detail/obesity-and-overweight
3. Муромцева Г.А., Концевая А.В., Константинов В.В. Распространенность факторов риска неинфекционных заболеваний в Российской популяции в 2012-2013 гг. Результаты исследования ЭССЕ-РФ // Кардиоваскулярная терапия и профилактика. — 2014. — Т. 13. — №6. — С. 4-11. doi: https://doi.org/10.15829/1728-8800-2014-6-4-11
4. Wu Z, McGoogan JM. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China. JAMA. 2020;323(13):1239. doi: https://doi.org/10.1001/jama.2020.2648
5. Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395(10229):1054-1062. doi: https://doi.org/10.1016/S0140-6736(20)30566-3
6. Ortega FB, Lavie CJ, Blair SN. Obesity and Cardiovascular Disease. Circ Res. 2016;118(11):1752-1770. doi: https://doi.org/10.1161/CIRCRESAHA.115.306883
7. Dzau VJ, Antman EM, Black HR, et al. The Cardiovascular Disease Continuum Validated: Clinical Evidence of Improved Patient Outcomes. Circulation. 2006;114(25):2850-2870. doi: https://doi.org/10.1161/CIRCULATIONAHA.106.655688
8. Petrilli CM, Jones SA, Yang J, et al. Factors associated with hospitalization and critical illness among 4,103 patients with Covid-19 disease in New York City. medRxiv. January 2020:2020.04.08.20057794. doi: https://doi.org/10.1101/2020.04.08.20057794
9. Garg S, Kim L, Whitaker M, et al. Hospitalization Rates and Characteristics of Patients Hospitalized with LaboratoryConfirmed Coronavirus Disease 2019 — COVID-NET, 14 States, March 1–30, 2020. MMWR Morb Mortal Wkly Rep. 2020;69:458-464. doi: https://dx.doi.org/10.15585/mmwr.mm6915e3
10. Deng S-Q, Peng H-J. Characteristics of and Public Health Responses to the Coronavirus Disease 2019 Outbreak in China. J Clin Med. 2020;9(2):575. doi: https://doi.org/10.3390/jcm9020575
11. Simonnet A, Chetboun M, Poissy J, et al. High Prevalence of Obesity in Severe Acute Respiratory Syndrome Coronavirus‐2 (SARS‐CoV‐2) Requiring Invasive Mechanical Ventilation. Obesity. 2020;28(7):1195-1199. doi: https://doi.org/10.1002/oby.22831
12. Samad F, Ruf W. Inflammation, obesity, and thrombosis. Blood. 2013;122(20):3415-3422. doi: https://doi.org/10.1182/blood-2013-05-427708
13. Maffetone PB, Laursen PB. The Perfect Storm: Coronavirus (Covid-19) Pandemic Meets Overfat Pandemic. Front Public Heal. 2020;8(20):3415-3422. doi: https://doi.org/10.3389/fpubh.2020.00135
14. Sattar N, McInnes IB, McMurray JJV. Obesity Is a Risk Factor for Severe COVID-19 Infection. Circulation. 2020;142(1):4-6. doi: https://doi.org/10.1161/CIRCULATIONAHA.120.047659
15. Mraz M, Haluzik M. The role of adipose tissue immune cells in obesity and low-grade inflammation. J Endocrinol. 2014;222(3):R113-R127. doi: https://doi.org/10.1530/JOE-14-0283
16. Qin C, Zhou L, Hu Z, et al. Dysregulation of Immune Response in Patients With Coronavirus 2019 (COVID-19) in Wuhan, China. Clin Infect Dis. 2020;71(15):762-768. doi: https://doi.org/10.1093/cid/ciaa248
17. Kern L, Mittenbühler M, Vesting A, et al. Obesity-Induced TNFα and IL-6 Signaling: The Missing Link between Obesity and Inflammation — Driven Liver and Colorectal Cancers. Cancers (Basel). 2018;11(1):24. doi: https://doi.org/10.3390/cancers11010024
18. Trim W, Turner JE, Thompson D. Parallels in Immunometabolic Adipose Tissue Dysfunction with Ageing and Obesity. Front Immunol. 2018;9(1):24. doi: https://doi.org/10.3389/fimmu.2018.00169
19. Yiu HH, Graham AL, Stengel RF. Dynamics of a Cytokine Storm. Dehmer M, ed. PLoS One. 2012;7(10):e45027. doi: https://doi.org/10.1371/journal.pone.0045027
20. de Lucena TMC, da Silva Santos AF, de Lima BR, et al. Mechanism of inflammatory response in associated comorbidities in COVID-19. Dehmer M, ed. Diabetes Metab Syndr Clin Res Rev. 2020;14(4):597-600. doi: https://doi.org/10.1016/j.dsx.2020.05.025
21. Ryan PM, Caplice NM. Is Adipose Tissue a Reservoir for Viral Spread, Immune Activation, and Cytokine Amplification in Coronavirus Disease 2019? Obesity. 2020;28(7):1191-1194. doi: https://doi.org/10.1002/oby.22843
22. Chinese Clinical Trial Registry. Registration number: ChiCTR2000029765 — A multicenter, randomized controlled trial for the efficacy and safety of tocilizumab in the treatment of new coronavirus pneumonia (COVID-19). 2020 [cited 2020 06/04/2020]. Available from: http://www.chictr.org.cn/showproj.aspx?proj=49409
23. Wang W, Xu Y, Gao R, et al. Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA. 2020;28(7):1191-1194. doi: https://doi.org/10.1001/jama.2020.3786
24. Nishimura H, Itamura S, Iwasaki T, et al. Characterization of human influenza A (H5N1) virus infection in mice: neuro-, pneumoand adipotropic infection. J Gen Virol. 2000;81(10):2503-2510. doi: https://doi.org/10.1099/0022-1317-81-10-2503
25. Drucker DJ. Coronavirus Infections and Type 2 Diabetes— Shared Pathways with Therapeutic Implications. Endocr Rev. 2020;41(3):457-470. doi: https://doi.org/10.1210/endrev/bnaa011
26. Stefan N, Birkenfeld AL, Schulze MB, Ludwig DS. Obesity and impaired metabolic health in patients with COVID-19. Nat Rev Endocrinol. 2020;16(7):341-342. doi: https://doi.org/10.1038/s41574-020-0364-6
27. Pal R, Bhadada SK. COVID-19 and diabetes mellitus: An unholy interaction of two pandemics. Dehmer M, ed. Diabetes Metab Syndr Clin Res Rev. 2020;14(4):513-517. doi: https://doi.org/10.1016/j.dsx.2020.04.049
28. Di Renzo L, Gualtieri P, Pivari F, et al. Eating habits and lifestyle changes during COVID-19 lockdown: an Italian survey. Dehmer M, ed. J Transl Med. 2020;18(1):229. doi: https://doi.org/10.1186/s12967-020-02399-5
29. Yumuk V, Tsigos C, Fried M, et al. European Guidelines for Obesity Management in Adults. Dehmer M, ed. Obes Facts. 2015;8(6):402-424. doi: https://doi.org/10.1159/000442721
30. Дедов И.И., Мельниченко Г.А., Шестакова М.В., и др. Национальные клинические рекомендации по лечению морбидного ожирения у взрослых. 3-й пересмотр (лечение морбидного ожирения у взрослых) // Ожирение и метаболизм. — 2018. — Т. 15. — №1. — С. 53-70. doi: https://doi.org/10.14341/omet2018153-70
31. Wilding JPH, Overgaard RV, Jacobsen LV, et al. Exposure-response analyses of liraglutide 3.0 mg for weight management. Diabetes, Obes Metab. 2016;18(5):491-499. doi: https://doi.org/10.1111/dom.12639
32. Дедов И.И., Трошина Е.А., Мазурина Н.В., и др. Роль нейротрансмиттеров в регуляции энергетического гомеостаза и возможности медикаментозной коррекции его нарушений при ожирении // Ожирение и метаболизм. — 2016. — Т. 13. — №1. — С. 9-15. doi: https://doi.org/10.14341/omet201619-15
33. Романцова Т.И. Сибутрамин: эффективность и безопасность применения в рутинной клинической практике. Ожирение и метаболизм. 2015;12(3):18-24. doi: https://doi.org/10.14341/omet2015318-24
34. James WPT, Caterson ID, Coutinho W, et al. Effect of Sibutramine on Cardiovascular Outcomes in Overweight and Obese Subjects. N Engl J Med. 2010;363(10):905-917. doi: https://doi.org/10.1056/NEJMoa1003114
35. Seimon R V, Espinoza D, Ivers L, et al. Changes in body weight and blood pressure: paradoxical outcome events in overweight and obese subjects with cardiovascular disease. Int J Obes. 2014;38(9):1165-1171. doi: https://doi.org/10.1038/ijo.2014.2
36. Caterson ID, Finer N, Coutinho W, et al. Maintained intentional weight loss reduces cardiovascular outcomes: results from the Sibutramine Cardiovascular OUTcomes (SCOUT) trial. Diabetes, Obes Metab. 2012;14(6):523-530. doi: https://doi.org/10.1111/j.1463-1326.2011.01554.x
37. Hayes JF, Bhaskaran K, Batterham R, et al. The effect of sibutramine prescribing in routine clinical practice on cardiovascular outcomes: a cohort study in the United Kingdom. Int J Obes. 2015;39(9):1359-1364. doi: https://doi.org/10.1038/ijo.2015.86
38. Аметов А.С. Отчет о программе ВЕСНА. Эффективное лечение ожирения — путь борьбы с эпидемией DIABETUS MELLITUS // Эндокринология: Новости. Мнения. Обучение. — 2013. — №2. — С. 12-16.
39. Дедов И.И., Мельниченко Г.А., Романцова Т.И. Стратегия управления ожирением: итоги Всероссийской наблюдательной программы «ПримаВера» // Ожирение и метаболизм. — 2016. — Т. 13. — №1. — C. 36-44. doi: https://doi.org/10.14341/omet2016136-44
40. Дедов И.И., Романцова Т.И., Шестакова М.В. Рациональный поход к терапии пациентов с СД2 и ожирением: Итоги Всероссийской наблюдательной программы «АВРОРА» // Ожирение и метаболизм. — 2018. — Т. 15. — №4. — C. 48-58. doi: https://doi.org/10.14341/omet10076
41. Демидова Т.Ю., Кишкович Ю.С. Предиабет: современное состояние проблемы и возможности коррекции // РМЖ. Медицинское обозрение. — 2019. — Т. 10. — №2. — C. 60-67.
42. Shen X, Fan B, Hu X, et al. Metformin Reduces LipotoxicityInduced Meta-Inflammation in β -Cells through the Activation of GPR40-PLC-IP3 Pathway. J Diabetes Res. 2019;2019(4):1-16. doi: https://doi.org/10.1155/2019/7602427
43. Hundal RS, Krssak M, Dufour S, et al. Mechanism by which metformin reduces glucose production in type 2 diabetes. Diabetes. 2000;49(12):2063-2069. doi: https://doi.org/10.2337/diabetes.49.12.2063
44. Zilov AV, Abdelaziz SI, AlShammary A, et al. Mechanisms of action of metformin with special reference to cardiovascular protection. Diabetes Metab Res Rev. 2019;35(7):2063-2069. doi: https://doi.org/10.1002/dmrr.3173
45. Malhotra A, Hepokoski M, McCowen KC, Y-J Shyy J. ACE2, Metformin, and COVID-19. iScience. 2020;23(9):101425. doi: https://doi.org/10.1016/j.isci.2020.101425
46. Jian M-Y, Alexeyev MF, Wolkowicz PE, et al. Metforminstimulated AMPK-α1 promotes microvascular repair in acute lung injury. Am J Physiol Cell Mol Physiol. 2013;305(11):L844-L855. doi: https://doi.org/10.1152/ajplung.00173.2013
47. Shang F, Zhang J, Li Z, et al. Cardiovascular Protective Effect of Metformin and Telmisartan: Reduction of PARP1 Activity via the AMPK-PARP1 Cascade. Huang Y, ed. PLoS One. 2016;11(3):e0151845. doi: https://doi.org/10.1371/journal.pone.0151845
48. Tsaknis G, Siempos II, Kopterides P, et al. Metformin attenuates ventilator-induced lung injury. Crit Care. 2012;16(4):R134. doi: https://doi.org/10.1186/cc11439
49. Jo YS, Choi SM, Lee J, et al. Effect of Preadmission Metformin Use on Clinical Outcome of Acute Respiratory Distress Syndrome among Critically Ill Patients with Diabetes. Tuberc Respir Dis (Seoul). 2017;80(3):296. doi: https://doi.org/10.4046/trd.2017.80.3.296
50. Luo P, Qiu L, Liu Y, et al. Metformin Treatment Was Associated with Decreased Mortality in COVID-19 Patients with Diabetes in a Retrospective Analysis. Am J Trop Med Hyg. 2020;103(1):69-72. doi: https://doi.org/10.4269/ajtmh.20-0375
51. Malin SK, Kashyap SR. Effects of metformin on weight loss. Curr Opin Endocrinol Diabetes Obes. 2014;21(5):323-329. doi: https://doi.org/10.1097/MED.0000000000000095
52. Аметов А.С., Пьяных О.П., Невольникова А.О. Современные возможности управления метаболическим здоровьем у пациентов с ожирением и нарушениями углеводного обмена // Эндокринология: новости, мнения, обучение. — 2020. — Т. 9. — №1. — C. 17-26. doi: https://doi.org/10.33029/2304-9529-2020-9-1-17-26
Об авторах
Т. Ю. ДемидоваРоссия
Демидова Татьяна Юльевна, доктор медицинских наук, профессор
Москва
eLibrary SPIN: 9600-9796
Конфликт интересов:
Демидова Т.Ю. — лектор, участник экспертных советов, клинических исследований компаний Astra Zeneca, Novo Nordisk, Sanofi, Novartis, Boehringer Ingelheim, Takeda, Berlin Chemi.
Е. И. Волкова
Волкова Екатерина Игоревна, ординатор
Москва
Е. Ю. Грицкевич
Грицкевич Елена Юрьевна
109263, Москва, ул. Шкулева, д. 4, кор. 1
eLibrary SPIN: 4125-2055
Дополнительные файлы
|
|
1. Рисунок 1. Рисунок 1. Отклонение количества жировой ткани от нормы повышает риск инфицирования и осложнений на фоне COVID-19 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(327KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Ожирение и индуцированное вирусом гипервоспаление. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(344KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Взаимоотягощающее влияние COVID-19, ожирения и нарушений углеводного обмена. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(406KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Демидова Т.Ю., Волкова Е.И., Грицкевич Е.Ю. Особенности течения и последствия COVID-19 у пациентов с избыточным весом и ожирением. Уроки текущей пандемии. Ожирение и метаболизм. 2020;17(4):375-384. https://doi.org/10.14341/omet12663
For citation:
Demidova T.Yu., Volkova E.I., Gritskevich E.Yu. Peculiarities of the COVID-19 course and consequences in overweight and obese patients. Lessons from the current pandemic. Obesity and metabolism. 2020;17(4):375-384. (In Russ.) https://doi.org/10.14341/omet12663

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































