Перейти к:
Церамиды: фокус на ожирение
https://doi.org/10.14341/omet12565
Аннотация
Общеизвестно, что ожирение повышает риск развития сердечно-сосудистых заболеваний. Патологическое увеличение массы жировой ткани приводит к нарушению контроля накопления липидов на молекулярном уровне, аномальному метаболизму липидов с образованием метаболитов, являющихся критическими для развития данных патологий на фоне ожирения. Одними из таких метаболитов являются церамиды. Церамиды выполняют множество физиологических функций, однако в патологических условиях индуцируют инсулинорезистентность, разобщают клеточное дыхание и фосфорилирование, активируют апоптоз клеток и играют важную роль в индукции дисфункции жировой ткани. Изменение биосинтеза церамидов посредством дисрегуляции ключевых ферментов приводит к образованию и накоплению церамидов, которые блокируют передачу сигналов инсулина и индуцируют воспаление жировой ткани.
В этом обзоре освещены метаболизм церамидов, причины их эктопического отложения в тканях при ожирении, а также потенциальные внутриклеточные сигнальные пути, модулирующие активность церамидов.
Для цитирования:
Дылева Ю.А., Груздева О.В., Белик Е.В. Церамиды: фокус на ожирение. Ожирение и метаболизм. 2020;17(3):307-315. https://doi.org/10.14341/omet12565
For citation:
Dyleva Yu.A., Gruzdeva O.V., Belik E.V. Ceramides: focus on obesity. Obesity and metabolism. 2020;17(3):307-315. (In Russ.) https://doi.org/10.14341/omet12565
ОБОСНОВАНИЕ
Церамиды – биологически активные липиды, члены семейства сфинголипидов, состоящие из длинноцепочечного сфингозинового основания (сфингозин, фитосфингозин, дигидросфингозин и 6-гидроксисфингозин) и амид-связанной жирной кислоты. Церамиды входят в состав клеточных мембран; играют важную роль в клетке в качестве сигнальной молекулы; участвуют в клеточной дифференцировке, пролиферации и апоптозе [1]. В тоже время, абберантное накопление церамидов в клетках является критическим по отношению к гомеостазу, как на клеточном уровне, так и для организма в целом. В результате инициируется множество патологических процессов, активно вовлеченных в патогенез ожирения. Хорошо известно, что в физиологических условиях адипоциты обладают способностью накапливать энергию в форме триглицеридов. Уникальные особенности этих клеток позволяют им служить центром энергетического баланса организма. Помимо хранения энергии, адипоциты активно вовлекаются в регуляцию этого процесса, поскольку секретируют множество биологически активных молекул – адипокинов, обладающих регуляторной активностью [2].
Нарушения в системе энергообмена жировой ткани и неспособность адипоцитов депонировать питательные вещества, приводит к эктопическому накоплению метаболитов липидного обмена – длинноцепочечного ацил-КоА, ацилкарнитина, диацилглицерина и церамидов в периферических тканях (в том числе в сердце и сосудистой сети), инициирующих множество патологических процессов, лежащих в основе сердечно-сосудистых заболеваний и сахарного диабета [3].
ПОИСК И КРИТЕРИИ ОТБОРА ЛИТЕРАТУРНЫХ ИСТОЧНИКОВ
Поиск источников литературы по теме литературного обзора осуществлен в базах данных Medline (https://pubmed.ncbi.nlm.nih.gov/), в полнотекстовой базе журналов издательства Wiley на платформе Wiley Online Library (https://onlinelibrary.wiley.com/) и издательства Elsevier (https://www.sciencedirect.com/), научной электронной библиотеке (elibrary.ru). В рассмотрение включались следующие обзорные и исследовательские статьи: обзорные статьи, метаанализы, рандомизированные и нерандомизированные контролируемые экспериментальные и клинические исследования. Ключевыми словами на русском языке в поиске являлись: ожирение, ожирение, церамиды, синтез церамидов, адипокины в адипоцитах, церамиды в адипоцитах, церамиды в жировой ткани. Ключевыми словами на английском языке: obesity, ceramides, synthesis of ceramides, de novo synthesis of ceramides, insulin resistance, apoptosis, adipokines, adiponectin, fibroblast growth factor. Для повышения специфичности и ограничения чувствительности поиска использовался оператор «AND». Поиск также проводился по спискам литературы анализируемых статей.
СИНТЕЗ ЦЕРАМИДОВ
Хорошо охарактеризованы 3 пути синтеза церамидов (рис. 1): сфингомиелиназный путь, путь рециклинга/«спасения» и путь de novo [4][5].
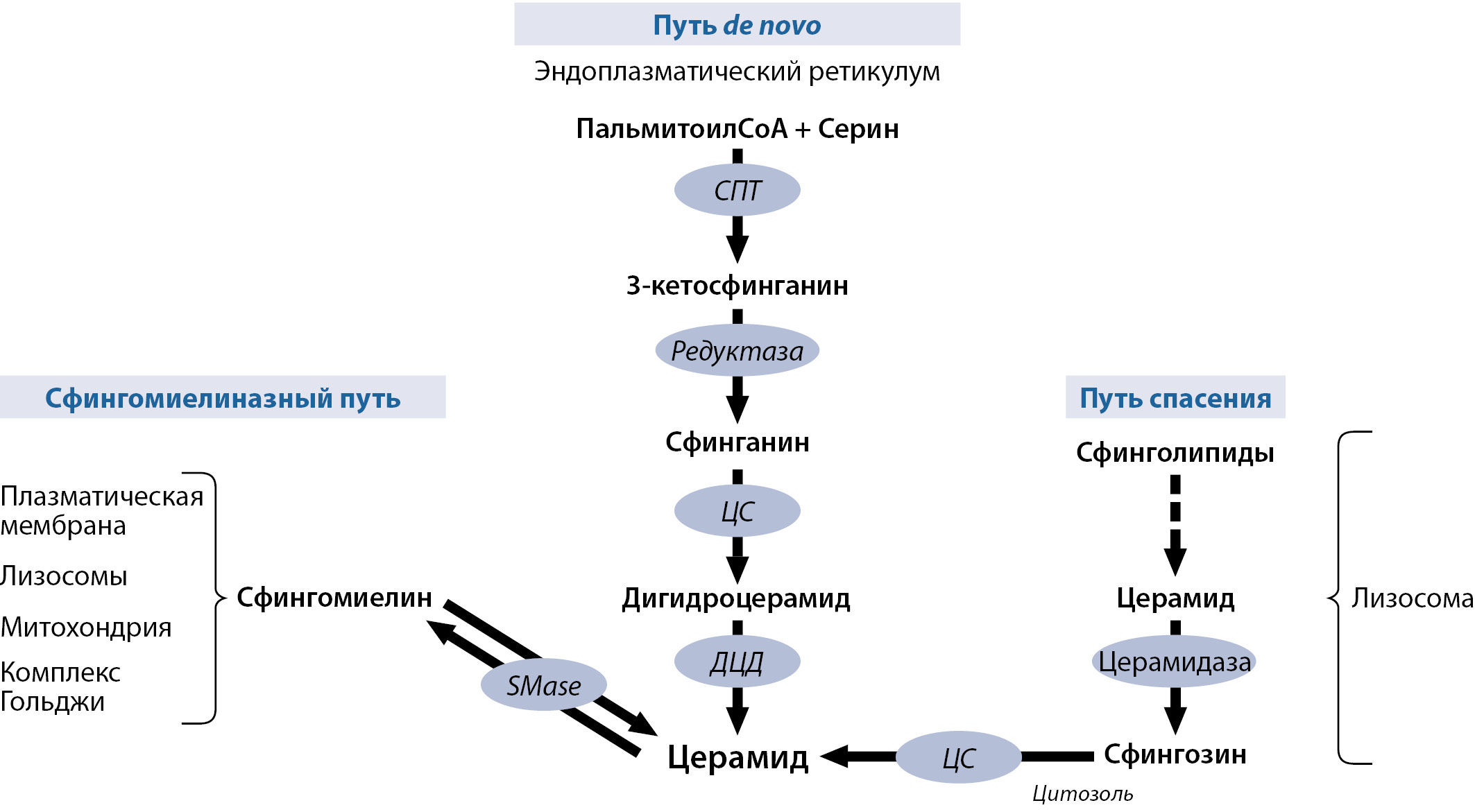
Рисунок 1. Синтез церамидов
Примечание. На рисунке представлены три основных пути синтеза церамида. Церамиды могут быть получены в результате гидролиза сфингомиелина плазматической мембраны с помощью сфингомиелиназы (SMase); посредством биосинтеза de novo в эндоплазматическом ретикулуме, который инициируется с помощью серин-пальмитоилтрансферазы (СПТ) путем превращения пальмитоил-КоА и серина в 3-кетосфинганин, который затем подвергается серии реакций, в результате чего образуется церамид. Сложные сфинголипиды могут также разлагаться с помощью различных ферментов, присутствующих в кислых лизосомах, обратно в церамид, который затем превращается в сфингозин под действием кислой церамидазы, и этот сфингозин может повторно поступать в цитозоль и рециркулировать в церамид через церамидсинтазу (ЦС).
1) Сфингомиелиназный путь, заключается в гидролизе сфингомиелина (СМ) кислой сфингомиелиназой (SMase) в нескольких клеточных компартментах, таких как плазматическая мембрана, лизосомы, комплекс Гольджи, митохондрии. Существует три типа сфингомиелиназ: магнийзависимая кислая сфингомиелиназа, магнийзависимая нейтральная сфингомиелиназа и щелочная сфингомиелиназа. Они отличаются оптимальным значением рН, молекулярной массой и зависимостью от двухвалентных ионов.
2) Путь рециклинга/«спасения» – наименее изученный, встречается в лизосомах и эндосомах. Сложные сфинголипиды, такие как сфингомиелин и гликосфинголипиды, подвергаются ферментативному расщеплению до церамида под действием кислой SMase и кислой β-глюкозидазы в пределах клеточных компартментах. Церамид превращается в сфингозин через кислую церамидазу (АЦ). Сфингозин может повторно поступать в цитозоль и использоваться для ресинтеза церамида с помощью ЦС (рис. 1).
3) Путь de novo реализуется в эндоплазматическом ретикулуме (ЭР) и является основным источником церамидов в клетке. Под действием серин-пальмитоилтрансферазы (СПТ) серин и пальмитоил-КоА преобразуется в 3-кетосфинганин, который восстанавливается 3-кетосфинганинредуктазой с образованием сфинганина, субстрата для церамидсинтаз (ЦС). Дигидроцерамидсинтаза катализирует ацилирование сфинганина с образованием дигидроцерамида. Дигидроцерамид под действием дигидроцерамид-десатуразы (ДЦД) подвергается реакции десатурации с образованием двойной связи в позициях 4,5 углеродной цепи, продуктом этой реакции является церамид.
Ниже приведена краткая характеристика основных ферментов этого пути.
СЕРИНПАЛЬМИТИЛТРАНСФЕРАЗА
Серинпальмитилтрансфераза (СПТ) представляет собой гетеродимер, который состоит из двух мономерных субъединиц – длинных цепей 1 и 2 (LCB1/2), кодируемых отдельными генами. Активный сайт субъединицы LCB2 содержит лизин и другие каталитические аминокислотные остатки, которые отсутствуют в субъединице LCB1, не участвует в катализе, но необходимы для синтеза и стабильности фермента [6].
Несколькими исследовательскими группами была изучена гипотеза о том, что активный биосинтез церамидов de novo участвует в патогенезе ожирения и метаболического синдрома [7]. Лечение грызунов, страдающих генетически обусловленным ожирением (Ob/ob) и ожирением, спровоцированным высоко жировой диетой миорицином, специфическим ингибитором СПТ, снижало уровень циркулирующих церамидов, стеатоз печени, вес и инсулинорезистентность (ИР). Несмотря на то, что блок синтеза церамидов на уровне СПТ представляется многообещающей стратегией лечения метаболического синдрома, полное ингибирование синтеза церамида может оказывать патологическое воздействие на клетку. Так СПТ необходимы для нормальной функции клеточной мембраны и участия в различных внутриклеточных сигнальных путях.
ЦЕРАМИДСИНТАЗА
Известны 6 церамидсинтаз млекопитающих (ЦС1-6). Они кодифицированы 6 генами, также называемыми Lass из-за их гомологии с геном «долголетия» LAG1, впервые идентифицированном у дрожжей. Lass1-6 гены расположены в разных хромосомах, а их белковые продукты представляют собой интегральные мембранные белки, расположенные в ЭР [8]. На ЦС-дефицитных мышах продемонстрировано, что метаболиты, полученные в ходе химических реакций разных ЦС, могут оказывать широкий спектр функциональных и тканеспецифических эффектов. Так, например, церамид C18:0, синтезированный ЦС1, необходим для развития мозжечка, церамиды C22:0–24:0, синтезированные ЦС2, регулируют функцию печени, а ЦС3-зависимые церамиды > C24:0 имеют решающее значение для поддержания функции кожного барьера [9].
У нокаутированных мышей по генам ЦС1-5 эти ферменты являются не только модуляторами длинных цепей в синтезе церамидов, но также контролируют уровень других биологически активных фосфолипидов (ФСЛ), которые имеют различные функции в разных тканях. Кроме того показано, что ЦС5 и -6 играют ключевую роль в развитии ожирения [10]. Необходимы дальнейшие исследования для более полного понимания роли каждой ЦС для выявления наиболее токсичных церамидов, играющих ключевую роль в ожирении, ИР и разработки специфических фармакологических ингибиторов ЦС.
ДИГИДРОЦЕРАМИД-ДЕСАТУРАЗА
В последнее время в зоне интереса находятся дигидроцерамиды. Дигидроцерамид-десатураза облегчает последнюю стадию синтеза de novo церамида, путем добавления 4,5-транс-двойной связи к сфингоидному остову дигидроцерамида. Ферментативная активность дигидроцерамид-десатуразы была описана в микросомах печени крысы [11]. Известно две изоформы фермента дигидроцерамид-десатуразы (ДЦД-1 и -2), локализованные на цитозольной поверхности ЭР. Фермент кодируется геном DEGS [12].
При ожирении возникает дисбаланс между дигидроцерамидами и церамидами, а уровень дигидроцерамидов в плазме крови сильнее коррелируют с индексом массы тела (ИМТ), чем церамиды [13]. В исследованиях, проведенных с фармакологическим ингибитором ДЦД-1 фенретинидом, показано, что ингибирование этого фермента может быть новой стратегией предотвращения и уменьшения степени резистентности к инсулину и ожирения [14].
ЦЕРАМИДЫ И ОЖИРЕНИЕ
Все больше появляется данных подтверждающих роль церамидов в патогенезе метаболических нарушений, вызванных ожирением через активацию воспаления, апоптоза, активных форм кислорода (АФК), «стресса» ЭР и аутофагии.
Церамиды совместно с жирными кислотами (ЖК), различными изоформами протеинкиназы С (ПКС), провоспалительными цитокинами активируют C-Jun N-терминальную киназу (JNK), транскрипционный ядерный фактор каппа-b (NF-kB), рецептор конечных продуктов гликозилирования (RAGE) и Toll-подобные рецепторы (TLR), вызывая активацию воспаления и резистентность к инсулину при ожирении [8]. Церамиды и аналог сфингозина FTY720 могут активировать серин/треонинфосфатазу 2А (PP2A) посредством прямого связывания с его ингибитором SET/I2PP2A, высвобождая и реактивируя PP2 [15]. Церамид-опосредованная активация PP2A дефосфорилирует серин/треонинкиназу (известную как протеинкиназа В или Akt), ингибируя передачу сигналов инсулина. Кроме того, церамиды могут активировать изофермент ПКCζ [16]. Таким образом, церамиды способны блокировать путь PKB/Akt, приводящий к ИР. Напротив, инсулин-сенсибилизирующий гормон адипонектин стимулирует активность церамидазы, которая усиливает катаболизм церамидов, что снижает резистентность тканей к инсулину, воспаление и апоптоз [17]. Кроме того, церамиды оказывают влияние на проницаемость мембран, ингибируют промежуточные звенья электронной транспортной цепи и стимулируют окислительный стресс. Было показано, что как короткоцепочечные, так и длинноцепочечные церамиды увеличивают выработку АФК в митохондриях сердца и печени крыс. Более того, церамиды являются как причиной, так и эффектором стресса ЭР [18]. Известно так же, что церамиды – медиаторы передачи сигналов грелина и лептина в гипоталамусе и высокий уровень церамидов повышает аппетит и массу тела [19].
НАКОПЛЕНИЕ ЦЕРАМИДОВ В ТКАНЯХ ПРИ ОЖИРЕНИИ
Одним из самых простых объяснений, почему содержание церамидов повышается в периферических тканях в ответ на ожирение, является повышенная доступность двух необходимых субстратов для синтеза церамидов de novo. На сегодняшний день ясно, что различные механизмы действуют в унисон, приводя к увеличению синтеза внутриклеточного церамида. Исследования Holland et al. и Velloso et al. продемонстрировали, что хроническое воспаление, связанное с ожирением, приводит к увеличению накопления церамидов в печени и скелетных мышцах, но подобного эффекта не наблюдалось у мышей дефицитных по TLR4, критическому фактору, участвующему в активации воспалительного ответа [20][21]. Кроме того, эти авторы продемонстрировали, что обработка миотрубок C2C12 липополисахаридом (ЛПС), эндотоксином, который индуцирует выраженный иммунный ответ, также увеличивает содержание внутриклеточного церамида [20]. Это исследование связало две основные гипотезы, объясняющие вызванную ожирением резистентность к инсулину, избыточное содержание липидов, воспаление и увеличение уровня внутриклеточных церамидов. Насыщенные жирные кислоты действуют как лиганды для TLR4, индуцируя воспалительный ответ и увеличивая экспрессию генов ферментов, участвующих в синтезе церамидов de novo (например, СПТ, ДЦД и ЦС).
Ранее эти авторы показали, что адипонектин регулирует уровень тканевых церамидов [22]. Так же показано, что рецептор адипонектина связан с активностью церамидазы. Индуцированная рецептором активация церамидазы и последующее снижение уровня церамидов в тканях способствует плейотропному метаболическому действию адипонектина при ожирении [22]. Лечение адипонектином приводит к значительному улучшению гомеостаза глюкозы на экспериментальных моделях ожирения [23]. Таким образом, снижение уровня циркулирующего адипонектина при ожирении приводит к накоплению тканевого церамида за счет снижения активности церамидазы, опосредованного рецептором адипонектина. Воспаление, связанное с ожирением, также способствует накоплению церамидов за счет активации пути гидролиза сфингомиелина, поскольку воспалительные цитокины, которые часто повышены в крови у тучных лиц с ИР, и сверхэкспрессия TLR4 повышают активность SMase [24][25].
На генетических моделях ожирения и диабета выявили заметное увеличение как экспрессии мРНК СПТ, так и активности СПТ. Аналогично, экспрессия мРНК СПТ увеличена в подкожной жировой ткани (ПЖТ) мышей ob/ob и множественных изоформ ЦС в печени мышей, находящихся на высокожировой диете от 4 до 20 недель [26]. В то же время у крыс не было обнаружено взаимосвязи между высокожировой диетой и уровнем экспрессии мРНК СПТ и ЦС-1 [27]. Увеличение поглощения церамидов тканями, по-видимому, не способствует их накоплению в тканях, так как инфузия липидов в течение 6 часов у худых или страдающих ожирением субъектов увеличивала уровень циркулирующих церамидов, но не влияла на фактическое содержание церамидов в ткани [28].
КЛЕТОЧНЫЕ ЭФФЕКТЫ ЦЕРАМИДОВ
Накопление различных видов церамидов в тканях на фоне ожирения приводит к активации ряда различных сигнальных путей, многие из которых оказывают патологическое влияние на функциональную активность клеток и, таким образом, предположительно являются ключевыми участниками, метаболических нарушений, связанных с ожирением.
РОЛЬ ЦЕРАМИДОВ В ПЕРЕДАЧЕ СИГНАЛОВ ИНСУЛИНА И МЕТАБОЛИЗМЕ ГЛЮКОЗЫ
Исследования биоптатов скелетных мышц лиц с ожирением в сочетании с ИР, и здоровых субъектов показали, что ожирение ассоциировалось с повышенным содержанием церамида по сравнению с нормой [5].
Ранние исследования ИР в жировой ткани показали, что фактор некроза опухоли альфа (TNF-α), экспрессия которого повышается в жировой ткани при ожирении, способен индуцировать резистентность к инсулину, ослабляя передачу сигналов инсулина на уровне рецептора инсулина и подавляя экспрессию транспортера глюкозы, чувствительного к инсулину GLUT4 [29]. Механизм, с помощью которого TNF-α вызывает эти эффекты, неясен. В 1996 году Long et al. продемонстрировали, что TNF-α опосредует биосинтез церамида через сфингомиелиновый путь в адипоцитах 3T3-L1 [30]. Результирующее повышение уровня внутриклеточного церамида сопровождается снижением содержания мРНК GLUT4 на 60%. Кроме того, обработка адипоцитов 3T3-L1 C8-церамидом также снижает содержание мРНК GLUT4, подтверждая тем самым, что в данной клетке существует путь передачи сигнала, инициируемый церамидами, который опосредует роль TNF-α в регуляции экспрессии GLUT4 [30]. Исследования на 3T3-L1 адипоцитах показали, что TNF-а участвует в ИР посредством увеличения сфинголипидного ганглиозида GM3, который может ослаблять передачу сигналов инсулина на уровне рецептора инсулина [31]. В 2007 году Kolak et al. показали, что у лиц с ожирением и стеатозом печени были повышены маркеры воспаления, уровень церамида и сфингомиелиназная активность в жировой ткани по сравнению с лицами без стеатоза печени [32].
Другими исследователями продемонстрировано, что увеличение внутриклеточного содержания церамидов нарушает метаболизм глюкозы, главным образом, путем ингибирования Akt [33], которая необходима для передачи сигналов инсулина. Накопление церамида в тканях блокирует активацию пути Akt через два идентифицированных механизма. Первый механизм включает в себя церамид-индуцированное дефосфорилирование Akt на сайтах фосфорилирования Ser473 и Thr308, посредством активизации протеинфосфатазы 2A (PP2A). Согласно второму механизму церамид блокирует транслокацию Akt и последующую активацию благодаря ингибирующему фосфорилированию Akt по Thr34 посредством атипичной ПКC [5, 34]. ПКC-индуцированное фосфорилирование Akt влияет на способность Akt связывать мембранные фосфоинозитиды и фосфорилироваться/активироваться вышестоящими киназами [35]. Преобладающий механизм индуцированного церамидами ингибирования передачи сигналов Akt и инсулина зависит от типа клеток. Так, Hajduch et al. продемонстрировали, что ассоциация ПКC-Akt является доминирующим церамид-индуцированным механизмом ингибирования Akt в микродоменах, обогащенных мембранными белками рецептор-независимого эндоцитоза кавеолинами, который опосредуется частично через ПКC, непосредственно взаимодействующей с кавеолином. Кроме того, способность церамида ингибировать Akt ослаблена в адипоцитах, дефицитных по кавеолину-1 [36]. В целом, активация Akt приводит к транслокации (GLUT4) на плазматическую мембрану, что представляет собой механизм, посредством которого накопление церамидов в тканях ингибирует метаболизм глюкозы, стимулируемый инсулином, опосредуя гипергликемию и ИР. Таким образом, жировая ткань играет немаловажную роль во взаимосвязи сфинголипидов, воспаления и ИР.
РОЛЬ ЦЕРАМИДОВ В МИТОХОНДРИАЛЬНОМ ОКИСЛЕНИИ ЖИРНЫХ КИСЛОТ
Было показано, что церамид C16:0 повышен при ожирении, сахарном диабете и является ключевым патологическим регулятором чувствительности к инсулину и окисления жирных кислот при ожирении [37]. Однако, механизм такого действия церамида не ясен. Имеются данные об увеличении содержания С16:0 в ПЖТ человека, причем, у женщин он отрицательно коррелировал с адипонектином [38]. Кроме того, анализ липидов ПЖТ и эпикардиальной жировой ткани (ЭЖТ) у пациентов с ожирением и без ожирения, без диабета также показал изменения уровня церамида C16:0. В ПЖТ содержание церамида С16:0 было выше у пациентов с ожирением и диабетом, чем у здоровых лиц. В ЭЖТ церамид С16:0 был значительно выше у пациентов без диабета, но с ожирением. В ПЖТ так же была обнаружена положительная корреляция со значением индекса HOMA-IR [39]. Эти исследования убедительно показывают роль C16:0 в ожирении и диабете.
Связь между C16:0 церамидом и окислением ЖК при ожирении
В исследованиях Turpin et al. и Raichur et al. определили церамид C16:0 в качестве ключевого церамида, блокирующего чувствительность к инсулину и окисление ЖК. Церамид C16: 0 de novo синтезируется ЦС-6 в ЭР [40]. Исследователи выявили повышенную экспрессию ЦС-6 в жировой ткани у лиц с ожирением, которая положительно коррелировала с ИМТ, количеством жировой ткани в организме, гипергликемией и ИР. Такая же картина наблюдалась у мышей на высокожировой диете [37]. Исследователями было показано высокое содержание церамида С16:0 и С18:0 у лиц с ожирением и мышей, и напротив, мыши с низким содержанием церамида C16:0 в печени и жировой ткани были не подвержены ожирению, индуцированному высокожировой диетой. ЦС-2 является доминирующей печеночной изоформой ЦС и преимущественно образует церамиды с очень длинной цепью (C22:0, C24:0, C24:1). Кроме того, избыточная экспрессия ЦС-6 в первичных гепатоцитах может воспроизводить фенотип ЦС-2, что повышает уровень церамида C16:0 и блокирует передачу инсулинового сигнала. Эти результаты показывают, что активация экспрессии ЦС-6 и последующее увеличение специфических ацильных цепей церамидов являются центральным механизмом, способствующим ожирению. ЦС-6 является новой терапевтической мишенью в борьбе с ожирением. Однако данные Gosejacob et al. демонстрируют, что ЦС-5 также повышает синтез церамида C16:0 в белой жировой ткани (БЖТ), скелетных мышцах, печени и селезенке [10]. У мышей с дефицитом ЦС-5 наблюдается снижение веса, увеличивается толерантность к глюкозе и уменьшается воспаление в БЖТ. Показано, что церамид C16:0 разобщает β-окисление ЖК посредством инактивации ферментных комплексов II и IV ЭПР, что способствует образованию АФК [41].
Окислительный стресс на фоне ожирения инактивирует множество ферментов. Исследование на клетках линии HeLa показало, что карнитин-пальмитоилтрансфераза-1 (CПT1) является одним из ферментов, ингибируемых окислительным стрессом. В исследовании Setoyama D. были изучены различные субстраты, подвергшиеся действию H2O2 и других АФК и показано, что CПT1 была основной мишенью для окислительной инактивации. Активность CПT1 может быть восстановлена путем добавления каталазы в клетки. Таким образом, АФК обеспечивают обратимое ингибирование CПT1 [42]. Это исследование раскрывает уникальную связь между окислительным стрессом и инактивацией CPT1. При ожирении это может объяснять снижение активности окисления ЖК. При ожирении так же увеличивается уровень насыщенных ЖК и ЦС-6, что приводит к накоплению церамида C16:0, вызывая дисфункцию ЭПР и генерацию АФК. Затем АФК инактивируют СПТ1, уменьшая окисление ЖК и, как следствие, способствуя накоплению липидов в клетках.
В исследовании с участием лиц с ожирением, выполняющих регулярно тренировки на выносливость, показано, что уровень церамида С16:0 снижается после физических нагрузок в сочетании с повышением активности СПТ1 и АФК в мышцах, что приводило к улучшению толерантности к глюкозе [43]. К сожалению, модификация образа жизни пациента как способ лечения ожирения влечет за собой долгосрочные обязательства пациентов, которые они не всегда готовы соблюдать.
Одной из стратегий, которая может имитировать тренировки, является усиление окисления ЖК посредством сверхэкспрессии CПT1. Данный подход был исследован на нескольких клеточных моделях и животных для успешного лечения ожирения. При применении некоторых из них показано снижение общего содержания церамидов [44]. В исследовании in vitro усиление окисления ЖК в клетках скелетных мышц защищало их от вызванной пальмитатом липотоксичности и ИР, что коррелировало с уменьшением общего содержания церамидов и, в частности, церамида C16:0 [45]. Это исследование подтверждает идею о том, что усиление b-окисления посредством сверхэкспрессии CПT1 может быть успешной тактикой снижения уровня церамида C16:0 и блокирования его патологического воздействия на метаболизм клеток при ожирении.
Вместе с тем, церамид C16:0 выполняет функции независимые от окисления ЖК. Ожирение связано с активацией передачи сигналов эндоканнабиноидной системой, что индуцирует ИР. На мышах было продемонстрировано, что ингибирование рецептора каннабиноида-1 инактивирует синтез de novo церамидов за счет снижения уровня экспрессии и активности ферментов СПТ, ЦС-1 и ЦС-6, что приводит, в частности, к уменьшению концентрации церамида C16:0 [46].
Учитывая полученные данные, в исследованиях метаболических заболеваний обязательно необходимо учитывать роль церамида С16:0, а циркулирующий уровень этого липида может стать маркером ожирения и связанных с ним дисфункциональных изменений. В связи с чем, крайне важно разработать специфические конкурентные ингибиторы ЦС-5 и -6 для лечения ожирения и связанных с ним сопутствующих заболеваний. Показано, что соединение ST1072 может ингибировать ЦС-4 и -6 [47], но пока нет данных об эффектах in vivo. Регуляция активности ЦС посредством фосфорилирования или деацетилирования открывает новые терапевтические возможности для контроля уровня церамида C16:0.
ЦЕРАМИДЫ И АПОПТОЗ КЛЕТКИ
Апоптоз – это запрограммированная гибель клеток, которая играет важную роль в поддержании гомеостаза тканей. Механизм апоптоза включает сложные сигнальные пути.
В многочисленных исследованиях было показано, что церамиды активируют сигнальные пути, ответственные за клеточный апоптоз. Obeid et al. показали, что обработка клеток линии U-937 в течение 3 часов аналогом С2-церамида проницаемым в клетки в концентрации 3М индуцировала апоптоз, на что указывала фрагментация ДНК [48]. В другом исследовании клетки линий HL-60 и U-937 подвергались обработке аналогами С2-церамида в концентрациях 10М, что приводило к аналогичным результатам [17]. Аналоги церамида, воздействуя на первичные кардиомиоциты (КМЦ), так же активируют клеточный апоптоз. Следовательно, повышенное накопление церамидов в сердце запускает апоптоз КМЦ снижая функцию левого желудочка (ЛЖ) при сердечной недостаточности, связанной с ожирением / СД2 [49]. Механизм опосредованного церамидом апоптоза, по-видимому, заключается в снижении уровня мРНК антиапоптотического белка Bcl-2, так как заметное снижение экспрессии мРНК Bcl-2 было продемонстрировано уже в течение 1,5 часов после обработки клеток линии HL-60 с 50 µМ С2-церамидом [50]. Кроме того, церамид активирует катепсин D, который в свою очередь активирует проапоптотический белок Bid. Церамид так же способствует олигомеризации и активации другого проапоптотического белка – Bax. В целом судьба клетки определяется балансом между проапоптотическими (Bad, Bid, Bax) и др.) и антиапоптотическими белками (Bcl-2, Bcl-xL и др.) [5].
Сообщается, что церамид-индуцированный апоптоз также включает инактивацию изоформ ПКC (-Сδ и -Cε). Обработка клеток различными агентами, индуцирующими апоптоз за счет повышения уровня церамидов (TNF и SMase), приводила к цитозольной транслокации и последующей инактивации этих изоформ ПКC. Индукция апоптоза в клетках 10 µМ C2-церамида была предотвращена путем предварительной обработки клеток стауроспорином или 12-O-тетрадеканоилфорбол-13-ацетатом, которые усиливали мембранную транслокацию ПКC. Позже было показано, что церамид-индуцированный апоптоз в клеточных линиях MCF-7 и MDA-MB-231 аденокарциномы молочной железы человека включает участие митохондриального цитохрома С, что способствует активации окислительного стресса, а цитохром С выходит с внутренней стороны мембраны в цитозоль [51]. Индуцированное церамидами ингибирование внутриклеточного фермента Akt, регулирующего пролиферацию, рост и выживание клеток также может контролировать уровень церамида при апоптозе [52].
РЕГУЛЯЦИЯ УРОВНЯ СФИНГОЛИПИДОВ АДИПОКИНАМИ
Жировая ткань секретирует широкий спектр уникальных факторов, адипокинов, которые широко обсуждаются в литературе в отношении их функции в качестве регуляторов метаболизма всего организма и чувствительности к инсулину [53]. Среди них лептин является одним из наиболее активных регуляторов массы тела и потребления пищи. Нарушение его регуляции обычно приводит к ожирению и, в конечном итоге, к ИР и СД2. E. Bonzon-Kulichenko и соавт. на крысах продемонстрировали, что внутрицеребровентрикулярная инфузия лептина снижает общее содержание церамида в белой ЖТ посредством воздействия на вегетативную нервную систему. Лептин подавлял активность фермента СПТ, ограничивая скорость продукции церамидов в белой ЖТ на 30% [54].
Адипонектин оказывает свои полезные метаболические эффекты, снижая уровень клеточного церамида. Адипонектин обладает сильным антиапоптотическим действием в отношении кардиомиоцитов и β-клеток поджелудочной железы снижая уровень клеточных церамидов in vivo. Рецепторы адипонектина, AdipR1 и AdipoR2, проявляют церамидазную активность [17]. Содержат ли рецепторы сами по себе церамидазную активность, или же они индуцируют церамидазу при активации, до сих пор неясно.
Еще один адипокин – фактор роста фибробластов (FGF-21), является объектом большого интереса исследователей. FGF-21 экспрессируется по большей части в печени при длительном голодании, но он также может быть синтезирован в других тканях, например, жировой [55]. Подобно адипонектину, FGF-21 оказывает положительные эффекты на углеводный и липидный обмен и эффективно снижает уровень церамидов [56]. По сути, эти эффекты зависят от способности FGF-21 стимулировать высвобождение адипонектина из адипоцитов. Тиазолидиндионы (TZD), агонисты ядерного рецептора PPARγ, являются мощными индукторами FGF-21 и адипонектина и, в свою очередь, также снижают уровень церамида в плазме. TZD индуцируют FGF-21, запуская повышенное высвобождение адипонектина из адипоцитов, что вызывает системное снижение уровня церамидов [56]. Эти наблюдения подчеркивают двойную роль адипоцитов, как источников жирных кислот, которые накапливаясь в тканях становятся субстратами для синтеза de novo церамидов, так и источников антилипотоксических адипокинов (лептин, адипонектин и FGF-21), которые выполняют защитные функции во время высвобождения СЖК из адипоцитов при голодании и в постпрандиальном состоянии.
ЗАКЛЮЧЕНИЕ
Таким образом, церамиды являются важными модуляторами метаболических нарушений, вызванных ожирением. Исследования выявили у лиц с ожирением нарушение метаболизма церамидов и накопление специфических насыщенных церамидов (C16:0 и C18:0). Эти данные дают представление о связи между изменением характера распределения жира в организме и метаболическим статусом с точки зрения физиологии церамидов, что предполагает более тонкое понимание процессов синтеза церамидов, его регуляции, сигнальных путей. Полученные результаты указывают на роль тканевых и циркулирующих церамидов в метаболических процессах. Тем не менее, до конца не решен вопрос, влияет ли характер распределения жира в организме на синтез церамидов de novo и их уровень. Поскольку церамиды играют важную роль в развитии метаболического синдрома и сердечно-сосудистых заболеваний, разумно предположить, что церамиды при ожирении являются перспективной терапевтической мишенью, а исследования демонстрируют, что ингибирование ключевых ферментов синтеза церамидов может эффективно нивелировать патологические эффекты этих биологически активных липидов в жировой ткани.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена в рамках фундаментальной темы НИИ КПССЗ № 0546-2019-0003 «Мультифокальный атеросклероз и коморбидные состояния. Особенности диагностики, управления рисками в условиях крупного промышленного региона Сибири».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Дылева Юлия Александровна – концепция, дизайн статьи, поиск и анализ научной литературы по данной теме; написание статьи; Груздева Ольга Викторовна – концепция, дизайн статьи; внесение в рукопись существенной правки с целью повышения научной ценности статьи; Белик Екатерина Владимировна – поиск и анализ научной литературы по данной теме; написание статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Gorski J. Ceramide and Insulin Resistance: How Should the Issue Be Approached? Diabetes. 2012;61(12):3081-3083. doi: https://doi.org/10.2337/db12-1157
2. Rutkowski JM, Stern JH, Scherer PE. The cell biology of fat expansion. J Cell Biol. 2015;208(5):501-512. doi: https://doi.org/10.1083/jcb.201409063
3. Muoio DM, Neufer PD. Lipid-Induced Mitochondrial Stress and Insulin Action in Muscle. Cell Metab. 2012;15(5):595-605. doi: https://doi.org/10.1016/j.cmet.2012.04.010
4. Алесенко А.В., Затейщиков Д.А., Лебедев А.Т., Курочкин И.Н. Участие сфинголипидов в патогенезе атеросклероза // Кардиология. 2019 - Т. 59 - №8 - С. 7787. doi: https://doi.org/10.18087/cardio.2019.8.10270
5. Кузьменко ДИ, Климентьева ТК. Церамид: роль в апоптозе и патогенезе резистентности к инсулину // Биохимия. -2016. - Т. 81 - №9 - С.1155 - 1171.
6. Gault CR, Obeid LM, Hannun YA. An overview of sphingolipid metabolism: from synthesis to breakdown. Adv Exp Med Biol. 2010;688:1-23. doi: https://doi.org/10.1007/978-1-4419-6741-1_1
7. Ussher JR, Koves TR, Cadete VJJ, et al. Inhibition of De Novo Ceramide Synthesis Reverses Diet-Induced Insulin Resistance and Enhances Whole-Body Oxygen Consumption. Diabetes. 2010;59(10):2453-2464. doi: https://doi.org/10.2337/db09-1293
8. Levy M, Futerman AH. Mammalian ceramide synthases. IUBMB Life. 2010;59(10):NA-NA. doi: https://doi.org/10.1002/iub.319
9. Ginkel C, Hartmann D, vom Dorp K, et al. Ablation of Neuronal Ceramide Synthase 1 in Mice Decreases Ganglioside Levels and Expression of Myelin-associated Glycoprotein in Oligodendrocytes. J Biol Chem. 2012;287(50):41888-41902. doi: https://doi.org/10.1074/jbc.M112.413500
10. Gosejacob D, Jager PS, vom Dorp K, et al. Ceramide Synthase 5 Is Essential to Maintain C 16:0 -Ceramide Pools and Contributes to the Development of Diet-induced Obesity. J Biol Chem. 2016;291(13):6989-7003. doi: https://doi.org/10.1074/jbc.M115.691212
11. Michel C, van Echten-Deckert G, Rother J, et al. Characterization of Ceramide Synthesis. J Biol Chem. 1997;272(36):22432-22437. doi: https://doi.org/10.1074/jbc.272.36.22432
12. Rodriguez-Cuenca S, Barbarroja N, Vidal-Puig A. Dihydroceramide desaturase 1, the gatekeeper of ceramide induced lipotoxicity. Biochim Biophys Acta - Mol Cell Biol Lipids. 2015;1851(1):40-50. doi: https://doi.org/10.1016/jbbalip.2014.09.021
13. Mamtani M, Meikle PJ, Kulkarni H, et al. Plasma dihydroceramide species associate with waist circumference in Mexican American families. Obesity. 2014;22(3):950-956. doi: https://doi.org/10.1002/oby.20598
14. Mcilroy GD, Delibegovic M, Owen C, et al. Fenretinide treatment prevents diet-induced obesity in association with major alterations in retinoid homeostatic gene expression in adipose, liver, and hypothalamus. Diabetes. 2013;62(3):825-836. doi: https://doi.org/10.2337/db12-0458
15. Oaks J, Ogretmen B. Regulation of PP2A by Sphingolipid Metabolism and Signaling. Front Oncol. 2015;4:388. doi: https://doi.org/10.3389/fonc.2014.00388
16. Powell DJ, Hajduch E, Kular G, Hundal HS. Ceramide Disables 3-Phosphoinositide Binding to the pleckstrin homology domain of protein kinase B (PKB)/Akt by a PKCZ-dependent mechanism. Mol Cell Biol. 2003;23(21):7794-7808. doi: https://doi.org/10.1128/MCB.23.21.7794-7808.2003
17. Holland WL, Miller RA, Wang Z V., et al. Receptor-mediated activation of ceramidase activity initiates the pleiotropic actions of adiponectin. Nat Med. 2011;17(1):55-63. doi: https://doi.org/10.1038/nm.2277
18. Boslem E, MacIntosh G, Preston AM, et al. A lipidomic screen of palmitate-treated MIN6 в-cells links sphingolipid metabolites with endoplasmic reticulum (ER) stress and impaired protein trafficking. Biochem J. 2011;435(1):267-276. doi: https://doi.org/10.1042/BJ20101867
19. Ramirez S, Martins L, Jacas J, et al. Hypothalamic Ceramide Levels Regulated by CPT1C Mediate the Orexigenic Effect of Ghrelin. Diabetes. 2013;62(7):2329-2337. doi: https://doi.org/10.2337/db12-1451
20. Holland WL, Bikman BT, Wang L-P et al. Lipid-induced insulin resistance mediated by the proinflammatory receptor TLR4 requires saturated fatty acid-induced ceramide biosynthesis in mice. J Clin Invest. 2011;121(5):1858-1870. doi: https://doi.org/10.1172/JCI43378
21. Velloso LA, Folli F, Saad MJ. TLR4 at the crossroads of nutrients, gut microbiota, and metabolic inflammation. Endocr Rev. 2015. doi: https://doi.org/10.1210/er.2014-1100
22. Holland WL, Knotts TA, Chavez JA, et al. Lipid Mediators of Insulin Resistance. Nutr Rev. 2008;65:S39-S46. doi: https://doi.org/10.1111/j.1753-4887.2007.tb00327.x
23. Ye R, Scherer PE. Adiponectin, driver or passenger on the road to insulin sensitivity? Mol Metab. 2013;2(3):133-141. doi: https://doi.org/10.1016/j.molmet.2013.04.001
24. Colell A, Morales A, Fernandez-Checa JC, Garcia-Ruiz C. Ceramide generated by acidic sphingomyelinase contributes to tumor necrosis factor-a-mediated apoptosis in human colon HT-29 cells through glycosphingolipids formation. FEBS Lett. 2002;526(1-3):135-141. doi: https://doi.org/10.1016/S0014-5793(02)03140-X
25. Cuschieri J, Bulger E, Billgrin J, et al. Acid Sphingomyelinase Is Required for Lipid Raft TLR4 Complex Formation. Surg Infect (Larchmt). 2007;8(1):91-106. doi: https://doi.org/10.1089/sur.2006.050
26. Lyn-Cook LE, Lawton M, Tong M, et al. Hepatic Ceramide May Mediate Brain Insulin Resistance and Neurodegeneration in Type 2 Diabetes and Non-alcoholic Steatohepatitis. Bierhaus A, ed. J Alzheimer's Dis. 2009;16(4):715-729. doi: https://doi.org/10.3233/JAD-2009-0984
27. Patel SA, Hoehn KL, Lawrence RT, et al. Overexpression of the Adiponectin Receptor AdipoR1 in Rat Skeletal Muscle Amplifies Local Insulin Sensitivity. Endocrinology. 2012;153(11):5231-5246. doi: https://doi.org/10.1210/en.2012-1368
28. Serlie MJ, Allick G, Groener JE, et al. Chronic Treatment with Pioglitazone Does Not Protect Obese Patients with Diabetes Mellitus Type II from Free Fatty Acid-Induced Insulin Resistance. J Clin Endocrinol Metab. 2007;92(1):166-171. doi: https://doi.org/10.1210/jc.2006-1518
29. Hotamisligil GS, Spiegelman BM. Tumor Necrosis Factor: A Key Component of the Obesity-Diabetes Link. Diabetes. 1994;43(11):1271-1278. doi: https://doi.org/10.2337/diab.43.11.1271
30. Long SD, Pekala PH. Lipid mediators of insulin resistance: ceramide signalling down-regulates GLUT4 gene transcription in 3T3-L1 adipocytes. Biochem J. 1996;319(1):179-184. doi: https://doi.org/10.1042/bj3190179
31. Tagami S, Inokuchi J, Kabayama K, et al. Ganglioside GM3 Participates in the Pathological Conditions of Insulin Resistance. J Biol Chem. 2002;277(5):3085-3092. doi: https://doi.org/10.1074/jbc.M103705200
32. Kolak M, Westerbacka J, Velagapudi VR, et al. Adipose Tissue Inflammation and Increased Ceramide Content Characterize Subjects With High Liver Fat Content Independent of Obesity. Diabetes. 2007;56(8):1960-1968. doi: https://doi.org/10.2337/db07-0111
33. Hajduch E, Balendran A, Batty IH, et al. Ceramide impairs the insulin-dependent membrane recruitment of Protein Kinase B leading to a loss in downstream signalling in L6 skeletal muscle cells. Diabetologia. 2001;44(2):173-183. doi: https://doi.org/10.1007/s001250051596
34. Chaurasia B, Summers SA. Ceramides - Lipotoxic Inducers of Metabolic Disorders. Trends Endocrinol Metab. 2015;26(10):538-550. doi: https://doi.org/10.1016/j.tem.2015.07.006
35. Powell DJ, Turban S, Gray A, et al. Intracellular ceramide synthesis and protein kinase CZ activation play an essential role in palmitate-induced insulin resistance in rat L6 skeletal muscle cells. Biochem J. 2004;382(2):619-629. doi: https://doi.org/10.1042/BJ20040139
36. Hajduch E, Turban S, Le Liepvre X, et al. Targeting of PKCZ and PKB to caveolin-enriched microdomains represents a crucial step underpinning the disruption in PKB-directed signalling by ceramide. Biochem J. 2008;410(2):369-379. doi: https://doi.org/10.1042/BJ20070936
37. Turpin SM, Nicholls HT, Willmes DM, et al. Obesity-Induced CerS6-Dependent C16:0 Ceramide Production Promotes Weight Gain and Glucose Intolerance. Cell Metab. 2014;20(4):678-686. doi: https://doi.org/10.1016/j.cmet.2014.08.002
38. Blachnio-Zabielska AU, Koutsari C, Tchkonia T, Jensen MD. Sphingolipid Content of Human Adipose Tissue: Relationship to Adiponectin and Insulin Resistance. Obesity. 2012;20(12):2341-2347. doi: https://doi.org/10.1038/oby.2012.126
39. Blachnio-Zabielska AU, Baranowski M, Hirnle T, et al. Increased Bioactive Lipids Content in Human Subcutaneous and Epicardial Fat Tissue Correlates with Insulin Resistance. Lipids. 2012;47(12):1131-1141. doi: https://doi.org/10.1007/s11745-012-3722-x
40. Turpin SM, Nicholls HT, Willmes DM, et al. Obesity-Induced CerS6-Dependent C16:0 Ceramide Production Promotes Weight Gain and Glucose Intolerance. Cell Metab. 2014;20(4):678-686. doi: https://doi.org/10.1016/j.cmet.2014.08.002
41. Zigdon H, Kogot-Levin A, Park J-W, et al. Ablation of Ceramide Synthase 2 Causes Chronic Oxidative Stress Due to Disruption of the Mitochondrial Respiratory Chain. J Biol Chem. 2013;288(7):4947-4956. doi: https://doi.org/10.1074/jbc.M112.402719
42. Setoyama D, Fujimura Y, Miura D. Metabolomics reveals that carnitine palmitoyltransferase-1 is a novel target for oxidative inactivation in human cells. Genes to Cells. 2013;18(12):1107-1119. doi: https://doi.org/10.1111/gtc.12098
43. Kogot-Levin A, Saada A. Ceramide and the mitochondrial respiratory chain. Biochimie. 2014;100:88-94. doi: https://doi.org/10.1016/j.biochi.2013.07.027
44. Bruce CR, Hoy AJ, Turner N, et al. Overexpression of Carnitine Palmitoyltransferase-1 in Skeletal Muscle Is Sufficient to Enhance Fatty Acid Oxidation and Improve High-Fat Diet-Induced Insulin Resistance. Diabetes. 2009;58(3):550-558. doi: https://doi.org/10.2337/db08-1078
45. Henique C, Mansouri A, Fumey G, et al. Increased mitochondrial fatty acid oxidation is sufficient to protect skeletal muscle cells from palmitate-induced apoptosis. J Biol Chem. 2010. doi: https://doi.org/10.1074/jbc.M110.170431
46. Cinar R, Godlewski G, Liu J, et al. Hepatic cannabinoid-1 receptors mediate diet-induced insulin resistance by increasing de novo synthesis of long-chain ceramides. Hepatology. 2014;59(1):143-153. doi: https://doi.org/10.1002/hep.26606
47. Schiffmann S, Hartmann D, Fuchs S, et al. Inhibitors of specific ceramide synthases. Biochimie. 2012;94(2):558-565. doi: https://doi.org/10.10167j.biochi.2011.09.007
48. Obeid L, Linardic C, Karolak L, Hannun Y. Programmed cell death induced by ceramide. Science (80-). 1993;259(5102):1769-1771. doi: https://doi.org/10.1126/science.8456305
49. Ussher JR. The role of cardiac lipotoxicity in the pathogenesis of diabetic cardiomyopathy. Expert Rev Cardiovasc Ther. 2014;12(3):345-358. doi: https://doi.org/10.1586/14779072.2014.891939
50. Chen M, Quintans J, Fuks Z, et al. Suppression of Bcl-2 messenger RNA production may mediate apoptosis after ionizing radiation, tumor necrosis factor alpha, and ceramide. Cancer Res. 1995;55(5):991-994.
51. Wu C-C, Bratton SB. Regulation of the Intrinsic Apoptosis Pathway by Reactive Oxygen Species. Antioxid Redox Signal. 2013;19(6):546-558. doi: https://doi.org/10.1089/ars.2012.4905
52. Sussman MA, Volkers M, Fischer K, et al. Myocardial AKT: The Omnipresent Nexus. Physiol Rev. 2011;91(3):1023-1070. doi: https://doi.org/10.1152/physrev.00024.2010
53. Scherer PE. Adipose Tissue: From Lipid Storage Compartment to Endocrine Organ. Diabetes. 2006;55(6):1537-1545. doi: https://doi.org/10.2337/db06-0263
54. Bonzon-Kulichenko E, Schwudke D, Gallardo N, et al. Central Leptin Regulates Total Ceramide Content and Sterol Regulatory Element Binding Protein-1C Proteolytic Maturation in Rat White Adipose Tissue. Endocrinology. 2009;150(1):169-178. doi: https://doi.org/10.1210/en.2008-0505
55. Груздева ОВ, Акбашева ОЕ, Дылева ЮА, и др. Адипокиновый и цитокиновый профили эпикардиальной и подкожной жировой ткани у пациентов с ишемической болезнью сердца // Бюллетень экспериментальной биологии и медицины. - 2017. - Т. 163 - №5. -С. 560-563.
56. Holland WL, Adams AC, Brozinick JT, et al. An FGF21-Adiponectin-Ceramide Axis Controls Energy Expenditure and Insulin Action in Mice. Cell Metab. 2013;17(5):790-797. doi: https://doi.org/10.1016/j.cmet.2013.03.019
Об авторах
Юлия Александровна ДылеваНаучно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний
Россия
Дылева Юлия Александровна, к.м.н., ORCID: https://orcid.org/0000-0002-6890-3287, ResearcherID: O-3883-2015, Scopus Author ID: 49360983500, eLibrary SPIN: 2064-6262, e-mail: dyleva87@yandex.ru
650002, Кемерово, Сосновый бульвар, д. 6
Конфликт интересов: нет
Ольга Викторовна Груздева
Россия
Груздева Ольга Викторовна, д.м.н., ORCID: https://orcid.org/0000-0002-7780-829X, ResearcherID: P-9723-2015, Scopus Author ID: 6507406046, eLibrary SPIN: 4322-0963, e-mail: o_gruzdeva@mail.ru
Кемерово
Конфликт интересов: нет
Екатерина Владимировна Белик
Россия
Белик Екатерина Владимировна, ORCID://orcid.org/0000-0003-3996-3325, ResearcherID: I-7850-2017, Scopus Author ID: 57188768885, eLibrary SPIN: 5705-9143, e-mail: sionina.ev@mail.ru
Кемерово
Конфликт интересов: нет
Дополнительные файлы
|
|
1. Синтез церамидов | |
| Тема | ||
| Тип | author.submit.suppFile.figureResearchMaterials | |
Посмотреть
(109KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Дылева Ю.А., Груздева О.В., Белик Е.В. Церамиды: фокус на ожирение. Ожирение и метаболизм. 2020;17(3):307-315. https://doi.org/10.14341/omet12565
For citation:
Dyleva Yu.A., Gruzdeva O.V., Belik E.V. Ceramides: focus on obesity. Obesity and metabolism. 2020;17(3):307-315. (In Russ.) https://doi.org/10.14341/omet12565

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































