Перейти к:
Особенности параметров обмена железа и воспалительного статуса у пациентов с сахарным диабетом и дислипидемией
https://doi.org/10.14341/omet12497
Аннотация
Обоснование. Актуальным представляется вопрос состояния воспалительного статуса и обмена железа у лиц с нарушениями углеводного обмена (НУО), однако довольно мало работ посвящено исследованию взаимосвязей между метаболическими параметрами, в том числе параметрами обмена липидов, показателями воспаления и состоянием феррокинетики при сахарном диабете 1 и 2 типов в сравнительном аспекте.
Цель. Установить направленность изменений воспалительного статуса и состояния феррокинетики у пациентов с сахарным диабетом 1 и 2 типа в зависимости от нарушений липидного обмена.
Методы. В исследование включено 48 пациентов с сахарным диабетом 1 типа, 81 пациент с сахарным диабетом 2 типа; 11 человек с ожирением без НУО составили группу сравнения, 17 здоровых добровольцев - группу контроля. Субклиническое воспаление оценивали по уровням высокочувствительного С-реактивного белка (СРБ), фактора некроза опухолей-а (ФНО-а) и скорости оседания эритроцитов (СОЭ). Состояние обмена железа оценивали по основным гематологическим показателям (гемоглобин, количество эритроцитов, гематокрит), концентрациям железа сыворотки, трансферрина, ферритина и гепсидина крови. Всем пациентам проводилась оценка липидного обмена, гликированного гемоглобина и микроальбуминурии.
Результаты. У пациентов с сахарным диабетом 1 и 2 типа имело место повышение содержания в крови воспалительных маркеров - ФНО-а, СОЭ и СРБ - относительно пациентов с ожирением и лиц группы контроля. Наибольшая концентрация ФНО-а отмечалась у пациентов с сахарным диабетом 1 типа (15,28 [12,41-24,41] пг/мл), а СРБ (7,00 [3,00-11,85] нг/мл) и СОЭ (18,00 [9,00-27,00] мм/час) - у пациентов с сахарным диабетом 2 типа. В структуре обследованных лиц с сахарным диабетом (вне зависимости от его типа) дислипидемия IIb в сравнении с менее атерогенной IIa дислипидемией характеризовалась более высокими значениями СРБ (6,9 [3,00-12,35] и 3,00 [1,80-8,70] нг/мл соответственно), СОЭ (20,00 [10,00-30,00] и 15,00 [5,00-24,50] мм/час соответственно) и ферритина (114,80 [48,90-196,45] и 50,90 [19,58-114,10] нг/мл соответственно). Анемия хронических заболеваний при сахарном диабете в сравнении с сидеропенической анемией чаще сопровождалась дислипидемией IIb χ2=2,743; p=0,098) и характеризовалась более высоким содержанием атерогенных фракций холестерина.
Заключение. Для лиц с сахарным диабетом 2 типа и более атерогенным профилем дислипидемии (IIb тип) характерен фенотип локальной воспалительной мезенхимальной реакции печени с повышением сывороточной концентрации острофазных белков, имеющих преимущественно печеночное происхождение (СРБ, ферритин), а для лиц, страдающих сахарным диабетом 1 типа и имеющих менее атерогенный липидный профиль (IIa тип) - фенотип аутоиммунного, генетически детерминированного воспалительного ответа. Развивающаяся на фоне сахарного диабета анемия хронических заболеваний ассоциирована с более атерогенным липидным профилем, в сравнении с сидеропенической анемией.
Ключевые слова
Для цитирования:
Мусина Н.Н., Саприна Т.В., Прохоренко Т.С., Зима А.П. Особенности параметров обмена железа и воспалительного статуса у пациентов с сахарным диабетом и дислипидемией. Ожирение и метаболизм. 2020;17(3):269-282. https://doi.org/10.14341/omet12497
For citation:
Musina N.N., Saprina T.V., Prokhorenko T.S., Zima A.P. Iron metabolism parameters and inflammatory status in patients with diabetes mellitus and dyslipidemia. Obesity and metabolism. 2020;17(3):269-282. (In Russ.) https://doi.org/10.14341/omet12497
ОБОСНОВАНИЕ
Известно, что сахарный диабет ассоциирован с провоспалительным иммунным статусом и сопровождается повышением уровня циркулирующих маркеров воспаления, при этом в основе сахарного диабета 1 типа лежит органо-специфическое воспаление аутоиммунного характера, которое приводит к гибели β-клеток островков Лангерганса поджелудочной железы [1–3], при сахарном диабете 2 типа патогенез хронического субклинического воспаления, как правило, рассматривается с точки зрения воспалительной активности, индуцируемой жировой тканью [4–7]. В то же время, имеются данные о том, что уровень цитокинов при сахарном диабете остается высоким даже после коррекции ожирения [8]. Это указывает на важную, однако не единственную роль избыточной жировой ткани в воспалении при сахарном диабете 2 типа: так, гипергликемия сама по себе способна индуцировать экспрессию провоспалительных молекул β-клетками и приводить к активации факторов роста фибробластов и маркеров воспаления [9][10]. Достаточно данных, подтверждающих вклад системного воспаления низкой интенсивности в развитие и прогрессирование атеросклеротического процесса, в том числе у лиц с нарушением углеводного обмена [11–13], в связи с чем инсулинорезистентность, гипергликемия, атеросклероз и хроническое воспаление могут рассматриваться как звенья одного патогенетического процесса. Стоит отметить, что как в отечественной, так и в зарубежной литературе представлены преимущественно результаты исследований состояния липидного обмена и воспалительного статуса, а также их взаимного влияния, проводившиеся на отдельных когортах пациентов с сахарным диабетом 1 типа и с сахарным диабетом 2 типа, что не позволяло в сравнительном аспекте оценить вклад свойственных сахарному диабету метаболических расстройств в развитие как системного воспаления, так и нарушений обмена липидов и феррокинетики. Показана роль хронического низкоинтенсивного воспаления в развитии анемического синдрома: цитокины смещают гематопоэз в сторону образования миелоидных клеток, а не эритропоэза, фактор некроза опухолей α (ФНО-α) ингибирует пролиферацию эритроидного предшественника, а также активирует макрофаги для эритрофагоцитоза, что приводит к сокращению жизни эритроцитов, интерлейкин 6 (IL-6) через гепсидин ингибирует высвобождение вторичного железа из макрофагов, вызывая гипоферремию [14]. В настоящее время достаточно актуальным представляется вопрос состояния обмена железа у лиц с нарушениями углеводного обмена [15–17], при этом довольно мало работ посвящено исследованию взаимосвязей между метаболическими параметрами, в том числе параметрами обмена липидов, показателями воспалительного статуса и состоянием феррокинетики при сахарном диабете 1 и 2 типов в сравнительном аспекте.
ЦЕЛЬ
Установить направленность изменений воспалительного статуса и состояния феррокинетики у пациентов с сахарным диабетом 1 и 2 типов в зависимости от типа нарушений липидного обмена.
МЕТОДЫ
Дизайн исследования
Обсервационное одноцентровое одномоментное выборочное контролируемое нерандомизированное исследование.
Критерии соответствия
Критерии включения в основную группу: наличие установленного диагноза сахарный диабет 1 или 2 типа соответственно, возраст пациента от 18 до 70 лет, стаж заболевания от 1 года до 30 лет, уровень гликированного гемоглобина от 6,5% до 10,5%.
Критерии включения в дополнительную группу: возраст пациента от 18 до 70 лет, отсутствие нарушений углеводного обмена (НУО) по данным исследования гликированного гемоглобина и проведения стандартного теста толерантности к глюкозе с 75 г глюкозы (СТТГ с 75 г глюкозы). Дополнительная группа была разделена на группу сравнения и контроля зависимости от индекса массы тела (ИМТ): в группу сравнения вошли пациенты с ИМТ 30 кг/м кв. и более, в группу контроля – лица с ИМТ от 18,5 до 29,9 кг/м кв.
Критерии невключения: инфекционные заболевания в стадии обострения, специфические инфекционные заболевания, такие как: ВИЧ/СПИД, вирусные гепатиты с любой степенью активности, цирроз печени вирусной и аутоиммунной этиологии, туберкулез; онкологические заболевания; хроническая обструктивная болезнь легких и бронхиальная астма; курение на момент включения в исследование; гемотрансфузии в период 1 месяца до включения в исследование и в настоящий момент; прием препаратов железа; пред- и постоперационный период; острая почечная, печеночная, сердечная недостаточность, скорость клубочковой фильтрации ниже 15 мл/мин, стадия протеинурии; декомпенсация сахарного диабета с наличием кетоацидоза/осмотической дегидратации.
Условия проведения
Исследование проводилось на базе эндокринологической клиники ФГБОУ ВО СибГМУ г. Томска. В исследование включались пациенты, находящиеся на плановой госпитализации в эндокринологической клинике ФГБОУ ВО СибГМУ г. Томска.
Продолжительность исследования
Набор пациентов в исследование проводился в течение двух лет (2017–2019 гг.).
Описание медицинского вмешательства
У всех включенных в исследование пациентов проводились сбор анамнестических данных, оценка антропометрических данных, а также забор венозной крови утром натощак из локтевой вены. У пациентов основной группы проводился забор утренней порции мочи с определением микроальбуминурии. В полученных образцах крови исследовались гликированный гемоглобин – в качестве основного параметра оценки компенсации углеводного обмена, уровень креатинина крови с последующим расчетом скорости клубочковой фильтрации по формуле CKD-EPI, оценивались основные гематологические показатели (количество эритроцитов, ретикулоцитов, концентрация гемоглобина, уровень гематокрита) и биохимические показатели обмена железа – концентрация сывороточного железа, трансферрина и ферритина. Также среди всех включенных в исследование пациентов проводилась оценка маркеров воспаления – скорости оседания эритроцитов (СОЭ), высокочувствительного С-реактивного белка (СРБ) и фактора некроза опухолей-α (ФНО-α), и показателей липидного спектра (общий холестерин, ЛПВП-холестерин, ЛПНП-холестерин, ЛПОНП-холестерин, триглицериды).
Методы регистрации исходов
Материалом исследования являлись плазма и сыворотка венозной крови, взятые утром натощак из локтевой вены в количестве 10 мл в вакуумные пробирки BD Vacutainer. Исследование гликированного гемоглобина проводилось с использованием анализатора D10 («BIO-RAD», США); исследование микроальбуминурии (мг/л) – с использованием анализатора Abbott Architect c4000. Для оценки основных гематологических показателей (количество эритроцитов, ретикулоцитов, концентрация гемоглобина, уровень гематокрита) использовался гематологический анализатор XN1000 («Sysmex», Япония). Для оценки уровня креатинина и биохимических показателей обмена железа, а именно – концентрации сывороточного железа (мкмоль/л), трансферрина (мг/дл) и ферритина (нг/мл) – использовался анализатор ARCHITECT i2000SR (Abbott, США). Показатели липидного спектра (общий холестерин, ЛПВП-холестерин, ЛПНП-холестерин, ЛПОНП-холестерин, триглицериды) (ммоль/л) исследовались на анализаторе ARCHITECT i2000SR (Abbott, США). Оценка СОЭ проводилась гематологическим анализатором XN1000 (Sysmex, Япония), высокочувствительного СРБ (нг/мл) – методом ИФА («Вектор Бест», Россия), исследование ФНО-α (пг/мл) также проводилось методом ИФА («Вектор Бест», Россия). Диагноз анемии устанавливался в соответствии с Федеральными клиническими рекомендациями по диагностике и лечению железодефицитной анемии (Румянцев А.Г., Масчан А.А. и др., 2015 г.) [18] и Федеральными клиническими рекомендациями по диагностике и лечению анемии хронических болезней (Румянцев А.Г., Масчан А.А., 2014 г.) 19]. Тип дислипидемии определялся по классификации D. Fredrickson (1967) [20].
Исходы исследования
В рамках задач проведенной работы планировалось исследовать и сравнить основные гематологические и биохимические показатели обмена железа, а именно – количество эритроцитов, ретикулоцитов, концентрация гемоглобина, уровень гематокрита, концентрацию железа сыворотки, ферритина и трансферрина – у лиц в зависимости от наличия и типа сахарного диабета. Также планировалось в сравнительном аспекте изучить концентрации маркеров воспаления, таких как СОЭ, высокочувствительный СРБ и ФНО-α у пациентов с сахарным диабетом 1 и 2 типа и лиц с ожирением. Одной из задач являлась оценка состояния липидного обмена и установление фенотипов дислипидемии в зависимости от типа сахарного диабета. В результате исследования планировалось установить направленность изменений воспалительного статуса и состояния феррокинетики у пациентов с сахарным диабетом 1 и 2 типов в зависимости от типа нарушений липидного обмена.
Анализ в подгруппах
Все включенные в исследование пациенты были разделены в четыре группы. Основная группа была разделена в зависимости от типа сахарного диабета на основную группу 1 (пациенты с сахарным диабетом 1 типа) и основную группу 2 (пациенты с сахарным диабетом 2 типа). Дополнительная группа была разделена на группу сравнения и контроля зависимости от индекса массы тела (ИМТ): в группу сравнения вошли пациенты с ожирением без нарушений углеводного обмена, в группу контроля были включены здоровые добровольцы, не имевшие ожирения и нарушений углеводного обмена.
Этическая экспертиза
Протокол исследования был одобрен локальным этическим комитетом ФГБОУ ВО СибГМУ Минздрава России, номер протокола 5596 от 06.11.2017 г. Все включенные в исследование пациенты подписали добровольное информированное согласие.
Статистический анализ
Принципы расчета размера выборки: С целью установления объема выборки, использовалась последовательная стратегия расчёта объема выборки с учетом коэффициента вариации (=среднеквадратичное отклонение от среднеарифметического в %), по результатам которой необходимый объем выборки для каждой из основных групп составил от 61 человека.
Методы статистического анализа данных: Статистическая обработка результатов осуществлялась с использованием пакета программ SPSS Statistics 23. Проверка нормальности распределения проводилась по критерию Колмагорова-Смирнова. Пороговый уровень значимости (р) был принят равным 0,05. Нормальному закону распределения подчинялись следующие параметры: гликированный гемоглобин, СКФ, трансферрин, гематокрит и количество эритроцитов. Остальные параметры, а именно: возраст, длительность заболевания диабетом, ИМТ, микроальбуминурия, креатинин крови, СРБ, ФНО-α, СОЭ, железо, ферритин, гемоглобин, ретикулоциты, лейкоциты, АСТ, АЛТ, общий холестерин, ЛПВП, ЛПНП, ЛПОНП и триглицериды не подчинялись нормальному закону распределения. С целью унификации представления данных, все результаты были представлены в виде медианы и интерквартильного размаха (Me, Q0,25–Q0,75). В целях установления значимости различий показателей между независимыми группами сравнения была проведена статистическая обработка с помощью критерия Манна–Уитни с использованием поправки Бонеферрони для четырех групп, пороговый уровень значимости был принят равным р<0,013. Для показателей, имевших нормальное распределение, проводилась статистическая обработка с помощью критерия Стьюдента. Статистическую значимость различий частоты встречаемости качественных признаков в анализируемых группах проверяли с помощью критерия χ2 Пирсона с критическим уровнем значимости р<0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
В исследование вошли 157 человек: 48 человек с сахарным диабетом 1, 81 пациент с сахарным диабетом 2 типа, 11 пациентов с ожирением, но без НУО и 17 здоровых добровольцев с нормальным ИМТ и без патологии углеводного обмена.
Среди лиц с сахарным диабетом было 43 мужчины (33,3%) и 86 (66,7%) женщин. Внутри основных групп соотношение мужчин и женщин было сопоставимым: в группе пациентов с сахарным диабетом 1 типа было 19 (39,6%) мужчин и 29 (60,4%) женщин, в группе пациентов с сахарным диабетом 2 типа – 24 (29,6%) мужчины и 57 (70,4%) женщин (χ²=1,276; p=0,259). В группе сравнения количество мужчин и женщин было практически равным: 5 мужчин (45,5%) и 6 женщин (54,5%). В группе здорового контроля, как и в основных группах, мужчин было меньше, чем женщин: 4 (23,5%) и 13 (76,5%) соответственно.
В таблице 1 приведена клиническая характеристика групп исследования.
Как видно из представленных в таблице 1 данных, основные группы 1 и 2 были сопоставимы по стажу заболевания диабетом, уровню гликированного гемоглобина и микроальбуминурии. При этом, пациенты с сахарным диабетом 2 типа имели ИМТ значимо выше, чем у пациентов с сахарным диабетом 1 типа (р<0,0001) и выше, чем у лиц группы контроля (р<0,0001). Характеристика структуры ожирения в исследуемых группах пациентов приведена в таблице 2. Как видно из представленных в таблице данных, ожирение у пациентов с сахарным диабетом 2 типа встречалось значимо чаще, чем у пациентов с сахарным диабетом 1 типа (χ²=71,257; p<0,0001). При этом в структуре ожирения у лиц с сахарным диабетом 2 типа преобладало ожирение 1 и 2 степени, а у пациентов с сахарным диабетом 1 типа ожирение встречалось только в 9,8% случаев. Уровень СКФ у пациентов с сахарным диабетом 2 типа был ниже, чем у пациентов с сахарным диабетом 1 типа (p=0,006), пациентов с ожирением (р<0,0001) и здоровых добровольцев (р<0,0001). Уровень гликированного гемоглобина как у лиц группы контроля, так и у пациентов с ожирением был значимо ниже, чем у пациентов с сахарным диабетом 1 и 2 типа (р<0,0001 во всех случаях).
Таблица 1. Клиническая характеристика групп.
|
Показатель |
Сахарный диабет 1 типа n=48 |
Сахарный диабет 2 типа n=81 |
Ожирение без НУО n=11 |
Группа контроля (здоровые) n=17 |
|
Возраст, лет |
34,00 [ 26,00–52,00] |
60,00 [ 56,00–65,00]* |
37,00 [ 25,00–49,00]# |
40,00 [ 32,00–58,00]# |
|
Стаж заболевания, лет |
9,00 [ 3,00–17,00] |
11,00 [ 8,00–15,00] |
– |
– |
|
ИМТ, кг/м кв. |
23,67 [ 21,43–26,03] |
33,80 [ 29,55–38,82]* |
36,39 [ 30,80–38,35]* |
25,10 [ 23,10–27,65]#” |
|
ОТ, см |
86,34 [ 74,43–92,33] |
106,64 [ 96,68–114,54] |
108,72 [ 99,11–118,24] |
79,34 [ 71,22–86,43] |
|
HbA1c, % |
8,80 [ 6,95–10,30] |
9,10 [ 7,97–11,03] |
5,30 [ 4,93–5,80]*# |
5,20 [ 4,90–5,85]*# |
|
СКФ, мл/мин |
95,00 [ 71,75–112,75] |
80,50 [ 63,00–93,00]* |
102,50 [ 97,50–115,25]# |
96,50 [ 93,00–106,00]# |
|
МАУ, мг/л |
20,50 [ 9,25–39,25] |
13,55 [ 8,53–30,00] |
– |
– |
|
АСТ, ЕД/л |
20,00 [ 16,60–27,00] |
19,40 [ 15,00–28,00] |
23,00 [14,00–29,00] |
20,00 [16,50–22,50] |
|
АЛТ, ЕД/л |
16,00 [ 12,00–24,00] |
20,00 [ 14,00–29,75]* |
25,00 [16,00–42,00]* |
18,00 [11,50–21,00] |
Таблица 2. Структура ожирения.
|
Наличие, степень ожирения |
Общая выборка (n=157) |
Сахарный диабет 1 типа (n=48) |
Сахарный диабет 2 типа (n=81) |
Ожирение без НУО (n=11) |
Группа контроля (здоровые) |
|
Нет ожирения, % (n) |
27,6 (43) |
62,7 (30) |
3,6 (3) |
0 (0) |
58,8 (10) |
|
Избыточная масса тела, % (n) |
23,9 (38) |
27,5 (13) |
21,4 (17) |
0 (0) |
41,2 (7) |
|
Ожирение 1 степени, % (n) |
19,6 (31) |
7,8 (4) |
27,4 (22) |
45,5 (5) |
0 (0) |
|
Ожирение 2 степени, % (n) |
17,2 (27) |
2,0 (1) |
27,4 (22) |
36,4 (4) |
0 (0) |
|
Ожирение 3 степени, % (n) |
11,7 (18) |
0 (0) |
20,2 (17) |
18,2 (2) |
0 (0) |
Среди всех пациентов с сахарным диабетом 94 человека (72,8%) на момент включения в исследование страдали гипертонической болезнью. Из них 13 человек (13,8%) не получали гипотензивную терапию, остальные 81 пациент (86,2%) получали от 1 до 4 антигипертензивных препаратов. В группе сравнения 4 пациента (36,4%) также страдали гипертонической болезнью, но ни один из них антигипертензивной терапии не получал. Пациенты группы контроля гипертонической болезнью не страдали.
Основные результаты исследования
В результате сравнительного анализа состояния воспалительного статуса в указанных группах было установлено, что содержание в крови ФНО-α было значимо выше у пациентов с сахарным диабетом 1 типа в сравнении как с пациентами с сахарным диабетом 2 типа (р<0,0001), так и с лицами группы сравнения (p=0,003) и контроля (p=0,004). При этом в группе пациентов с сахарным диабетом 2 типа была значимо выше концентрация СРБ, чем у пациентов с сахарным диабетом 1 типа (р<0,0001). У лиц групп сравнения и контроля сывороточное содержание СРБ по техническим причинам определено не было. Стоит отметить, что при сахарном диабете 2 типа уровень СОЭ был также достоверно выше, чем при сахарном диабете 1 типа (р<0,0001), ожирении без НУО (р=0,013) и контрольной группе (р<0,0001). Параметры воспаления значимо не различались у пациентов с ожирением и у здоровых добровольцев.
Были выявлены значимые различия в содержании ферритина – данный параметр был достоверно выше у пациентов с сахарным диабетом 2 типа, чем у пациентов с сахарным диабетом 1 типа (p=0,013), а также достоверно выше у лиц с ожирением, чем при 1 типе диабета (р=0,013). Между остальными параметрами обмена железа в указанных группах значимых различий выявлено не было. Результаты сравнительной оценки воспалительного статуса и феррокинетики приведены в таблице 3.
На основании результатов исследования параметров обмена железа (гемоглобин, железо сыворотки, ферритин) был установлен тип нарушения феррокинетики для всех включенных в исследование лиц (латентный дефицит железа, железодефицитная анемия, анемия хронических заболеваний). Стоит отметить, что в 2 из 157 случаев имели место признаки дисметаболической перегрузки железом, а именно: повышение содержания ферритина выше 300 нг/мл и железа сыворотки выше референтных значений. Данные случаи имели место в группе пациентов с сахарным диабетом 2 типа и в группе пациентов с ожирением без НУО. Однако выделить данные случаи в отдельную группу перегрузки железом не представлялось возможным ввиду отсутствия достаточного количества критериев диагностики: насыщение трансферрина железом и общая железосвязывающая способность сыворотки не исследовались. Частота диагностики латентного дефицита железа и анемии приведена в таблице 4.
Среди всех включенных в исследование лиц (n=157) дислипидемия была выявлена в 79% случаев (n=124), при этом стоит отметить, что в группе здоровых добровольцев дислипидемии выявлено не было. Среди пациентов с сахарным диабетом 1 типа частота дислипидемии составила 83,3%, а в группе пациентов с сахарным диабетом 2 типа – 95,1%. У пациентов с ожирением без нарушений углеводного обмена дислипидемия была выявлена в 63,6% случаев (табл. 5, рис. 1). Частота встречаемости дислипидемии в общей выборке и в отдельных группах пациентов представлена в таблице 5 и на рисунке 1.
Кроме того, было установлено, что в общей когорте пациентов с дислипидемией (n=124) преобладали пациенты с сахарным диабетом 2 типа (рис. 2), что подтверждает вклад в развитие и прогрессирование нарушений липидного обмена как функциональной активности жировой ткани, так и дисгликемии.

Рисунок 1. Частота встречаемости дислипидемии
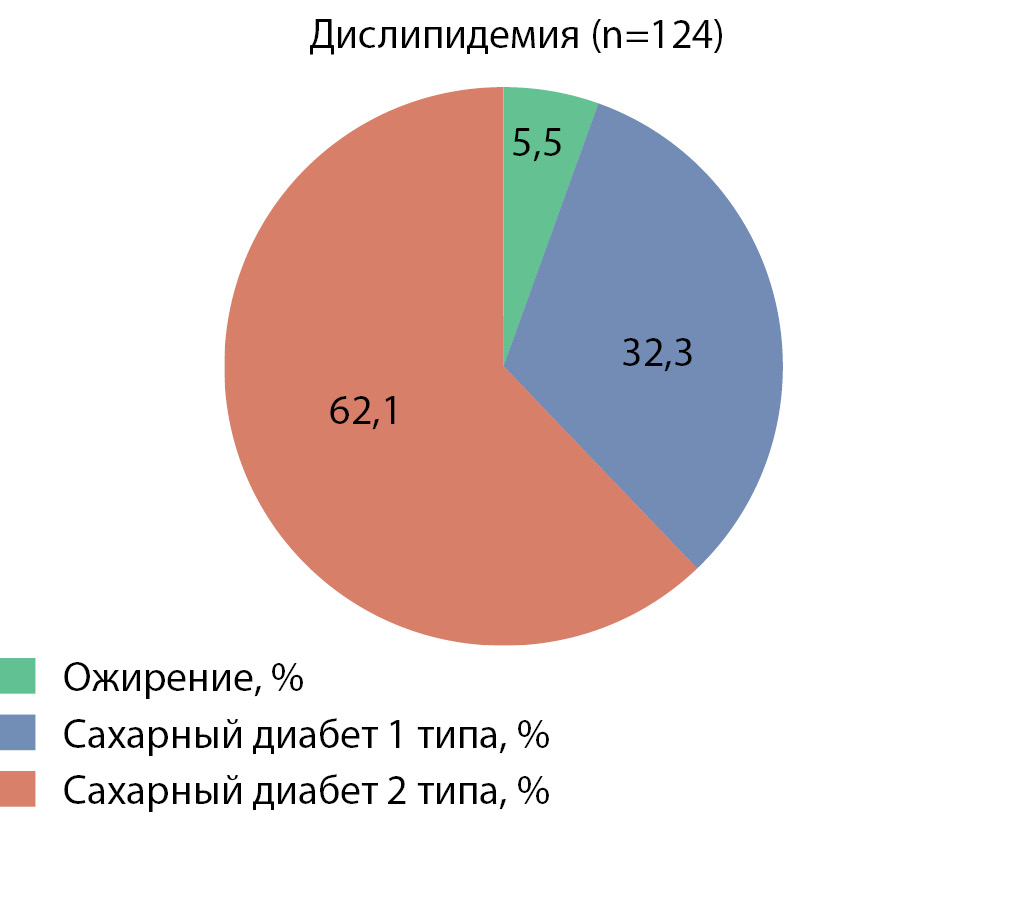
Рисунок 2. Структура дислипидемии в зависимости от типа метаболических нарушений.
Таблица 3. Параметры воспалительного статуса и обмена железа.
|
Показатель |
Сахарный диабет 1 типа |
Сахарный диабет 2 типа |
Ожирение без НУО |
Группа контроля (здоровые) |
|
ФНО-α, пг/мл |
15,28 [ 12,41–24,41] |
8,54 [ 6,27–11,60]* |
9,83 [ 5,89–14,58]* |
9,68 [ 5,68–15,38]* |
|
СРБ, нг/мл |
2,00 [ 1,05–4,05] |
7,00 [ 3,00–11,85]* |
– |
– |
|
СОЭ, мм/ч |
14,00 [ 5,00–21,25] |
18,00 [ 9,00–27,00]* |
10,00 [ 5,00–17,00]# |
7,00 [ 5,00–9,00]# |
|
Лейкоциты, ×109/л |
6,55 [ 5,30–7,83] |
7,38 [ 6,08–8,74] |
7,59 [ 5,51–8,32] |
6,08 [ 5,25–7,53] |
|
Гемоглобин, г/л |
138,50 [ 122,50–151,00] |
141,00 [ 125,25–151,00] |
150,00 [ 138,00–159,00] |
146,00 [ 135,00–150,00] |
|
Эритроциты, ×1012/л |
4,69 [ 4,38–5,09] |
4,79 [ 4,39–5,19] |
5,24 [ 4,60–5,44] |
4,80 [ 4,49–5,02] |
|
Ретикулоциты, % |
1,51 [ 1,12–1,75] |
1,76 [ 1,54–1,91] |
1,53 [ 1,20–2,27] |
1,60 [ 1,40–1,66] |
|
Гематокрит, % |
40,95 [ 38,40–43,65] |
42,05 [ 38,00–44,55] |
43,95 [ 41,45–47,73] |
42,70 [ 40,70–44,85] |
|
Железо, мкмоль/л |
12,00 [ 8,00–17,00] |
13,00 [ 11,00–18,25] |
19,00 [ 11,75–23,25] |
16,00 [ 11,00–20,50] |
|
Ферритин, нг/мл |
44,48 [ 18,35–148,50] |
96,52 [ 42,93–189,70]* |
97,60 [ 21,70–445,60]* |
72,05 [ 43,23–148,60] |
|
Трансферрин, мг/дл |
284,00 [ 250,00–334,00] |
293,00 [ 267,00–321,50] |
270,00 [ 207,00–346,00] |
267,50 [ 208,75–306,50] |
|
рТФР, нг/мл |
136,72 [ 119,85–157,09] |
121,01 [ 113,74–141,95] |
117,52 [ 109,38–121,59] |
116,36 [ 107,05–119,85] |
|
Гепсидин, пг/мл |
9798,00 [ 3737,00–12667,00] |
7697,00 [ 3434,50–11454,50] |
– |
– |
Таблица 4. Структура анемического синдрома.
|
Общая выборка (n=157) |
Сахарный диабет 1 типа (n=48) |
Сахарный диабет 2 типа (n=81) |
Ожирение без НУО (n=11) |
Группа контроля (здоровые) (n=17) |
|
|
Нет анемии, % (n) |
51,0 (80) |
43,8 (21) |
50,6 (41) |
54,5 (6) |
70,6 (12) |
|
Латентный дефицит железа, % (n) |
28,7 (45) |
27,1 (13) |
30,9 (25) |
18,2 (2) |
29,4 (5) |
|
Железодефицитная анемия, % (n) |
9,6 (15) |
16,7 (8) |
7,4 (6) |
9,1 (1) |
0 (0) |
|
Анемия хронических заболеваний, % (n) |
9,6 (15) |
12,5 (6) |
9,9 (8) |
9,1 (1) |
0 (0) |
Таблица 5. Частота встречаемости дислипидемии в общей выборке и в отдельных группах пациентов.
|
Общая выборка (n=157) |
Сахарный диабет 1 типа (n=48) |
Сахарный диабет 2 типа (n=81) |
Ожирение без НУО |
Группа контроля (здоровые) (n=17) |
|
|
Дислипидемия, % (n) |
79 (124) |
83,3 (40) |
95,1 (77) |
63,6 (7) |
0,0 (0) |
|
Нет дислипидемии, % (n) |
21 (33) |
16,7 (8) |
4,9 (4) |
36,4 (4) |
100,0 (17) |
Среди всех пациентов с дислипидемией (n=124) липид-корригирующую терапию на момент включения в исследование получали только 25,8% пациентов (n=32), тогда как остальные 74,2% человек (n=92) никаких препаратов, направленных на коррекцию липидного обмена, не принимали. Стоит отметить, что все принимавшие липид-корригирующие препараты получали препараты из группы статинов. В группе пациентов с сахарным диабетом 1 типа и дислипидемией частота приема статинов составила 12,5% (n=5), в группе пациентов с сахарным диабетом 2 типа – 35,1% (n=27), среди пациентов с ожирением без патологии углеводного обмена ни один человек статины не принимал (табл. 6). Как видно из представленных данных, в целом приверженность пациентов к липид-корригирующей терапии была достаточно низкой.
Среди пациентов с дислипидемией, не принимавших на момент включения в исследование препаратов, направленных на коррекцию нарушений липидного обмена (n=91), был проведен анализ типов дислипидемии по классификации D. Fredrickson [3], результат анализа представлен в таблице 7 и на рисунке 3.
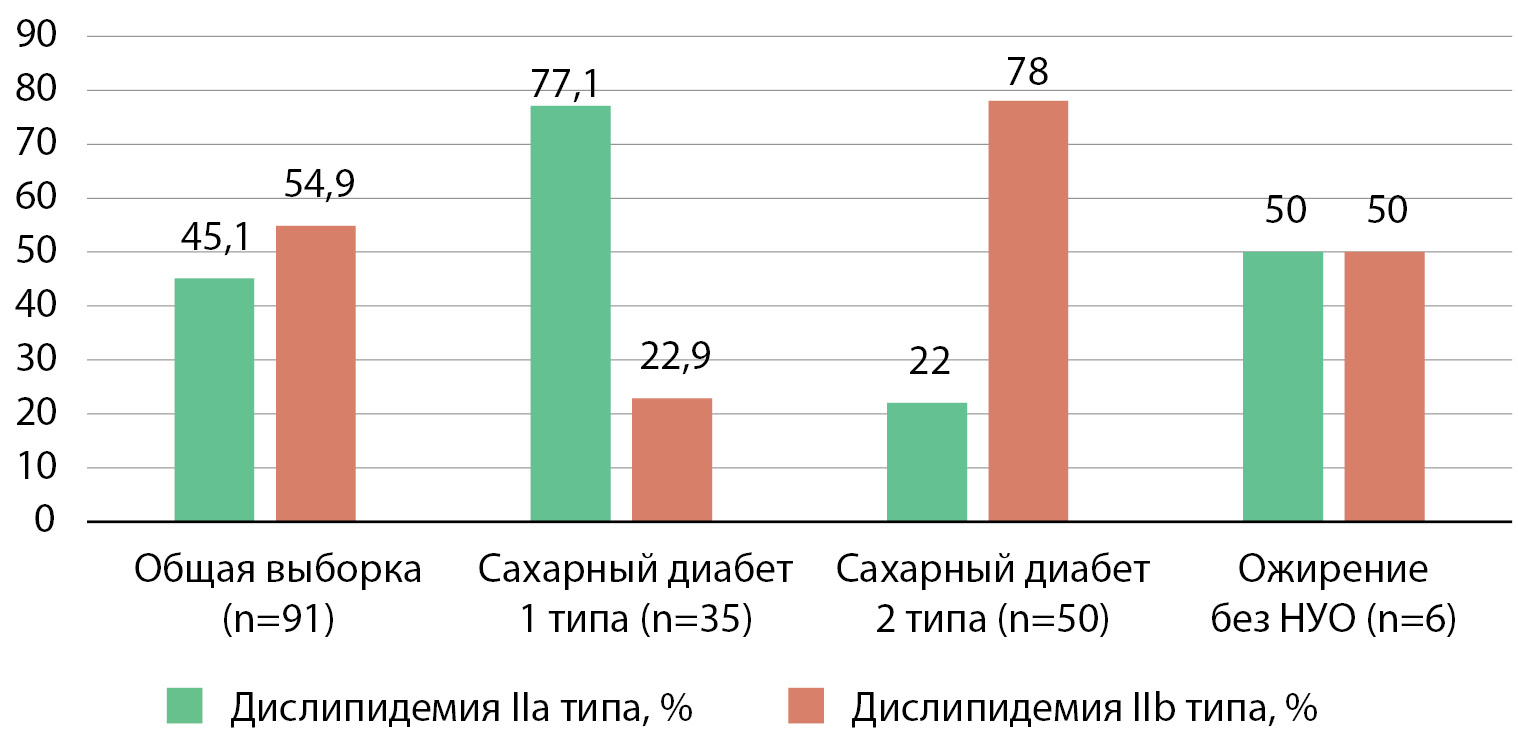
Рисунок 3. Характеристика дислипидемии по классификации D. Fredrickson [20] в общей выборке лиц и в отдельных группах пациентов
Таким образом, в группе пациентов с сахарным диабетом 2 типа преобладал наиболее атерогенный тип дислипидемии, в то время как у пациентов с ожирением различий в частоте встречаемости дислипидемии типа IIa и типа IIb выявлено не было, а у пациентов с сахарным диабетом 1 типа чаще встречался менее атерогенный фенотип дислипидемии (χ²=34,051; p<0,0001).
Были выявлены значимые различия отдельных показателей липидного спектра в зависимости от наличия и вида сахарного диабета. Так, у пациентов с сахарным диабетом 2 типа были достоверно выше уровни ЛПОНП-холестерина (р<0,0001), триглицеридов (р<0,0001), и коэффициент атерогенности (р<0,0001), а уровень ЛПВП-холестерина – значимо ниже (р<0,0001) в сравнении с аналогичными показателями в группе пациентов с сахарным диабетом 1 типа (табл. 7). Кроме того, показатели ЛПОНП-холестерина и триглицеридов при сахарном диабете 2 типа были выше в сравнении с таковыми у пациентов с ожирением, но без нарушений углеводного обмена (p=0,040 и р=0,019 соответственно) (табл. 8). При этом не наблюдалось значимых различий между содержанием компонентов холестерина у пациентов с сахарным диабетом 1 типа и пациентов с ожирением без диабета, а также пациентов группы здорового контроля (табл. 8). Сравнительная характеристика параметров липидного спектра в указанных группах представлена в таблице 8.
Среди пациентов с сахарным диабетом и дислипидемией (n=117) был проведен сравнительный анализ между маркерами неспецифического воспаления и параметрами феррокинетики в зависимости от типа дислипидемии и независимо от факта приема статинов. Результаты анализа представлены в таблице 9.
Как видно из представленной таблицы, у пациентов с сахарным диабетом и дислипидемией IIb уровень таких воспалительных маркеров, как СРБ, СОЭ и ферритин был значимо выше, чем у пациентов с сахарным диабетом и менее атерогенной дислипидемией IIa типа. При этом содержание в крови ФНО-α и концентрация гепсидина, обычно повышенные в условиях воспаления, было выше у пациентов с дислипидемией IIa типа.
Поскольку в структуре дислипидемии при сахарном диабете 1 типа преобладала дислипидемия IIa, а при сахарном диабете 2 типа – дислипидемия IIb, с целью уточнения степени влияния типа дислипидемии и типа сахарного диабета на состояние воспалительного статуса, был проведен анализ параметров воспалительного ответа во вновь сформированных подгруппах, где выбраны пациенты с сахарным диабетом 1 и 2 типа и минорным для данного типа диабета вариантом дислипидемии. Таким образом сформированы следующие подгруппы: 1) сахарный диабет 1 типа в сочетании с IIb дислипидемией 2) сахарный диабет 2 типа в сочетании с IIа дислипидемией. Результаты данного субанализа приведены в таблице 10.
Таблица 6. Частота приема статинов у лиц с дислипидемией в общей выборке и в отдельных группах пациентов.
|
Общая выборка (n=124) |
Сахарный диабет 1 типа (n=40) |
Сахарный диабет 2 типа (n=77) |
Ожирение без НУО (n=7) |
|
|
Принимали статины, % (n) |
25,8 (32) |
12,5 (5) |
35,1 (27) |
0 (0) |
|
Не принимали статины, % (n) |
74,2 (92) |
87,5 (35) |
64,9 (50) |
100,0 (7) |
Таблица 7. Характеристика дислипидемии по классификации D. Fredrickson [20] в общей выборке лиц и в отдельных группах пациентов.
|
Общая |
Сахарный диабет 1 типа |
Сахарный диабет 2 типа |
Ожирение |
|
|
Дислипидемия IIa типа, % (n) |
45,1 (41) |
77,1 (27) |
22,0 (11) |
50,0 (3) |
|
Дислипидемия IIb, типа, % (n) |
54,9 (50) |
22,9 (8) |
78,0 (39) |
50,0 (3) |
Таблица 8. Сравнительная характеристика параметров липидного спектра.
|
Сахарный диабет 1 типа (n=48) |
Сахарный диабет 2 типа (n=81) |
Ожирение без НУО (n=11) |
Группа контроля (здоровые) (n=17) |
|
|
Общий холестерин, ммоль/л |
4,98 [ 4,33–5,68] |
5,41 [ 4,58–6,40] |
5,00 [ 4,60–6,00] |
4,90 [ 4,50–5,35] |
|
ЛПВП-холестерин, ммоль/л |
1,50 [ 1,23–1,84] |
1,04 [ 0,90–1,30]* |
1,25 [ 1,03–1,50] |
1,60 [ 1,33–1,90]** |
|
ЛПНП-холестерин, ммоль/л |
2,95 [ 2,55–3,28] |
3,25 [ 2,28–4,00] |
2,95 [ 2,63–3,61] |
3,00 [ 2,25–3,24]** |
|
ЛПОНП-холестерин, ммоль/л |
0,50 [ 0,36–0,68] |
1,00 [ 0,73–1,31]* |
0,68 [ 0,55–0,98]** |
0,41 [ 0,29–0,70]** |
|
Триглицериды, ммоль/л |
1,05 [ 0,73–1,58] |
2,20 [ 1,60–2,70]* |
1,45 [ 1,25–2,13]** |
0,90 [ 0,65–1,45]** |
|
Коэффициент атерогенности |
2,38 [ 1,80–3,83] |
4,00 [ 2,95–5,11]* |
3,20 [ 2,15–4,50] |
2,30 [ 1,88–2,85]** |
Таблица 9. Характеристика воспалительного статуса и состояния обмена железом у пациентов с сахарным диабетом в зависимости от типа дислипидемии.
|
Показатель |
Дислипидемия IIa типа |
Дислипидемия IIb типа |
|
ФНО-α, пг/мл |
13,21 [ 9,15–24,02] |
9,78 [ 7,15–13,92]* |
|
СРБ, нг/мл |
3,00 [ 1,80–8,70] |
6,9 [ 3,00–12,35]* |
|
СОЭ, мм/час |
15,00 [ 5,00–24,50] |
20,00 [ 10,00–30,00]* |
|
Лейкоциты, ×109/л |
6,96 [ 5,95–7,93] |
7,51 [ 6,12–8,98] |
|
Гепсидин, пг/мл |
11414,00 [ 5040,25–13404,00] |
7414,00 [ 2929,50–10282,75]* |
|
Ферритин, нг/мл |
50,90 [ 19,58–114,10] |
114,80 [ 48,90–196,45]* |
|
Железо, мкмоль/л |
12,00 [ 8,00–18,00] |
12,00 [ 10,25–18,75] |
|
Трансферрин, мг/дл |
300,00 [ 245,00–320,00] |
286,00 [ 263,50–320,00] |
|
рТФР, нг/мл |
139,05 [ 120,43–161,16] |
126,54 [ 115,05–141,38] |
|
Эритроциты, ×1012/л |
4,70 [ 4,40–5,08] |
4,77 [ 4,39–5,16] |
|
Гемоглобин, г/л |
139,00 [ 123,50–151,00] |
141,00 [ 126,50–151,00] |
|
Гематокрит, % |
41,20 [ 37,65–43,50] |
41,90 [ 38,08–44,53] |
|
Ретикулоциты, % |
1,53 [ 1,25–1,78] |
1,76 [ 1,46–1,95] |
Таблица 10. Состояние параметров воспаления в зависимости от типа диабета и дислипидемии.
|
Показатель |
Сахарный диабет 1 типа и Дислипидемия IIb типа |
Сахарный диабет 2 типа и Дислипидемия IIa типа |
|
ФНО-α, пг/мл |
14,60 [ 9,78–24,02] |
8,61 [ 6,93–13,14]* |
|
СРБ, нг/мл |
4,00 [ 1,65–19,48] |
7,00 [ 5,00–12,00] |
|
СОЭ, мм/час |
43,00 [ 14,00–56,50] |
22,00 [ 5,00–27,25] |
|
Лейкоциты, ×109/л |
7,02 [ 6,37–10,47] |
7,37 [ 6,44–9,60] |
|
Гепсидин, пг/мл |
9838,00 [ 4216,90–12828,50] |
11717,00 [ 8161,75–13404,00] |
|
Ферритин, нг/мл |
151,20 [ 38,95–270,95] |
61,57 [ 31,46–138,85] |
Стоит отметить, что достоверные различия в указанных группах были получены только для концентрации ФНО-α – данный параметр был значимо выше у лиц с сочетанием сахарного диабета 1 типа и дислипидемии IIb (р=0,05). Данный результат указывает на более значимый вклад типа сахарного диабета (СД1), нежели типа дислипидемии в повышение уровня ФНО-α. Для остальных параметров воспаления уровень статистической значимости различий достигнут не был. Однако обращает внимание явная тенденция к повышению СОЭ и ферритина в подгруппе пациентов с сочетанием сахарного диабета 1 типа и дислипидемии IIb типа, несмотря на то, что данные маркеры были значимо выше у лиц с сахарным диабетом 2 типа вне зависимости от типа дислипидемии.
В общей выборке пациентов с сахарным диабетом и 1, и 2 типа был проведен частотный анализ, который показал, что у пациентов с сахарным диабетом и АХЗ преобладал наиболее атерогенный тип дислипидемии (IIb по D. Fredrickson), тогда как у пациентов с диабетом и ЖДА чаще встречался IIa фенотип (χ²=2,743; p=0,098) (рис. 4).
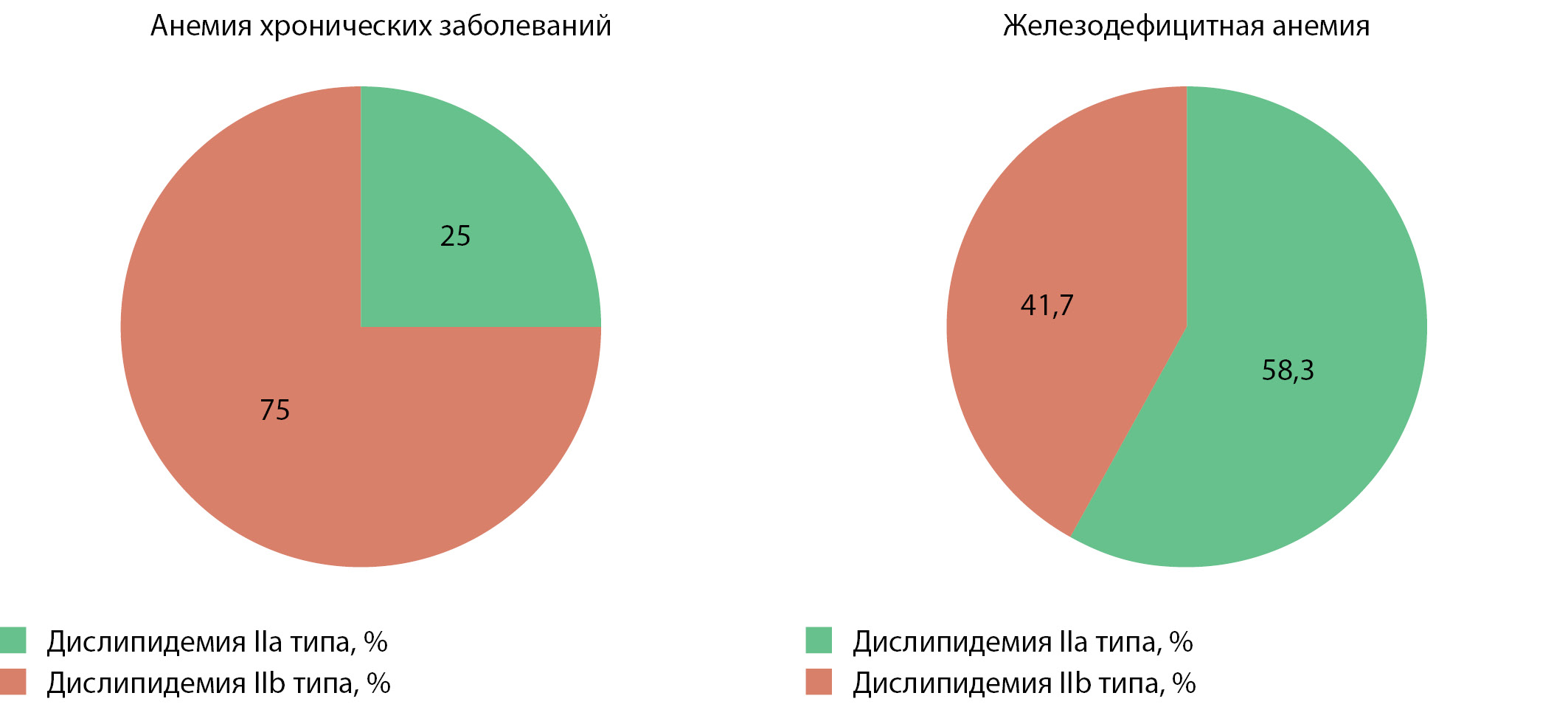
Рисунок 4. Структура дислипидемии у пациентов с сахарным диабетом и анемическим синдромом.
Также была проведена оценка параметров липидного спектра у пациентов с сахарным диабетом 1 и 2 типа в зависимости от наличия и вида анемического синдрома. Результаты представлены в таблице 11.
Таблица 11. Состояние липидного спектра у пациентов в зависимости от наличия и вида анемии
|
ЖДА |
АХЗ |
Латентный дефицит железа |
Нет анемии |
|
|
Общий холестерин, ммоль/л |
4,75 [ 4,41–5,28] |
5,60 [ 5,10–7,05]* |
5,48 [ 4,70–6,48] |
5,20 [ 4,33–6,35] |
|
ЛПВП-холестерин, ммоль/л |
1,32 [ 0,99–1,79] |
1,11 [ 0,85–1,55] |
1,25 [ 1,00–1,70] |
1,20 [ 1,00–1,50] |
|
ЛПНП-холестерин, ммоль/л |
2,60 [ 2,25–3,26] |
3,46 [ 3,09–4,42]* |
2,95 [ 2,52–3,91] |
3,10 [ 2,35–3,94] |
|
ЛПОНП-холестерин, ммоль/л |
0,68 [ 0,52–1,05] |
0,95 [ 0,53–1,75] |
0,59 [ 0,41–1,26] |
0,82 [ 0,60–1,18] |
|
Триглицериды, ммоль/л |
1,39 [ 0,96–2,28] |
2,50 [ 1,45–3,10]* |
1,80 [ 0,98–2,55] |
1,80 [ 1,14–2,50] |
|
Коэффициент атерогенности |
2,92 [ 1,95–4,95] |
4,05 [ 2,47–5,23] |
3,00 [ 2,36–4,00] |
3,40 [ 2,28–4,99] |
Как видно из приведенной таблицы, были получены значимые различия содержания общего холестерина, ЛПНП-холестерина и триглицеридов крови в зависимости от вида анемии – у лиц с сахарным диабетом и анемией хронических заболеваний данные показатели были значимо выше, чем у пациентов с сахарным диабетом и сидеропенической анемией. Можно предположить, что данные отличия обусловлены как влиянием субклинического воспаления на развитие АХЗ, так и его ролью в формировании и прогрессировании дислипидемии, а также потенциальным взаимоотягощающим эффектом нарушений феррокинетики, обмена липидов и воспаления.
Нежелательные явления
Нежелательных явлений в ходе исследования отмечено не было.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Таким образом, в результате проведенного нами исследования было установлено, что у пациентов с сахарным диабетом как 1, так и 2 типа, имеет место повышение содержания в крови воспалительных маркеров, таких как ФНО-α, СОЭ и СРБ, относительно пациентов с ожирением без НУО и лиц группы здорового контроля. При этом наибольшая концентрация ФНО-α отмечалась у пациентов с сахарным диабетом 1 типа, а повышение концентрации СРБ и СОЭ – у пациентов с сахарным диабетом 2 типа. Также было установлено, что в группе обследованных сахарный диабет 2 типа характеризуется более частым развитием дислипидемии, в структуре которой преобладает более атерогенный тип согласно классификации D. Fredrickson – дислипидемия IIb, тогда как у пациентов с сахарным диабетом 1 типа чаще встречается IIa дислипидемия. В структуре обследованных нами лиц с сахарным диабетом (вне зависимости от его типа) дислипидемия IIb в сравнении с менее атерогенной IIa дислипидемией характеризовалась более высокими значениями маркеров воспаления – СРБ, СОЭ и ферритина. Анемия хронических заболеваний при сахарном диабете в сравнении с сидеропенической анемией чаще сопровождается дислипидемией IIb и характеризуется более высоким содержанием атерогенных фракций холестерина.
Обсуждение основного результата исследования
ФНО-α является одним из основных провоспалительных цитокинов и представляет собой пептид с низкой молекулярной массой, который в естественных условиях синтезируется многими типами клеток: мононуклеарными фагоцитами, лимфоцитами, базофилами, эозинофилами, моноцитами, тканевыми макрофагами, нейтрофилами, а также фибробластами и клетками эндотелия сосудов [21]. Известно, что ФНО-α взаимодействует с двумя различными рецепторами – рецептором ФНО 1 (TNFR1) и рецептором ФНО 2 (TNFR2), и реализует провоспалительные эффекты за счёт NF-kB регулируемых белков, таких как IL-6, IL-8, IL-18 и хемокины. Кроме того, через активацию NF- kB ФНО-α способен индуцировать экспрессию самого себя [22]. Еще одним известным источником продукции ФНО-α являются адипоциты, при этом имеются данные о том, что при наличии ожирения способность адипоцитов к синтезу данного цитокина значительно возрастает [23]. Это обуславливает повышение уровня ФНО-α у пациентов с ожирением и синдромом инсулинорезистентности, а также снижение его экспрессии и концентрации в крови при уменьшении массы тела [24]. ФНО-α нарушает чувствительность к инсулину и стимулирует липолиз [25], участвуя в патогенезе сахарного диабета 2 типа.
Имеются данные, подтверждающие важную роль ФНО-α в развитии атеросклероза: как за счет повышения свободных жирных кислот с формированием атерогенного липидного профиля, так и за счет влияния данного цитокина на эндотелий. ФНО-α повышает синтез адгезивных молекул эндотелиальными и гладкомышечными клетками, способствуя проникновению воспалительных клеток в сосудистую стенку, а также – уменьшает образование оксида азота, что угнетает дилатацию сосудов и способствует дисфункции эндотелия [26].
С учетом представленных данных литературы, в нашем исследовании максимальное повышение ФНО-α, как маркера воспаления, ожидалось в группе пациентов с сахарным диабетом 2 типа – данная когорта пациентов характеризовалась достоверно более высоким ИМТ, а также более атерогенным липидным профилем в сравнении с пациентами с сахарным диабетом 1 типа. Однако, согласно результатам исследования, наибольшее повышение сывороточной концентрации ФНО-α имело место именно у пациентов с сахарным диабетом 1 типа. Более того, уровень данного цитокина был значимо выше у лиц с сочетанием сахарного диабета (независимо от типа) и менее атерогенной дислипидемией IIa, чем у пациентов с сахарным диабетом и более атерогенным липидным профилем (IIb дислипидемия). С учетом проведенного нами субанализа, это связано с тем, что дислипидемия IIa типа значимо чаще встречалась у лиц с сахарным диабетом 1 типа.
В то же время полученные нами результаты в отношении содержания в крови ФНО-α согласуются с некоторыми данными литературы. Так, имеются работы, в которых отмечается повышение концентрации ФНО-α в сыворотке крови больных сахарным диабетом 1 типа, особенно – на начальных стадиях заболевания, а также при развитии микроангиопатий [27, 28, 29]. Роль ФНО-α в патогенезе сахарного диабета 1 типа обусловлена способностью данного цитокина стимулировать пролиферацию аутореактивных лимфоцитов, а также вызывать аберрантную экспрессию молекул адгезии и антигенов гистосовместимости II класса на поверхности панкреатических клеток, что приводит к нарушению процессов распознавания антигенов и способствует развитию аутоиммунного инсулита. Кроме того, одним из основных биологических свойств ФНО-α является его участие в рецепторном пути апоптоза иммунокомпетентных клеток [30].
Таким образом, повышение продукции ФНО-α при сахарном диабете, с одной стороны, может быть следствием ожирения, дисгликемии и отражать развитие и прогрессирование микрососудистых осложнений на фоне эндотелиальной дисфункции. С другой стороны – нарушения в системе ФНО-α могут являться первичными, генетически детерминированными и обуславливать, наряду с другими механизмами, иммунопатогенез аутоиммунного сахарного диабета [29].
Стоит отметить и обсудить тот факт, что более низкие значения ФНО-α в группе пациентов с сахарным диабетом 2 типа, согласно результатам нашего исследования, могут быть обусловлены приемом метформина большинством пациентов данной группы. Имеются данные о противовоспалительной активности метформина как in vivo, так и in vitro. Так, в опыте с гепатоцитами животных метформин подавлял ФНО-α индуцированную деградацию негативного регулятора NF- kB IkB, в результате чего имело место ингибирование экспрессии IL-1β и IL-6 [31]. Кроме того, терапия метформином в сочетании с пиоглитазоном в течение 6 месяцев у пациентов с сахарным диабетом и ишемической болезнью сердца приводила к статистически значимому снижению уровней ФНО-α и IL-6 [32].
С-реактивный белок является неспецифическим биологическим маркером воспаления, синтезируемым преимущественно печенью и в меньшей степени эндотелиальными клетками [33]. Повышение СРБ у пациентов с сахарным диабетом 2 типа, в нашем исследовании, а также максимальная его продукция у лиц с сочетанием сахарного диабета и дислипидемии IIb типа соотносится с результатами литературы [5][6][8][33]. Известно, что СРБ является независимым предиктором сердечно-сосудистых исходов [34] – повышенный уровень данного цитокина ассоциирован не только с риском развития сахарного диабета, артериальной гипертонии и наличием атеросклероза, но и позволяет предсказать развитие основных сердечно-сосудистых событий и смерти, тогда как снижение концентрации СРБ сопровождается уменьшением риска по шкале Framingham. Механизм атерогенного влияния СРБ заключается в подавлении эндотелиального синтеза оксида азота, стимуляции образования сосудосуживающего эндотелина-1 и IL-6, а также повышении экспрессии молекул адгезии и фактора хемотаксиса моноцитов-1 (MCP-1) [35].
Ферритин сыворотки является одним из основных белков, отражающих запас железа в организме. Как правило, гиперферритинемия является отражением нарушений обмена железа, а именно – признаком формирующегося или уже сформированного синдрома перегрузки железом. Однако помимо основной функции регуляции феррокинетики, ферритин играет важную роль в других процессах. Так, концентрация сывороточного ферритина повышается при наличии активного воспалительного процесса в организме, причем здесь его роль изучена недостаточно [36]. Кроме того, было установлено, что сывороточный ферритин имеет довольно высокую чувствительность и специфичность в качестве предиктора сахарного диабета 2 типа у пациентов с хроническим гепатитом (как вирусной, так и неуточненной этиологии), что позволяет использовать его как дополнительный критерий для выявления нарушений углеводного обмена при наличии хронической патологии печени [36]. В нашем исследовании повышение продукции ферритина у пациентов с сахарным диабетом 2 типа относительно лиц группы здорового контроля и пациентов с сахарным диабетом 1 типа наиболее вероятно было обусловлено мезенхимальной реакцией печени воспалительного характера и формированием неалкогольного стеатогепатоза. Об этом же свидетельствует более высокая концентрация ферритина у пациентов с наиболее атерогенной дислипидемией IIb независимо от типа сахарного диабета.
Стоит отметить, что ни в российской, ни в зарубежной литературе не представлено результатов исследования параметров феррокинетики в зависимости от состояния обмена липидов, в том числе у лиц с патологией углеводного обмена. Полученные в ходе нашего исследования результаты свидетельствуют о более атерогенном липидном профиле у лиц с анемией хронических заболеваний в сравнении с железодефицитной анемией и могут отражать влияние хронического низкоинтенсивного воспаления при сахарном диабете как на состояние обмена железа, так и на липидный профиль.
Ограничения исследования
Ограничением данного исследования можно считать относительно небольшой объем групп контроля и сравнения, а также недостаточный объем выборок, сформированных для дополнительного субанализа у пациентов с сахарным диабетом 1 и 2 типа и минорным для данного типа диабета вариантом дислипидемии, в связи с чем достоверные отличия внутри данных выборок были получены только для уровня ФНО-α. Увеличение объема данных выборок может способствовать уточнению влияния характера дислипидемии и типа сахарного диабета на состояние воспалительного статуса пациентов.
ЗАКЛЮЧЕНИЕ
Таким образом, в результате данного исследования впервые проведен сравнительный анализ фенотипов воспалительного статуса в зависимости от типа сахарного диабета и дислипидемии (согласно классификации D. Fredrickson). Установлено, что сахарный диабет 1 типа ассоциирован с увеличением содержания ФНО-α в крови, а сахарный диабет 2 типа – с повышением концентраций СРБ, ферритина и СОЭ. Дислипидемия IIb типа у пациентов с сахарным диабетом (независимо от его типа) сопровождается повышением значений таких провоспалительных маркеров, как СРБ, ферритин и СОЭ, тогда как дислипидемия IIa характеризуется более высокими значениями ФНО-α и гепсидина.
Иными словами, для лиц с сахарным диабетом 2 типа и более атерогенным профилем дислипидемии (IIb тип) характерен фенотип локальной воспалительной мезенхимальной реакции печени с повышением острофазных белков, имеющих преимущественно печеночное происхождение (СРБ, ферритин), а для лиц, страдающих сахарным диабетом 1 типа и имеющих менее атерогенный липидный профиль (IIa тип) – фенотип аутоиммунного, генетически детерминированного воспалительного ответа.
Установлено, что развивающаяся на фоне сахарного диабета анемия хронических заболеваний ассоциирована с более атерогенным липидным профилем, в сравнении с сидеропенической анемией. Оценка состояния обмена железа в зависимости от характера нарушений липидного обмена у пациентов с сахарным диабетом, согласно данным литературы, проведена впервые, и требует дальнейшего изучения на расширенных выборках пациентов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено при финансовом обеспечении грантом РФФИ Аспиранты №19-315-90061 «Взаимосвязь нарушений феррокинетики и метаболических изменений при сахарном диабете».
The reported study was funded by RFBR according to the research project №19-315-90061 «Research of carbohydrate metabolism compensation parameters and glycaemia lability in ferrokinetics disorder among patients with diabetes mellitus».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Мусина Надежда Нурлановна – разработка концепции и дизайна исследования, сбор материала, анализ и интерпретация данных, подготовка текста статьи, внесение правок согласно требованиям рецензентов; Саприна Татьяна Владимировна – разработка концепции и дизайна, написание обоснования рукописи и проверка критически важного интеллектуального содержания, внесение правок согласно требованиям рецензентов, окончательное утверждение рукописи для публикации; Прохоренко Татьяна Сергеевна – сбор материала, анализ и интерпретация данных, написание обоснования рукописи и проверка критически важного интеллектуального содержания; Зима Анастасия Павловна – анализ и интерпретация данных, написание обоснования рукописи и проверка критически важного интеллектуального содержания. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Rabinovitch A, Suarez-Pinzon WL. Roles of cytokines in the pathogenesis and therapy of type 1 diabetes. Cell Biochem Biophys. 2007;48(2-3):159-163. doi: https://doi.org/10.1007/s12013-007-0029-2
2. Schneider-Brachert W, Tchikov V, Neumeyer J, et al. Compartmentalization of TNF Receptor 1 Signaling. Immunity. 2004;21(3):415-428. doi: https://doi.org/10.1016/jjmmuni.2004.08.017
3. Uno S, Imagawa A, Okita K, et al. Macrophages and dendritic cells infiltrating islets with or without beta cells produce tumour necrosis factor-а in patients with recentonset type 1 diabetes. Diabetologia. 2007;50(3):596-601. doi: https://doi.org/10.1007/s00125-006-0569-9
4. Климонтов В.В., Тян Н.В., Фазуллина О.Н., и др. Клинические и метаболические факторы, ассоциированные с хроническим воспалением низкой интенсивности, у больных сахарным диабетом 2 типа // Сахарный диабет. - 2016. —Т. 19. - №4. -С. 295-302. doi: https://doi.org/10.14341/DM7928
5. Wang Z, Shen X-H, Feng W-M, Ye G, Qiu W, Li B. Analysis of Inflammatory Mediators in Prediabetes and Newly Diagnosed Type 2 Diabetes Patients. J Diabetes Res. 2016;2016(4):1-10. doi: https://doi.org/10.1155/2016/7965317
6. Yamamoto Y, Yamamoto H. RAGE-Mediated Inflammation, Type 2 Diabetes, and Diabetic Vascular Complication. Front Endocrinol (Lausanne). 2013;4(4):1-10. doi: https://doi.org/10.3389/fendo.2013.00105
7. Esser N, Legrand-Poels S, Piette J, Scheen AJ, Paquot N. Inflammation as a link between obesity, metabolic syndrome and type 2 diabetes. Diabetes Res Clin Pract. 2014;105(2):141-150. doi: https://doi.org/10.1016/j.diabres.2014.04.006
8. Dandona P, Aljada A, Chaudhuri A, Bandyopadhyay A. The Potential Influence of Inflammation and Insulin Resistance on the Pathogenesis and Treatment of Atherosclerosis-Related Complications in Type 2 Diabetes. J Clin Endocrinol Metab. 2003;88(6):2422-2429. doi: https://doi.org/10.1210/jc.2003-030178
9. Donath MY, Gross DJ, Cerasi E, Kaiser N. Hyperglycemia-induced beta-cell apoptosis in pancreatic islets of Psammomys obesus during development of diabetes. Diabetes. 1999;48(4):738-744. doi: https://doi.org/10.2337/diabetes.48.4738
10. Kluppelholz B, Thorand B, Koenig W, et al. Association of subclinical inflammation with deterioration of glycaemia before the diagnosis of type 2 diabetes: the KORA S4/F4 study. Diabetologia. 2015;58(10):2269-2277. doi: https://doi.org/10.1007/s00125-015-3679-4
11. Ammirati E, Moroni F, Norata GD, Magnoni M, Camici PG. Markers of Inflammation Associated with Plaque Progression and Instability in Patients with Carotid Atherosclerosis. Mediators Inflamm. 2015;2015(10):1-15. doi: https://doi.org/10.1155/2015/718329
12. Soeki T, Sata M. Inflammatory Biomarkers and Atherosclerosis. Int Heart J. 2016;57(2):134-139. doi: https://doi.org/10.1536/ihj.15-346
13. Hameed I, Masoodi SR, Mir SA, et al. Type 2 diabetes mellitus: From a metabolic disorder to an inflammatory condition. World J Diabetes. 2015;6(4):598. doi: https://doi.org/10.4239/wjd.v6.i4.598
14. Ganz T. Anemia of Inflammation. N Engl J Med. 2019;381(12):1148-1157. doi: https://doi.org/10.1056/NEJMra1804281
15. Куфелкина Т.Ю., Валеева Ф.В. Анемия у больных сахарным диабетом 1 типа // Сахарный диабет. - 2010. - №4 - С.49-53. doi: https://doi.org/10.14341/2072-0351-6057
16. Семакова А.Д., Брыкова Я.И., Силина М.Н., Волынкина А.П. Оценка распространенности анемии у больных с сахарным диабетом // Центральный научный вестник. - 2019. - Т. 7. - №72 - С. 7-8.
17. Мартынов С.А., Шестакова М.В., Шилов Е.М., Шамхалова М.Ш., и др. Распространенность анемии у больных сахарным диабетом 1 и 2 типа с поражением почек. // Сахарный диабет. - 2017. -Т.20. - №5 - С.318-328. doi: https://doi.org/10.14341/DM9369
18. Румянцев А.Г., Масчан А.А., Чернов В.М., Тарасова И.С. ФГБУ «ФНКЦ ДГОИ имени Дмитрия Рогачева» Минздрава России; Общественная организация Национальное общество детских гематологов, онкологов. Федеральные клинические рекомендации по диагностике и лечению железодефицитной анемии. - 2015.
19. Румянцев А.Г., Масчан А.А.; ФГБУ «ФНКЦ ДГОИ имени Дмитрия Рогачева» Минздрава России; Общественная организация Национальное общество детских гематологов, онкологов. Федеральные клинические рекомендации по диагностике и лечению анемии хронических болезней. - 2014.
20. Fredrickson DS, Lees RS. Editorial. Circulation. 1965;31(3):321-327. doi: https://doi.org/10.1161/01.CIR.31.3321
21. Kalliolias GD, Ivashkiv LB. TNF biology, pathogenic mechanisms and emerging therapeutic strategies. Nat Rev Rheumatol. 2016;12(1):49-62. doi: https://doi.org/10.1038/nrrheum.2015.169
22. Aggarwal BB. Signalling pathways of the TNF superfamily: a double-edged sword. Nat Rev Immunol. 2003;3(9):745-756. doi: https://doi.org/10.1038/nri1184
23. Hotamisligil GS. Molecular mechanisms of insulin resistance and the role of the adipocyte. Int J Obes. 2000. doi: https://doi.org/10.1038/sj.ijo.0801497
24. Hauner H, Petruschke T, Russ M, Rohrig K, Eckel J. Effects of tumour necrosis factor alpha (TNFa) on glucose transport and lipid metabolism of newly-differentiated human fat cells in cell culture. Diabetologia. 1995;38(7):764-771. doi: https://doi.org/10.1007/s001250050350
25. Zhang HH, Halbleib M, Ahmad F, et al. Tumor Necrosis Factor-Stimulates Lipolysis in Differentiated Human Adipocytes Through Activation of Extracellular Signal-Related Kinase and Elevation of Intracellular cAMP. Diabetes. 2002;51(10):2929-2935. doi: https://doi.org/10.2337/diabetes.51.10.2929
26. Gotsman I, Stabholz A, Planer D, et al. Serum cytokine tumor necrosis factor-alpha and interleukin-6 associated with the severity of coronary artery disease: indicators of an active inflammatory burden? Isr Med Assoc J. 2008;10(7):494-498.
27. Ben-Mahmud BM, Chan WH, Abdulahad RM, et al. Clinical validation of a link between TNF-а and the glycosylation enzyme core 2 GlcNAc-T and the relationship of this link to diabetic retinopathy. Diabetologia. 2006;49(9):2185-2191. doi: https://doi.org/10.1007/s00125-006-0332-2
28. Hussain MJ, Peakman M, Gallati H., et al. Elevated serum levels of macrophage-derived cytokines precede and accompany the onset of IDDM. Diabetologia. 1996;39(1):60-69.
29. Прохоренко Т.С., Саприна Т.В., Лазаренко Ф.Э., и др. Система фактора некроза опухолей а в патогенезе аутоиммунного сахарного диабета // Бюллетень сибирской медицины. - 2011. - Т. 10. - №1. -С. 64-69. doi: https://doi.org/10.20538/1682-0363-2011-1-64-69
30. Schutze S, Tchikov V, Schneider-Brachert W, Regulation ofTNFR1 and CD95 signalling by receptor compartmentalization. Nat Rev Mol Cell Biol. 2008;9(8):655-662. doi: https://doi.org/10.1038/nrm2430
31. Saisho Y. Metformin and Inflammation: Its Potential Beyond Glucose-lowering Effect. Endocrine, Metab Immune Disord Targets. 2015;15(3):196-205. doi: https://doi.org/10.2174/1871530315666150316124019
32. Шаенко З.А., Расин М.С. Эффективность и безопасность метформина и пиоглитазона у пациентов с ишемической болезнью сердца и сахарным диабетом 2-го типа // Международный эндокринологический журнал. - 2015. - №2. -С. 66-70.
33. Пизов А.В., Пизов Н.А., Скачкова О.А., Пизова Н.В. Эндотелиальная дисфункция как ранний предиктор атеросклероза // Медицинский алфавит. 2019. - Т.4. - №35. - С.:28-33. doi: https://doi.org/10.33667/2078-5631-2019-4-35(410)-28-33
34. Koenig W, Lowel H, Baumert J, Meisinger C. C-Reactive Protein Modulates Risk Prediction Based on the Framingham Score. Circulation. 2004;109(11):1349-1353. doi: https://doi.org/10.1161/01.CIR.0000120707.98922.E3
35. Соловьева А.Е., Кобалава ЖД. Перспективы противовоспалительной терапии атеросклероза // Клиническая фармакология и терапия. 2014. - Т.23. - №3. - С.:28-38.
36. Пальцев И.В., Калинин А.Л., Сницаренко Е.Н. Сывороточный ферритин-предиктор сахарного диабета 2 типа у пациентов с хроническими гепатитами // Проблемы здоровья и экологии. -2016. - Т. 2. - №48. - С. 65-68.
Об авторах
Надежда Нурлановна МусинаРоссия
Мусина Надежда Нурлановна, аспирант, ORCID: http://orcid.org/0000-0001-7148-6739, eLibrary SPIN: 3468-8160, e-mail: nadiezhda-musina@mail.ru
634050, Томск, Московский тракт, д. 2
Конфликт интересов: нет
Татьяна Владимировна Саприна
Россия
Саприна Татьяна Владимировна, д.м.н., профессор, ORCID: http://orcid.org/0000-0001-9011-8720, eLibrary SPIN: 2841-2371, e-mail: tanja.v.saprina@mail.ru
Томск
Конфликт интересов: нет
Татьяна Сергеевна Прохоренко
Россия
Прохоренко Татьяна Сергеевна, к.м.н., ORCID: http://orcid.org/0000-0002-8016-4755, eLibrary SPIN: 1495-4127, e-mail: mmikld.ssmu@gmail.com
Томск
Конфликт интересов: нет
Анастасия Павловна Зима
Россия
Зима Анастасия Павловна, д.м.н., профессор, ORCID: http://orcid.org/0000-0002-9034-7264, eLibrary SPIN: 5710-4547, e-mail: zima2302@gmail.com
Томск
Конфликт интересов: нет
Дополнительные файлы
|
|
1. Рисунок 1. Частота встречаемости дислипидемии | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(20KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Структура дислипидемии в зависимости от типа метаболических нарушений | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(22KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Характеристика дислипидемии по классификации D. Fredrickson | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(23KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Структура дислипидемии у пациентов с сахарным диабетом и анемическим синдромом | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(41KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Мусина Н.Н., Саприна Т.В., Прохоренко Т.С., Зима А.П. Особенности параметров обмена железа и воспалительного статуса у пациентов с сахарным диабетом и дислипидемией. Ожирение и метаболизм. 2020;17(3):269-282. https://doi.org/10.14341/omet12497
For citation:
Musina N.N., Saprina T.V., Prokhorenko T.S., Zima A.P. Iron metabolism parameters and inflammatory status in patients with diabetes mellitus and dyslipidemia. Obesity and metabolism. 2020;17(3):269-282. (In Russ.) https://doi.org/10.14341/omet12497

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































