Перейти к:
Влияние пищевых молекул на переход белой жировой ткани в бежевую
https://doi.org/10.14341/omet13070
Аннотация
Ожирение является одной из важнейших проблем здравоохранения. Известно, что массу тела можно контролировать с помощью сочетания здорового питания и физической активности, однако гипертрофическое ожирение часто осложнено другими сопутствующими заболеваниями, такими как сахарный диабет 2 типа, сердечно-сосудистые заболевания, артериальная гипертензия и различные формы артрита. В случае, когда больным противопоказаны интенсивные физические нагрузки, могут быть разработаны альтернативные подходы для борьбы с ожирением. Открытие бежевых адипоцитов в белой жировой ткани привлекло внимание к их использованию в качестве терапевтической мишени. Существуют молекулы различной природы, которые способны модулировать процесс образования бежевых адипоцитов, взаимодействуя с критически важными сигнальными каскадами, что приводит к усилению термогенеза. В данный момент разрабатываются препараты на основе малых молекул, а также перепрограммирование с использованием инструментов генной терапии. В данном обзоре рассматривается возможность стимуляции перехода белых жировых клеток в бежевые с помощью нутриентов, а также подробно обсуждаются молекулярные мишени пищевых и синтетических малых молекул, действующих на процесс побурения жировой ткани.
Ключевые слова
Для цитирования:
Егорова В.С., Гурциева Д.Т., Егоров А.Д. Влияние пищевых молекул на переход белой жировой ткани в бежевую. Ожирение и метаболизм. 2024;21(3):295-301. https://doi.org/10.14341/omet13070
For citation:
Egorova V.S., Gurtsieva D.T., Egorov A.D. Nutrient molecules affecting the white-to-beige adipose tissue transition. Obesity and metabolism. 2024;21(3):295-301. (In Russ.) https://doi.org/10.14341/omet13070
Введение
Жировая ткань, в особенности белая жировая ткань, является местом депонирования избытка питательных веществ в форме триглицеридов. Во время периодического дефицита энергии, такого как при голодании или интенсивной физической нагрузке, накопленные триглицериды могут расщепляться и высвобождаться из адипоцитов, обеспечивая организм энергией. Этот динамический процесс накопления и высвобождения липидов из жировой ткани регулирует энергетический баланс в организме. Особую роль в данном процессе играет бурая жировая ткань, которая способна к интенсивному липолизу и термогенезу. Чрезмерное накопление триглицеридов в жировой ткани приводит к ожирению и другим метаболическим нарушениям и вызвано нарушением энергетического баланса.
Бурая жировая ткань в организме взрослого человека представлена мало и сосредоточена в подмышечных впадинах, межлопаточной и надключичной областях. В бурых адипоцитах экспрессируется ген UCP1 белка термогенина, разобщающего дыхательную цепь в митохондриях. Это позволяет протонам входить в матрикс без синтеза АТФ и приводит к высвобождению энергии в форме тепла. Поскольку вместе с протоном UCP1 переносит свободные жирные кислоты, использующиеся в качестве субстрата для окисления, то данный переносчик значительно влияет на катаболический обмен. Показано, что наличие бурой жировой ткани коррелирует с более низким уровнем сахарного диабета 2 типа (СД2), дислипидемии, ишемической болезни сердца, гипертонии [1][2]. Активация программы бурого адипогенеза в белой жировой ткани приводит к появлению скоплений «бежевых» адипоцитов, в которых происходит интенсивный липолиз и термогенез.
Ожирение на данный момент считается одной из серьезных неразрешенных проблем медицины, в том числе из-за распространенности инфекционных заболеваний среди людей с повышенным индексом массы тела (ИМТ) проявляется эффект двойной нагрузки на систему общественного здравоохранения [3]. Известно, что массу тела можно контролировать с помощью сочетания здорового питания и физической активности, однако гипертрофическое ожирение часто осложнено другими сопутствующими заболеваниями, такими как СД2, сердечно-сосудистые заболевания (ССЗ), артериальная гипертензия и различные формы артрита [4]. В случае, когда больным противопоказаны интенсивные физические нагрузки, могут быть применены терапевтические подходы, связанные с использованием малых молекул, пептидных препаратов или генной терапии.
Влияние на конверсию жировых клеток с помощью небольших молекул, воздействующих (активирующих или ингибирующих) на молекулярные мишени (рис. 1), участвующие в биогенезе жировой ткани, представляет собой простой неинвазивный метод, который в настоящее время активно изучается. Такой подход дает возможность противодействовать ожирению и сопутствующим заболеваниям, таким как СД2, гиперлипидемия, дислипидемия, ССЗ и др., и избежать множества вопросов, связанных с применением генной терапии.
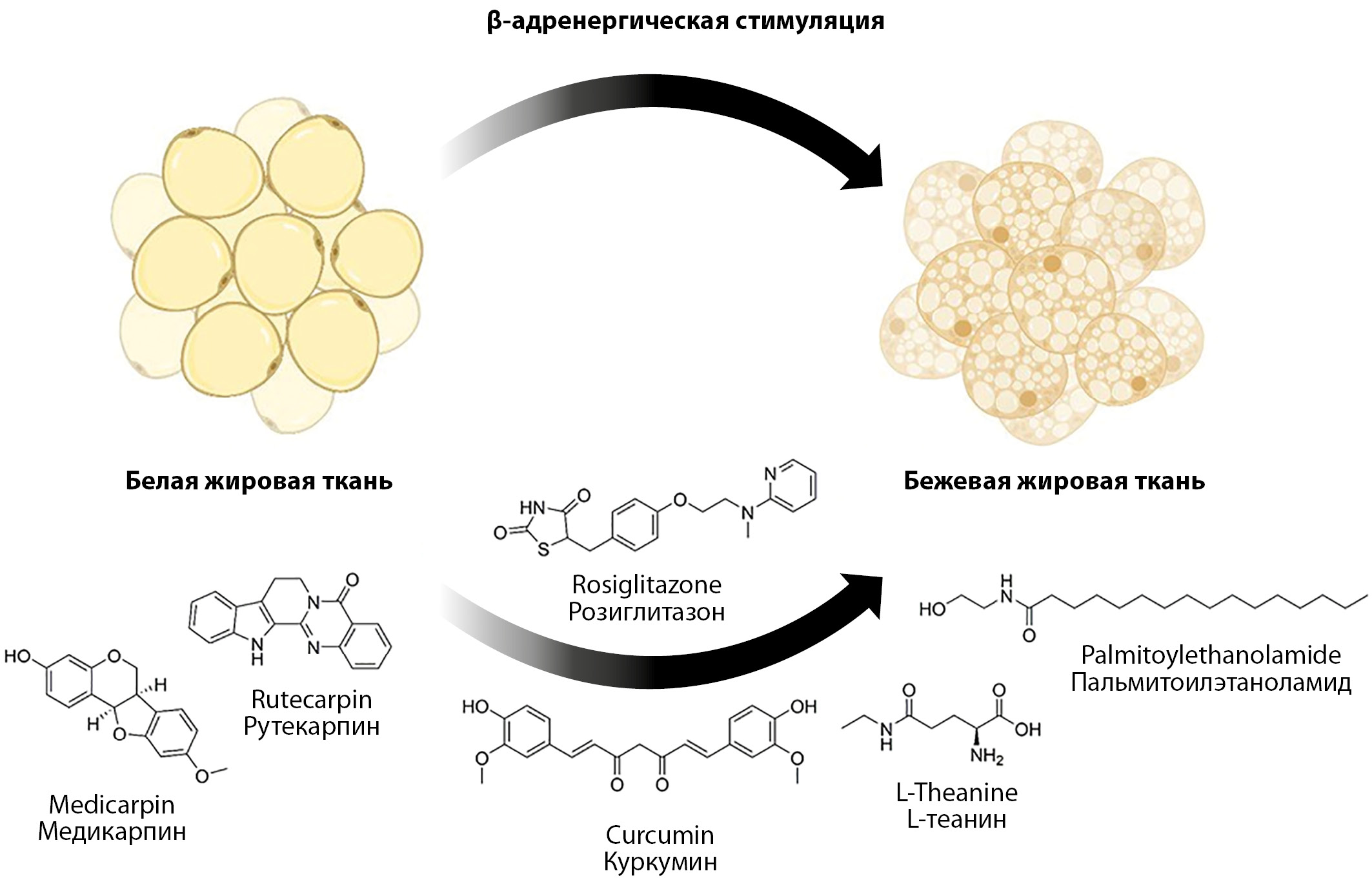
Рисунок 1. Влияние различных по природе факторов на переход белой жировой ткани в бежевую.
Figure 1. Influence of various factors on the conversion of white adipose tissue to beige adipose.
Применение малых молекул для перепрограммирования жировой ткани
Отмечено, что хроническая симпатическая стимуляция приводит к образованию в белой жировой ткани локусов, в которых экспрессируется специфичный для бурой жировой ткани ген Ucp1, кодирующий белок термогенин [5]. Позднее обнаружены и охарактеризованы клетки белой жировой ткани, морфологически и функционально напоминающие бурые адипоциты, содержащие множество липидных капель и большое количество митохондрий, — бежевые адипоциты [6]. Поскольку, аналогично клеткам бурой жировой ткани, бежевые адипоциты экспрессируют UCP1, они также способны к термогенезу [7]. Сохранение термогенно активной жировой ткани на протяжении жизни является важным показателем отсутствия метаболических заболеваний [8]. В этой связи воздействие на жировую ткань, результатом которого будет модуляция экспрессии гена Ucp1 и активация термогенеза, имеет значение в свете разработки новых терапевтических подходов.
Одним из перспективных подходов может стать стимуляция перехода белых жировых клеток в более катаболически активные бежевые с использованием препаратов на основе малых молекул, а также с помощью добавления физиологически активных нутриентов в диету. Конверсия белых адипоцитов в бежевые широко исследуется и называется побурением [9]. Влияние на конверсию жировых клеток с помощью небольших молекул, воздействующих (активирующих или ингибирующих) на молекулярные мишени, участвующие в биогенезе жировой ткани, представляет собой простой неинвазивный метод, который в настоящее время активно изучается.
Показано, что малые молекулы могут стимулировать переход в бежевые адипоциты не только белых жировых клеток, но и фибробластов [10], эндотелиальных клеток [11] и миобластов [12]. Существует мнение, подтвержденное исследованиями на животных моделях, что сопряженный с термогенезом активный липолиз в жировой ткани способен избавить организм от избытков пищевой энергии [13]. В масштабном сравнительном исследовании было показано, что диета (состав поглощаемых макронутриентов) может оказывать значительное влияние не только на массу тела, но и на побурение белой и рекрутирование бурой жировой ткани у мышей [14].
Таким образом, возможность того, что жировая ткань не только запасет избыточную энергию в форме триглицеридов, но и сохранит нас стройными, полностью зависит от наличия термогенеза, опосредованного бурым жиром и вызванного диетой. В последнее время растет число публикаций, посвященных исследованию влияния пищевых и синтетических малых молекул на побурение жировой ткани. Мы рассмотрим наиболее подробно изученные нутриенты, индуцирующие конверсию жировой ткани в соответствии с задействованными в процессе адипогенеза факторами транскрипции, на которые они оказывают воздействие.
Применение агонистов PPARγ
Наиболее важным для развития адипоцитов является PPARγ — ядерный рецептор, относящийся к семейству PPAR (рецепторы, активируемые пролифераторами пероксисом). Белки этого семейства выполняют роль транскрипционных регуляторов внутриклеточных процессов во многих клеточных типах, однако именно действие этого фактора транскрипции определяет дифференцировку клеток жировой ткани. Как и все рецепторы семейства PPAR, PPARγ активен только в форме гетеродимера с RXR (retinoid X-receptors, рецепторы ретиноидов X) [15]. PPARγ способен связывать многочисленные соединения, включая природные (15-дезокси-Δ12,14 простагландин J2) и синтетические антидиабетические тиазолидиндионы, что способствует гетеродимеризации и активации PPAR-зависимых генов. Было показано, что полный агонизм, проявляемый лигандами PPARγ, способен индуцировать транскрипционную программу бурых адипоцитов в подкожном белом жире [16]. Однако благодаря специфическому строению лиганд-связывающего участка PPARγ способен взаимодействовать не только с синтетическими лигандами, такими как розиглитазон, пиоглитазон, тезаглитазар [17], но и с более низкой аффинностью связывает множество природных соединений, среди которых — флавоноиды кверцетин [18], кемпферол [19], каротиноид ликопин [20][21]. Эффекты вышеописанных веществ включают специфическую активацию и повышение уровня экспрессии PPAR-зависимых генов в различных клеточных типах: макрофагах, клетках слюнных желез, опухолевых клетках предстательной железы, что не исключает их действие на конверсию клеток жировой ткани. Также было показано, что применение сесаминола — лигнана, экстрагируемого из семян кунжута индийского (Sesamum indicum), способствует повышению уровня экспрессии генов — маркеров бурой жировой ткани Ucp1, Fabp4, Pparg, а также связанных с митохондриальными процессами генов Cidea, Pgc1a, Ppara, Cox8b и Dio2 в первичных белых жировых клеток мышей in vitro. Интраперитонеальное введение сесаминола in vivo приводило к образованию многокапельных адипоцитов в жировой ткани мышей, а также к снижению содержания липидов на ~43%. При введении сесаминола у мышей наблюдалось усиление базального клеточного дыхания примерно на 50% в сравнении с животными из контрольной группы, которые не получали сесаминол. Введение сесаминола мышам, получающим корм с высоким содержанием жиров (высокожировая диета, ВЖД) приводило к снижению набора массы тела на 6% в сравнении с животными из контрольной группы на ВЖД, а также к усилению клиренса глюкозы и повышению чувствительности к инсулину [22].
Применение агонистов и стабилизаторов PRDM16
Существенно, что для перехода адипоцитов из белого типа в бежевый требуется активность коактиваторов PPARγ, к которым относится гистоновая (H3K9) метилтрансфераза PRDM16 (Positive regulatory domain zinc finger region protein 16). Было показано, что удаление гена, кодирующего PRDM16, приводило к значительному ослаблению эффектов побурения адипоцитов и снижению уровня разобщенного дыхания, вызванного воздействием розиглитазона. Таким образом, описанные выше синтетические тиазолидиндионы способны вызвать побурение вследствие увеличения стабильности PRDM16 в составе комплексов с PPARγ [16]. В норме при холодовой адаптации, а также при стимуляции жировой ткани β3-селективными адренергическими агонистами активируется PRDM16, что в конечном счете приводит к экспрессии гена Ucp1 и выработке термогенина в жировых клетках [8]. Именно термогенин разобщает градиент протонов в митохондриях, переносит жирные кислоты для их окисления, тем самым повышая катаболизм [23] в жировой ткани, и является маркёром локусов бежевых адипоцитов (фенотипически схожих с бурыми).
Аминокислота L-теанин, являющаяся компонентом экстракта зеленого чая, вызывала повышение уровней экспрессии, характерных для бурой жировой ткани генов Prdm16, PGC1a and Ucp1 in vitro при обработке клеток C3H10T1/2, причем уровень экспрессии повышался пропорционально дозе аминокислоты. In vivo введение мышам L-теанина приводило к повышению уровня потребления кислорода и, следовательно, — к повышению функциональной активности митохондрий в белой жировой ткани в сравнении с животными из контрольной группы. Введение L-теанина приводило к повышению уровней экспрессии генов — маркеров бурой жировой ткани в белой жировой ткани, выделенной из межлопаточной области и придатка семеника, а также в бурой жировой ткани и к повышению содержания белков PRDM16, UCP1 и PGC1α, согласно данным, вестерн-блоттинга. У мышей с ожирением, получавших ВЖД, введение L-теанина приводило к снижению в два раза массы эпидидимальной жировой ткани и жировой ткани в межлопаточной области, а также к снижению прироста массы тела. У мышей, получавших L-теанин, также наблюдалось повышение толерантности к глюкозе и чувствительности к инсулину [24]. Следует отметить, что при нокауте гена Prdm16 у мышей не наблюдалось индуцированного введением L-теанина повышения уровня экспрессии генов — маркеров бурой жировой ткани и снижалась толерантность к холоду [24].
Ретиноид бексаротен является специфичным агонистом рецепторов ретиноидов X (RXR), которые включаются в процессе адипогенеза после PPARγ. В экспериментах in vitro обработка клеток C2C12 бексаротеном приводила к повышению уровня экспрессии генов, характерных для бурой жировой ткани, включая Pparg, Prdm16, Pgc1a и Ucp1, способствуя дифференцировке клеток в сторону бурых адипоцитов. При этом антагонист рецепторов RXR HX531 препятствовал дифференцировке клеток C2C12 в бурые адипоциты под действием бексаротена. Пероральное введение бексаротена мышам в дозе 50 мг/кг/сутки на протяжении четырех недель в сочетании с высокожировой диетой приводило к повышению уровней экспрессии генов Ucp1, Pgc1a, Prdm16, Ppara, Pparg и Ppard в жировой ткани. Кроме того, введение бексаротена приводило к снижению прироста массы тела в сравнении с животными из контрольной группы, несмотря на сравнимое количество потребляемой пищи, то есть бексаротен повышал расход энергии, а также повышал выделение тепла, чувствительность к глюкозе и инсулину и повышал холодостойкость [12].
Также оказывать противовоспалительное действие и вызывать побурение жировой ткани способны пищевые длинноцепочечные полиненасыщенные омега-3 жирные кислоты, в частности эйкозапентаеновая кислота — основной компонент рыбьего жира [25]. Было показано, что эйкозапентаеновая кислота повышает уровни экспрессии генов — маркеров бурой жировой ткани (например, PGC1α и PRDM16), вне зависимости от UCP1 [26][27]. Введение эйкозапентаеновой кислоты мышам дикого типа и мышам с нокаутом UCP1 приводило к облегчению инсулинорезистентности и снижению воспаления, однако введение эйкозапентаеновой кислоты не сказывалось на массе тела животных и на содержании жировой ткани [28].
Воздействие на сигнальный путь SIRT1 / AMPK / PGC1α
Значительная доля нутриентов, оказывающих влияние на переход белых адипоцитов в метаболически активное состояние бежевых, оказывает воздействие на AMPK-сигнальный путь (SIRT1/AMPK/PGC1α). В широкомасштабных скрининговых исследованиях cреди 500 проверенных природных соединений было обнаружено действие алкалоида рутекарпина, входящего в состав созревших плодов рутовых [29]. Эта небольшая молекула была идентифицирована как положительный регулятор «побурения» белых адипоцитов как in vitro, так и in vivo. Анализ данных RNA-seq показал, что рутекарпин регулирует сигнальный путь АМФ-зависимой киназы (AMPK). Эффект рутекарпина, заключающийся в индукции транскрипционной программы бурой жировой ткани в клетках белого жира, также исчезал при делеции гена Prdm16, мишени сигнального пути AMPK.
Медикарпин представляет собой природный птерокарпан, обнаруженный в растениях семейства бобовые — розовом дереве (Swartzia madagascariensis) и люцерне усеченной (Medicago truncatula), который демонстрирует различные биологические эффекты, включая стимуляцию регенерации костей, ингибирование остеокластогенеза и индукцию апоптоза. Индукция медикарпином in vitro увеличивала экспрессию маркеров и бежевого жира в клетках C3H10T1/2, включая Ucp1 (в 2,6 раза), Ppargc1a (в 4,5 раза), Prdm16 (в 2 раза), Ppara (в 2,3 раза), Cidea (в 1,9 раза) и Elovl3 (в 4,8 раза). Медикарпин достоверно повышал экспрессию некоторых митохондриальных генов (Cox7a, Cox8b, Tfam и ключевого маркера митохондриального биогенеза Sirt1 (в 4 раза)) и значимо увеличивал митохондриальную массу в сравнении с синтетическим розиглитазоном. Добавление медикарпина индуцировало активацию AMPKα дозозависимым образом. Для подтверждения механизма действия медикарпина через AMPK использовали специфический ингибитор AMPK дорсоморфин, который отменял обусловленную медикарпином активацию специфичных для бурого жира генов [30].
Кофеин, часто употребляемый в пищу в сочетании с другими родственными соединениями, такими как катехины, теобромин и кверцетин, способствует побурению белых адипоцитов. В частности, показано, что кофеин способен увеличивать экспрессию специфичных для бурых адипоцитов генов и индуцировать липолиз. Обработка дифференцированных клеток 3T3-L1 кофеином и катехинами приводит к снижению количества накопленных липидов в сочетании с усилением экспрессии генов, кодирующих PPARγ, GLUT4 (глюкозозависимого транспортера глюкозы), HSL (гормон-чувствительной липазы), UCP1 и TMEM26 [31]. В адипоцитах человека культивирование in vitro в присутствии 1 мМ кофеина повышало уровень UCP1, а термографическое исследование показало увеличение локальной температуры (термогенез) в надключичной области после употребления кофеина (в виде напитка) человеком [32].
Содержащийся в какао-бобах метилксантин теобромин обладает структурным сходством с кофеином. Теобромин ингибирует накопление липидов и снижает экспрессию PPARγ, C/EBPα, aP2 и лептина в клетках 3T3-L1. Нарушение дифференцировки 3T3-L1 теобромином осуществляется через сигнальные пути AMPK и ERK/JNK [33]. Введение теобромина мышам на высокожировой диете приводит к увеличению экспрессии ключевых маркеров бурых адипоцитов, таких как PRDM16 и UCP1, а также к побурению белой жировой ткани и активации бурой жировой ткани [34].
Биоактивные компоненты кофе, чая и какао, обладающие действием против ожирения, включают хлорогеновую кислоту, тригонеллин, кавеол, катехины, галлат эпигаллокатехина, теафлавины, теарубигины и кверцетин [35].
Кверцетин, биологически активное соединение, также являющееся компонентом экстракта луковой шелухи, вызывает побурение жировой ткани путем воздействия на сигнальный путь SIRT1/AMPK [36][37]. Действие производных кверцетина в концентрации до 25 мкг/мл вызывало перепрограммирование культуры клеток 3T3-L1 в бурые адипоциты [36]. Введение мышам C57Bl/6J экстракта луковой шелухи или 0,1% (по массе) раствора кверцетина в сочетании с ВЖД приводило к повышению в белой жировой ткани уровней экспрессии генов — маркеров бурой жировой ткани, таких как PRDM16, UCP1, Cidea и PGC-1α. Кроме того, введение кверцетина мышам приводило к снижению уровня триглицеридов в плазме крови, но не оказывало влияния на состав тела животных и расход энергии [36][37].
Куркумин — натуральный куркуминоид, входящий в состав корня куркумы, также оказывает воздействие на сигнальный путь SIRT1/AMPK/PGC1α. Куркумин безопасен и хорошо переносится людьми даже в высоких дозах (12 г/день) [38]. Куркумин оказывает благотворное влияние на здоровье, предотвращает увеличение веса и облегчает связанное с ожирением воспаление в животных моделях [39]. In vitro куркумин значительно увеличивает экспрессию маркеров бурого жира (PGC-1α и UCP1) в клетках 3T3-L1 и первичных адипоцитах дозозависимым образом. Под действием куркумина усиливается митохондриальный биогенез: растет плотность митохондрий и, кроме того, заметно повышаются уровни мРНК Ppargc1a и белка PGC-1α, коактиватора PPARγ и ключевого участника митохондриального биогенеза. Прием куркумина увеличивает как общий уровень AMPK, так и уровень фосфорилированной формы; поэтому исследователи считают, что куркумин вызывает побурение через AMPK-зависимый сигнальный путь. Эта гипотеза была подтверждена в эксперименте с обработкой адипоцитов AICAR (активатор AMPK) и дорсоморфином (ингибитор AMPK). Обработка дорсоморфином устраняла сверхэкспрессию UCP1, PRDM16 и PGC-1α, в то время как обработка активатором AICAR приводила к повышенной экспрессии этих маркерных белков бурой жировой ткани.
In vivo куркумин индуцировал экспрессию ряда генов, специфичных для бурого жира в паховых жировых отложениях мыши, включая Ucp1, Ppargc1a, Prdm16, Dio2, Ppara, Cidea, усиливал митохондриальный биогенез, определяемый количеством копий мтДНК. Куркумин снижал набор веса у мышей C57BL/6, но не снижал аппетит, то есть увеличивал расход энергии. Мыши, получавшие куркумин, проявляли повышенную устойчивость к холоду по сравнению с мышами из контрольной группы [38][40].
Пальмитоилэтаноламид (ПЭА) — натуральный эндоканнабиноидоподобный липидный медиатор, амид пальмитиновой кислоты. Являясь компонентом многих пищевых продуктов, поскольку присутствует в яичном желтке и многих растениях, он также синтезируется эндогенно различными типами клеток животных. Противовоспалительный характер действия ПЭА, в частности в подавлении активации тучных клеток, был показан в поздних работах Риты Леви-Монтальчини [41]. Применяется в терапевтических целях для лечения воспалительных заболеваний, болевых синдромов и нейродегенеративных расстройств, а также как пищевая добавка в нутрициологии [42][43]. Было показано, что ПЭА способствует конверсии белой жировой ткани в бежевую и способен восстанавливать чувствительность к лептину и тканевым гормонам [44]. Одновременно с повышением уровня экспрессии генов — маркёров термогенеза Ucp1, Ppargc1a, Prdm16 и Cox8b, уровня транскрипции гена лептинового рецептора, а также уровня адипонектина, в эксперименте на клетках 3T3-L1 наблюдалось снижение уровня секреции воспалительных факторов интерлейкина-6 и фактора некроза опухолей-α. Данный механизм действия ПЭА на клетках 3T3-L1 опосредован активацией гомолога основного регулятора адипогенеза PPARα, который в комплексе PPARα-PGC-1α способствует экспрессии вышеупомянутых генов, запуская положительную петлю обратной связи и усиливая экспрессию PGC-1α [44]. Были показаны метаболические, термогенные и противовоспалительные эффекты ПЭА в процессе перепрограммирования клеток жировой ткани.
ЗАКЛЮЧЕНИЕ
Нами были рассмотрены молекулы различной природы, которые способны модулировать процесс образования бежевых адипоцитов, взаимодействуя с критически важными сигнальными каскадами. Очевидно, что не только состав макронутриентов определяет функциональные свойства жировой ткани и влияет на развитие ожирения, но и некоторые микронутриенты способны вносить значительный вклад, в особенности в стимуляцию конверсии белых жировых клеток в более катаболически активный фенотип бежевых адипоцитов. В данном обзоре нами обсуждаются молекулярные мишени пищевых и синтетических малых молекул, действующих на процесс побурения жировой ткани. В разработке диетических подходов для коррекции массы тела, разработке антидиабетических препаратов на основе малых молекул могут быть учтены структурные особенности данных микронутриентов.
Дополнительная информация
Источники финансирования. Исследование выполнено за счет средств гранта Российского научного фонда и Кубанского научного фонда № 22-14-20046.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Егорова В.С. — поиск первичных данных, написание статьи; Гурциева Д.Т. — поиск первичных данных; Егоров А.Д. —концепция, написание статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Благодарности. Выражаем благодарность Кузовлеву Андрею Сергеевичу за помощь в создании графических изображений структуры веществ.
Список литературы
1. Becher T, Palanisamy S, Kramer DJ, et al. Brown adipose tissue is associated with cardiometabolic health. Nat Med. 2021;27(1):58-65. doi: https://doi.org/10.1038/s41591-020-1126-7
2. Wibmer AG, Becher T, Eljalby M, et al. Brown adipose tissue is associated with healthier body fat distribution and metabolic benefits independent of regional adiposity. Cell Reports Med. 2021;2(7):100332. doi: https://doi.org/10.1016/j.xcrm.2021.100332
3. Pugliese G, Liccardi A, Graziadio C, Barrea L, Muscogiuri G, Colao A. Obesity and infectious diseases: pathophysiology and epidemiology of a double pandemic condition. Int J Obes. 2022;46(3):449-465. doi: https://doi.org/10.1038/s41366-021-01035-6
4. de Resende Guimarães MFB, Rodrigues CEM, Gomes KWP, et al. High prevalence of obesity in rheumatoid arthritis patients: association with disease activity, hypertension, dyslipidemia and diabetes, a multi-center study. Adv Rheumatol. 2019;59(1):44. doi: https://doi.org/10.1186/s42358-019-0089-1
5. Cinti S, Frederich RC, Zingaretti MC, De Matteis R, Flier JS, Lowell BB. Immunohistochemical localization of leptin and uncoupling protein in white and brown adipose tissue. Endocrinology. 1997;138(2):797-804. doi: https://doi.org/10.1210/endo.138.2.4908
6. Wu J, Boström P, Sparks LM, et al. Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human. Cell. 2012. doi: https://doi.org/10.1016/j.cell.2012.05.016
7. Harms M, Seale P. Brown and beige fat: Development, function and therapeutic potential. Nat Med. 2013. doi: https://doi.org/10.1038/nm.3361
8. Seale P, Conroe HM, Estall J, Kajimura S, Frontini A, et al. Prdm16 determines the thermogenic program of subcutaneous white adipose tissue in mice. J Clin Invest. 2011;121(1):96-105. doi: https://doi.org/10.1172/JCI44271
9. Bartelt A, Heeren J. Adipose tissue browning and metabolic health. Nat Rev Endocrinol. 2014;10(1):24-36. doi: https://doi.org/10.1038/nrendo.2013.204
10. Tu WZ, Fu YB, Xie X. RepSox, a small molecule inhibitor of the TGFβ receptor, induces brown adipogenesis and browning of white adipocytes. Acta Pharmacol Sin. 2019;40(12):1523-1531. doi: https://doi.org/10.1038/s41401-019-0264-2
11. Haynes BA, Yang LF, Huyck RW, Lehrer EJ, et al. Endothelial-to-Mesenchymal Transition in Human Adipose Tissue Vasculature Alters the Particulate Secretome and Induces Endothelial Dysfunction. Arterioscler Thromb Vasc Biol. 2019;39(10):2168-2191. doi: https://doi.org/10.1161/ATVBAHA.119.312826
12. Nie B, Nie T, Hui X, Gu P, Mao L, et al. Brown Adipogenic Reprogramming Induced by a Small Molecule. Cell Rep. 2017;18(3):624-635. doi: https://doi.org/10.1016/j.celrep.2016.12.062
13. Nedergaard J, von Essen G, Cannon B. Brown adipose tissue: can it keep us slim? A discussion of the evidence for and against the existence of diet-induced thermogenesis in mice and men. Philos Trans R Soc Lond B Biol Sci. 2023;378(1888):20220220. doi: https://doi.org/10.1098/rstb.2022.0220
14. Hu S, Wang L, Yang D, Li L, Togo J, et al. Dietary Fat, but Not Protein or Carbohydrate, Regulates Energy Intake and Causes Adiposity in Mice. Cell Metab. 2018;28(3):415-431.e4. doi: https://doi.org/10.1016/j.cmet.2018.06.010
15. Kliewer SA, Umesono K, Noonan DJ, et al. Convergence of 9-cis retinoic acid and peroxisome proliferator signalling pathways through heterodimer formation of their receptors. Nature. 1992;358(6389):771-774. doi: https://doi.org/10.1038/358771a
16. Ohno H, Shinoda K, Spiegelman BM, Kajimura S. PPARγ agonists induce a white-to-brown fat conversion through stabilization of PRDM16 protein. Cell Metab. 2012;15(3):395-404. doi: https://doi.org/10.1016/j.cmet.2012.01.019
17. Kroon T, Harms M, Maurer S, Bonnet L, Alexandersson I, et al. PPARγ and PPARα synergize to induce robust browning of white fat in vivo. Mol Metab. 2020;36:100964. doi: https://doi.org/10.1016/j.molmet.2020.02.007
18. Lee SM, Moon J, Cho Y, Chung JH, Shin MJ. Quercetin up-regulates expressions of peroxisome proliferator-activated receptor γ, liver X receptor α, and ATP binding cassette transporter A1 genes and increases cholesterol efflux in human macrophage cell line. Nutr Res. 2013;33(2):136-43. doi: https://doi.org/10.1016/j.nutres.2012.11.010
19. Beekmann K, Rubió L, de Haan LH, Actis-Goretta L, van der Burg B, et al. The effect of quercetin and kaempferol aglycones and glucuronides on peroxisome proliferator-activated receptor-gamma (PPAR-γ). Food Funct. 2015;6(4):1098-107. doi: https://doi.org/10.1039/c5fo00076a
20. Yang CM, Lu IH, Chen HY, Hu ML. Lycopene inhibits the proliferation of androgen-dependent human prostate tumor cells through activation of PPARγ-LXRα-ABCA1 pathway. J Nutr Biochem. 2012;23(1):8-17. doi: https://doi.org/10.1016/j.jnutbio.2010.10.006
21. Selim MA, Mosaad SM, El-Sayed NM. Lycopene protects against Bisphenol A induced toxicity on the submandibular salivary glands via the upregulation of PPAR-γ and modulation of Wnt/β-catenin signaling. Int Immunopharmacol. 2022;112:109293. doi: https://doi.org/10.1016/j.intimp.2022.109293
22. Divakaran SJ, Srivastava S, Jahagirdar A, Rajendran R, et al. Sesaminol induces brown and beige adipocyte formation through suppression of myogenic program. FASEB J. 2020;34(5):6854-6870. doi: https://doi.org/10.1096/fj.201902124R
23. Fedorenko A, Lishko PV, Kirichok Y. Mechanism of fatty-acid-dependent UCP1 uncoupling in brown fat mitochondria. Cell. 2012;151(2):400-13. doi: https://doi.org/10.1016/j.cell.2012.09.010
24. Peng WQ, Xiao G, Li BY, Guo YY, Guo L, Tang QQ. l-Theanine Activates the Browning of White Adipose Tissue Through the AMPK/α-Ketoglutarate/Prdm16 Axis and Ameliorates Diet-Induced Obesity in Mice. Diabetes. 2021;70(7):1458-1472. doi: https://doi.org/10.2337/db20-1210
25. Kalupahana NS, Claycombe K, Newman SJ, Stewart T, et al. Eicosapentaenoic acid prevents and reverses insulin resistance in high-fat diet-induced obese mice via modulation of adipose tissue inflammation. J Nutr. 2010;140(11):1915-1922. doi: https://doi.org/10.3945/jn.110.125732
26. Pahlavani M, Razafimanjato F, Ramalingam L, Kalupahana NS, Moussa H, Scoggin S, Moustaid-Moussa N. Eicosapentaenoic acid regulates brown adipose tissue metabolism in high-fat-fed mice and in clonal brown adipocytes. J Nutr Biochem. 2017;39:101-109. doi: https://doi.org/10.1016/j.jnutbio.2016.08.012
27. Miller EK, Pahlavani M, Ramalingam L, Scoggin S, Moustaid-Moussa N. Uncoupling protein 1-independent effects of eicosapentaenoic acid in brown adipose tissue of diet-induced obese female mice. J Nutr Biochem. 2021;98:108819. doi: https://doi.org/10.1016/j.jnutbio.2021.108819
28. Zu Y, Pahlavani M, Ramalingam L, Jayarathne S, Andrade J, et al. Temperature-Dependent Effects of Eicosapentaenoic Acid (EPA) on Browning of Subcutaneous Adipose Tissue in UCP1 Knockout Male Mice. Int J Mol Sci. 2023;24(10):8708. doi: https://doi.org/10.3390/ijms24108708
29. Liu X, Zhang Y, Chu Y, Zhao X, Mao L, Zhao S, Lin S, et al. The natural compound rutaecarpine promotes white adipocyte browning through activation of the AMPK-PRDM16 axis. Biochem Biophys Res Commun. 2021;545:189-194. doi: https://doi.org/10.1016/j.bbrc.2021.01.080
30. Imran KM, Yoon D, Kim YS. A pivotal role of AMPK signaling in medicarpin-mediated formation of brown and beige. Biofactors. 2018;44(2):168-179. doi: https://doi.org/10.1002/biof.1392
31. Sugiura C, Zheng G, Liu L, Sayama K. Catechins and Caffeine Promote Lipid Metabolism and Heat Production Through the Transformation of Differentiated 3T3‐L1 Adipocytes from White to Beige Adipocytes. J Food Sci. 2020;85:192–200. doi: https://doi.org/10.1111/1750-3841.14811
32. Velickovic K, Wayne D, Leija HAL, Bloor I, Morris DE, et al. Caffeine Exposure Induces Browning Features in Adipose Tissue in Vitro and in Vivo. Sci Rep. 2019;9:9104. doi: https://doi.org/10.1038/s41598-019-45540-1
33. Jang YJ, Koo HJ, Sohn EH, Kang SC, Rhee DK, Pyo S. Theobromine Inhibits Differentiation of 3T3-L1 Cells during the Early Stage of Adipogenesis via AMPK and MAPK Signaling Pathways. Food Funct. 2015;6:2365–2374. doi: https://doi.org/10.1039/C5FO00397K
34. Jang MH, Mukherjee S, Choi MJ, Kang NH, Pham HG, Yun JW. Theobromine Alleviates Diet-Induced Obesity in Mice via Phosphodiesterase-4 Inhibition. Eur J Nutr. 2020;59:3503–3516. doi: https://doi.org/10.1007/s00394-020-02184-6
35. Wang Q, Hu GL, Qiu MH, Cao J, Xiong WY. Coffee, Tea, and Cocoa in Obesity Prevention: Mechanisms of Action and Future Prospects. Curr Res Food Sci. 2024;8:100741. doi: https://doi.org/10.1016/j.crfs.2024.100741
36. Lee SG, Parks JS, Kang HW. Quercetin, a functional compound of onion peel, remodels white adipocytes to brown-like adipocytes. J Nutr Biochem. 2017;42:62–71. doi: https://doi.org/10.1016/j.jnutbio.2016.12.018
37. Jin T, Zhang Y, Botchway BOA, Huang M, Lu Q, Liu X. Quercetin activates the Sestrin2/AMPK/SIRT1 axis to improve amyotrophic lateral sclerosis. Biomed Pharmacother. 2023;161:114515. doi: https://doi.org/10.1016/j.biopha.2023.114515
38. Wang S, Wang X, Ye Z, Xu C, Zhang M, Ruan B, Wei M, Jiang Y, Zhang Y, Wang L, Lei X, Lu Z. Curcumin promotes browning of white adipose tissue in a norepinephrine-dependent way. Biochem Biophys Res Commun. 2015;466(2):247-53. doi: https://doi.org/10.1016/j.bbrc.2015.09.018
39. Lone J, Choi JH, Kim SW, Yun JW. Curcumin induces brown fat-like phenotype in 3T3-L1 and primary white adipocytes. J Nutr Biochem. 2016;27:193-202. doi: https://doi.org/10.1016/j.jnutbio.2015.09.006
40. Song Z, Revelo X, Shao W, Tian L, Zeng K, Lei H, et al. Dietary Curcumin Intervention Targets Mouse White Adipose Tissue Inflammation and Brown Adipose Tissue UCP1 Expression. Obesity (Silver Spring). 2018;26(3):547-558. doi: https://doi.org/10.1002/oby.22110
41. Aloe L, Leon A, Levi-Montalcini R. A proposed autacoid mechanism controlling mastocyte behaviour. Agents Actions. 1993;39:C145-C147. doi: https://doi.org/10.1007/BF01972748
42. Petrosino S, Di Marzo V. The pharmacology of palmitoylethanolamide and first data on the therapeutic efficacy of some of its new formulations. Br J Pharmacol. 2017;174:1349–1365. doi: https://doi.org/10.1111/bph.13580
43. Clayton P, Hill M, Bogoda N, Subah S, Venkatesh R. Palmitoylethanolamide: A Natural Compound for Health Management. Int J Mol Sci. 2021;22(10):5305. doi: https://doi.org/10.3390/ijms22105305
44. Annunziata C, Pirozzi C, Lama A, Senzacqua M, Comella F, et al. Palmitoylethanolamide Promotes White-to-Beige Conversion and Metabolic Reprogramming of Adipocytes: Contribution of PPAR-α. Pharmaceutics. 2022;14(2):338. doi: https://doi.org/10.3390/pharmaceutics14020338
Об авторах
В. С. ЕгороваРоссия
Егорова Вера Сергеевна - к.б.н., научный сотрудник [
Сириус
Researcher ID IWD-9182-2023; Scopus Author ID 57195327345
Конфликт интересов:
Нет
Д. Т. Гурциева
Россия
Гурциева Дзерасса Таймуразовна - аспирант, младший научный сотрудник.
Сириус
Researcher ID KSL-9382-2024; Scopus Author ID 58848190600
Конфликт интересов:
Нет
А. Д. Егоров
Направление «Генная терапия», Центр трансляционной медицины, Научно-технологический университет «Сириус»
Россия
Егоров Александр Дмитриевич - к.б.н., ведущий научный сотрудник, руководитель группы.
354340, Сириус, Олимпийский проспект, д. 1
Researcher ID A-7393-2014; Scopus Author ID 55568681100
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Влияние различных по природе факторов на переход белой жировой ткани в бежевую | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(271KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Егорова В.С., Гурциева Д.Т., Егоров А.Д. Влияние пищевых молекул на переход белой жировой ткани в бежевую. Ожирение и метаболизм. 2024;21(3):295-301. https://doi.org/10.14341/omet13070
For citation:
Egorova V.S., Gurtsieva D.T., Egorov A.D. Nutrient molecules affecting the white-to-beige adipose tissue transition. Obesity and metabolism. 2024;21(3):295-301. (In Russ.) https://doi.org/10.14341/omet13070

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































