Перейти к:
Поствакцинальный и постинфекционный иммунитет против новой коронавирусной инфекции на фоне ожирения и избыточной массы тела
https://doi.org/10.14341/omet12966
Аннотация
Осенью 2019 г. мировое здравоохранение столкнулось с новым РНК-вирусом — коронавирусом 2 тяжелого острого респираторного синдрома SARS-CoV-2. На фоне стремительного распространения инфекции исследовательские центры всех стран мира начали разработку специфических вакцин против COVID-19, используя накопленный опыт и эмпирические данные о стереотипах строения и физиологии других вирусных агентов этого семейства (вируса тяжелого острого респираторного синдрома (SARS) и ближневосточного респираторного синдрома (MERS)). Однако еще до разработки противоковидных вакцин было высказано предположение о, вероятно, их меньшей эффективности у ряда лиц, в частности у людей, страдающих избыточной массой тела или ожирением. Эта гипотеза возникла на основании исследований прошлых лет, изучающих применение различных вакцин у данной категории пациентов, а также на основании многочисленных экспериментов на мышах, благодаря которым ученые пришли к выводу, что перманентный воспалительный процесс на фоне накопления избыточного количества жировой ткани в организме приводит к развитию иммунной дисфункции и, в результате, к сниженной локальной и системной резистентности в отношении бактериальных и вирусных агентов.
В данном литературном обзоре с использованием современных публикаций, полученных по поисковым запросам «covid-19 vaccination and obesity» и «vaccination and obesity» в базах данных PubMed и «вакцинация covid-19 и ожирение» и «вакцинация и ожирение» в базе e-Library, обсуждаются изменения в иммунном ответе как на саму инфекцию, так и иммунизацию на фоне избыточной массы тела или ожирения.
Ключевые слова
Для цитирования:
Климчук А.В., Белоглазов В.А., Яцков И.А., Агзамова Ю.М., Камший А.А., Заяева А.А. Поствакцинальный и постинфекционный иммунитет против новой коронавирусной инфекции на фоне ожирения и избыточной массы тела. Ожирение и метаболизм. 2023;20(1):60-65. https://doi.org/10.14341/omet12966
For citation:
Klimchuk A.V., Beloglazov V.A., Yatskov I.A., Agzamova Yu.M., Kamshii A.A., Zayaeva A.A. Post-vaccination and post-infectious immune response against new coronavirus infection on the background of obesity and overweight. Obesity and metabolism. 2023;20(1):60-65. (In Russ.) https://doi.org/10.14341/omet12966
ВВЕДЕНИЕ
По данным ВОЗ, по состоянию на 2016 г. во всем мире насчитывалось более 650 млн человек, страдающих ожирением [1]. А в период с 1975 по 2016 гг. распространенность ожирения среди населения мира возросла в среднем три раза [2].
При ожирении отмечаются повышенная экспрессия гена TMPRSS2, который кодирует одноименный трансмембранный белок, используемый коронавирусом для активации вирусного S-белка и проникновения в клетку, а также увеличение количества рецепторов ангиотензинпревращающего фермента (ACE2), в том числе в легочной паренхиме, к которым тропен вирус SARS-CoV-2, что и способствует более высокой восприимчивости организма к инфекции среди пациентов с ожирением [2–5].
Избыточная масса тела и ожирение, наряду с другими факторами, оказались предикторами неблагоприятного прогноза течения инфекции, вызванной вирусом SARS-CoV-2, а также причиной высокого риска развития осложнений и летальных исходов. Согласно статистическому отчету по заболеваемости и смертности от COVID-19 Центра по контролю и профилактике заболеваний Соединенных Штатов за период с декабря по март 2020 г., большинство случаев заражения COVID-19 было выявлено именно среди популяции с ожирением. Ожирение также связано с более частыми случаями госпитализаций, высокой вероятностью перевода в отделение интенсивной терапии, интубации и проведения искусственной вентиляции легких по сравнению с пациентами того же возраста и пола, но с нормальной массой тела [4][6–14].
Известно, что избыточная масса тела и ожирение создают клинические сложности при проведении искусственной вентиляции легких из-за ухудшения адекватной вентиляции и экскурсии грудной клетки у этой категории пациентов. У данных лиц может потребоваться использование больших дыхательных объемов и повышенного давления в дыхательном контуре с целью поддержания адекватной оксигенации организма. Из-за этого создается повышенный риск разрыва буллезно-измененной ткани легкого и нарастающего пневмоторакса [6].
РОЛЬ ЛЕПТИНА В ИММУННОЙ ДИСФУНКЦИИ НА ФОНЕ ИЗБЫТОЧНОГО ВЕСА И ОЖИРЕНИЯ
Висцеральная форма ожирения, а также ассоциированный с ожирением метаболический синдром характеризуются хроническими иммунными нарушениями организма, системным увеличением количества лейкоцитов и повышением уровня провоспалительных цитокинов в плазме крови и не только. Состояние перманентного воспаления со временем ведет к истощению организма и закономерной иммунной дисфункции со снижением сопротивляемости организма. В пользу этого утверждения говорят клинические исследования, выявившие, что наличие ожирения у пациентов увеличивало вероятность внутрибольничных и послеоперационных инфекционных процессов, а также их осложнений, а во время эпидемий гриппа отмечалось, что именно лица с избыточной массой тела и ожирением нуждались в более длительной госпитализации [15–19].
Адипокины, являющиеся гормонами жировой ткани, выделяемые адипоцитами, относятся к цитокинам и, как и другие разновидности цитокинов, участвуют в формировании иммунного ответа на инфекционный агент. Следовательно, их уровень модифицирует силу иммунной реакции как на внедрившийся патоген, так и на вводимый с целью приобретения адаптивного искусственного иммунитета компонент вакцины. Адипокины, в частности лептин, регулирующий аппетит и контролирующий энергетический обмен, вырабатываются в основном клетками белой жировой ткани. Рецептор лептина экспрессируется во всей иммунной системе и регуляторные эффекты лептина охватывают клетки как врожденной, так и адаптивной иммунной системы. Таким образом, лептин играет роль не только в энергетическом балансе, но и в поддержке хронического воспалительного процесса, регистрируемого у пациентов с ожирением (рис. 1) [15].
Повышенный уровень лептина (в сочетании со снижением чувствительности организма к нему) у лиц с ожирением ассоциирован со снижением количества T-регуляторных иммунных клеток, большей экспрессией провоспалительных цитокинов, активацией JAK/STAT-сигнального пути, прогрессивным усилением воспаления и гиперактивацией нейтрофилов и нейтрофильной инфильтрацией легочной паренхимы при COVID-19, что ведет к ее серьезному повреждению. Соответственно, усиление воспалительной реакции прямо пропорционально количеству жировой ткани. Кроме того, при повышенном уровне лептина культивируемые ex vivo В-клетки с гораздо меньшей эффективностью демонстрируют процесс «переключения классов антител», то есть с синтеза иммуноглобулинов острой фазы — иммуноглобулинов М на иммуноглобулины класса G за счет подавляющего действия лептина на фермент цитидиндезаминазу и ее транскрипционный регулятор E47 [14][18][20][21].

Рисунок 1. Влияние лептина на иммунную систему.
Figure 1. Effect of leptin on the immune system.
ИММУННЫЙ ОТВЕТ НА ФОНЕ ИЗБЫТОЧНОГО ВЕСА И ОЖИРЕНИЯ
Популяции эффекторных Т-клеток памяти отводится решающая роль в обеспечении долгосрочной иммунной защиты. Опыт, полученный при эпидемиях гриппа, продемонстрировал, что у лиц с ожирением наблюдается ослабленная активация и дифференцировка T-клеток, а также выработка ими эффекторных молекул (например, IFN-γ и гранзима В) в ответ на внедрившийся вирус гриппа, в отличие от лиц со здоровым весом. А также отмечается более низкая активация в ответ на инфекцию и среди пула В-клеток [21].
Дисфункция Т-клеток на фоне ожирения в настоящее время объясняется более короткой длиной теломер Т-клеток, что развивается вследствие хронического воспаления и сопутствующего оксидативного стресса. Это ведет к снижению способности клеток к ответу на проникший патогенный микроорганизм, а также к нарушению специфичной дифференцировки для ответа против того самого инфекционного агента, с которым ранее сталкивался организм [19].
Еще одно объяснение дисфункции эффекторных Т-клеток — усиление экспрессии мембранного белка PD-1 (рецептор запрограммированной клеточной смерти), а также его лиганда — PD-L1 на поверхности других иммунных клеток, которые взаимодействуют с Т-лимфоцитами. Суть заключается в том, что повышенная их экспрессия ведет к большей степени взаимодействия между ними, а далее — замедлению пролиферации Т-лимфоцитов, а также их активности (в том числе чувствительности к экспрессируемым антигенпредставляющими клетками (АПК) антигенам инфекционных патогенов) (рис. 2) [19].
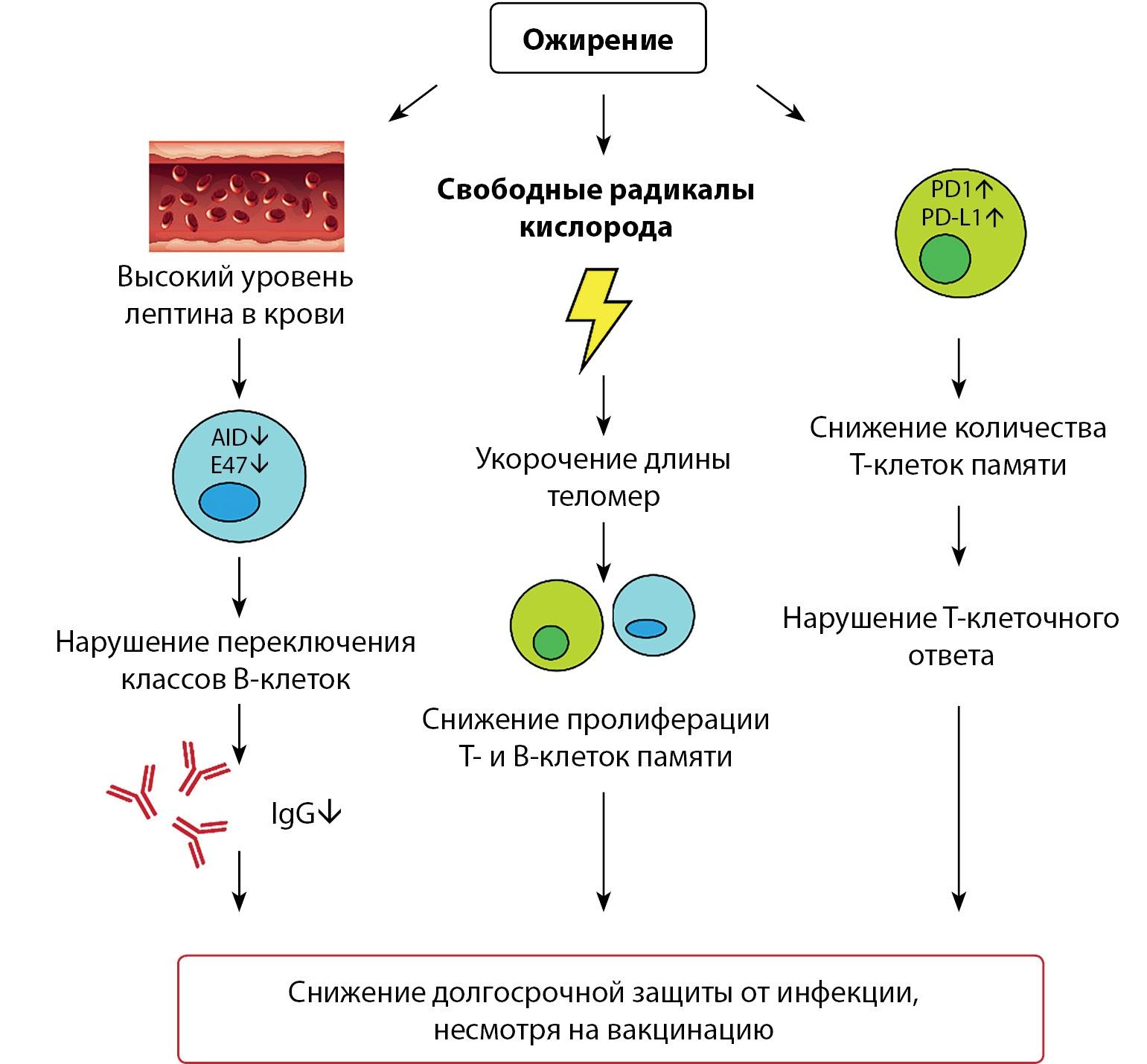
Рисунок 2. Механизмы снижения долгосрочной иммунной защиты пациентов с ожирением против вирусных инфекций, в том числе против COVID-19. Усиление экспрессии мембранного рецептора Т-клеток PD-1 и его лиганда PD-L1. Роль оксидативного стресса в снижении длины теломер Т-клеток, впоследствии — снижение пролиферации и дифференцировки клеток. А также роль гиперлептинемии в снижении долгосрочной защиты в виде дефекта выработки специфичных иммуноглобулинов класса G.
Figure 2. Mechanisms for reducing the long-term immune protection of obese patients against viral infections, including against COVID-19. Increased expression of the T-cell membrane receptor PD-1 and its ligand PD-L1. The role of oxidative stress in reducing the length of T-cell telomeres, subsequently — reducing cell proliferation and differentiation. As well as the role of hyperleptinemia in reducing long-term protection in the form of a defect in the production of specific class G immunoglobulins.
Существуют данные, свидетельствующие, что кровь пациентов, переболевших 17 лет назад инфекцией, вызванной SARS-CoV, все еще содержит цитотоксические Т-клетки памяти, специфично реагирующие на пептидные фрагменты вируса SARS-CoV [22].
Однако несколько исследований на животных выявили, что при ожирении с течением времени популяция данных клеток стремительно уменьшается, функция оставшихся значительно нарушена (их специфичность по отношению к определенному патогену сомнительна, также снижен уровень продуцируемого IFN-γ), и в конце концов иммунная защита оказывается абсолютно неэффективной [23]. Экспериментальные исследования на мышах выявили, что ожирение ассоциируется со снижением функции тимуса и приводит к ограничению видового субпопуляционного разнообразия Т-клеток [19].
Другие исследования показали, что у мышей, у которых искусственно вызвали ожирение гиперкалорийной диетой (так называемые diet induced obesity mice), были выявлены более низкие титры антител после заражения штаммом гриппа и после введения адъювантной вакцины против вируса гриппа по сравнению с популяцией мышей с нормальным весом [24][25].
Гипотеза о недостаточной эффективности разработанных на сегодняшний день вакцин против SARS-CoV-2 при применении их у людей, страдающих избыточной массой тела или ожирением, появилась в результате эмпирически полученных данных о недостаточной активации иммунной системы данных лиц на вакцинацию в первую очередь от вируса гриппа A (H1N1). Необходимо отметить, что в исследования по гриппу и при коронавирусной инфекции были проведены в группе, в которую входили лица как с избыточной массой тела, так и с ожирением. На данный момент нет достаточной информации и убедительных данных о сравнительных исследованиях позволяющих судить о том, одинаковы ли иммунные механизмы снижения уровня вакцин-индуцированных антител при избыточной массе тела и ожирении [21].
Сниженный титр антител у людей с ожирением наблюдался также при вакцинации против гепатита В, столбняка и бешенства [26].
В исследовании поствакцинального иммунитета против сезонного гриппа и клещевого энцефалита было проведено сравнение иммунного ответа у лиц с нормальным весом и ожирением. Было убедительно показано, что при ожирении инициальный ответ на вакцину сопровождался более высоким уровнем специфических антител, чем у лиц с нормальной массой тела. Кроме этого, было выявлено, что циркуляция поствакцинальных антител была намного менее продолжительна в организме, и титр их снижался гораздо быстрее с течением времени в группе лиц с ожирением [19]. Сходные результаты получены при другом небольшом когортном исследовании, показавшем, что ожирение связано со снижением титра антител после вакцинации против гриппа как в группе молодых, так в группе пожилых пациентов [24].
Среди 360 лиц, получивших две дозы неактивной вакцины против COVID-19 инфекции (Corona Vac, произведенная компанией Sinovac Life Sciences в Пекине, Китай) было проведено следующее исследование. Опытная группа была набрана среди пациентов Центра, занимающегося лечением ожирения при Стамбульском университете Серрахпаша, и состояла из 169 лиц, чей ИМТ 30 кг/м2 и более. Контрольная группа состояла из случайных лиц, не страдающих ожирением. У обеих групп кровь для количественного анализа на сероконверсию специфических вируснейтрализующих антител группы G была взята на 3–4 неделе после введения второго компонента вакцины. Выявлена корреляция между индексом массы и сниженным уровнем нейтрализующих антител после введения двух компонентов вакцины у пациентов с ожирением I степени [27]. Внутри опытной и контрольной групп были выделены также подгруппы пациентов, которые переболели новой коронавирусной инфекцией до получения вакцины. При проведении сравнительного анализа в данных подгруппах установлено, что уровень антител, выработанных в ответ на неактивную вакцину от COVID-19 у людей с ожирением, был достоверно значительно ниже, чем в подгруппе лиц с нормальной массой тела (р=0,001 и р=0,03 соответственно). Этот результат свидетельствует об ослаблении специфического иммунного ответа на искусственно вводимую инактивированную вакцину после перенесенной COVID-19 инфекции в группе лиц с ожирением. Авторы исследования отмечают, что одним из факторов риска сниженной иммунореактивности явился пол: среди женщин, даже с ожирением, наблюдался больший иммунный ответ, чем среди мужчин с ожирением [10].
Более низкие титры антител после двух фаз вакцинации были зарегистрированы у лиц с ожирением и в другом исследовании, проведенном в группе вакцинированных сотрудников медицинской организации Policlinico Umberto I Hospital в Риме, Италия. Среди 86 медицинских работников, вакцинированных дважды с интервалом в 3 нед вакциной Pfizer/BioNTech, более низкие титры нейтрализующих антител к S-белку SARS-Cov-2 вируса, были обнаружены у лиц с висцеральной формой ожирения (p=0,004), а также у курильщиков (p=0,007), лиц, страдающих гипертонической болезнью (р=0,001) и лиц с выявленной дислипидемией (р=0,005) по сравнению с сотрудниками с нормальными липидным профилем и массой тела, не курящих, не страдающих гипертонией соответственно. В данном исследовании, в отличие от описанного ранее, ожирение, определяемое как ИМТ≥30 кг/м2, не коррелировало с более низкими титрами антител к SARS-CoV‐2 (р=0,524). В этом случае более чувствительным критерием явился именно критерий висцеральной формы ожирения. Это объясняется тем, что окружность талии в большей степени, чем показатель ИМТ, связана с состоянием хронического низко интенсивного воспаления [28].
Следующее исследование продемонстрировало связь висцеральной формы ожирения со степенью иммунной реакции на вводимую вакцину. Так, 22 пациента с абдоминальным ожирением, вакцинированные мРНК Pfizer BNT162b2, сразу после получения полного курса вакцинации были переведены на диетическое питание с рассчитанной индивидуальной калорийностью. На протяжении эксперимента пациенты потеряли в среднем 10% массы тела, что сопровождалось улучшением специфического иммунного ответа на вакцинацию, и подтверждает достоверное влияние жировой ткани на уровень иммунной реактивности [29].
Необходимо отметить, что существуют и противоположные данные о том, что на эффективность антиковидных вакцин наличие ожирения не оказывает существенного влияния. Так, согласно исследованиям о безопасности и эффективности препаратов компаний Pfizer, Moderna и Johnson & Johnson (J&J), разработанные ими вакцины против SARS-CoV-2 оказались одинаково результативными как у пациентов со здоровой массой тела, так и среди людей с ожирением. Эффективность вакцинации у Pfizer составила 94,5% у лиц с ожирением и 94,8% со нормальной массой тела.
Согласно экспертным мнениям, исследования вакцин Pfizer/BioNTech, Moderna и J&J относительно их безопасности и эффективности недостаточно информативны из-за малой величины испытуемых подгрупп, а также ограничений из-за неполной стратификации по степени и причинам ожирения [21].
Таким образом, пациенты с ожирением, изначально входящие в группу потенциально более высокого риска среднетяжелой и тяжелой форм течения инфекции и летальных исходов, также остаются более уязвимыми даже после профилактической вакцинации из-за меньшей продолжительности защиты, обеспечиваемой вакциной [30].
ЗАКЛЮЧЕНИЕ
Многофакторность этиологии и патогенеза ожирения, сложность лечения коморбидных патологий у данной категории больных приводит к потребности в индивидуальном подходе и поиске более совершенных методов ведения этих пациентов, а также разработки для них персонифицированных профилактических мероприятий, в том числе при проведении вакцинации. Данные, полученные в ходе клинических исследований, убедительно доказывают, что у пациентов с ожирением снижены иммунная реактивность и эффективность специфической вакцинации.
Степень распространенности ожирения и прогноз последующего роста его в ближайшие годы приводит к важности поиска более совершенных алгоритмов вакцинации, а также подходов к лечению тяжелых вирусных, бактериальных и грибковых инфекций у данной категории пациентов.
Необходимы дальнейшее изучение долгосрочной эффективности имеющихся вакцин против SARS-CoV-2 среди пациентов с ожирением, использование дополнительных бустеров, адъювантов для повышения эффективности мер специфической профилактики. Кроме этого, целесообразно продолжить мониторирование за уровнем поствакцинальных вируснейтрализующих антител к SARS-CoV-2, а также специфического клеточного иммунного ответа у лиц с различными вариантами распределения жировой ткани.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Аналитическая работа была выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Все авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Белоглазов В.А. — концепция работы, анализ данных, внесение правок в рукопись; Климчук А.В. — анализ данных, внесение существенных правок в рукопись; Яцков И.А. — концепция работы, анализ данных, написание статьи и внесение правок в рукопись; Агзамова Ю.М. — концепция работы, написание статьи; Камший А.А. — анализ данных, написание статьи; Заяева А.А. — концепция работы, написание статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
*Автор, ответственный за переписку / Corresponding author.
Список литературы
1. WHO [Internet] 2021. Fact sheet on overweight and obesity: World Health Organization. [cited 16.02.2023] Available from: https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight
2. Rychter AM, Zawada A, Ratajczak AE, e Should patients with obesity be more afraid of COVID‐19? Obes Rev. 2020;21(9):e13083. doi: https://doi.org/10.1111/obr.13083
3. Karlsson EA, Beck MA. The burden of obesity on infectious disease. Exp Biol Med. 2010;235(12):1412-1424. doi: https://doi.org/10.1258/ebm.2010.010227
4. Lu R, Zhao X, Li J, et al. Genomic characterization and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. The Lancet. 2020;395(10224):565-574. doi: https://doi.org/10.1016/S0140-6736(20)30251-8
5. Rokkam VRP, Vegunta R, Prudhvi K, et al. “Weighing” the risks and benefits – Thromboprophylaxis challenges in obese COVID-19 patients. Obes Med. 2020;(19):100284. doi: https://doi.org/10.1016/j.obmed.2020.100284
6. Alfaro S, Autrey C, Sen-Crowe B, Elkbuli A. Obesity implications on SARS-CoV-2 infections’ prevalence, hospitalizations, critical care needs, fatalities & vaccination rates: A public health crisis. Ann Med Surg. 2021;(72):103096. doi: https://doi.org/10.1016/j.amsu.2021.103096
7. Croci S, Venneri MA, Mantovani S, et al. The polymorphism L412F in TLR3 inhibits autophagy and is a marker of severe COVID-19 in males. Autophagy. 2022;18(7):1662-1672. doi: https://doi.org/10.1080/15548627.2021.1995152
8. Gebhard C, Regitz-Zagrosek V, Neuhauser HK, et al. Impact of sex and gender on COVID-19 outcomes in Europe. Biol Sex Differ. 2020;11(1):29. doi: https://doi.org/10.1186/s13293-020-00304-9
9. Helvaci N., Eyupoglu N.D., Karabulut E., et al. Prevalence of obesity and its impact on outcome in patients with COVID-19: a systematic review and meta-analysis. Front Endocrinol (Lausanne). 2021;12:598249. doi: https://doi.org/10.3389/fendo.2021.598249
10. Izquierdo JL, Ancochea J, Soriano JB. Clinical characteristics and prognostic factors for intensive care unit admission of patients with COVID-19: retrospective study using machine learning and natural language processing. J Med Internet Res. 2020;22(10):e21801. doi: https://doi.org/10.2196/21801
11. O’Neill S, O’Driscoll L. Metabolic syndrome: a closer look at the growing epidemic and its associated pathologies. Obesity Reviews. 2015;16(1):1-12. doi: https://doi.org/10.1111/obr.12229
12. Sattar N, McInnes IB, McMurray JJV. Obesity is a risk factor for severe COVID-19 infection. Circulation. 2020;142(1):4-6. doi: https://doi.org/10.1161/CIRCULATIONAHA.120.047659
13. Stefan N, Birkenfeld AL, Schulze MB, Ludwig DS. Obesity and impaired metabolic health in patients with COVID-19. Nat Rev Endocrinol. 2020;16(7):341-342. doi: https://doi.org/10.1038/s41574-020-0364-6
14. Trayhurn P, Wood IS. Adipokines: inflammation and the pleiotropic role of white adipose tissue. Br J Nutr. 2004;92(3):347-355. doi: https://doi.org/10.1079/BJN20041213
15. Абатуров А.Е. Особенности метаболического синдрома у детей // Дитячий лікар. — 2011. — Т. 4. — №11. — С. 54-61.
16. Ройтберг Г.Е. Метаболический синдром. — М.: МЕДпресс-информ; 2007.
17. Шпилевская Ю.Р., Штонда М.В. Метаболический синдром: современные аспекты диагностики и лечения // Медицинские новости. — 2021. — №5. — С. 4-8.
18. Vandanmagsar B, Youm Y-H, Ravussin A, et al. The NLRP3 inflammasome instigates obesity-induced inflammation and insulin resistance. Nat Med. 2011;17(2):179-188. doi: https://doi.org/10.1038/nm.2279
19. Westheim AJF, Bitorina AV, Theys J, Shiri‐Sverdlov R. COVID‐19 infection, progression, and vaccination: Focus on obesity and related metabolic disturbances. Obes Rev. 2021;22(10):e13313. doi: https://doi.org/10.1111/obr.13313
20. Павлова З.Ш., Голодников И.И. Ожирение = воспаление. Патогенез. Чем это грозит мужчинам? // Медицинский вестник Юга России. — 2020. — Т. 11. — №4. — С. 6-23. doi: https://doi.org/10.21886/2219-8075-2020-11-4-6-23
21. Nasr M-JC, Geerling E, Pinto AK. Impact of Obesity on Vaccination to SARS-CoV-2. Front Endocrinol (Lausanne). 2022;13(10). doi: https://doi.org/10.3389/fendo.2022.898810
22. Le Bert N, Tan AT, Kunasegaran K, et al. SARS‐CoV‐2‐specific T cell immunity in cases of COVID‐19 and SARS, and uninfected controls. Nature. 2020;584(7821):457‐462. doi: https://doi.org/10.1038/s41586-020-2550-z
23. Karlsson EA, Sheridan PA, Beck MA. Diet-Induced Obesity in Mice Reduces the Maintenance of Influenza-Specific CD8+ Memory T Cells. J Nutr. 2010;140(9):1691-1697. doi: https://doi.org/10.3945/jn.110.123653
24. Frasca D, Ferracci F, Diaz A, et al. Obesity decreases B cell responses in young and elderly individuals. Obesity (Silver Spring). 2016;24(3):615‐625. doi: https://doi.org/10.1002/oby.21383
25. Kosaraju R, Guesdon W, Crouch MJ, et al. B cell activity is impaired in human and mouse obesity and is responsive to an essential fatty acid upon murine influenza infection. J Immunol. 2017;198(12):4738-4752. doi: https://doi.org/10.4049/jimmunol.1601031
26. Painter SD, Ovsyannikova IG, Poland GA. The weight of obesity on the human immune response to vaccination. Vaccine. 2015;33(36):4422-4429. doi: https://doi.org/10.1016/j.vaccine.2015.06.101
27. Kara Z, Akçin R, Demir AN, et al. Risk Factors Influencing Seroconversion after Inactive SARS-CoV-2 Vaccination in People Living with Obesity. Obes Facts. 2022;15(5):648-654. doi: https://doi.org/10.1159/000525555
28. Watanabe M, Balena A, Tuccinardi D, et al. Central obesity, smoking habit, and hypertension are associated with lower antibody titres in response to COVID‐19 mRNA vaccine. Diabetes Metab Res Rev. 2022;38(1). doi: https://doi.org/10.1002/dmrr.3465
29. Watanabe M, Balena A, Masi D, et al. Rapid weight loss, central obesity improvement and blood glucose reduction are associated with a stronger adaptive immune response following COVID-19 mRNA vaccine. Vaccines. 2022;10(1):79. doi: https://doi.org/10.3390/vaccines10010079
30. Poland GA, Ovsyannikova IG, Kennedy RB. Personalized vaccinology: A review. Vaccine. 2018;36(36):5350-5357. doi: https://doi.org/10.1016/j.vaccine.2017.07.062
Об авторах
А. В. КлимчукРоссия
Климчук Анастасия Васильевна, кандидат медицинских наук
295051, Симферополь, бульвар Ленина 5/7
В. А. Белоглазов
Россия
Белоглазов Владимир Алексеевич, доктор медицинских наук, профессор
Симферополь
Scopus Author ID: 7007129056
И. А. Яцков
Россия
Яцков Игорь Анатольевич, кандидат медицинских наук
Симферополь
Scopus Author ID: 57218873902
Ю. М. Агзамова
Россия
Агзамова Юлдуз Мансуровна, студент
Симферополь
А. А. Камший
Россия
Камший Алина Анатольевна
Симферополь
А. А. Заяева
Россия
Заяева Анна Анатольевна, кандидат медицинских наук
Симферополь
Дополнительные файлы
|
|
1. Рисунок 1. Влияние лептина на иммунную систему | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(250KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Механизмы снижения долгосрочной иммунной защиты пациентов с ожирением против вирусных инфекций, в том числе против COVID-19. Усиление экспрессии мембранного рецептора Т-клеток PD-1 и его лиганда PD-L1. Роль оксидативного стресса в снижении длины теломер Т-клеток, впоследствии — снижение пролиферации и дифференцировки клеток. А также роль гиперлептинемии в снижении долгосрочной защиты в виде дефекта выработки специфичных иммуноглобулинов класса G | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(250KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Климчук А.В., Белоглазов В.А., Яцков И.А., Агзамова Ю.М., Камший А.А., Заяева А.А. Поствакцинальный и постинфекционный иммунитет против новой коронавирусной инфекции на фоне ожирения и избыточной массы тела. Ожирение и метаболизм. 2023;20(1):60-65. https://doi.org/10.14341/omet12966
For citation:
Klimchuk A.V., Beloglazov V.A., Yatskov I.A., Agzamova Yu.M., Kamshii A.A., Zayaeva A.A. Post-vaccination and post-infectious immune response against new coronavirus infection on the background of obesity and overweight. Obesity and metabolism. 2023;20(1):60-65. (In Russ.) https://doi.org/10.14341/omet12966

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































