Перейти к:
Новые возможности коррекции неалкогольной жировой болезни печени у мужчин с сахарным диабетом 2 типа и гипогонадизмом
https://doi.org/10.14341/omet12495
Аннотация
Обоснование. Общность патогенетических связей сахарного диабета 2 типа (СД2), дефицита тестостерона (Т) и неалкогольной жировой болезни печени (НАЖБП) обозначила новое направление в изучении взаимного влияния данных состояний. Было установлено, что у мужчин с СД2 и гипогонадизмом НАЖБП выражена более значимо, чем у эугонад-ных пациентов, и ассоциирована с развитием гиперинсулинемии, инсулинорезистентности, нарушениями липидного обмена и дисфункцией жировой ткани. Однако исследования о влиянии заместительной терапии тестостероном (ЗТТ) на выраженность НАЖБП у мужчин с гипогонадизмом не проводились.
Цель. Оценить влияние ЗТТ на выраженность НАЖБП у мужчин с СД2 и гипогонадизмом.
Методы. Больным проводили оценку антропометрических данных и биохимических показателей (аланинаминотрансфераза (АЛТ), аспартатаминтрансфераза (АСТ), гамма-глутамилтранспептидаза (ГГТП), глюкоза, иммунореактивный инсулин, индекс НОМА, гликированный гемоглобин, липидограмма), выполняли иммуноферментные исследования (лютеинизирующий гормон, общий Т, глобулин, связывающий половые гормоны, резистин, адипонектин, лептин), магнитно-резонансную томографию с определением фракции жира печени.
Результаты. Исследование включало 60 мужчин с СД2 и гипогонадизмом (средний возраст 54 [49; 57] года), которые были рандомизированы в 2 группы: 1 (n=30) - пациенты, получавшие ЗТТ 1% трансдермальным гелем Т в дозе 50 мг в сутки в дополнение к стандартной сахароснижающей терапии; 2 (n=30) - больные, находившиеся на стандартной сахароснижающей терапии. Срок наблюдения составил 6 месяцев. Терапия Т была ассоциирована со снижением уровней ферментов печени: АСТ на 31%, АЛТ на 21%, и ГГТП на 15,9% (р<0,05) и печеночной фракции жира в 1,7 раза, что отражает регресс воспалительной активности в печени. Более того, ЗТТ улучшала функцию жировой ткани - снижала концентрации лептина в 1,4 раза и резистина в 1,5 раз, что сопровождалось увеличением уровня адипонектина в 1,3 раза (р<0,01). Применение ЗТТ способствовало уменьшению выраженности висцерального ожирения, снижению гиперинсулинемии в 1,5 раза, индекса инсулинорезистентности НОМА в 2,2 раза, показателей гликемии натощак и уровня HbA1c при неизменной сахароснижающей терапии. Со стороны липидного обмена на фоне ЗТТ наблюдалось статистически значимое снижение уровней общего холестерина и триглицеридов. Таким образом, снижение дисфункции жировой ткани и инсулинорезистентности на фоне ЗТТ можно рассматривать как патогенетический механизм, ответственный за снижение воспаления в печени и степени выраженности стеатоза при НАЖБП, что потенциально оказывает превентивное влияние на формирование фиброза и цирроза печени у таких пациентов.
Заключение. ЗТТ у мужчин с СД2 и гипогонадизмом способствует регрессу воспалительной активности в печени и уменьшению выраженности стеатоза гепатоцитов, что отражается в снижении уровня печеночных ферментов и фракции печеночного жира по данным МРТ.
Ключевые слова
Для цитирования:
Хрипун И.А., Воробьев С.В., Аллахвердиева Я.С., Дзантиева Е.О., Рассказова М.А. Новые возможности коррекции неалкогольной жировой болезни печени у мужчин с сахарным диабетом 2 типа и гипогонадизмом. Ожирение и метаболизм. 2020;17(3):241-248. https://doi.org/10.14341/omet12495
For citation:
Khripun I.A., Vorobyev S.V., Allahverdieva Ya.Y., Dzantieva E.O., Rasskazova M.A. New opportunities for the correction of non-alcoholic fatty liver disease in men with type 2 diabetes mellitus and hypogonadism. Obesity and metabolism. 2020;17(3):241-248. (In Russ.) https://doi.org/10.14341/omet12495
ОБОСНОВАНИЕ
Внимание многих исследователей в последнее десятилетие приковано к проблеме неалкогольной жировой болезни печени (НАЖБП), занимающей лидирующие позиции среди всех заболеваний печени – 71,6% и принимающей масштабы неинфекционной эпидемии [1][2]. В Российской популяции распространенность НАЖБП составляет 27%, из которых 80,3% случаев приходится на стеатоз печени, 16,8% – на стеатогепатит, а 2,9% выпадает на долю цирроза печени [2]. Особо остро данный вопрос стоит у пациентов с ожирением и сахарным диабетом 2 типа (СД2), у которых НАЖБП выявляется в 2–3 раза чаще, чем в популяции в целом [3]. При этом, данные заболевания являются взаимоотягощающими – не только стеатогепатит встречается чаще у пациентов с нарушениями углеводного обмена, но и напротив, НАЖБП является предиктором развития СД2 [4]. Так, наличие у пациента НАЖБП увеличивает риск развития СД2 вдвое [5]. Предполагается, что столь тесная связь между этими состояниями патогенетически обусловлена общим механизмом развития – инсулинорезистентностью, но в то же время, хорошо известно, что она лежит в основе метаболического синдрома и сердечно-сосудистых заболеваний [6][7]. Изучение НАЖБП в данном аспекте привело к неожиданным выводам – ее стали рассматривать как новый фактор риска кардиоваскулярных заболеваний, причем, даже на доклиническом этапе [8].
С другой стороны, выявлена тесная связь СД2, ожирения, артериальной гипертензии и дислипидемии с дефицитом тестостерона (Т) у мужчин, который повышает риск развития данных состояний в 1,5–2,5 раза [9]. Российское исследование определило, что распространенность синдрома гипогонадизма у мужчин с СД2 составляет 32,7% [10]. Интересно то, что в основе патогенетической связи компонентов метаболического синдрома и дефицита Т также лежит инсулинорезистентность в сочетании с дисбалансом цитокинов и эндотелиальной дисфункцией [11][12]. Таким образом, общность патогенетических механизмов развития компонентов метаболического синдрома, дефицита Т и НАЖБП обозначила новое направление в изучении взаимного влияния данных состояний [13]. Так, было установлено, что у мужчин с СД2 и гипогонадизмом НАЖБП выражена более значимо, чем у эугонадных пациентов, и ассоциирована с развитием гиперинсулинемии, инсулинорезистентности, нарушениями липидного обмена и дисфункцией жировой ткани [14]. Получив столь важные результаты, возможно предположить, что восстановление дефицита Т может позитивно повлиять на функцию печени. На сегодняшний день хорошо известны положительные эффекты заместительной терапии тестостероном (ЗТТ) на углеводный, липидный обмен, эректильную дисфункцию и даже сосудистый эндотелий и сердце [15][16][17]. Однако исследования о влиянии ЗТТ у мужчин с гипогонадизмом на выраженность НАЖБП не проводились.
ЦЕЛЬ
Оценить влияние ЗТТ на выраженность НАЖБП у мужчин с СД2 и гипогонадизмом.
МЕТОДЫ
Дизайн исследования
Проведено интервенционное одноцентровое проспективное контролируемое рандомизированное открытое исследование.
Критерии соответствия
Критерии включения: СД2 длительностью не менее 1 года, мужской пол, наличие у пациента диагностических критериев гипогонадизма Российской ассоциации эндокринологов (2017), возраст 40–65 лет, терапия пероральными гипогликемическими препаратами групп бигуанидов, сульфонилмочевины и/или ингибиторами ДПП-4, стабильность сахароснижающей терапии в течение 3 месяцев.
Критерии исключения: употребление алкоголя более 30 г в сутки, согласно европейским рекомендациям по ведению НАЖБП, для исключения алкогольного генеза поражения печени [18], наличие вирусных гепатитов в анамнезе, прием лекарственных препаратов, имеющих гепатотоксическое действие, противопоказания к назначению ЗТТ.
Условия проведения
Исследование проводили на базе эндокринологического отделения клиники ФГБОУ ВО «Ростовский государственный медицинский университет» МЗ РФ. В исследование включали как больных, находившихся на стационарном лечении, так и пациентов, обратившихся за амбулаторной помощью.
Продолжительность исследования
Включение пациентов в исследование производили с 2018 по 2019 гг, динамическое наблюдение осуществляли с 2018 по 2020 гг. Период наблюдения составил 6 месяцев.
Описание медицинского вмешательства
Больным проводили сбор жалоб, изучение анамнеза, измерение антропометрических показателей (масса тела, рост, индекс массы тела, окружность талии (ОТ), окружность бедер (ОБ), отношение ОТ/ОБ). Пациентам осуществляли забор венозной крови объемом 10 мл, строго натощак после 12-часового голодания. Для проведения биохимических анализов использовали свежую сыворотку крови, иммуноферментные исследования осуществляли из сыворотки, замороженной при температуре -20° С. Оценку интенсивности воспаления печени проводили по биохимическим показателям (аланинаминотрансферазе (АЛТ), аспартатаминтрансферазе (АСТ), гамма-глутамилтранспептидазе (ГГТП)). Состояние углеводного и липидного обменов оценивали при помощи следующих показателей: глюкоза и иммунореактивный инсулин (ИРИ) натощак с расчетом индекса инсулинорезистентности НОМА, гликированный гемоглобин (НbА1с) и липидограмма (общий холестерин, уровень триглицеридов, ЛПНП). Также изучали содержание половых гормонов – общего Т, глобулина, связывающего половые гормоны (ГСПГ), расчетного свободного Т, лютеинизирующего гормона (ЛГ) и гормонов жировой ткани – лептина, резистина, адипонектина. Для оценки выраженности НАЖБП и определения содержания жира в печени проводили ее магнитно-резонансную томографию (МРТ). Полное комплексное обследование проводили исходно и через 6 месяцев.
Сахароснижающая терапия по условиям протокола исследования на всем протяжении исследования оставалась стабильной.
Пациенты терапевтической группы (группа 1) получали терапию 1% трансдермальным гелем Т (Андрогель) в дозе 50 мг в сутки. Гель наносили накожно в утренние часы ежедневно.
Основной исход исследования
Основными конечными точками исследования были антропометрические параметры, показатели функции печени (АЛТ, АСТ, ГГТП), концентрации гормонов жировой ткани (лептина, резистина, адипонектина) и содержание фракции жира печени по данным МРТ.
Дополнительные исходы исследования
Дополнительными конечными точками исследования были уровни половых гормонов, показатели углеводного и липидного обменов.
Анализ в подгруппах
Пациенты были рандомизированы в две группы:
1 группа (терапевтическая) – 30 мужчин с СД2 и гипогонадизмом, получавших ЗТТ в дополнение к стандартной сахароснижающей терапии;
2 группа (группа контроля) – 30 мужчин с СД2 и гипогонадизмом, находившихся на стандартной сахароснижающей терапии.
Методы регистрации исходов
Оценку показателей гликемии, липидограммы и ферментов печени проводили при помощи анализатора Bayer ADVIA 1650, определение НbА1с – Siemens Healthcare Diagnostics DCA 2000+. Иммуноферментный анализ выполняли с использованием анализатора Zenyth 340. Иммуноферментный анализ уровней половых гормонов проводили при помощи лабораторных наборов «Алкор-Био» (Россия), ИРИ – Monobind Inc (США), гормонов жировой ткани: лептина – Bcm diagnostic llc (Германия), резистина – Biovendor laboratory (Чехия), адипонектина – eBioscience (Австрия). Степень выраженности инсулинорезистентности определяли при помощи расчета индекса НОМА по формуле:
HOMA = гликемия натощак (ммоль/л) × уровень инсулина (мкЕд/мл) / 22,5.
МРТ печени выполняли на мультисрезовом спиральном рентгеновском компьютерном томографе Brilliance 64 Slice (Philips Medical Systems, Нидерланды) по методу Диксона с оценкой доли печеночного жира, взвешенной по протонной плотности.
Этическая экспертиза
Все пациенты до начала исследования подписали форму информированного согласия, одобренную Локальным этическим комитетом Ростовского государственного медицинского университета (протокол №12/18 от 28.06.2018).
Статистический анализ
Принципы расчета размера выборки: Размер выборки предварительно не рассчитывался.
Методы статистического анализа данных: Статистический анализ данных проводили при помощи пакета прикладных программ Statistica 10.0 (StatSoft Inc., США). Переменные были проверены на нормальность распределения с помощью критерия Колмогорова–Смирнова. Данные представлены в виде медиан и интерквартильного размаха Me [Q1; Q3]. Оценка различий количественных признаков между группами проводилась с помощью U-критерия Манна–Уитни, внутри групп (исходно и после лечения) – критерия Вилкоксона. Статистически значимым считали различие при значении р<0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Исследование включало 60 мужчин с СД2 в сочетании с гипогонадизмом (средний возраст 54 [ 49; 57 ] года, длительность диабета – 6 [ 2; 10 ] лет). 1-ая группа была представлена 30 мужчинами с СД2 и гипогонадизмом, которым помимо стандартной сахароснижающей терапии была назначена ЗТТ. 2-ая группа состояла из 30 мужчин с СД2 и гипогонадизмом, находившихся на стандартной сахароснижающей терапии. Обе группы состояли преимущественно из пациентов с НАЖБП на стадии стеатоза. Исходно группы были сопоставимы по возрасту, длительности, терапии СД2 и всем изучаемым показателям.
Основные результаты исследования
Изменение антропометрических показателей в группах представлено в таблице 1. Проведенное исследование выявило статистически значимое снижение массы тела и ИМТ в 1-ой группе по сравнению со 2-ой (р<0,001). Это сопровождалось достоверным уменьшением показателей ОТ и ОБ в 1-ой группе, тогда как во 2-ой группе, на фоне некомпенсированного дефицита Т, несмотря на незначительное снижение массы тела, происходило перераспределение жировой клетчатки – увеличение ОТ при статистически значимом снижении ОБ. Данные изменения привели к достоверным межгрупповым различиям по всем вышеописанным параметрам после лечения.
Обращает на себя внимание динамика уровней ферментов печени, представленная в таблице 2. У пациентов, получавших ЗТТ отмечено снижение концентраций АСТ на 31%, АЛТ на 21%, и ГГТП на 15,9% (р<0,05). В то же время, в группе контроля наблюдалось некоторое повышение содержания ферментов печени в сыворотке крови, статистически значимое в отношении АЛТ. В итоге, к концу наблюдения были выявлены достоверные межгрупповые отличия по всем вышеописанным показателям (р<0,001).
Таблица 3 демонстрирует изменения содержания гормонов жировой ткани на фоне лечения. Терапия Т приводила к снижению уровней лептина в 1,4 раза и резистина в 1,5 раз, что сопровождалось увеличением уровня адипонектина в 1,3 раза (р<0,01). В группе контроля статистически значимым было лишь уменьшение концентрации адипонектина (р<0,05). Таким образом, разнонаправленные изменения концентраций адипогормонов у пациентов 1 и 2 групп привели к достоверным межгрупповым различиям после лечения (р<0,001).
Таблица 1. Влияние заместительной терапии тестостероном на антропометрические показатели.
|
Параметр |
Группа 1 До лечения |
Группа 1 После лечения |
Группа 1/ группа 2, р до лечения |
Группа 2 До лечения |
Группа 2 После лечения |
Группа 1/ группа 2, р После лечения |
|
Масса тела, кг |
104 [ 102; 105] |
97,5 [ 95; 100]* |
0,414 |
105 [ 102; 108] |
104,5 [ 100; 109] |
<0,001 |
|
ИМТ, кг/м2 |
33,1 [ 31,8; 34,6] |
31,4 [ 30,2; 32,4]* |
0,808 |
33,9 [ 31,1; 34,5] |
33,9 [ 32; 34,8] |
<0,001 |
|
ОТ, см |
110 [ 109; 112] |
104 [ 100; 107]* |
0,373 |
112 [ 109; 114] |
113 [ 107; 113] |
<0,001 |
|
ОБ, см |
109 [ 106; 110] |
101 [ 99; 107]* |
0,751 |
110 [ 104; 113] |
108 [ 103; 110]* |
0,001 |
|
ОТ/ОБ, ед. |
1,02 [ 1,0; 1,04] |
1,01 [ 0,98; 1,04] |
0,786 |
1,02 [ 1,0; 1,02] |
1,03 [ 1,01; 1,05]* |
0,045 |
Таблица 2. Влияние заместительной терапии тестостероном на содержание ферментов печени.
|
Параметр |
Группа 1 До лечения |
Группа 1 После лечения |
Группа 1/ группа 2, р до лечения |
Группа 2 До лечения |
Группа 2 После лечения |
Группа 1/ группа 2, р После лечения |
|
АСТ, Ед/л |
24 [ 21; 35] |
19 [ 16; 22]* |
0,409 |
23,0 [ 21; 27] |
25,0 [ 23; 30] |
<0,001 |
|
АЛТ, Ед/л |
29 [ 23; 41] |
20 [ 15; 35]* |
0,498 |
32,0 [ 27; 43] |
40,0 [ 30; 50]* |
<0,001 |
|
ГГТП, Ед/л |
70 [ 64; 80] |
59 [ 54; 68]* |
0,428 |
71 [ 66; 83] |
72 [ 65; 85] |
<0,001 |
Таблица 3. Влияние заместительной терапии тестостероном на содержание гормонов жировой ткани.
|
Параметр |
Группа 1 До лечения |
Группа 1 После лечения |
Группа 1/ группа 2, р до лечения |
Группа 2 До лечения |
Группа 2 После лечения |
Группа 1/ группа 2, р После лечения |
|
Лептин, нг/мл |
9,2 [ 7,9; 12,0] |
6,4 [ 4,4; 7,5]* |
0,301 |
8,9 [ 8,3; 9,7] |
9,0[ 8,4; 9,8] |
<0,001 |
|
Резистин, нг/мл |
9,8 [ 8,2; 12,9] |
6,4 [ 2,1; 8,0]* |
0,757 |
9,7 [ 8,2; 11,0] |
9,8 [ 8,3; 11,1] |
<0,001 |
|
Адипонектин, мкг/мл |
2,3 [ 0,8; 2,8] |
2,9 [ 4,4; 7,5]* |
0,746 |
2,0 [ 1,8; 2,5] |
1,8 [ 1,6; 2,4]* |
<0,001 |
Как видно из рисунка 1, содержание жира в печени по данным МРТ у пациентов, получавших ЗТТ уменьшилось в 1,7 раза, в то время, как отсутствие коррекции дефицита Т в группе контроля приводило к статистически значимому (р<0,05) нарастанию выраженности стеатогепатоза даже при отсутствии прибавки массы тела. Так, к концу наблюдения отмечалось высокодостоверное межгрупповое отличие в содержании жира в печени, а следовательно и выраженности НАЖБП (р<0,001).
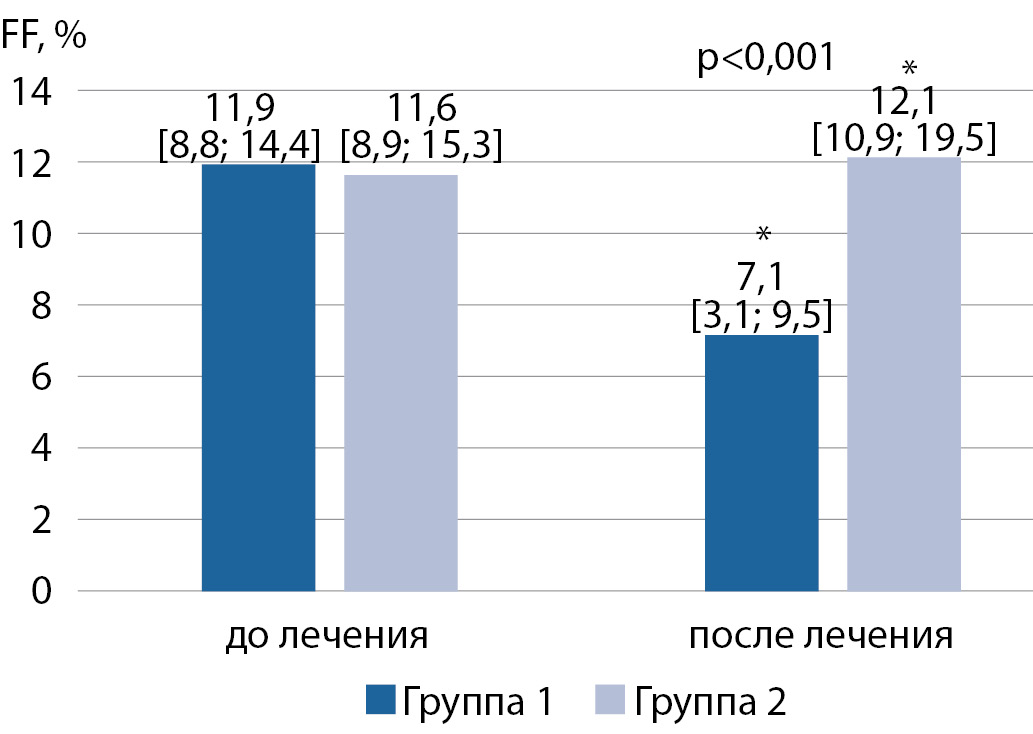
Рисунок 1. Влияние заместительной терапии тестостероном на содержание фракции жира печени (FF).
Примечание. * – р<0,05 по сравнению с исходным показателем.
Дополнительные результаты исследования
Как видно из таблицы 4, назначение ЗТТ приводило к статистически значимому увеличению концентрации общего и свободного Т при уменьшении глобулина, связывающего половые гормоны (р<0,001), тогда как уровень ЛГ значимо не изменился. В группе контроля статистически значимого изменения уровней половых гормонов не происходило.
Нужно отметить существенную динамику показателей углеводного обмена на фоне ЗТТ, представленную в таблице 5. Так, уровень НbА1с в 1-ой группе снизился на 0,5%, а гликемии натощак – на 0,8 ммоль/л (р<0,001). Кроме того, терапия Т приводила к снижению гиперинсулинемии в 1,5 раза, а индекса инсулинорезистентности НОМА в 2,2 раза. В то же время в группе контроля некомпенсированный дефицит Т приводил к статистически значимому нарастанию гиперинсулинемии. Важно подчеркнуть, что достигнутые межгрупповые отличия по показателям углеводного обмена в обеих группах были достигнуты без изменения сахароснижающей терапии.
Таблица 4. Изменение уровней половых гормонов на фоне заместительной терапии тестостероном.
|
Параметр |
Группа 1 До лечения |
Группа 1 После лечения |
Группа 1/ группа 2, р до лечения |
Группа 2 До лечения |
Группа 2 После лечения |
Группа 1/ группа 2, р После лечения |
|
Общий тестостерон, нмоль/л |
8,5 [ 6,5; 11,5] |
13,7 [ 12,6; 14,9]* |
0,541 |
8,4 [ 6,4; 10,2] |
8,4 [ 5,6; 9,1] |
<0,001 |
|
Глобулин, связывающий половые гормоны, нмоль/л |
25,1 [ 22,3; 27,1] |
20,6 [ 18,6; 23,8]* |
0,273 |
25,7 [ 22,6; 29,2] |
24,5 [ 22,2; 28,3] |
<0,001 |
|
Свободный тестостерон, пмоль/мл |
192 [ 152; 256] |
356 [ 339; 366]* |
<0,001 |
187 [ 149; 216] |
191 [ 130; 201] |
<0,001 |
|
ЛГ, мМЕ/мл |
5,2 [ 4,5; 5,6] |
4,9 [ 4,1; 6,0] |
0,689 |
5,0 [ 3,7; 6,2] |
4,5 [ 3,3; 6,3] |
0,281 |
Таблица 5. Влияние заместительной терапии тестостероном на показатели углеводного обмена.
|
Параметр |
Группа 1 До лечения |
Группа 1 После лечения |
Группа 1/ группа 2, р до лечения |
Группа 2 До лечения |
Группа 2 После лечения |
Группа 1/ группа 2, р После лечения |
|
HbA1c, % |
7,0 [ 6,6; 7,5] |
6,5 [ 6,3; 7,2]* |
0,087 |
7,2 [ 7,1;8,2] |
7,6 [ 7,0; 7,9] |
<0,001 |
|
Глюкоза натощак, ммоль/л |
7,1 [ 6,6; 7,9] |
6,3 [ 5,8; 6,8]* |
0,077 |
7,8 [ 6,8; 9,0] |
7,8 [ 7,0; 8,8] |
<0,001 |
|
ИРИ, мкМЕ/мл |
35,0 [ 23,3; 60,0] |
22,6 [ 19,8; 30,2]* |
0,255 |
27,6 [ 23,3; 40,8] |
34,2 [ 25,3; 44,3]* |
0,002 |
|
Индекс НОМА, ед. |
13,1 [ 5,9; 21,0] |
6,0 [ 5,2; 8,6]* |
0,951 |
10,1 [ 8,0; 15,8] |
11,9 [ 8,8; 16,0] |
<0,001 |
Вместе с тем, ЗТТ была ассоциирована с улучшением липидного обмена: уменьшением уровней общего холестерина с 5,6 [ 5,1; 6,4] до 5,2 [ 4,6; 5,5] ммоль/л, триглицеридов с 1,9 [ 1,3; 2,6] до 1,6 [ 1,1; 2,1] ммоль/л (р<0,05). Тогда как в группе контроля произошло статистически значимое нарастание уровня общего холестерина с 6,2 [ 5,6; 7,2] до 6,4 [ 5,8; 7,1] ммоль/л (р=0,01). Таким образом, после лечения группы отличались по уровням общего холестерина, триглицеридов и липопротеидов очень низкой плотности (р<0,01).
Нежелательные явления
В ходе исследования нежелательные явления не были зарегистрированы.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
На основании анализа результатов исследования, проведенного на 60 мужчинах с СД2 в сочетании с гипогонадизмом, было установлено, что ЗТТ приводит не только к значительному улучшению углеводного и липидного обменов, но и значимо уменьшает воспалительную активность в печени и выраженность стеатоза гепатоцитов при НАЖБП, а именно: снижает уровни АСТ, АЛТ и ГГТП, уменьшает содержание печеночной фракции жира в 1,7 раза. Это сопровождается восстановлением функции жировой ткани (снижением уровней лептина и резистина, увеличением концентрации адипонектина), что наряду с уменьшением выраженности инсулинорезистентности может являться важным механизмом положительного влияния ЗТТ на течение и прогрессию НАЖБП.
Обсуждение основного результата исследования
Ранее нами было показано, что дефицит Т у мужчин с СД2 ассоциирован с ухудшением функции печени и прогрессией НАЖБП по сравнению с нормогонадными пациентами, что и послужило поводом для поиска путей патогенетической коррекции данных состояний [14].
Многие исследователи уже отмечали снижение выраженности висцерального ожирения на фоне ЗТТ у мужчин с гипогонадизмом [12][15]. Аналогичные результаты были получены и в нашем исследовании – терапия Т приводила к статистически значимому снижению массы тела, ИМТ, ОТ и ОБ. Интерес вызывают данные, полученные в группе контроля – у пациентов, не получавших ЗТТ и остававшихся в состоянии дефицита Т в течение полугода, без статистически значимого изменения массы тела и ИМТ происходило перераспределение жировой ткани – уменьшение подкожного жира (ОБ) на фоне незначительной прибавки жира висцерального (ОТ).
Важнейшей задачей исследования было изучение влияния ЗТТ на интенсивность воспаления в печени. К сожалению, диагностические возможности ее определения в рутинной клинической практике ограничены – биопсия печени, являющаяся «золотым стандартом» диагностики НАЖБП, будучи инвазивным методом, имеет множество ограничений, а оценка уровней гепатокинов является крайне дорогостоящей, причем, результаты данных анализов пока невозможно экстраполировать на популяцию в целом. Поэтому, нами были выбраны традиционные маркеры интенсивности воспаления в печени – ферменты АЛТ, АСТ и ГГТП, легко воспроизводимые в клинической практике. Выявленные снижения концентраций печеночных ферментов на фоне ЗТТ свидетельствует о регрессе воспалительного процесса в печени.
Более того, впервые, при помощи МРТ, являющейся наиболее информативной из неинвазивных диагностических методик НАЖБП, было показано улучшение структурных характеристик печени, а именно уменьшение печеночной фракции жира, на фоне ЗТТ у мужчин с СД2 и гипогонадизмом. На сегодняшний день в литературе не было описано механизмов влияния ЗТТ при гипогонадизме у мужчин на НАЖБП. Это послужило поводом к изучению важнейших маркеров функции жировой ткани в нашем исследовании. Было показано, что терапия Т у мужчин с СД2 и гипогонадизмом приводила к выраженному снижению концентраций лептина и резистина, синхронно с увеличением уровня адипонектина. Важнейшим эффектом резистина является угнетение инсулин-опосредованного захвата глюкозы тканями-мишенями, но кроме того, он участвует в активации процессов воспаления в сосудистом эндотелии и печени, становясь связующим звеном между компонентами метаболического синдрома и НАЖБП [17]. В свою очередь, лептин стимулирует отложение холестерина в макрофагах, способствуя параллельному развитию стеатогепатита и атерогенеза. С другой стороны, показателем метаболического здоровья является гормон жировой ткани адипонектин, который обладает противовоспалительным, противодиабетическим и даже кардиопротективным эффектами, а снижение его уровня ассоциировано с высоким риском развития СД2 и сердечно-сосудистых заболеваний [12][19]. Более того, имеются данные о гепатопротективном действии адипонектина, увеличивающим продолжительность жизни гепатоцитов, а также подавляющим инсулинорезистентность, воспаление и фиброз печеночной ткани [19].
Было показано, что положительное влияние ЗТТ на функцию жировой ткани у мужчин с СД2 и гипогонадизмом ассоциировано с уменьшением секреции биохимических маркеров эндотелиальной дисфункции – молекул адгезии ICAM-1 и р-селектина, а также С-реактивного белка [17]. Можно предположить, что восстановление функции эндотелия на фоне ЗТТ приводит к уменьшению печеночной инсулинорезистентности и тем самым способствует замедлению прогрессии НАЖБП.
Безусловно, восполнение дефицита Т оказывает комплексное действие на метаболические процессы и невозможно рассматривать влияние ЗТТ на функцию печени в отрыве от ее эффектов на углеводный и липидный обмены. Известно, что гиперинсулинемия ингибирует липолиз, синхронно стимулируя печеночный липогенез, что и приводит к накоплению свободных жирных кислот гепатоцитами, тем самым усиливая их инсулинорезистентность [6, 7]. Выявленные в нашем исследовании снижение инсулинорезистентности и гиперинсулинемии на фоне ЗТТ закономерно ассоциировано со снижением накопления липидов гепатоцитами и уменьшением доли печеночного жира. При этом, статистически значимое снижение уровня НbА1с и гликемии натощак без коррекции сахароснижающей терапии является отражением совокупного взаимного положительного влияния ЗТТ на метаболизм углеводов и степень воспаления в печени.
Нужно отметить, что гипогликемическая терапия в группах была сопоставима, стабильна в течение 3 месяцев до включения пациентов в исследование и неизменна на протяжении всего исследования. Причем рекомендации по немедикаментозной терапии (режим питания и физической активности) были даны пациентам обеих групп в одинаковой форме. Следовательно, можно утверждать, что полученные изменения антропометрических данных, метаболических параметров, ферментов печени и содержания жира печени в 1 группе были связаны именно с назначением ЗТТ.
Известно, что Т контролирует активность печеночной липазы, гидролиз ТГ и фосфолипидов, более того, регулирует избирательный захват липидов клетками печени [20]. Поэтому очевидно, что терапия Т, вносит существенный вклад в уменьшение выраженности НАЖБП не только снижая уровень общего холестерина и триглицеридов, но и подавляя бесконтрольное накопление холестерина гепатоцитами. Таким образом, снижение дисфункции жировой ткани и улучшение чувствительности к инсулину на фоне ЗТТ можно рассматривать как механизм, ответственный за снижение метаболического воспаления в печени и профилактику прогрессирования НАЖБП.
Особо нужно отметить, что у пациентов, имевших некомпенсированный дефицит Т в течение полугода было выявлено статистически значимое увеличение уровня АЛТ и гиперинсулинемии, снижение уровня адипонектина, нарастание содержания печеночной фракции жира. То есть, отсутствие лечения функционального гипогонадизма у мужчин с СД2 приводит к постепенному нарастанию метаболических нарушений и прогрессированию НАЖБП.
Учитывая большое число осложнений СД2 и сопутствующих заболеваний, пациенты зачастую бывают вынуждены принимать широкий спектр лекарственных препаратов для их коррекции. Сочетание СД2, дефицита Т и НАЖБП имеет взаимно отягощающее влияние, а медикаментозных препаратов, доказавших свою эффективность в плане лечения НАЖБП при нарушениях углеводного обмена в настоящее время не существует. В данной ситуации назначение ЗТТ у мужчин с СД2 и гипогонадизмом позволяет решить множество проблем: от улучшения метаболического контроля, снижения висцерального ожирения и дисфункции жировой ткани, уменьшения выраженности воспаления при НАЖБП до положительного влияния на эректильную дисфункцию и качество жизни пациентов.
Ограничения исследования
Ограничением исследования является отсутствие расчета объема выборки. В связи с ограниченным объемом выборки, пациенты не были разделены на подгруппы по принципу наличия стеатоза или стеатогепатита, что позволило бы соотнести динамику лабораторных показателей с клинической эффективностью проводимой терапии. Кроме того, все пациенты в исследовании имели диагноз СД2, что не позволяет перенести полученные результаты на популяцию мужчин с дефицитом Т без нарушений углеводного обмена и требует дальнейшего проведения контролируемых исследований.
ЗАКЛЮЧЕНИЕ
Работы последних лет выявили, что дефицит Т у мужчин ассоциирован не только с висцеральным ожирением, СД2, нарушениями липидного обмена, но и формированием НАЖБП, что требует проведения исследований, направленных на поиск путей решения данных патогенетических взаимосвязей. Результаты проведенного нами исследования продемонстрировали у мужчин с СД2 и гипогонадизмом на фоне ЗТТ улучшение биохимических параметров печени – снижение концентраций печеночных ферментов АЛТ, АСТ и ГГТП, сопоставимых со снижением печеночной фракции жира по данным МРТ, что свидетельствует об уменьшении выраженности НАЖБП. Кроме того, терапия Т была ассоциирована с улучшением углеводного и липидного обменов, уменьшением инсулинорезистентности и дисфункции жировой ткани.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена при поддержке Государственного задания №14 «Функция печени у мужчин с сахарным диабетом 2 типа» (регистрационный номер НИОКТР: АААА-А18-118013090205-0).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Участие авторов. Хрипун И.А. – концепция и дизайн исследования, интерпретация данных, написание текста; Воробьев С.В. – концепция и дизайн исследования, редактирование текста; Аллахвердиева Я.С. – получение и анализ данных, написание текста статьи; Дзантиева Е.О. – получение и анализ данных, написание текста статьи; Рассказова М.А. – получение и анализ данных, написание текста статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Andronescu CI, Purcarea MR, Babes PA. Nonalcoholic fatty liver disease: epidemiology, pathogenesis and therapeutic implications. J Med Life. 2018;11(1):20-23.
2. Драпкина О.М., Ивашкин В.Т. Эпидемиологические особенности неалкогольной жировой болезни печени в России (результаты открытого многоцентрового проспективного исследования наблюдения DIREGL 01903). // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2014. — Т. 24. — №4. — С. 32-38.
3. Lucas C, Lucas G, Lucas N, Krzowska-Firych J, Tomasiewicz K. A systematic review of the present and future of nonalcoholic fatty liver disease. Clin Exp Hepatol. 2018;4(3):165-174. doi: https://doi.org/10.5114/ceh.2018.78120
4. Lonardo A, Ballestri S, Marchesini G, et al. Nonalcoholic fatty liver disease: A precursor of the metabolic syndrome. Dig Liver Dis. 2015;47(3):181-190. doi: https://doi.org/10.1016/j.dld.2014.09.020
5. Targher G, Marchesini G, Byrne CD. Risk of type 2 diabetes in patients with non-alcoholic fatty liver disease: Causal association or epiphenomenon? Diabetes Metab. 2016;42(3):142-156. doi: https://doi.org/10.1016/j.diabet.2016.04.002
6. Watt MJ, Miotto PM, De Nardo W, Montgomery MK. The Liver as an Endocrine Organ—Linking NAFLD and Insulin Resistance. Endocr Rev. 2019;40(5):1367-1393. doi: https://doi.org/10.1210/er.2019-00034
7. Мишина Е.Е., Майоров А.Ю., Богомолов П.О., и др. Неалкогольная жировая болезнь печени: причина или следствие инсулинорезистентности? // Сахарный диабет. — 2017. — Т. 20. — №5. — С. 335-343. doi: https://doi.org/10.14341/DM9372
8. Lee SB, Park G-M, Lee J-Y, et al. Association between non-alcoholic fatty liver disease and subclinical coronary atherosclerosis: An observational cohort study. J Hepatol. 2018;68(5):1018-1024. doi: https://doi.org/10.1016/jjhep.2017.12.012
9. Mulligan T, Frick MF, Zuraw QC, et al. Prevalence of hypogonadism in males aged at least 45 years: the HIM study. Int J Clin Pract. 2008;60(7):762-769. doi: https://doi.org/10.1111/j.1742-12412006.00992.x
10. Мельниченко Г.А., Шестакова М.В., Роживанов Р.В. Клиникоэпидемиологические характеристики синдрома гипогонадизма у мужчин с сахарным диабетом 2 типа. // Сахарный диабет. — 2019. — Т. 22. — №6. — С. 536-541. doi: https://doi.org/10.14341/DM10211
11. Traish AM, Zitzmann M. The complex and multifactorial relationship between testosterone deficiency (TD), obesity and vascular disease. RevEndocr Metab Disord. 2015;16(3):249-268. doi: https://doi.org/10.1007/s11154-015-9323-2
12. Коган М.И., Воробьев С.В., Хрипун И.А., и др. Тестостерон: от сексуальности к метаболическому контролю. -Ростов-на-Дону: Феникс; 2017.
13. Jaruvongvanich V, Sanguankeo A, Riangwiwat T, Upala S. Testosterone, Sex Hormone-Binding Globulin and Nonalcoholic Fatty Liver Disease: A Systematic Review and Meta-Analysis. Ann Hepatol. 2017;16(3):382-394. doi: https://doi.org/10.5604/01.3001.0009.8593
14. Хрипун И.А., Воробьев С.В., Аллахвердиева Я.С. Дефицит тестостерона и неалкогольная жировая болезнь печени у мужчин с сахарным диабетом 2 типа. // Сахарный диабет. — 2019. — Т. 22. — №6. — С. 542-549. doi: https://doi.org/10.14341/DM10232
15. Wang K-J, Li H, Cai X, et al. Metabolic effects of testosterone replacement therapy on hypogonadal men with type 2 diabetes mellitus: a systematic review and meta-analysis of randomized controlled trials. Asian J Androl. 2014;16(1):146. doi: https://doi.org/10.4103/1008-682X.122346
16. Kirby M, Hackett G, Ramachandran S. Testosterone and the Heart. Eur Cardiol Rev. 2019;14(2):103-110. doi: https://doi.org/10.15420/ecr.2019.13.1
17. Khripun I, Vorobyev S, Belousov I, et al. Influence of testosterone substitution on glycemic control and endothelial markers in men with newly diagnosed functional hypogonadism and type 2 diabetes mellitus: a randomized controlled trial. Aging Male. 2019;22(4):241-249. doi: https://doi.org/10.1080/13685538.2018.1506918
18. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016;64(6):1388-1402. doi: https://doi.org/10.1016/jjhep.2015.11.004
19. Park HK, Kwak MK, Kim HJ, Ahima RS. Linking resistin, inflammation, and cardiometabolic diseases. Korean J Intern Med. 2017;32(2):239-247. doi: https://doi.org/10.3904/kjim.2016.229
20. Adolph TE, Grander C, Grabherr F, Tilg H. Adipokines and NonAlcoholic Fatty Liver Disease: Multiple Interactions. Int J Mol Sci. 2017;18(8):1649. doi: https://doi.org/10.3390/ijms18081649
Об авторах
Ирина Алексеевна ХрипунРоссия
Хрипун Ирина Алексеевна, к.м.н., ORCID: https://orcid.org/0000-0003-0284-295X, eLibrary SPIN: 8630-4828, e-mail: khripun.irina@gmail.com
344022, Ростов-на-Дону, пер. Нахичеванский, 29
Конфликт интересов:
нет конфликта интересов
Сергей Владиславович Воробьев
Россия
Воробьев Сергей Владиславович, д.м.н., профессор, ORCID: https://orcid.org/0000-0001-7884-2433, eLibrary SPIN: 9773-6100, e-mail: endocrinrostov@mail.ru.
Ростов-на-Дону
Конфликт интересов:
нет конфликта интересов
Янина Сергеевна Аллахвердиева
Россия
Аллахвердиева Янина Сергеевна, ORCID: https://orcid.org/0000-0001-5514-9978; eLibrary SPIN: 8547-8020; e-mail yana.allakhverdieva@yandex.ru.
Ростов-на-Дону
Конфликт интересов:
нет конфликта интересов
Елизавета Олеговна Дзантиева
Дзантиева Елизавета Олеговна, к.м.н., ORCID: https://orcid.org/0000-0001-5645-1116; eLibrary SPIN: 3940-7190; e-mail lizo4@list.ru.
Ростов-на-Дону
Конфликт интересов:
нет конфликта интересов
Мария Алексеевна Рассказова
Россия
Рассказова Мария Алексеевна, ORCID: https://orcid.org/0000-0002-2085-6055, eLibrary SPIN: 8758-7155, e-mail mari.rasskazova.94@inbox.ru.
Ростов-на-Дону
Конфликт интересов:
нет конфликта интересов
Дополнительные файлы

|
1. экспертное заключение | |
| Тема | ||
| Тип | common.other | |
Скачать
(123KB)
|
Метаданные ▾ | |

|
2. официальное письмо на бланке | |
| Тема | ||
| Тип | Прочее | |
Скачать
(53KB)
|
Метаданные ▾ | |

|
3. печать РостГМУ | |
| Тема | ||
| Тип | Прочее | |
Скачать
(133KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 1. Влияние заместительной терапии тестостероном на содержание фракции жира печени (FF). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(86KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Хрипун И.А., Воробьев С.В., Аллахвердиева Я.С., Дзантиева Е.О., Рассказова М.А. Новые возможности коррекции неалкогольной жировой болезни печени у мужчин с сахарным диабетом 2 типа и гипогонадизмом. Ожирение и метаболизм. 2020;17(3):241-248. https://doi.org/10.14341/omet12495
For citation:
Khripun I.A., Vorobyev S.V., Allahverdieva Ya.Y., Dzantieva E.O., Rasskazova M.A. New opportunities for the correction of non-alcoholic fatty liver disease in men with type 2 diabetes mellitus and hypogonadism. Obesity and metabolism. 2020;17(3):241-248. (In Russ.) https://doi.org/10.14341/omet12495

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































